Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 1 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
BioB<br />
3.HTX<br />
AS<br />
<strong>2003</strong>-<strong>10</strong>-20
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 2 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Titel:<br />
Tema:<br />
Projektperiode:<br />
<strong>Side</strong>antal:<br />
Fag:<br />
Udarbejdet af:<br />
<strong>Morten</strong> <strong>Tolberg</strong><br />
Vejledere:<br />
Anni Simonsen<br />
EUC Køge HTX afd.<br />
Resume:<br />
Titelblad<br />
Hvorfor Opstår Kræft?<br />
Kræft.<br />
Til 31 oktober <strong>2003</strong>.<br />
32<br />
Biologi B.<br />
I lang tid har patienter blevet plaget med en interessant<br />
sygdom. Dens navn ”krabbe, klo” hentyder til sygdommens<br />
senere faser hvor svulsten vokser længere ind i kroppen fra<br />
sin plads i endotelceller, hvor 90% af kræft opstår.<br />
Ca. 90 % af de overlevende helbredes med kirurgi.<br />
I dette projekt gennemgås hvordan kræften kan opstå trin for<br />
trin, samt vil der undervejs være konklusioner på hvordan<br />
man kunne bremse lige netop denne udvikling.<br />
FORORD<br />
Dette projekt er lavet som led i undervisningen i Biologi B på Køge Tekniske Gymnasium (EUC sj.<br />
Køge afd.). Jeg er glad for den hjælp jeg har fået både af lærer og til kræftkonferencen i Bella<br />
Center, som i øvrigt var en interessant fornøjelse. Udover materialet fra kræftens bekæmpelse, er<br />
jeg kommet i besiddelse af en interessant artikel fra Lægemiddelforskning, hvori antisenseteknikken<br />
(og hvordan den kan bruges i lægemidler) beskrives. Se bilag.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 3 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Indholdsfortegnelse<br />
FORORD........................................................................................................................................................................... 2<br />
BAGGRUND..................................................................................................................................................................... 4<br />
1: OPBYGNING AF DNA. .............................................................................................................................................. 6<br />
2: PROTEINSYNTESE.................................................................................................................................................... 7<br />
3: CELLEDELING: MITOSE. ..................................................................................................................................... <strong>10</strong><br />
4:OVERORDNET: KRÆFT:........................................................................................................................................ 12<br />
5: DE OTTE KRÆFTTRIN .......................................................................................................................................... 14<br />
5,1: REPARATIONSMEKANISME ......................................................................................................................... 14<br />
5,2: CELLEDELINGSKONTROL OG TUMORSUPRESSORER ........................................................................... 16<br />
5,3: APOPTOSE......................................................................................................................................................... 19<br />
5,4: IMMUNFORSVARET........................................................................................................................................ 21<br />
5,5: ANGIOGENESE................................................................................................................................................. 25<br />
5,6: TELOMERER..................................................................................................................................................... 26<br />
5,7: METASTASERING............................................................................................................................................ 29<br />
6: KONKLUSION .......................................................................................................................................................... 31<br />
7: LITTERATURLISTE................................................................................................................................................ 32<br />
7,1: LISTE OVER FIGURER............................................................................................................................................. 32<br />
7,2: ANDET MATERIALE................................................................................................................................................ 32<br />
8: BILAG......................................................................................................................................................................... 33
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 4 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Indeledning<br />
BAGGRUND FOR PROJEKT<br />
I 75 år har Kræftens bekæmpelse prøvet at løse et voksende problem i mange menneskers liv,<br />
nemlig kræft. Kræft i sig selv er, ifølge statistik, et ”gammelmandssyndrom”, som figur<br />
bi01(NORDCAN):<br />
Statistisk kan man se en ”eksplosion” af nyopdagede tilfælde af i en sen alder, og for denne kræfttype<br />
(lungekræft) er det specielt mænd (de øverste kurver) det går ud over. (1973-1997)<br />
Fig. Bi01.<br />
Men det er nu ikke sådan at kræft er et meget nyt problem, for i f.eks. er der nogle familier der har<br />
arvelige anlæg for kræft, og i de seneste hundrede år har man kunne følge deres ”udvikling”.<br />
En anden kræfttype, der er på retur, er mavekræft, som på fig. Bi02. Denne udvikling kan skyldes<br />
bedre mad:<br />
Alder Fig. Bi02 For mænd er situationen stort set den samme.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 5 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Men der er så sandelig også kræftformer hvor det går den stik modsatte vej, f.eks. hu<strong>dk</strong>ræft, som<br />
illustreret på fig. Bi03:<br />
Alder Fig. Bi03<br />
Der er altså tilfælde af kræfttyper som er på tilbagegang og så er der nogle der er på fremmarch,<br />
noget tyder på at visse kræfttyper som f.eks. mave- og hu<strong>dk</strong>ræft er et produkt af livsstilen, men<br />
rent biologisk vil årsager blive diskuteret i senere afsnit.<br />
Behandling af patienter<br />
Det må unægtelig være et hård slag for en person at få stillet diagnosen kræft, og dette får måske<br />
også nogle til at miste ”livssynet”. Derfor er det vigtigt at patienterne får den psykiske bahandling<br />
(eller: palitativ behandling, lindrende behandling. ) lige så hurtigt som den kirurgiske.<br />
Ud over at man for at stille diagnosen må tage en masse prøver for at være sikker, så er det faktisk<br />
omkring 80-90% af de patienter som helbredes, der er helbredt med kirurgi, altså hvor man har<br />
måttet skære i patienten. Kun en 5-8 % helbredes med kemoterapi.<br />
Selve bagrrunden for dette projekt er lige netop behandlingen, og hvad der kan gøres ved dette, da<br />
man sagtens med kirurgi kan fjerne svulster der sidder på overfladen af patienten et let tilkommeligt<br />
sted, men det er meget svært/umuligt at fjerne svulster fra livsnødvendige organer som hjerte,<br />
lunger og hjerne.<br />
På det punkt vil det være smartere hvis man kunne bekæmpe kræften ”indefra”, altså hvor man<br />
simpelthen forhindrer at de normale celler muterer og derved kan blive til kræft.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 6 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Genetisk sygdom<br />
1 : DNAs OPBYGNING<br />
Kræft er en genetisk sygdom, altså at den stammer fra gener der bliver ”syge”. Genet (generne)<br />
bliver ”syge” af en række mutationer som tilfældigt rammer dem, dvs. kræft opstår når DNA<br />
ændres.<br />
DNA er en opskrift<br />
DNA er vores arvemasse, der indeholder ”opskriften” på os, altså opskriften på alle de proteiner der<br />
skal dannes for at kunne opbygge et menneske. Sker der en mutation i et (eller flere) gen(er) vil det<br />
være som at ændre farmors opskrift på boller; det bliver ikke det samme, altså der dannes et andet<br />
protein i stedet for. Dette kan være det første skridt i retning af kræft.<br />
DNA er en lang række af nukleotider der er bundet sammen og har form som en dobbelt α-spiral. (<br />
α angiver hvilken vej DNA-strengene er spundet op, altså højre om )<br />
Nukleotider<br />
Hver nukleotid er opbygget af tre ting:<br />
• En sukker ( Deoxyribose, en femkantet sukker, der er ”af-iltet” )<br />
• En fosfor til at holde sammen på molekylet<br />
• En base, som kan være : Adenin (A) som sætter sig på Thymin (T) eller Cytosin (C) der sætter sig<br />
sammen med Guanin (G).<br />
Fig 01:<br />
DNA: Nukleotid<br />
Hver fosfor (gul) holder fast i to sukker<br />
(violet) som så sider fast på en base.<br />
Adenin på Thymin, Cytosin på Guanin.<br />
Nå alle disse nukleotider sættes sammen<br />
(hydrogenbindinger) vikles de sammen til en<br />
dobbelt spiral, da den ovenover viste<br />
nukleotid sætter sig over for en ligende.<br />
Denne spiral kommer til at se ud som vist på<br />
fig. 02
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 7 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Fig. 02. DNA i Rumlig udgave.<br />
Når der arbejdes med gener her, vises gensekvensen således:<br />
1 2 3<br />
Mellemrummene angiver en sektion i DNA som ikke bruges, for selv om at vi har afsindigt mange<br />
gener, er det ikke alle der bruges.<br />
2: Proteinsyntesen<br />
Proteinsyntesen er hvordan genet i DNA bliver til et protein, som kan bruges i kroppen.<br />
Inde i cellekernen ligger DNA og en masse små RNA-nukleotider.<br />
Når processen starter, kommer et enzym, RNA-polymerase, som klipper DNA-strengen op på det<br />
sted hvor koden for det protein der skal dannes sidder (Fig 03). Nu sætter RNA-nukleotiderne sig<br />
på de åbne pladser (Fig. 04) og danner messenger-RNA , m-RNA, som kan komme ud gennem<br />
porer i cellekernemembranen (Fig. 05).<br />
Fig. 03
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 8 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
DNA er blevet usnoet og RNA-polymerase har lynet strengen op.<br />
Fig. 04<br />
RNA-nukleotider sætter sig på den oplynede del af DNA. Til forskel for DNA er RNA anderledes<br />
på følgende måder:<br />
• Dens sukker er bare ribose, altså ikke ingen deoxylering.<br />
• I RNA binder basen Adenin (a) sig til RNA-basen Urasil (U).<br />
Fig. 05<br />
m-RNA kan komme ud gennem cellekernemembranen via. små porer i den.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 9 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Nu er m-RNA kommet ud i cytoplasmaet, og her bevæger det sig hen til et af de mange ribosomer,<br />
som er kroppens protein-/enzymfabrikker.<br />
t-RNA<br />
t- RNA findes i cytoplasmaet, og er en lille kløverbladformet ting<br />
der har tre nukleotider i den ene ende, og et tilhæftningssted for<br />
aminosyrer i den anden ende.<br />
Derved koder nukleotiderne tre og tre (tripletter) for alle de<br />
aminosyrer der skal bruges.<br />
I ribosomet er der plads til m-RNA og to t-RNA, og her på disse pladser sætter der sig t-RNA over<br />
for m-RNA med den kode der modsvarer de tre første på m-RNA (Fig. 06).<br />
Fig. 06<br />
Når der nu sidder to t-RNA i ribosomet, flytter alt i<br />
den sig et hak, og den første t-RNA hopper ud, og<br />
dens aminosyre hopper op på aminosyre nr. 2 ved en<br />
peptidbinding (aminosyrer har en syregruppe i den<br />
ene ende, og aminogruppen -NH2 i den anden ende<br />
virker som base.). Nu kommer der et nyt t-RNA og<br />
sætter sig på plads nr.2, da hopper t-RNA på plads 1<br />
ud, og efterlader sine to aminosyrer på den ny t-RNAs<br />
aminosyre. Se Fig. 07.<br />
Sådan fortsætter det indtil en stopkode. Fig 07
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> <strong>10</strong> <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
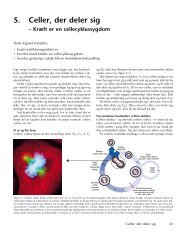
M itose<br />
3: CELLENS DELING<br />
Ved<br />
den normale celledeling forstår man at der kun dannes en kopi af den delte celle, modsat<br />
meiosen, hvor generne blandes lidt.<br />
Nedenstående proces sker efter resptriktionspunktet<br />
R, (Kapitel 5,2).<br />
Sen<br />
Interfase:<br />
Kromosomer kopier<br />
sig selv og hænger sammen i centromeren<br />
Profase:<br />
Kromatider<br />
opspiraliseres så de bliver korte og tykke, og cellekernen opløses.<br />
Metafase:<br />
Kromatidtrådene<br />
orienterer sig i midterplanet og deres centromer forbindes med en tentråde til hver<br />
af de to centrioler (pollegeme)
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 11 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Anafase:<br />
Centromeren løsnes, og hvert centriol<br />
har nu fat i en del af kromatiderne, der nu kan betragtes som<br />
selvstændige kromosomer.<br />
Se Forsiden. (Lungecelle)<br />
Telofase:<br />
Der dannes<br />
cellekernemembran om de to grupper af kromosomer, og cellen deles lige over.<br />
Interfase<br />
To datterceller<br />
med samme arveanlæg.<br />
Nu har man to celler der er ens.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 12 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Mutationer<br />
4: KRÆFT<br />
Kroppen<br />
består sådan cirka af 5/<strong>10</strong>0 milliard millioner (50.000.000.000.000) celler, som alle<br />
faktisk er potentielle kræftceller.<br />
Alle<br />
kroppens celler er sociale, dvs. de foretager sig ikke noget uden at have fået besked på det, og<br />
hvis den endeligt foretager sig noget uden at have fået besked på det, så er det selvmord.<br />
Dette sker på grund af cellens sociale liv, for hvis den ikke får at vide hvad den skal gøre, så er den<br />
overflødig, og den vil begå selvmord. Kræftceller er anderledes, da den er selvstændig, den har ikke<br />
brug for nogle andre for at overleve.<br />
Men<br />
den normale celles vej til at blive til en kræftcelle ligger i en række mutationer.<br />
Disse mutationer kan skyldes mange ting, f.eks. visse kemiske stoffer og stråling, det er<br />
specielt de<br />
celler der ”vender ud mod verdenen”, altså epitelceller. I omkring 90 % af kræfttilfældene er<br />
kræften udsprunget af epitelceller.<br />
Fig. 08.<br />
Dette<br />
kan forklares ved at det er epitelcellerne<br />
specielt, der i og på kroppen der deler sig efter<br />
den hårde hverdag de nu engang har; overhuden<br />
(epidermis) slides konstant og deler sig derfor<br />
ofte.<br />
Under de mange celledelinger kan der<br />
forekomme forandringer, mutationer, som<br />
kan<br />
være resultat af kemisk påvirkning eller stråling<br />
(det er et udbredt modefænomen at lægge sig<br />
selv i en cancergrill i en halv times tid, og vores<br />
mad er heller ikke for sund). Men det er ikke<br />
kun ydre påvirkninger der er skyld i udvikling<br />
af kræft, for naturen har altid ændret og<br />
forbedret livet på jorden, sådan at det blev<br />
bedre<br />
udrustet til det miljø organismen lever i<br />
(Kroppen prøver at tilvænne sig det foder vi<br />
kaster indenbords…), og kræft er en sygdom<br />
der opstår når der kommer en uheldig<br />
mutationen i et kræftgen, onkogen. Denne<br />
mutation kunne lige så godt / der sker også<br />
mutationer andre steder i arvemassen, og når<br />
det ikke udvikler sig til kræft, så har vi fået en<br />
ny egenskab.<br />
Skader<br />
på DNA kan f.eks. komme fra stråling fra en cancergrill. Enten repareres skaden ellers dør<br />
cellen, da det normale DNA-polymerase ikke kan kopiere forbi skaden. Men hvis der nu kommer et<br />
alternativt enzym, så vil DNA-strengen blive kopieret alligevel, da det alternative enzym er ligeglad<br />
med muteringen. Derved er der kommet en mutation (punktmutation) på cellen.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 13 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Det vil sige at den naturlige evolution sikkert kører efter ”trial and error” systemet, hvor der<br />
kommer<br />
en mutation, og hvis det ikke dur, så opstår der en sygdom og organismen dør. Modsat,<br />
hvis mutationen bliver en succes, overlever organismen med en ny egenskab.<br />
Men celler bliver ikke til kræftceller bare på grund af en mutation, for det første<br />
skal mutationen<br />
ramme<br />
den kodende del af arvemassen, exons, som kun udgør ca. 1 % af den samle arvemasse.<br />
For det andet skal mutationen også ramme de særlige onkogener, som, hvis der rammes, har en<br />
ekstra stor sandsynlighed for at føre til kræft.<br />
Det er bestemte typer mutationer der er skyld i ændringen af DNA:<br />
Øverst til venstre ses<br />
et kort og<br />
fiktivt gen,<br />
der<br />
koder for et<br />
specifikt protein.<br />
I den første ændring<br />
kommer genet til at<br />
kode for et andet<br />
protein.<br />
I den anden mutation, der har ændret c til T, gør at der nu kodes for en alt for kort<br />
sekvens, da<br />
mutationen laver et stop-punkt midt i nukleinsyresekvensen.<br />
I den sidste mutation vil proteinet mangle en aminosyre,<br />
dvs. at genet har fået en ny sekvens, og alle<br />
de fremtidige gener vil have denne fejl. Derved bliver det et helt andet protein der vil blive dannet.<br />
Til højre ses forskellige store mutationer: en deletion, hvor et stykke af genet (1) fjernes. En<br />
indsættelse, hvor et fjerde gen indsættes mellem gen 1 og 2. Der er en translokation, hvor en del af<br />
genet<br />
har sat sig på en helt andet kromosom. Til sidst er der amplifikationen, hvor et gen (2)<br />
indsætter sig mange gange, sådan at det bliver forstærket.<br />
I de følgende afsnit ser vi nærmere på de barrierer der ligger mellem den raske celler og den<br />
fuldmodne<br />
kræftsvulst. De barrierer er :<br />
• Cellernes reparationsmekanisme.<br />
• Kontrol af celledeling.<br />
• Tumorsuppressorer<br />
• Apoptose.<br />
• Immunsystemet.<br />
• Angiogenese.<br />
• Telomere<br />
• Metastasering<br />
Fig. 09
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 14 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
5: DE 8 KRÆFTTRIN<br />
I disse afsnit vil hvert<br />
trin i kræfttrappen beskrives: Fig. <strong>10</strong><br />
5,1: Reparationsmekanisme<br />
Den<br />
første barriere for muterende celler er kroppens egen reparationsmekanisme, som har til opgave<br />
at<br />
opstøve fejl i DNA før at cellen deler sig.<br />
Man<br />
har erfaret at det ikke kun er et enkelt eller få enzymer/proteiner (altså gener der koder for<br />
disse) der er involveret i reparationsmekanismen, men det er et stærk specialiseret system hvor hver<br />
kun har et ganske lille område de kan reparere.<br />
Indtil videre har man fundet bare 7 gener der koder for proteiner der er involveret i DNAreparationsprocessen,<br />
og i forbindelse med forskning i nedarvet brystkræft, har man fundet to gener,<br />
BRCA1 og BRCA 2, som, hvis de er muteret i den<br />
ene allel (se Fig. 11), giver en ekstra høj risiko<br />
for brystkræft. Disse to gener (samt et tredje, formoder man)<br />
spiller også en rolle i reparationsmekanismen, da de typisk<br />
lægger<br />
sig i cellekernen hvor DNA er, men det er svært præcist at finde<br />
ud af hvilken funktion de har, pga. deres enorme størrelse. (Det<br />
(BRCA1) fylder mere end <strong>10</strong>0.000 basepar og koder for et<br />
protein på1863 aminosyrer.<br />
Fig. 11<br />
Knudsons ”two-hit model” Normal<br />
er der to kromosompar i cellen<br />
(en<br />
fra hver forælder), begge skal være muteret for at give kræft,<br />
men hvis<br />
den ene arveligt er skadet, er risikoen for at få kræft<br />
større<br />
end normalt, da her kun er en der skal mutere.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 15 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
En skade vil blive opdaget som at DNA-strengen ”knækker”, da<br />
strengen enten er blevet kortere eller længere af mutation, f.eks er<br />
det ”mismatch” hvor baserne ikke passer sammen (se fig. 12). Dette<br />
knæk påkalder sig opmærksomhed fra to reparationsproteiner (Fig.<br />
13) der sætter sig sammen til en dimer (kompleks der består af to<br />
andre stoffer) som så vil tilkalde andre proteiner der piller det<br />
skadede ud, og syntetiserer (producerer) nyt fejlfrit som indsættes.<br />
Fig.<br />
13<br />
Fig.<br />
12<br />
Fejlfindning og reparation af DNA.<br />
Generne nævnt heri er fundet ved at udnytte<br />
viden fra bakteriers og gærcellers<br />
reparationsmekanismer.<br />
De lysegrønne er dimerer der kan finde<br />
frem<br />
til og binde sig til tre slags fejl i DNA som<br />
vist<br />
på tegningen til venstre.<br />
I ”mispair” er der indsat en forkert base, som<br />
gør at DNA-strengen bøjer.<br />
I enkelt og dobbelt insertion, er<br />
der indsat for<br />
mange baser.<br />
Derefter bindes yderligere to proteiner til komplekset (de mørkegrønne), der derefter samles med<br />
resten af reparationsproteinerne til reparasomet. Disse tre komplekser kan så reparere en enkelt<br />
eller to insertioner, men kun komplekset til venstre (blå ramme) kan udbedre fejl i baseparringen.<br />
Som det ses på tegningen går MSH2 og MLH1 igen i alle komplekserne, og det viser sig at det er<br />
disse der er muteret i størstedelen af kræften HNPCC. (arvelig kræft i tyktarmen).<br />
Hvis<br />
man skulle forhindre mutationer i kroppens celler, og derved forhindre kræft, så ville det nok<br />
være<br />
passende med en stor indsats på lige netop dette område, altså forsøge at kortlægge de<br />
mekanismer<br />
der fungerer i denne barriere, sådan at man kan bruge denne viden til at forebygge<br />
kræft, specielt i familier der har en arvelig tendens til kræft. Her kan man også specialisere<br />
forebyggelsen sådan at den er rette mod den specifikke kræft som gør sig gældende i familien.<br />
Men nu var det jo sådan at kræften kom da lige netop denne funktion muterede, så en eventuel kur<br />
skal altså fungere uden cellens eget system, da dette typisk vil være uden funktion, så kuren skal<br />
altså bestå af noget der fungerer ligesom DNA-reparationsmekanismen, men uden at være afhængig<br />
af kroppens system. Det kunne f.eks. være de enzymer og proteiner som skal til for at reparere<br />
DNA-strengen. Det ville i hvert fald være et godt skridt i retning af at forhindre mutationer.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 16 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
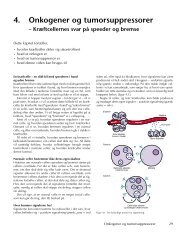
5,2: Celledelingskontrol og Tumorsuppressorer<br />
Alle cellerne i kroppen deler sig, og for at undgå at DNA muterer uhensigtsmæssigt, er cellen<br />
udstyret med en slags forhindring, kaldet restriktionspunktet.(Derefter<br />
deler cellen sig, se:MITOSE)<br />
Cellen<br />
futter rundt i en cyklus som vist på fig. 14:<br />
Fig. 14.<br />
Når<br />
cellen ligger og venter på at dele sig, Gap0<br />
(G0) , producerer<br />
den proteiner og enzymer.<br />
Når<br />
cellen skal dele sig, hopper den ud i G1, hvor<br />
der lige før restriktionspunktet er checkpoints,<br />
for at cellen kan kontrollere sit DNA for skader,<br />
og hvis der er skader, repareres de, ellers begår<br />
cellen selvmord. Der er et lignede checkpoint i<br />
slutningen af G2, lige før cellen laver mitose.<br />
Restriktionspunktet er det sted hvor cellen<br />
endeligt bestemmer sig for om den skal dele sig eller<br />
ej, og hvis cellen først kommer over dette<br />
punkt, så vil cellen dele sig. Det er typisk at R og checkpoints er væk i en kræftcelle, for ellers ville<br />
den jo stoppe sin deling.<br />
Restriktionspunktet er biologisk set lig retinablastom-proteinet, Rb,(se Fig. 15) og dette protein har<br />
den funktion at det blokerer<br />
E2F-transkriptionsfaktoren, der har til opgave at få cellen delt.<br />
Fig. 15.<br />
Rb kan blokeres ved at der tilkommer cellen vækstfaktorer, hvorefter der dannes cyklin D, der ikke<br />
normalt findes i cellen. Dette har ingen effekt i sig selv, men i cellen findes der proteinet CDK4,<br />
som sammen med cyklin D bliver aktivt (fosfylering af protein, kinase), og kan sende fosfat over på<br />
Rb-proteinet, der derved bliver inaktivt og ude af stand til at blokere E2F, som så frit kan danne<br />
vækstproteiner som fører til cellens deling.<br />
Afgørelsen om hvorvidt cellen skal dele sig eller ej, afhænger af balancen af Rb i forhold til cyklin<br />
D / CDK4, hvilket vil sige at så snart der er mere<br />
CDK4-kompleks end Rb, så vil ”bommen” være<br />
hævet<br />
så cellen deler sig og vice versa. Cyklin D er altså et kræftfremkalden gen.<br />
Af tumorsupressende gener kan der udover Rb-proteinet nævnes p53, DNA’ets vogter. Dets<br />
funktion er at forhindre celler med skader at dele sig. Det sker ved at p53 ved skade<br />
på DNA bliver<br />
aktivt,<br />
og sørger for at danne p21-proteiner, som stopper cellens deling. Men hvis nu at det er p53<br />
genet der er skadet, vil DNA kopiere sig uhindret, da der ikke er noget p21 der stopper delingen.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 17 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Normale celler bestemmer ikke selv om de vil dele sig, men de<br />
får besked på det af andre celler ved hjælp af vækstfaktorer, altså<br />
proteiner i blodbanen der får cellen til at dele sig.<br />
De signalstoffer kan komme på tre måder, som vist på fig. 16:<br />
Fig. 16<br />
• Endokrin<br />
Signalstoffet kommer fra en kirtel der munder ud i blodbanen.<br />
• Parakrin<br />
Signalstoffet kommer fra en eller flere naboceller.<br />
• Autokrin<br />
Cellen udskiller<br />
selv signalstof, og aktiverer sig selv.<br />
Fig. 17 , Signalkæden<br />
På fig.17 kan man<br />
se hvordan at en vækstfaktor, her<br />
PDGF,<br />
får cellen til at reagere.<br />
Dette<br />
sker ved en kæde af fosfyleringer; det ene<br />
protein laver fosfyleringer på det andet osv.<br />
På tegningen sker det at PDGF får<br />
de to PGDF<br />
receptorer<br />
til at komme så tæt på hinanden, at der<br />
sker en stukturændring af ”boret” som går gennem<br />
det dobbelt-fosforlipide lag der omkranser cellen.<br />
Fosfor kommer da til at sidde sådan at det aktiverer<br />
Grbr2, som slæber Sos med sig, der er i stand til at<br />
aktivere Ras, som sidder på fedtlaget.<br />
Ras findes i en inaktiv og en aktiv udgave. I den<br />
inaktive udgave binder den GDP, i den aktive<br />
udgave er det GTP der bindes, men den har en kort<br />
levetid,<br />
da GAP-proteiner hurtigt sørger for at få den<br />
omdannet til den inaktive form.<br />
Fosfyleringerne fortsætter ned til cellekernen, hvor<br />
transkriptionsfaktorer bliver aktiveret, som sørger for<br />
at cellen deler sig ved at danne nogle proteiner.<br />
Nu kan det, af hensyn til kræft, gå galt flere steder i kæden, men typisk sker det at receptorernes gen<br />
er muteret, sådan at de er konstant aktive eller der er dannet så mange receptorer at blot den midste<br />
påvirkning<br />
aktiverer signalkæden. Det kan også ske at der bliver pladsmangel på overfladen, sådan<br />
at<br />
receptorerne tvinges sammen og bliver aktive.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 18 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Før, i den lille blå boks, blev det nævnt at Ras enten var aktiv eller inaktiv, og Ras er en typisk (1/4<br />
af kræfttilfælde) årsag til at cellen går amok med sine delinger. Det sker hvis genet for Ras er<br />
muteret, sådan at der dannes en udgave der er konstant aktiv, altså bliver den ved med at sende<br />
vækstsignal ned i cellekernen.<br />
En måde at forhindre denne alternative Ras i at slå sine folder er at forhindre den i at nå frem til<br />
fedtlaget, for det har Ras brug for, da den ellers ikke er moden.<br />
Fig.18<br />
Ved at sætte en hæmmer (fig. 18) på Ras, og derved undgå at farnesyl-gruppen kan sætte sig på Ras<br />
og gøre den moden. Ras med hæmmer kan ikke komme frem til fedtmembranen og kan derved ikke<br />
aktivere cellens deling.<br />
Cellen har også en ”bremse” der fungerer ved signalstof/receptorer og en kæde af fosfyleringer med<br />
Smad2 , Smad3 og Smad4 der danner kompleks og aktiverer p15, som stopper cellens deling.(se<br />
fig.19) Men i denne kæde<br />
kan der mangle de enkelte Smad-proteiner, ligesom receptor og selve<br />
p15-genet<br />
kan<br />
mangle.<br />
Fig. 19<br />
TGF-beta<br />
receptorerne<br />
modtager<br />
TGF-<br />
beta,<br />
som er en<br />
antivækstfaktor.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 19 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
5,3: Apoptose<br />
Som<br />
før nævnt er alle cellerne i kroppen sociale og foretager sig derved ikke noget uden at have fået<br />
besked<br />
på det, og hvis den så ikke får nogle vækstfaktorer i et stykke tid, begår den selvmord, da<br />
den åbenbart nok ikke<br />
er nødvendig.<br />
I normalt væv sker der en afbalanceret deling / selvmord, men en mutation i selvmordsgenerne kan<br />
bremse cellernes selvmord, f.eks. i en svulst.<br />
Fig. 20<br />
ligand på cellens FAS-receptorer.<br />
Men cellen vil også dø hvis der er opstået uoprettelige skader<br />
på<br />
DNA, som f.eks. fra stråling eller kemikalier, da dette<br />
aktiverer p53, DNA’ets vogter. Men<br />
cellen vil også begå<br />
selvmord<br />
selv om den ikke får nogle af delene overhovedet,<br />
da den så er overflødig.<br />
Når en celle begår selvmord, går cellen ikke bare til grunde,<br />
men alle dens organeller som mitokondrier, ribosomer og det<br />
endoplasmatiske<br />
reticulum. På fig.20 ses hvordan cellen trin<br />
for trin går i opløsning, selv om processen kun tager kort tid.<br />
Et øjeblik førend cellen går i opløsning, ser den normal ud,<br />
men så fortættes DNA i cellekernen (det klippes i stykker af<br />
enzymer, CAD) og bliver synligt (A).<br />
Derefter skiller cellen sig fra basalmembranen og slipper de<br />
omgivende celler, og falder sammen (B).<br />
Cellen vender vrangen ud af sig selv, sådan at organellerne<br />
nu befinder sig uden på cellen(C). Dette<br />
er et signal til de<br />
omkringliggende celler og makrofager skal fagocytere den,<br />
altså spise resterne af cellen.<br />
Denne mekanisme, selvmordsprogrammet,<br />
kan aktiveres på<br />
forskellige<br />
måder, som vist på fig. 21.<br />
Fig. 21<br />
Cellen<br />
begår selvmord<br />
hvis der kommer en Tdræbercelle<br />
hen til<br />
cellen og påsætter<br />
dødsfaktoren FAS-
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 20 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Fig. 21 var den korte forklaring af hvordan cellen begår selvmord, men på Fig.22 er hvad der sker<br />
efter<br />
påvirkning.<br />
Fig.<br />
22<br />
I en normal celle der begår selvmord dannes der<br />
ikke så megen<br />
Bcl-2 at det gør noget, men i<br />
denne særlige form<br />
for lymfekræft er der sket en<br />
translokation<br />
af Bcl-genet fra kromosom 18 til<br />
kromosom 14, som har en høj genaktivitet, altså<br />
den er ”arbejder” meget. Derved dannes der<br />
meget mere Bcl-2 protein, som sætter sig i<br />
mitokondriet og blokerer cytokrom C og derved dødsprocessen.<br />
Efter at cellen er blevet påvirket af T-dræbercellen eller ingen<br />
vækstfaktorer eller en skade på DNA, sendes der signal til<br />
mitokondriet om at den skal frigive cytokrom C, som sidder på<br />
mitokondriet.<br />
Cytokrom C aktiverer dødsproteteaserne,<br />
caspaserne, som så ødelægger cellens skelet, cytoskelettet.<br />
Udover ødelæggelsen af skellet i cellen, aktiverer caspaserne<br />
CAD ved at spalte den fra sin hæmmer, ICAD.<br />
CAD<br />
går ind i cellekernen og klipper DNA-strengen i bitte små<br />
stykker, hvilket resulterer i at cellen dør.<br />
Men<br />
kræftceller begår ikke selvmord fordi de selv danner<br />
vækstfaktorer, eller dette system er ”kortsluttet”, som beskrevet<br />
i kapitlet om celledelingskontrol.<br />
Selv<br />
om p53 fungerer udmærket og forsøger at aktivere<br />
dødsprogrammet, kan det forhindres af Bcl-2 proteinet, som på<br />
fig. 23 kan holde cytokrom C tilbage i cellen og undgå at dette<br />
overhovedet kommer ud, ved at danne<br />
megen Bcl-2.<br />
Fig. 23.<br />
Cellernes selvmord kan også forhindres af proteinet<br />
Survivin, som kun findes i celler der deler sig,<br />
som f.eks. kræftceller. Survivin har den egenskab at det holder cellen<br />
i live ved at blokere<br />
caspaserne<br />
(se Fig. 22), og derved forbliver cellen intakt.<br />
Den<br />
sidste forhindring for dødsprogrammet er overlevelsesproteinet Hsp-70, som har en lignede<br />
effekt som Survivin, altså den bremser dødsprogrammet.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 21 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Men Hsp-70 er Jesper Nylandsted Larsen i stand til at fjerne, og det gør han ved at proppe en<br />
forkølelsesvirus med et stykke RNA der kan binde sig til Hsp-70’s m-RNA, således at den ikke<br />
er i<br />
stand til at blive oversat i ribosomet, da et stykke af Hsp-70<br />
m-RNA-strengen er dobbelt.<br />
Denne metode hedder antisense-hæmning og bruges til at hæmme bestemte proteiner i at blive<br />
dannet. I Jespers forsøg virkede ”kuren” både i petriskålen og i en hvis udstrækning også i mus,<br />
men<br />
nogle kræftceller overlevede, måske fordi at de ikke blev inficeret med virus.<br />
Det smarte træk i Jespers forsøg var at normale celler ikke behøver noget for at overleve, men i det<br />
øjeblik man tager Hsp-70 fra kræftceller, dør de.<br />
Dette gør at hvis man gerne vil ind hæmme / stoppe spirende kræftceller, så vil denne teknik<br />
være et<br />
godt skridt på vejen til at stoppe cellerne, måske kan det ikke gøres af en ”kur” alene, jævnfør<br />
Jespers forsøg hvor nogle kræftceller overlever, men i det tilfælde kan man angribe kræften ikke<br />
bare ad en vej, men ad flere, hvor man angriber kræftcellen med Rb-styrkende (eller<br />
hæmmer<br />
cyklin D / CDK4) , noget survivinhæmmende , antisense-Hsp70 og Bcl-2-hæmmer.<br />
Det er nok en god ide hvis man kan holde p53-genet<br />
intakt, eller benyttet ”kunstigt” p53.<br />
Et godt skridt på vejen ville også være en udersøgelse / forskning i hvilke funktioner mitokondriet<br />
har udover at være ”kakkelovnen” som giver energi til cellen, for det viste sig jo at dette<br />
dødsprogram var afhængigt af mitokondriets cytokrom C.<br />
5 ,4: Immunforsvaret<br />
Det<br />
specifikke immunforsvar:<br />
Når<br />
en bakterie kommer ind:<br />
Bakterien bliver ”spist” af makrofagen, som findeler denne og udstiller et stykke antigen (bakteriens<br />
væv)<br />
på sin overflade.(Fig. 24)<br />
Fig. 24<br />
Fig.<br />
25
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 22 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Derefter kommer der en T-hjælpecelle hen til makrofagen, som tager antigenet.(Fig. 25) Det er T-<br />
hjælpecellens<br />
opgave at genkende antigenet, og når det for bakterie-vævstypen er gjort, tilkalder<br />
den en B-celle vha. signalstoffer, ligesom makrofagen tilkaldte T-hjælpecellen<br />
med signalstoffer.<br />
Den<br />
B-celle kunne enten være en hukommelsescelle hvis nu immunsystemet inden for en bestemt<br />
tid har været udsat for det samme antigen, eller kan det være en anden B-celle som prøver sig frem,<br />
indtil at der er et virksomt antistof mod antigenet. Når det er sket sender B-cellen signal til<br />
plasmaceller om at producere det virksomme antistof.(Fig. 26)<br />
Fig.<br />
26<br />
Antistoffet har form som et y, sådan at den kan binde<br />
to antigener til et kompleks på en gang.<br />
Når en virus kommer ind.<br />
Hvis det er en virus i stedet for en bakterie, sker der det samme i starten, nemlig at makrofagen<br />
æder og udstiller antigenet på sin overflade, og en T-hjælpecelle tilkaldes.<br />
Men<br />
her sker der noget andet;<br />
T-hjælpecellen tilkalder en T-<br />
dræbercelle,<br />
som er i stand til<br />
at ødelægge celler der<br />
fremviser det fremmede<br />
antigen på sin overflade,<br />
derved dræber den de af<br />
kroppens celler der er<br />
inficeret.(Fig. <strong>27</strong>)<br />
Fig. <strong>27</strong><br />
Sort<br />
streg = fas-ligand som<br />
binder sig til fas-receptorer<br />
på<br />
den syge celles overflade,<br />
hvorefter<br />
cellen begår<br />
selvmord
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 23 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Dette system er lavet sådan at kun et antistof klumper med et antigen, deraf specifikt. Det udvikles i<br />
staten<br />
af livet, hvor man konfronteres med alle mulige forskellige sygdomme.<br />
Det<br />
uspecifikke immunforsvar.<br />
Det<br />
bedste der kan gøres for at undgå at blive syg, er at undgå at noget utøj slipper ind i kroppen.<br />
Det<br />
er hvad dette immunsystem gør, og med til dette hører huden og alle slimhinder, som f.eks. dem<br />
i munden. De aktive ”stoffer” her er det utal af bakterier og enzymer som i f.eks. har i munden, som<br />
hjælper med til at æde hvad der kunne<br />
komme på huden eller i munden. (Fig 28).<br />
Heri er det nu kun den specifikke del af immunsystemet der har interesse.<br />
T-cellen<br />
kunne altså finde frem til ”dårlige” celler ved hjælp af<br />
receptorer<br />
der sidder på cellernes overflade, og som viste hvad<br />
cellen var for en.<br />
Men<br />
kræftceller der undgår immunsystemet har fået en mutation<br />
i de gener der frembringer disse udstillingsgafler på overfladen,<br />
således at der ikke er nogle, og derved er kræftcellen usynlig for<br />
immunsystemet. (Fig.<br />
29, B)<br />
Fig. 29<br />
Nu er det en meget nærliggende tanke at immunsystemet jo bare<br />
kunne<br />
rydde kræftcellerne af vejen, for DNA’et er jo muteret så<br />
mange<br />
gange at det faktisk er fremmed, men så er der jo bare den<br />
hage<br />
at nogle kræftceller bruger T-dræbercellens eget våben.<br />
De har (Fig. 30) selv udviklet FAS-ligand, som sidder på cellens<br />
overflade, og når T-cellen kommer hen til den, sætter den sine<br />
egne FAS-receptorer på kræftcellens FAS. Dette udløser en<br />
øjeblikkelig selvmordreaktion.<br />
Fig. 28
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 24 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Fig.30<br />
Kræftcellen<br />
snyder T-cellen ved at give en<br />
omgang af ”dens egen medicin”.<br />
En måde at stoppe kræften på ville være at bruge immunterapi, altså hvor man bruger<br />
immunsystemets egne funktioner mod kræftcellerne(Fig.<br />
31). En måde er at trække nogle celler ud<br />
fra en svulst og bestemme deres antistoffer, sådan at man kan fremstille en svækket kræft i<br />
petriskål, som man så bruger til at stimulere T-celler med inden man putter dem ind i kroppen<br />
igen.<br />
Det vil virke ligesom en vaccination, men forskellen er bare at man skal tage prøver mange steder i<br />
svulsten for at kunne bestemme alle antistoffer på<br />
kræftcellerne, da en kræftsvulst ikke er ensartet,den<br />
består af mange genetisk forskellige celler, og<br />
derfor er man nødt til at stimulere mange grupper af<br />
T-celler, og dette arbejde skal gøres inden for en vis<br />
tid, da kræftcellerne ændrer sin arvemasse ved<br />
mutationer.<br />
En anden ide ville være at fremdyrke en slags T-<br />
Dræberceller, som er genetisk rendyket ud fra den<br />
pågældende patient, men hvor man har fjernet dens<br />
FAS-receptorer, sådan at den ikke slås ihjel når den<br />
opsporer celler med kræft-specifikke træk, men som<br />
har udviklet FAS-ligand.<br />
For at kunne styre cellen og stoppe den når der ikke<br />
længere er brug for den (kræften er død), skal den<br />
være afhængig af et eller andet stimulerende<br />
(altså<br />
en vækstfaktor), som stoppes med at indtage når der<br />
ikke er brug for cellen.<br />
Måske ville mange patienter være rigtigt godt<br />
hjulpet på vej hvis deres eget immunsystem ikke gik<br />
ned, (patienten ”går i sort”<br />
når diagnosen stilles)<br />
men styrket på en eller anden måde, det kunne for<br />
eksempel være en stimulerende vaccine.<br />
Fig. 31
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 25 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
5,5: Angiogenese<br />
Når<br />
kræftcellen vokser, har den et stigende behov for at få næring tilført, og dette gør at der er en<br />
naturlig stopper for kræftsvulsten,<br />
men så sker det naturligvis at der kommer mutationer i<br />
kræftcellerne,<br />
der skaber blodårer ind i svulsten, hvorefter kræften frit kan vokse videre.<br />
Når man kommer meget længere væk end <strong>10</strong>0 µm(omkring 20 cellelag) væk fra blodårerne,<br />
er<br />
iltniveauet kritisk. Dette gør at cellerne der er ved at blive kvalt, sender VEGF ud, og som har den<br />
effekt<br />
at de nærmeste blodårers endotelceller brydes og danner blodårer mod nø<strong>dk</strong>aldet.<br />
Men så enkelt fungerer angiogenesen heldigvis ikke, da der på endotelcellerne er et par<br />
forhindringer:<br />
Den<br />
første er at der på endotelcellens overflade er to slags VEGF receptorer, en R-1 og en R-2<br />
model, hvor det kun er hvis VEGF sætter sig på VEGFR-2 modellen at der sendes signal til kernen<br />
om angiogenese.<br />
Ud over dette problem er der et andet; de dannede blo<strong>dk</strong>ar er ”dårligt konstruerede”, dvs. at de<br />
lækker og hænger ikke sammen, for det skal der et andet protein, kaldet Ang-1 og Ang-2, der skal<br />
sætte sig på Tie-2 receptorerne der sidder på endotelcellens overflade.<br />
Ang-1 har den funktion at den styrker endotelcellernes opbygning, altså den styrker karvæggene.<br />
Ang-2 har den funktion at den blokerer Tie-2 receptorerne, og giver VEGF<br />
fri bane til angiogenese.<br />
Dvs. først skal blodbanen ved svulsten opløses, og der skal dannes blo<strong>dk</strong>ar til svulsten.<br />
Dette kræver at VEGF sætter sig på VEGFR-2, og Ang-2 sætter sig på Tie-2. (Fig. 32, nr.3)<br />
Derefter skal de ny blo<strong>dk</strong>ar modnes, og det sker kun hvis der er VEGF på VEGFR-2 og<br />
Tie-2. (Fig. 32, nr 1)<br />
Ang-1 på<br />
Hvis der ikke kommer signal ned til cellekernen på endotelcellerne, begår disse selvmord. (Fig. 32,<br />
nr 4)<br />
Fig. 32
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 26 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Denne viden om angiogenese kan så bruges til at hæmme kræftsvulster ved at man har fundet ud af<br />
at<br />
endotelcellerne i blodårerne ikke bliver immune af en behandling<br />
(angiostatin)<br />
som kræftcellerne vil blive.<br />
Derved<br />
kan man altså gang på gang slå en opblomstret koloni af<br />
kræftceller ned, og hvis man anvender noget cellegift ved siden af,<br />
altså f.eks. den ”kur” som beskrevet i den orange<br />
delkonklusions.boks under sidste kapitel, ville man måske være så<br />
heldig at man bliver i stand til at kværke kræftcellerne helt.<br />
At anvende angiostatin mod blodårerne og derved kvæle kræften, er<br />
muligvis en bedre løsning til at fjerne fremskredne kræftsvulster hos<br />
patienter, specielt ved tilfælde hvor svulsten sidder et sted hvor man<br />
ikke kan komme til at fjerne den kirurgisk, som f.eks. ved kræft<br />
i<br />
lunger/hjerne/lever og andre livsvigtige organer.<br />
Fig. 33<br />
5 ,6: Telomerer<br />
Normale<br />
celler deler sig kun et vist antal gange før de går på ”pension”, og derved stopper sin<br />
deling.<br />
Kræftceller kan derimod blive ved med at dele sig.<br />
Fig. 34<br />
Årsagen til at normale celler stopper sin deling, ligger i enden af kromosomerne. Her findes<br />
telomere, som er en lang gentagelse af sekvensen TTAGGG (cirka et par tusind gange).(fig.34)<br />
Når cellen deler sig, kommer DNA-polymerase og åbner strengen som kopieres, men enzymet kan<br />
ikke<br />
kopiere hele telomerhalen med, og efterlader sig et lille stykke på en 50-<strong>10</strong>0 nukleotider. Se<br />
fig. 35:
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> <strong>27</strong> <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Fig. 35<br />
En forklaring på hvorfor DNA<br />
ikke kopieres helt til enden:<br />
DNA består af to strenge, der<br />
hver skal kopieres ved<br />
celledeling. Her bliver den<br />
øverste<br />
(ledende) streng<br />
kopieret<br />
af DNA-polymerase<br />
δ, der kan kopiere helt til<br />
enden.<br />
Men den anden side af<br />
strengen ( manglende del)<br />
bliver kopieret med DNApolymerase<br />
α, som ikke kan<br />
starte kopieringen<br />
selv, med er<br />
nødt til at have en RNA-<br />
primer til at ”holde” strengen,<br />
mens at der kopieres. Lidt lige<br />
som et videobånd: Der er nødt<br />
til at være et stykke af båndet<br />
som sidder fast på spolerne,<br />
for at maskinen kan aflæse<br />
film en. Da RNA-primeren fjernes efter brug, er der altså et stykke af DNA-strengen, nærmere<br />
betegnet telomer-enden, der mangler, fordi at dette stykke ikke kunne kopieres da der sad en RNAprimer<br />
der.<br />
Når den normale celle får slidt sine<br />
telomere ned,<br />
kommer den til et<br />
punkt,<br />
kaldet Hayflick-grænsen, hvor<br />
DNA-vogteren<br />
p53 med p21 og p16<br />
går<br />
ind og stopper cellens deling.<br />
(Fig. 36, samt kapitel om<br />
celledelingskontrol med cirklen).<br />
Hen imod grænsen stiger mængden<br />
af vogterne, og lige så snart cellen<br />
får af vide at den ikke skal dele sig,<br />
stopper den for altid. Hvis den<br />
derimod fortsætter med at kopiere,<br />
som følge af at der ikke er nogen af<br />
vogterne til stede, vil telomerene<br />
blive så svage, at de ikke længere<br />
kan forhindre de klistrede<br />
kromosomer i at klistre sammen, og<br />
da vil cellen dø (krisen). Fig. 36
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 28 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
At kræftceller kan fortsætte forbi grænsen og alligevel overleve, fandt man svaret på i<br />
Tretrahymena.<br />
Da dens DNA meget ligner vores, måtte den have det samme problem, men den har et udviklet et<br />
træk som kræftceller<br />
der passerer telomer-katastrofen også har: Telomerase. (Fig 37):<br />
Fig. 37<br />
Telomerase er et enzym der er i stand til at gøre telemeren på kromosomerne længere.<br />
Det kan den gøre uden hjælp, da den selv (1) indeholder en omvendt skabelon til telomer-<br />
gentagelsen, dvs. at når nukleotiddelene der flyder rundt inde i cellek ernen sætter sig på RNAskabelonen<br />
i telomerase, dannes der den fantasiløse gentagelse af TTAGGG.(2)<br />
Når nu den ene streng er blevet genskabt, følger den anden med og bliver genskabt ved at RNA-<br />
primeren sætter sig på enden af det nyskabte telomer, hvorefter DNA-polymerasen δ lukker<br />
”hullet”, der er mellen RNA-primeren og enden på kromosomstrengen.<br />
Kræftcellerne bliver først reddet i sidste øjeblik, faktisk lige på det tidspunkt<br />
hvor krisen tager livet<br />
af mange celler, men kræftcellerne overlever lige med en smule uorden, hvilket er et særkende for<br />
kræft.<br />
Hos<br />
kønsceller er der<br />
også telomerase,<br />
men der bliver<br />
telomererne<br />
repareret straks<br />
efter<br />
delingen.(Fig.<br />
38)<br />
Fig. 38
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 29 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Telomerasen ligger i et gen ligesom alle andre proteiner og enzymer, og i normale celler ligger<br />
genet og slumrer, men<br />
genopleves pludselig ved en mutation, f.eks i en hæmmer eller ligende.<br />
Det<br />
må næsten være kræftcellens endeligt, hvis man finder ud af hvad og hvordan telomerasen<br />
aktiveres<br />
og hæmmes. F.eks. kunne man indføre et defekt telomerase-gen. (se fig. 39).(Er gjort)<br />
Fig. 39<br />
Virus (rød sekskant) indsætter en defekt udgave af telomerase-genet, og når kræftcellen så prøver at<br />
producere telomerase, danner den kun en defekt udgave, som bare optager pladsen for den rigtige<br />
telomerase. Snart vil cellen genopleve krisen og dø. Her gælder det bare om at virussen kun skal<br />
ramme<br />
kræftceller, for ellers går det galt. Det tager selvfølgelig også lige sin tid før at telomerasen<br />
på kræftcellerne er slidt helt ned, og derfor et stykke tid før behandligen virker.<br />
5 ,7: Metastase<br />
Der<br />
mangler kun et trin før at kræften kan kaldes en fuldmoden kræftknude; prikken over i’et er<br />
simpelthen<br />
at kræftcellerne vrister sig ud af deres leje, og bliver i stand til at kolonisere andre steder<br />
i kroppen. Cellerne er ”bundet” til hinanden ved hjælp af cadherin som vist på fig.40:<br />
Fig. 40<br />
Cellerne hænger sammen med<br />
E-cadherin, der sidder<br />
som et<br />
netværk på cellernes overflade,<br />
men uden<br />
modhageren β-catenin<br />
og forankningen α-catenin som<br />
sidder fast i cytoskelettet, ville<br />
E-cadherin bare blive trukket fra<br />
hinanden uden modstand.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 30 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
For at kræften skal kunne metastasere, skal den altså have nedbrudt ”forankningen”, altså<br />
cytoskelettet<br />
skal slippe α-cateninen. Men det er ikke nok at den bare løsrevet, men den skal også<br />
kunne<br />
flytte sig, og for at kunne dette (kræver stadig foskning) skal den have udskiftet/aktiveret en<br />
række gener, som gør cellen i stand til at kunne bevæge sig ligesom encellede dyr.<br />
Basalt kan metastaseringen opdeles i følgende faser:<br />
• Løsrivelse.<br />
• Mobilitet.<br />
• Passere karvæggen til blodbanen.<br />
• Overleve selvmord/immunsystem<br />
i blodbanen.<br />
• Målsøgning, den skal ramme lige netop det sted den er bestemt til.<br />
• Igen passere karvæg til nyt væv.<br />
• Tilpasning til de nye omgivelser.<br />
For at den mobile celle kan komme ud i blodbanen, skal der være et hul i karvæggen af kollagen.<br />
Uden for cellerne ligger inaktive udgaver<br />
af MMP samt deres hæmmer, TIMP. MMP’erne er både<br />
inaktive<br />
og der er en hæmmer, og dette er for at undgå at de pludselig finder på at nedbryde<br />
kollagenen der indespærrer cellerne.<br />
Lavinen, der aktiverer MMP’erne og får den til at gennemhulle kollagenen starter med at en inaktiv<br />
version af µ-Pa (Pro-µ-Pa) ligger mellem cellerne og venter på at blive aktiveret, hvilket sker f.eks.<br />
ved at kræftsvulsten kalder på mere blod,<br />
angiogenesen starter, og<br />
aktive proteaser aktiverer Pro-µ-Pa. Derved er lavinen (Fig. 41)<br />
startet.<br />
Fig. 41<br />
Plasmin,<br />
der er det sidste i rækken, er både i stand til at aktivere<br />
mere<br />
Pro-µ-Pa, og den kan nedbryde kollagen. Men vigtigst kan<br />
den aktivere MMP’erne samt nedbryde MMP’ernes hæmmer,<br />
TIMP. - En rigtig skidt fyr…<br />
Nu kan MMP’erne altså slippe metastase-cellen ud i blodbanen, og hvis den endelig overlever<br />
selvmord<br />
og immunsystem, skal den finde sig et passende sted at slå sig ned.<br />
Man<br />
mener at cellen gør det ved at der er såkaldte integriner på overfladen af cellen, som<br />
simpelthen hæfter sig til et bestemt sted som er mål for målsøgningen. Integriner har følgende<br />
egenskaber:<br />
• Forhindrer cellens selvmord.<br />
• Hjælper cellen<br />
med at flytte sig.<br />
• Den binder proteaser på overfalden af cellen, som nedbryder det omgivende væv.<br />
• Binder sig til receptorer som findes<br />
ved målet for målsøgningen.<br />
Når cellen skal ind i vævet, nedbryder proteaserne på overfladen cellevæggen, og dermed<br />
frigøres<br />
der vækstfaktorer som altså starter cellens kolonisering.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 31 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
Koloniseringen, altså den egentlige metastasering bunder måske (for brystkræft) i at kræftcellerne<br />
er afhængige af nogle vækstfaktorer som frigøres når osteoclasterne nedbryder knoglevævet.<br />
Kræftceller<br />
kan, når de er i knoglevævet, udskille hormonet PTH-rP, som stimulerer osteoclasterne,<br />
som<br />
derved vil nedbryde mere knogle..<br />
I andre kræftformer er det andre enheder der udnyttes, f.eks. ved prostatakræft, hvor det er noget<br />
som osteoblasterne (der opbygget knogler) udskiller som kræftcellerne er afhængige af.<br />
Da metastaseringsevnen stiger med tiden og derved alderen, kan cellerne til sidst blive uafhængige<br />
af<br />
kroppen, og derfor er det vigtigt at blive behandlet så hurtigt som muligt, for selvom at stoffet<br />
marimastat kan binde sig til zink-ionen i MMP’erne og hæmme metastaseringen, så er det (efter<br />
min overbevisning) vigtigt at få bremset kræften førend at den når at metastasere.<br />
6: KONKLUSION<br />
Hvis man skal have en rimelig chance mod kræften, må man angribe den adskillige steder fra, f.eks.<br />
med en kombinationskur, hvor man først forhindrer kræften i at<br />
metastasere, f.eks. med marimastat.<br />
Derefter<br />
kan man f.eks. angribe store kolonier uden kirurgi ved hjælp af anti-angiogenese stoffer.<br />
Førend<br />
man gjorde det havde man udtaget mange kræftceller og analyseret deres<br />
overfladeproteiner, som man så stimulerede T-celler med, som så blev sendt ind i kroppen for at<br />
rydde op.<br />
En anden mulighed er at ”fjerne” de proteiner som f.eks. er defekte ved at lave et antisense-nummer<br />
med dem. På samme måde som Jesper Nylandsteds forsøg med Hsp-70-proteinet, ville specielt<br />
arvelige sygdomme<br />
(herunder: kræft) kunne hæmmes med antisense-medicin, som kun virker<br />
specifikt,<br />
altså behandlingen rammer ikke alle celler i kroppen som f.eks. kemoterapi gør.<br />
Man vil altså kunne tilrette ”kuren”, behandlingen efter lige den sygdom som den pågældende<br />
patient har. Det er da med en langt mere elegant måde at kunne angribe lige netop de syge væv, i<br />
stedet for at ”skyde gråspurve med kanoner”.<br />
Det kræver naturligvis stadig en del forskning, bla. er det nødvendigt at øge cellernes<br />
optagelsesevne af medicinen, for ellers kræver det toxiske koncentrationer af stoffet. Antisensemedicinen<br />
har svært ved at komme igennem det fedtlag som omkranser cellen. Se vedlagt bilag:<br />
Lægemiddelforskning.<br />
Men det ville naturligvis være bedre at kunne stoppe tidlige mutationer ved at styrke kroppens eget<br />
reparationssystem, hvilket<br />
vil kræve en omfattende kortlægning af disse funktioner. Dette system<br />
kunne<br />
nemlig hele tiden sørge for at der ikke kommer nogle mutationer. Det kan også komme på<br />
banen<br />
at finde en måde at stimulere immunsystemet på, sådan at det vil slå virkeligt hurtigt og hårdt<br />
ned på mutant-celler.<br />
Langt hen ad vejen vil vi dog være godt hjulpet hvis vi undgik usunde levevaner som rygning,<br />
alkohol i store mængder og for megen mættet fedt, samt undgå cancergrille og solbagning, og af<br />
hensyn til kræft i tarmen,<br />
ville det hjælpe meget hvis vi undgik at spise så meget mere protein, altså<br />
langt<br />
ud over de anbefalede <strong>10</strong> %. Og når vi nu er ved ernæring, ville kroppen fungere noget bedre,<br />
altså hvis vi holder os til de 60 % sukker / stivelse , maks. 30 % fedt, og så de <strong>10</strong> % protein.
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 32 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
7,1: Liste Over Figurer:<br />
7: Litteraturliste<br />
Forside: Fra ”Bogen om kræft”. , Dr. Conly L. Rieder, Wadsworth Center, Albany, New York<br />
Grafer<br />
på indholdsfortegnelse, Bi01, Bi02 og Bi03 kommer fra NORDCAN.<br />
Figurer<br />
08 til og med 23 kommer fra sine respektive kapitler fra ”Bogen om Kræft”.<br />
(Birgitte Lerche, Lerche’s Tegnestue)<br />
Figurer<br />
29 til og med 41 kommer fra sine respektive kapitler fra ”Bogen om Kræft”.<br />
(Birgitte Lerche, Lerche’s Tegnestue)<br />
undtagen<br />
venstre del af Fig. 34:<br />
(34: Professor Peter Lansdorp, BC Cancer Research Centre, University of BC Vancouver,<br />
Canada)<br />
7,2: Andet materiale:<br />
”Bogen om kræft”, Kræftens Bekæmpelse. (Erhvervsskolernes Forlag 2001) ISBN: 87-7881-<strong>27</strong>4-7.<br />
Artikel<br />
fra ”Lægemiddelforskning” : ”Antisense-medicin – en vej til bedre lægemidler”.<br />
(Lise Smith, Jerzy W. Jaroszewski,<br />
Klaus Bahl Andersen og Lars Hovgaard.)
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 33 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong><br />
8: BILAG
<strong>Morten</strong> <strong>Tolberg</strong> <strong>Side</strong> 34 <strong>27</strong>-<strong>10</strong>-<strong>2003</strong>