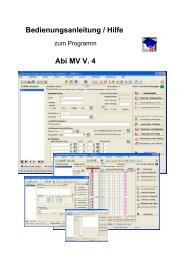
Version 0.8 (2011) - lern-soft-projekt
Version 0.8 (2011) - lern-soft-projekt
Version 0.8 (2011) - lern-soft-projekt
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
(Die Gitterstruktur-Darstellung (Abb. rechts) ist heute ein Sinnbild für die Chemie geworden)<br />
Zwar konnte diese Formel einige Besonderheiten des Benzen's erklären, aber einige chemische<br />
Eigenschaften stimmen nicht mit den Erwartungen aus den Formeln überein:<br />
So fehlen Isomere, wenn man an benachbarten Positionen substituiert. Eigentlich müssten<br />
die Bindungsabstände alternieren (ungleichseitiges Sechseck). Bei Messungen wurden sie<br />
aber als gleichgroß (gleichseitiges Sechseck) ermittelt. Der Bindungsabstand (139 pm) liegt<br />
fast mittig zwischen Einfach- (154 pm) und Doppelbindung (134 pm). Bei der vollständigen<br />
Hydrierung stimmen die praktisch gemessenen Energiedifferenzen nicht mit den theoretischen<br />
Vorhersagen (Standardberechnungen) überein (Hydrierwärme nur knapp doppelt so hoch, wie<br />
für eine Doppelbindung (hätte aber rund 3x so groß sein müssen)!). Weiterhin reagiert Benzen schwerer<br />
mit Brom (theor. sollte es Addition sein). Praktisch handelt es sich um eine Substition. Mit<br />
Bromwasserstoff reagiert Benzen überhaupt nicht.<br />
1867 versuchte James DEWAR (1842 – 1923) mit seinem Vorschlag einige<br />
ungeklärte Probleme zu lösen. Für einen sechseckigen Ring gab er drei mesomere<br />
Formeln an. Die von ihm vorgeschlagene Substanz konnte erst 1962<br />
wirklich hergestellt werden und ist ein vom Benzen abweichender Stoff. DE-<br />
WAR zu Ehre wurde der Stoff DEWAR-Benzen genannt.<br />
THIELE schlug 1899 eine Auflösung der Doppelbindungen vor und verteilte<br />
die freien Bindungen gleichmäßig auf den Sechseck-Körper. Die von THIELE<br />
vorgeschlagene Partialvalenz-Formel war der entscheidende weiterführende<br />
Schritt zur Aufklärung der Verhältnisse im Benzen-Molekül.<br />
Die Elektronen sind im regelmäßigen C-Sechseck scheinbar gleichmäßig verteilt. Durch<br />
spezielle Untersuchungen und Messungen konnte man die Existenz von Elektronen-Wolken<br />
ober- und unterhalb der Ringebene nachweisen.<br />
1925 erarbeitete der amerikanische Chemiker R. ROBINSON () dann eine völlig<br />
neue Schreibung für den aromatischen Zustand. Die besondere Elektronen-Anordnung<br />
wurde in einem – zur aufgeklärten Struktur passenden – Ring<br />
in das Cohlenstoff-Sechseck (Cohlenstoff-6er-Ring) eingezeichnet.<br />
Die ROBINSON-Formel ist mitlerwiele eines der verbreitesten Sinnbilder für<br />
die Chemie geworden.<br />
Heute wissen wir, dass die Elektronen-Wolken von den sechs delokalisierten -Elektronen<br />
gebildet werden. Es entsteht ein Elektronen-Sextett, die den besonderen aromatischen Zustand<br />
mit allen chemischen Konsequenzen ausmachen. Die theoretisch zwischen den C-<br />
Atomen alternierenden "Bananen"-Bindungen werden zu Ringen.<br />
Allgemein versteht man unter einem aromatischen Zustand heute solche Systeme, die aus<br />
cyclisch angeordneten, vollkonjugierten Polyenen bestehen. Sie besitzen ein Mesomeriestabilisiertes<br />
-Elektronen-System. Nach Erich HÜCKEL (1896 – 1980) sind solche cyclischen<br />
Polyene aromatisch, die mit 4n+2 -Elektronen ausgestattet sind (HÜCKELsche Regel,<br />
1931).<br />
Auch der Sonderfall n=1 in der HÜCKEL-Regel mit zwei -Elektrone ist wirklich bekannt<br />
(Cyclopropenyl-Kation).<br />
BK_SekII_orgChem_BioEL.doc - 96 - (c,p) 2009-<strong>2011</strong> lsp: dre