Grundlagen der Physikalischen Chemie 1 - TUM
Grundlagen der Physikalischen Chemie 1 - TUM
Grundlagen der Physikalischen Chemie 1 - TUM
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Grundlagen</strong> <strong>der</strong> <strong>Physikalischen</strong> <strong>Chemie</strong> 1<br />
– Chemische Thermodynamik & Kinetik –<br />
Hubert Gasteiger (Technische Elektrochemie) Thermodynamik<br />
Raum: 62-303<br />
Tel.: 13628<br />
E-mail: hubert.gasteiger@tum.de<br />
Sekretariat: Veronika Pichler, Raum 62-305, Tel.: 13679<br />
veronika.pichler@tum.de<br />
Thomas Kiefhaber (Biophysikalische <strong>Chemie</strong>) Kinetik<br />
Raum: 43-106<br />
Tel.: 13420<br />
E-mail: t.kiefhaber@tum.de<br />
Sekretariat: Sabine Kullick, Raum 43-104, Tel.: 13421<br />
sabine.kullick@ch.tum.de<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 1
Zeiten & Räume<br />
Vorlesung:<br />
dienstags: 15:30-17:15 mit Pause<br />
donnerstags: 15:15-16:00<br />
Übungen:<br />
Alexan<strong>der</strong> Ogrodnik: Raum 43309; Tel.: 13464; alexan<strong>der</strong>.ogrodnik@ch.tum.de<br />
Zentralübung-1: donnerstags, 16:00-17:00 (für alle an<strong>der</strong>en)<br />
Zentralübung-2: montags, 10:05-11:00 (für CIW-ler)<br />
Gruppe 1: montags, 11:15-12:00 (CH53301/ CH53306)<br />
Gruppe 2: donnerstags, 10:15-11:00 (CH21010)<br />
Gruppe 3: donnerstags, 14:15-15:00 (CH53301/ CH53306)<br />
Zusatzübungen mit Fragestunde und Vertiefung:<br />
nach Wunsch und Bedarf<br />
jede Woche 1 Übungsblatt mit 3-4 Aufgaben<br />
Ausgabe auf <strong>der</strong> homepage jeweils am Dienstag:<br />
http://dante.phys.chemie.tu-muenchen.de/<br />
Musterlösung nach <strong>der</strong> Übung auf homepage abrufbar<br />
Kennwort: tumpc<br />
Klausur: 8. August 2012 (Ort, Zeit noch zu bestimmen)<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 2
Inhaltsverzeichnis<br />
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
2. Erster Hauptsatz: Arbeit und Wärme<br />
3. Entropie und Zweiter Hauptsatz <strong>der</strong> Thermodynamik<br />
4. Freie Enthalpie G, Freie Energie A, Gibbs Helmholtz’sche Gleichung<br />
5. Mehrkomponenten Systeme – Gleichgewichte<br />
6. Einführung in die Kinetik<br />
Acknowledgements: Für Folien, Bil<strong>der</strong>, Anregungen und moralische Unterstützung!<br />
- Julia Kunze (<strong>TUM</strong>, Physik)<br />
- Alexan<strong>der</strong> Ogrodnik (<strong>TUM</strong>, <strong>Chemie</strong>)<br />
- Thomas Schmidt (ETH, <strong>Chemie</strong>)<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 3
Inhaltsverzeichnis<br />
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.1 Definitionen: System & Zustandsgrößen<br />
1.2 Ideale Gase<br />
1.3 Kinetische Gastheorie<br />
1.4 Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
1.5 Geschwindigkeitsverteilung <strong>der</strong> Moleküle<br />
1.6 Mittlere freie Weglänge und Stoßzahl<br />
1.7 Zustandsgleichung realer Gase<br />
2. Erster Hauptsatz: Arbeit und Wärme<br />
2.1 Was ist eine Zustandsfunktion ?<br />
2.2 Innere Energie<br />
2.3 Die Molwärme<br />
2.4 Zustandsfunktion bei konstantem Druck: die Enthalpie<br />
2.5 Temperaturabhängigkeit von U und H<br />
2.6 Enthalpie- und Energie <strong>der</strong> Elemente<br />
3. Entropie und Zweiter Hauptsatz <strong>der</strong> Thermodynamik<br />
3.1 Reversible, irreversible Prozesse<br />
3.2 Wärmekraftmaschinen (Carnot’scher Kreisprozess)<br />
3.3 Entropie - thermodynamische Definition<br />
3.4 Entropieän<strong>der</strong>ung reversibler Prozesse<br />
3.5 Entropieän<strong>der</strong>ung irreversibler Prozesse<br />
3.6 Entropie von System & Umgebung – Clausius’sche Ungleichung<br />
3.7 Messung <strong>der</strong> Entropie – 3. Hauptsatz<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 4
Inhaltsverzeichnis<br />
3.8 Mikroskopische (statistische) Interpretation <strong>der</strong> Entropie<br />
3.9 Entropieän<strong>der</strong>ung bei chemischen Reaktionen<br />
4. Freie Enthalpie G, Freie Energie A, Gibbs Helmholtz’sche Gleichung<br />
4.1 Maximal mögliche Arbeit freie Energie A<br />
4.2 Maximal mögliche Nicht-Volumenarbeit Freie Enthalpie G<br />
4.3 Gibbs’sche Gleichungen – Fundamentalgleichungen <strong>der</strong> Thermodynamik<br />
4.4 `Die Gibbs-Helmholtz Gleichung – T-Abhängigkeit von G<br />
4.5 Die Maxwellgleichungen<br />
5. Mehrkomponenten Systeme - Gleichgewichte<br />
5.1 Physikalische Gleichgewichte - Phasengleichgewichte<br />
5.2 Chemisches Gleichgewicht<br />
5.3 Chemisches Potential in Lösungen und Mischungen<br />
5.3 Elektrochemisches Gleichgewicht<br />
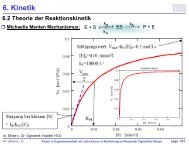
6. Einführung in die Kinetik<br />
6.1 Geschwindigkeit von Reaktionen<br />
6.2 Reaktionsordnungen<br />
6.3 Aktivierung/Katalyse<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 5
Literatur<br />
• Peter W. Atkins, Physikalische <strong>Chemie</strong>, 2. Aufl., Wiley-VCH.<br />
• Peter W. Atkins, Julio de Paula, Physikalische <strong>Chemie</strong>, 4. Aufl., Wiley-VCH.<br />
• Direktverweise auf Folien.<br />
• G. Wedler, Lehrbuch <strong>der</strong> <strong>Physikalischen</strong> <strong>Chemie</strong>, 3. Aufl., VCH Weinheim.<br />
• G. Wedler, Lehrbuch <strong>der</strong> <strong>Physikalischen</strong> <strong>Chemie</strong>, 5. Aufl., VCH Weinheim.<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 6
Thermodynamik/Kinetik – wozu?<br />
Was passiert, wenn man Salz in kochendes Wasser gibt ?<br />
Kann man auf Trockeneis Schlittschuh laufen ?<br />
Wie beschreibt man ein chemisches Gleichgewicht ?<br />
Wie macht man flüssige Luft ?<br />
Was ist eine elektromotorische Kraft ?<br />
Wie schnell ist eine Reaktion ?<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 7
Übersichtsfolien – Zielsetzung<br />
Aufgaben und Ziele <strong>der</strong> Thermodynamik<br />
1. Hauptsatz:<br />
U, H<br />
2. Hauptsatz:<br />
S, G, F<br />
Funktionelle Thermodynamik:<br />
Kennt keinen Molekül bzw. Atombegriff.<br />
Verknüpft makroskopisch messbare<br />
Größen miteinan<strong>der</strong>.<br />
Umsatz von Energie (Wärme, Arbeit) bei physikalischen und<br />
chemischen Vorgängen<br />
chem. Reaktionen, Schmelzen, Verdampfen, Sublimieren, Lösen<br />
Richtung <strong>der</strong> freiwillig ablaufenden physikalischen und chemischen<br />
Vorgänge (Irreversibilität).<br />
Maximale Arbeit beim Ablauf von Vorgängen;<br />
Beschreibung von Gleichgewichten;<br />
Formalismus zur Beschreibung u. Ableitung physikalischer u.<br />
chemischer Reaktionen;<br />
Statistische Thermodynamik:<br />
Geht von den Eigenschaften <strong>der</strong> Atome und<br />
Moleküle aus und leitet mit statistischen<br />
Methoden daraus makroskopisch messbare<br />
Eigenschaften ab.<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 8
Übersichtsfolien – 1. Hauptsatz<br />
Definition<br />
offene<br />
geschlossene Systeme<br />
isolierte<br />
Definition<br />
Innere Energie<br />
U = Q + w<br />
Zuführung von Arbeit unter<br />
adiabatischen Bedingungen<br />
Adiabatisches System<br />
U = w<br />
Isochorer Fall w= U Isobarer Fall w= H<br />
bessere Beschreibung durch U bessere Beschreibung durch Enthalpie H<br />
U U<br />
dU CVdT<br />
dV dni<br />
V n <br />
i<br />
Abhängigkeit von U von T,V und <strong>der</strong><br />
Zusammensetzung (ni )<br />
Molwärme bei V=const.<br />
<br />
<br />
<br />
<br />
<br />
U<br />
<br />
CV <br />
T<br />
<br />
V, ni<br />
U U0<br />
CVdT<br />
Temperaturabhängigkeit von U<br />
H H<br />
dH CpdT<br />
dp dni<br />
p n <br />
i<br />
Abhängigkeit von H von T,p und <strong>der</strong><br />
Zusammensetzung (ni )<br />
Molwärme bei p=const.<br />
<br />
i<br />
<br />
<br />
<br />
H<br />
<br />
Cp <br />
T<br />
<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 9<br />
p, ni<br />
von: Julia Kunze<br />
H H0<br />
CpdT<br />
ΔHf,<br />
fl Cp<br />
dT ΔH C dT<br />
fl<br />
f, gl pgl<br />
Temperaturabhängigkeit von H
Übersichtsfolien – chem. Gleichgewichte<br />
Bedeutung & Anwendung <strong>der</strong> Gleichgewichtsthermodynamik<br />
1. Hauptsatz:<br />
Energieerhaltung<br />
Definition: Innere Energie U,<br />
Enthalpie H<br />
Richtung von Prozessen<br />
in nicht abgeschlossenen<br />
Systemen:<br />
G > 0 nicht möglich<br />
G = 0 Gleichgewicht<br />
G < 0 möglich<br />
von: Julia Kunze<br />
Gibbs-Helmholtz-Gleichung: G = H – TS<br />
Definition: Freie Energie A, Freie Enthalpie G<br />
Chemisches Potential µ i : µi = µ i 0 + RT ln ai<br />
G und<br />
chemisches<br />
Gleichgewicht:<br />
ln K = – G 0 /RT<br />
G und elektrochemisches<br />
Gleichgewicht:<br />
0 = – G 0 /zF<br />
2. Hauptsatz:<br />
Richtung von Prozessen in<br />
abgeschlossenen Systemen<br />
Definition: Entropie S<br />
G zur<br />
Ableitung von<br />
chemischen u.<br />
physikalischen<br />
Gleichgewichten<br />
G bei <strong>der</strong> Kopplung<br />
biochemischer Prozesse;<br />
Gruppenübertragungspotential;<br />
„energiereiche“ Bindung<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 10
Kapitel 1 – Teil 1<br />
Ideale Gase<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 11
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.1. System & Zustandsgrössen<br />
Offenes System<br />
– Materiefluss über die Systemgrenze möglich<br />
– Energiefluss über die Systemgrenze möglich (diatherm)<br />
Austausch von Materie und Energie mit <strong>der</strong> Umgebung<br />
Geschlossenes System<br />
– Kein Materiefluss über die Systemgrenze möglich<br />
– Energiefluss über die Systemgrenze möglich<br />
Austausch von Energie mit <strong>der</strong> Umgebung<br />
Umgebung<br />
System<br />
Abgeschlossenes System<br />
– Kein Materiefluss über die Systemgrenze möglich<br />
– Kein Energiefluss über die Systemgrenze möglich (adiabatisch)<br />
Kein Austausch mit <strong>der</strong> Umgebung<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 12
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.1. System & Zustandsgrössen<br />
Mikroskopische Beschreibung eines idealen Gases anhand seiner Freiheitsgrade<br />
(pro Mol >10 23 ) schwierig.<br />
Beschreibung des Zustandes eines idealen Gases anhand von makroskopischen<br />
Eigenschaften (=Zustandsgrößen): vollständige und eindeutige Charakterisierung.<br />
Volumen: V<br />
Druck: p ( Kraft/Fläche)<br />
Temperatur: T<br />
Teilchenzahl N bzw. Molmenge n<br />
Extensive Größen: hängen von <strong>der</strong> Größe des Systems bzw. <strong>der</strong> Stoffmenge ab: V, m, N, ect.;<br />
Intensive Größen: sind unabhängig von <strong>der</strong> Stoffmenge: p, T;<br />
Molare Größen: extensive Größen, die auf die Molmenge normiert sind:<br />
- Molvolumen: Vm =V/n<br />
- Molmasse: M=m/n<br />
durch Normierung intensive Größen geworden.<br />
Auch <strong>der</strong> Quotient zweier extensiver Grössen ist eine intensive Grösse: z.B. ρ=m/V<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 13
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.1. System & Zustandsgrössen<br />
Volumen: V<br />
Druck: p ( Kraft/Fläche)<br />
Temperatur: T<br />
Teilchenzahl N bzw. Molmenge n<br />
Mikroskopische Deutung dieser Zustandsgrößen ist möglich:<br />
- anhand <strong>der</strong> kinetischen Gastheorie;<br />
- und anhand <strong>der</strong> Boltzmannverteilung (ergibt sich aus statistischer Untersuchung <strong>der</strong><br />
Möglichkeiten, die Energie auf die Freiheitsgrade zu verteilen)<br />
Gesamtenergie des Systems ist durch die Zustandsgrößen eindeutig definiert.<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 14
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Zustandsgleichung<br />
Gasgesetze: ideales Gas: punktförmigen Teilchen ohne Wechselwirkung<br />
& elastische Stösse zwischen den Teilchen<br />
Gesucht: empirischer Zusammenhang zwischen den Zustandsgrößen p,V,T und n<br />
Zustandsgleichung<br />
Ansatz: Untersuchung des Zusammenhang jeweils zweier Größen (an<strong>der</strong>e konstant):<br />
Boyle-Mariotte: p & V variabel (n & T konstant)<br />
Isothermen<br />
Gay-Lussac/Charles: T & V variabel (n & p konstant)<br />
Isobaren<br />
Avogadro: V & n variabel (T & p konstant)<br />
Skript (Dr. Ogrodnik): Kap. 2, S. 14<br />
Robert Boyle<br />
1627-1691<br />
J.L. Gay-Lussac<br />
1778-1850<br />
Amedeo Avogadro<br />
1776-1856<br />
E. Mariotte<br />
1620-1684<br />
Jacques Charles<br />
1746-1823<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 15
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Zustandsgleichung<br />
Boyle-Mariotte: isotherme Kompression/Expansion<br />
(T konstant via Wärmebad; n=konstant)<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 16<br />
<br />
p <br />
1<br />
V<br />
at T=konstant<br />
Hyperbeln (pV=konstant) nähern sich asymptotisch <strong>der</strong> V- und <strong>der</strong> p-Achse<br />
mit steigendem T nimmt pV zu Hyperbeln verschieben sich zu höheren Werten<br />
gilt exakt im Grenzfall p 0<br />
V <br />
wenn p 0
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Zustandsgleichung<br />
Gay-Lussac: isobare Kompression/Expansion<br />
(p & n = konstant)<br />
Anwendung:<br />
Das erste Thermometer, 1612 von Santorio (1561 – 1636)<br />
war ein Gasthermometer (Luft-Thermometer)<br />
Beobachtung: Gas ist ein Medium mit hoher Linearität<br />
<strong>der</strong> thermischen Ausdehnung.<br />
Skript (Dr. Ogrodnik): Kap. 2, S. 16<br />
Volumen dehnt sich linear mit T aus<br />
extrapolation auf V=0: absolute T-Skala<br />
V <br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 17<br />
<br />
T<br />
at p=konstant
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase – Zustandsgleichung: absolute Temperatur Skala<br />
Beobachtung:<br />
Extrapolation <strong>der</strong> Geraden V(T) o<strong>der</strong> p(T) nach sehr tiefen T ergibt:<br />
Verschiedene Ausgangsmengen eines Gases extrapolieren auf den gleichen Punkt.<br />
Verschiedene Gase extrapolieren auf den gleichen Punkt.<br />
Dieser Punkt entspricht V=0, bzw. p=0.<br />
Skript (Dr. Ogrodnik): Kap. 2, S. 16<br />
Schlussfolgerung:<br />
Es gibt eine tiefste Temperatur<br />
(V & p können nicht negativ sein)<br />
Diese Temperatur ist als<br />
absoluter T-Nullpunkt festgelegt<br />
Kelvinskala: -273,15 °C 0K T[K] = [ºC] + 273.15<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 18
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Zustandsgleichung<br />
Satz von Avogadro:<br />
gleiche Volumina idealer Gase bei gleichem p & T<br />
enthalten die gleiche Anzahl Moleküle<br />
Definition <strong>der</strong> Stoffmenge, n [mol]:<br />
12g Kohlenstoff ( 12C Isotop) 1 mol Teilchen (SI Einheit)<br />
NA = 6,0221023 Teilchen/mol-1 (Avogadro‘sche Zahl).<br />
V <br />
gilt umso besser, je geringer p<br />
z.B. bei 0ºC / 0.1MPa: V m (CO 2 )=22.26 L/mol, V m (Ar)=22.09 L/mol<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 19<br />
<br />
n<br />
at p & T=konstant
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Zustandsgleichung<br />
Zustandsgleichung (ideales Gasgesetz):<br />
Boyle-Mariotte: pV = Konstante (n & T = konstant)<br />
Gay-Lussac: V = Konstante T (n & p = konstant)<br />
Avogadro: V = Konstante n (T & p = konstant)<br />
<br />
Skript (Dr. Ogrodnik): Kap. 2, S. 17<br />
pV = Konstante nT<br />
pV = nRT<br />
mit <strong>der</strong> Gaskonstante<br />
R <br />
8,<br />
31441<br />
J<br />
K mol<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 20<br />
pV<br />
nT<br />
<br />
R via pV/(nT) wenn p 0<br />
n.b.: T muss in Kelvin eingesetzt werden (Einheiten!)
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Zustandsgleichung<br />
Gaskonstante:<br />
die Gaskonstante R bezieht sich auf die Stoffmenge.<br />
bezieht man sich auf die Teilchenzahl N=nNA , erhält man:<br />
N R<br />
pV nRT RT<br />
N T<br />
pV N k B T<br />
N N<br />
Boltzmannkonstante:<br />
A<br />
k<br />
B<br />
A<br />
R<br />
23<br />
J<br />
1,<br />
38110<br />
auf 1 Teilchen bezogen !<br />
N<br />
K<br />
A<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 21
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Zustandsgleichung<br />
Standardbedingungen & molares Volumen:<br />
a) SATP (Standard Ambient Temperature and Pressure)<br />
heute gebräuchlicher Standard: T = 298,15 K = 25 °C ; p = 100000 Pa = 10 5 Pa = 1 bar<br />
<br />
V<br />
θ<br />
m<br />
V<br />
n<br />
R T<br />
θ<br />
p<br />
8.<br />
314<br />
b) STP (Standard Temperature and Pressure)<br />
θ<br />
<br />
J<br />
<br />
mol<br />
K<br />
5 N<br />
10 2<br />
m<br />
298K<br />
24,<br />
79<br />
früher gebräuchlicher Standard (üblich in USA/UK): T = 273,15 K = 0 °C ; p = 101325 Pa = 1 atm<br />
<br />
<br />
V θ<br />
m <br />
<br />
<br />
22,<br />
41<br />
L<br />
mol<br />
Standards werden von folgenden Organisationen festgelegt:<br />
IUPAC: International Union of Pure and Applied Chemistry<br />
NIST: National Institute of Standards and Technology<br />
ISO: International Organization for Standardization<br />
EPA: United States Environmental Protection Agency<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 22<br />
<br />
L<br />
mol
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Zustandsgleichung<br />
Zustandsgleichung (ideales Gas) – 3D Zustandsdiagramm:<br />
Auflösung <strong>der</strong> idealen Gasgleichung nach p, V o<strong>der</strong> pV :<br />
Darstellung müsste 4-dimensional sein (n!)<br />
für n= konst. gilt die rechte 3D Auftragung<br />
Isothermen:<br />
Isobaren:<br />
Isochoren:<br />
pV<br />
n R<br />
T<br />
n R<br />
V T<br />
p<br />
n R<br />
p T<br />
V<br />
Es gibt Prozesse, die nicht isotherm, isobar o<strong>der</strong> isochor<br />
ablaufen, z.B. aidiabatische Prozesse (kein Wärmeaustausch)<br />
gleichzeitige Variation von p & T in adiabaten Prozessen<br />
Skript (Dr. Ogrodnik): Kap. 2, S. 17<br />
Isotherme: T = konst.<br />
Isobare: p = konst.<br />
Isochore: V = konst.<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 23
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase – Daltonsches Gesetz<br />
Ideale Gasgemische: Druck einer idealen Gasmischung ist Summe <strong>der</strong> Einzeldrücke,<br />
die die Einzelkoponenten im Gesamtvolumen ausüben würden<br />
= N 2<br />
<br />
p<br />
<br />
p<br />
....<br />
<br />
p<br />
N<br />
p = +<br />
= O 2 2<br />
p<br />
wobei:<br />
A<br />
B<br />
p j <br />
n<br />
Partialdruck N 2<br />
p<br />
O<br />
2<br />
Partialdruck O 2<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 24<br />
j<br />
RT<br />
V<br />
<br />
j<br />
p<br />
+<br />
j
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase – Molenbruch & Partialdruck<br />
Molenbruch:<br />
x j <br />
<br />
n<br />
n<br />
j<br />
, mit n = n A +n B + …<br />
x A x B ...<br />
1<br />
Definition des Partialdrucks eines idealen/realen gases:<br />
p ...<br />
( x x ) p<br />
p<br />
p A B<br />
A b...<br />
<br />
nur für ideales gas:<br />
p<br />
j<br />
<br />
n<br />
n<br />
j<br />
<br />
nRT<br />
V<br />
<br />
n<br />
p j x j p<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 25<br />
j<br />
RT<br />
V<br />
Daltonsches Gesetz
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.2. Ideale Gase - Partialvolumen<br />
Volumen einer Gaskomponente, wenn alleine bei gleichem Druck vorliegend<br />
V<br />
N<br />
V = +<br />
2<br />
V<br />
O<br />
2<br />
Druck bleibt gleich Volumenverteilung spezifisch<br />
… Tafelanschrieb<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 26
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.3. Kinetische Gastheorie – Gasdruck eines idealen Gases<br />
Annahmen: - Moleküle mit Masse, m, und Durchmesser, D, in kontinuierlicher<br />
zufälliger Bewegung<br />
- Molekülgrösse klein i. Vgl. zur mittleren freien Weglänge<br />
- elastische Stösse als einzige Wechselwirkung<br />
(Translationsenergie zur und nach Stoss unverän<strong>der</strong>t)<br />
Druck: p= F(Kraft) / A(Fläche) Kraft ?<br />
Kraft via Impulsübertragung<br />
beim Stoss an die Wand:<br />
F<br />
Skript (Dr. Ogrodnik): Kap. 4, S. 48<br />
x<br />
m a<br />
<br />
<br />
x<br />
x<br />
dv<br />
m <br />
dt<br />
x<br />
F dt 2<br />
m v<br />
d(<br />
m v<br />
<br />
dt<br />
x<br />
x<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 27<br />
)<br />
v x : Geschwindigkeit<br />
a x : Beschleunigung<br />
t: Zeit<br />
m: Masse<br />
mv x : Impuls
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.3. Kinetische Gastheorie – Gasdruck eines idealen Gases<br />
Annahmen:<br />
- Beobachtung über t<br />
- Teilchenkonzentration: nNA /V<br />
- Teilchengeschwindigkeit: vx Tafelanschrieb: Ableitung des Drucks<br />
<br />
n M<br />
<br />
p <br />
V<br />
v<br />
2<br />
x<br />
1<br />
pV n M <br />
3<br />
2<br />
<br />
; = quadratisch gemittelte Molekülgeschwindigkeit,<br />
Vergleich mit idealem Gasgesetz:<br />
; M = Molekulargewicht<br />
= N A m<br />
v<br />
das heisst,<br />
3RT<br />
M<br />
v 2 z.B., bei 298K:<br />
2 2 2<br />
1/<br />
2<br />
2<br />
v v v v<br />
c <br />
<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 28<br />
x<br />
y<br />
z<br />
v 2<br />
CO 2<br />
<br />
411 m / s
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.3. Kinetische Gastheorie – Vergleich mit idealem Gasgesetz<br />
kin. Gastheorie:<br />
unter Berücksichtigung dass<br />
<br />
1<br />
pV n M <br />
3<br />
2<br />
v ;n.b.:<br />
c <br />
2<br />
v<br />
Ekin 1<br />
M<br />
<br />
per Mol 2<br />
2<br />
v M <br />
2<br />
v 2<br />
Ekin<br />
2<br />
pV n Ekin<br />
3<br />
pro Mol<br />
pV hängt nur von <strong>der</strong> Molmenge, n, &<br />
E<br />
per Mol<br />
<strong>der</strong> mittl. kinetischen Energie, , ab<br />
Vergleich mit empirischer Zustandsgleichung des idealen Gases: pV nRT<br />
2<br />
3<br />
kin<br />
E RT<br />
pro<br />
kin <br />
pro Mol<br />
3<br />
2<br />
n E nRT<br />
pV Mol<br />
die Temperatur bestimmt die kinetische Energie <strong>der</strong> Teilchen !<br />
bei T = 25ºC = 298,15 K: 3,<br />
718kJ<br />
mol<br />
Ekin pro Mol<br />
Anregung von Molekülschwingungen bei 25ºC nicht möglich<br />
(s. Skript, Kapitel 9.2: Schwingungsenergien meist 20-50 kJ/mol)<br />
per Mol<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 29<br />
kin
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.3. Kinetische Gastheorie – Vergleich mit idealem Gasgesetz<br />
Einfluss <strong>der</strong> Molekülmasse:<br />
<br />
1<br />
Zwei Gase mit M1 und M2 haben im thermischen<br />
Gleichgewicht die gleiche Temperatur<br />
gleiche mittlere kinetische Energie bei<strong>der</strong> Gase<br />
2<br />
1<br />
1 n<br />
p1 M1<br />
<br />
3 V<br />
1 n<br />
p2 M2<br />
<br />
3 V<br />
1<br />
2 1<br />
2<br />
Ekin,1 M<br />
per Mol<br />
1 v1<br />
M2<br />
v2<br />
<br />
2<br />
2<br />
2<br />
2<br />
2<br />
v<br />
2<br />
1<br />
per Mol<br />
M v M v schwere Moleküle sind langsamer<br />
Bei gleicher Konzentration, n/V, üben Teilchen unterschiedlicher Molmasse<br />
trotz unterschiedlicher Geschwindigkeit den gleichen Druck aus:<br />
v<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 30<br />
2<br />
2<br />
E<br />
kin,2
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Nullter Hauptsatz <strong>der</strong> Thermodynamik<br />
diatherme Wand<br />
hohe<br />
Wärme<br />
niedrige<br />
Temperatur Temperatur<br />
Sind zwei Systeme durch eine wärmedurchlässige (diatherme)<br />
Wand verbunden, kann sich ein thermisches Gleichgewicht einstellen<br />
Stehen verschiedene Systeme (A, B, C) im thermischen Gleichgewicht,<br />
so haben sie die gleiche Temperatur<br />
gleiche mittlere kinetische Energie:<br />
3RT<br />
2<br />
<br />
Ekin A<br />
Ekin<br />
B<br />
<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 31<br />
E<br />
kin<br />
C
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Gleichverteilungssatz<br />
Energieerhaltungssatz: über alle Teilchen gemittelter Mittelwert <strong>der</strong><br />
Energie ist konstant: konst.<br />
Ekin Ensemble<br />
Gleichverteilungssatz: jedes einzelne Teilchen gemitteltet über die<br />
E <br />
Zeit hat dieselbe mittlere Energie: kin Zeit kin Ensemble<br />
für N Teilchen, die Mittelwerte <strong>der</strong> Energie, E gesamt , sind:<br />
bei gleicher Masse aller Teilchen, gleiche kinetische Energie<br />
da keine Vorzugsrichtung:<br />
<br />
E<br />
x<br />
kin<br />
<br />
E<br />
y<br />
kin<br />
<br />
E<br />
z<br />
kin<br />
<br />
v<br />
2<br />
x<br />
gleiches<br />
<br />
E<br />
3<br />
kin<br />
v<br />
Einzelteilchen<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 32<br />
2<br />
y<br />
<br />
<br />
RT<br />
2<br />
v<br />
2<br />
z<br />
2<br />
v<br />
<br />
v<br />
2<br />
3<br />
E<br />
kin<br />
E<br />
Einzelteilchen<br />
Im thermischen GG hat je<strong>der</strong> Translationsfreiheitsgrad die gleiche mittlere Energie<br />
<br />
E<br />
gesamt<br />
N
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Gesamtenergie eine thermodynamischen Systems – die Innere Energy, U<br />
Ordnen und Zusammenfassen dieser Energien ergibt:<br />
Translationsenergie: translatorische Bewegungsenergie (kin. Energie) <strong>der</strong> Atome/Moleküle<br />
in 3 Raumrichtungen<br />
Rotationsenergie: kin. Energie aufgrund <strong>der</strong> Rotation <strong>der</strong> Moleküle um versch. Achsen.<br />
v<br />
Schwingungsenergie: pot. und kin. Energie <strong>der</strong> Atome aufgrund <strong>der</strong> Schwingungsbewegung<br />
<strong>der</strong> Atome im Molekül<br />
Chem. Bindungsenergie: intramolekulare WW.<br />
Intermolekulare WW: aller Moleküle: reales Gas (Van-<strong>der</strong>-Waals WW)<br />
Die Innere Energie U setzt sich aus den Beiträgen <strong>der</strong> Translations-, Rotationsund<br />
Schwingungsfreiheitsgrade zusammen (ideales System)<br />
Skript (Dr. Ogrodnik): Kap. 5.1, 5.2, 5.3 & 5.8<br />
mit, U: E kin + U pot aller Elektronen<br />
und aller Kerne<br />
vorerst vernachlässigt<br />
(keine Reaktionen;<br />
ideales Gas)<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 33
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Translationsfreiheitsgrade:<br />
Tranlationsfreiheitsgrade in x, y, und z: FG trans =3<br />
Rotationsfreiheitsgrade:<br />
Rotation um Molekülschwerpunkt, abhängig von <strong>der</strong> Molekülsymmetrie:<br />
- einatomig: FGrot =0<br />
durch Stoss von einem Atom mit an<strong>der</strong>em,<br />
keine Drehimpulsübertragung möglich<br />
(“abrutschen” an “glatter” Elektronenhülle)<br />
- lineare Moleküle: FG rot =2<br />
2 Rotationsachsen<br />
(Rotation um Molekülachse:<br />
keine Positionsverän<strong>der</strong>ung)<br />
- nicht-lineare Molek.: FG rot =3<br />
3 unabhängige Rotationsachsen<br />
Skript (Dr. Ogrodnik): Kap. 5.1, 5.2<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 34
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Schwingungsfreiheitsgrade:<br />
Zahl hängt von <strong>der</strong> Struktur ab<br />
Bedingung: - keine Bewegung des Molekülschwerpunkts<br />
- voneinan<strong>der</strong> unabhängige Bewegungen<br />
Normalschwingungsmoden via Symmetrieeigenschaften (Gruppentheorie)<br />
Zahl <strong>der</strong> Schwingungsfreiheitsgrade eines N-atomigen Moleküls:<br />
FG vib =FG gesamt -FG trans -FG rot<br />
FG vib =3N-3-FG rot<br />
Skript (Dr. Ogrodnik): Kap. 5.3<br />
symmetrische asymmetrische Deformationsschwingung<br />
Streckschwingung Streckschwingung o<strong>der</strong> Knickschwingung<br />
Molekül<br />
atomar<br />
linear<br />
nicht-linear<br />
FG trans<br />
FG rot<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 35<br />
3<br />
3<br />
3<br />
0<br />
2<br />
2<br />
Fg vib<br />
0<br />
3N-5<br />
3N-6<br />
FG ges<br />
3<br />
3N<br />
3N
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Molekülschwingung:<br />
Gleichgewichtsabstand<br />
R 0<br />
Harmonisches Potential<br />
2 k<br />
VMorse RR0 2<br />
ständiger Austausch zwischen<br />
kinetischer und potentieller Energie:<br />
E kin =0 (v=0,Umkehrpunkt )<br />
maximales E pot<br />
im Mittel :<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 36<br />
E<br />
pot<br />
<br />
E<br />
Eges<br />
2<br />
E pot =0: max. E kin<br />
kin<br />
<br />
E<br />
ges<br />
2
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Gleichverteilungssatz für alle Freiheitsgrade – bei Stößen:<br />
Durch nicht-zentrale Stöße wird Translationsenergie auf alle 3 FG trans verteilt:<br />
vorher: nachher:<br />
Bei nicht-zentralen Stößen mit mehratomigen<br />
Molekeln kann Translationsenergie in<br />
Rotationsenergie umgewandelt werden:<br />
Durch geeignete Stöße kann Translationsenergie in Schwingungsenergie umgewandelt<br />
werden (und umgekehrt):<br />
vorher:<br />
nachher:<br />
- vorher: nur blaues T. bewegt sich.<br />
- nachher: grünes Teilchen bewegt<br />
sich entlang Verbindungslinie.<br />
- 3 Pfeile (schwarz, rot, rot) müssen<br />
rechtwinkliges Dreieck ergeben:<br />
Pythagoras: v² vorher = v² nachher<br />
Empirisch: im zeitl. Mittel wird die Gesamtenergie aller Moleküle auf alle unterschiedlichen<br />
Freiheitsgrade gleichmäßig verteilt (Nullter Hauptsatz). Da Schwingungsfreiheitsgrade<br />
potentielle & kinetische Energie aufnehmen, werden sie in <strong>der</strong> Energiebilanz doppelt gezählt.<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 37
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Gesamtenergie eine thermodynamischen Systems – die Innere Energy, U<br />
<br />
mit, U: E kin + U pot aller Elektronen<br />
und aller Kerne<br />
für abgeschlossenes (isoliertes) System: kein Energieaustauch mit <strong>der</strong> Umgebung:<br />
Gleichverteilungssatz:<br />
E therm mol & FG<br />
<br />
U = konstant o<strong>der</strong> dU = 0<br />
RT<br />
2<br />
, wobei therm trans., rot. & vibr.<br />
die molare mittlere Energie in jedem Freiheitsgrad ist gleich<br />
das heisst:<br />
x<br />
Ekin <br />
y<br />
Ekin<br />
<br />
z<br />
Ekin<br />
<br />
RT<br />
E trans <br />
mol & FG 2<br />
U FG trans E trans FG rot Erot<br />
2<br />
FG vib E vib<br />
RT<br />
( FG trans FG<br />
rot 2<br />
FG vib)<br />
<br />
2<br />
(doppelte Zählrung von , da bestehend aus E kin und E pot )<br />
Gleichverteilungsannahme setzt voraus, dass die Energie zwischen den verschiedenen FG<br />
ausgetauscht werden kann. Dies gilt nicht, wenn Anregungsenergie >> RT/2<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 38
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Translationsfreiheitsgrade:<br />
sehr kleine E trans zw. verschiedenen Energieniveaus i.Vgl. zur thermischen Energie<br />
RT kJ<br />
bei 298 K: 1,<br />
24 E<br />
trans FGtrans immer besetzte Zustände<br />
2 mol<br />
Rotationsfreiheitsgrade:<br />
E rot in <strong>der</strong> Grössenordnung von 0.005-0.2 kJ/mol<br />
bei 298 K:<br />
Skript (Dr. Ogrodnik): Kap. 9<br />
RT<br />
2<br />
<br />
1,<br />
24<br />
kJ<br />
mol<br />
E<br />
viele FG rot besetzt bei 298K<br />
Gleichverteilungssatz anwendbar<br />
wenn T > rot<br />
rot<br />
Molekül Rot typisch<br />
J/mol]<br />
Rotation<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 39<br />
Rot<br />
<br />
<br />
[GHz]<br />
H2 730.0 85.4 1,780 59.38<br />
N2 23.8 2.86 60 1.99<br />
O2 17.2 2.07 43 1.44<br />
CO 23.0 2.77 58 1.93<br />
NO 20.1 2.42 50 1.68<br />
HCl 126.4 15.2 317 10.57<br />
HBr 100.6 12.1 252 8.41<br />
HI 74.8 9 188 6.26<br />
Cl2 2.9 0.346 7.2 0.24<br />
Br2 1.0 0.116 2.4 0.08<br />
I2 0.4 0.054 1.1 0.04<br />
<br />
<br />
1<br />
cm <br />
aus: T. Hill, Statistical Thermodynamics
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.4. Freiheitsgrade und energetisches Gleichgewicht des Moleküls<br />
Schwingungsfreiheitsgrade:<br />
sehr hohe E vib zw. verschiedenen Energieniveaus i.Vgl. zur thermischen Energie<br />
bei 298 K:<br />
Skript (Dr. Ogrodnik): Kap. 9<br />
RT<br />
2<br />
<br />
1,<br />
24<br />
kJ<br />
mol<br />
E<br />
FG vib normal nicht besetzte Zustände<br />
nur signifikant besetzt,<br />
wenn T > rot<br />
vib<br />
Molekül vib, typisch<br />
[J/mol]<br />
Schwingung<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 40<br />
vib<br />
<br />
<br />
[THz]<br />
1<br />
cm <br />
H2 51630 6210 129.4 4318<br />
N2 27769 3340 69.6 2322<br />
O2 18540 2230 46.5 1551<br />
CO 25524 3070 64.0 2135<br />
NO 22365 2690 56.1 1870<br />
HCl 34420 4140 86.3 2879<br />
HBr 30762 3700 77.1 2573<br />
HI 26605 3200 66.7 2225<br />
Cl2 6734 810 16.9 563<br />
Br2 3908 470 9.8 327<br />
I2 2577 310 6.5 216<br />
aus: T. Hill, Statistical Thermodynamics
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.5. Geschwindigkeitsverteilung <strong>der</strong> Moleküle<br />
Maxwellsche Geschwindigkeitsverteilung (statistische Thermodynamik)<br />
Herleitung: Skript (Dr. Ogrodnik): Kap. 10 und Atkins<br />
m <br />
f(v) 4<br />
<br />
2 kT <br />
<br />
<br />
k = 1.38*10 -23 J/K -1 (Boltzmann Konstante)<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 41<br />
3<br />
2<br />
v<br />
2<br />
e<br />
2<br />
mv<br />
<br />
2kT<br />
M <br />
4<br />
<br />
2 RT <br />
<br />
<br />
wobei:<br />
- f(v) Verteilung <strong>der</strong> Geschwindigkeit v<br />
0 <br />
f(v) dv 1<br />
3<br />
2<br />
v<br />
2<br />
e<br />
2<br />
Mv<br />
<br />
2RT<br />
- f(v) dv Wahrscheinlichkeit, dass die Geschwindigkeit<br />
eines Teilchens zwischen v und v+dv liegt<br />
Wahrscheinlichkeit, dass ein Teilchen eine<br />
Geschwindigkeit zw. hat muss 1 sein,<br />
so dass: (Fläche unter <strong>der</strong> Kurve)
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.5. Geschwindigkeitsverteilung <strong>der</strong> Moleküle<br />
Maxwellsche Geschwindigkeitsverteilung (statistische Thermodynamik)<br />
häufigste (wahrscheinlichste) Geschwindigkeit: für f‘(v)=0 <br />
durchschnittliche Geschwindigkeit:<br />
Mittelwert <strong>der</strong> Geschwindigkeitsquadrate:<br />
Breite des Intervalls (dv)<br />
v w <br />
2RT<br />
M<br />
8RT<br />
v f(v)<br />
dv <br />
0 M<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 42<br />
v<br />
2<br />
v<br />
<br />
<br />
0<br />
v<br />
2<br />
f(v)<br />
dv <br />
3RT<br />
M<br />
empirischem idealen Gasgesetz
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.5. Geschwindigkeitsverteilung <strong>der</strong> Moleküle<br />
Maxwellsche Geschwindigkeitsverteilung (statistische Thermodynamik)<br />
m <br />
f(v) 4<br />
<br />
2 kT <br />
<br />
<br />
3<br />
2<br />
mv<br />
<br />
2kT<br />
N 0 =Normierungsfaktor (garantiert, dass Gesamtwahrscheinlichkeit<br />
(Integral über alle Geschwindigkeiten) =1<br />
Skript (Dr. Ogrodnik): Kap. 10<br />
v<br />
2<br />
e<br />
2<br />
Diskussion:<br />
- v 0: Anteil Moleküle mit sehr kleiner v<br />
klein<br />
- T hoch: schnellere Molekülbewegung<br />
dh v nur langsam gegen 0<br />
- v : Anteil Moleküle mit sehr hoher v<br />
klein (e-Fkt.),<br />
v.a. für schwere Moleküle<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 43
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.5. Geschwindigkeitsverteilung <strong>der</strong> Moleküle<br />
Maxwellsche Geschwindigkeitsverteilung (statistische Thermodynamik)<br />
typische errechnete Geschwindigkeiten:<br />
Skript (Dr. Ogrodnik): Kap. 10<br />
vw vSchall<br />
O2 393 m/s 440m/s 482m/s 316m/s<br />
H2 1574 m/s 1776m/s 1928m/s 1280m/s<br />
He 1113 m/s 1256m/s 1363m/s 981m/s<br />
korreliert mit <strong>der</strong> Schallgeschwindigkeit: v Schall <br />
Schalldruck kann sich nicht schneller ausbreiten als die Gasmoleküle <br />
berechnete Geschwindigkeiten in<br />
Übereinstimmung mit Messungen<br />
(Quelle: Atkins)<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 44
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.6. Stosszahl und mittlere freie Weglänge<br />
Ideales Gas - Annahmen:<br />
- Gas = Teilchen <strong>der</strong> Masse m mit Durchmesser d<br />
- d
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.6. Stosszahl und mittlere freie Weglänge<br />
Zahl Stöße pro Zeiteinheit (1 Teilchen):<br />
z<br />
<br />
2 <br />
mit:<br />
Mittlere freie Weglänge:<br />
zpro Zeiteinheit<br />
vrel<br />
v<br />
1 1 kT<br />
v <br />
= Stoßquerschnitt<br />
z 2 p<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 46<br />
<br />
N p<br />
<br />
V kT<br />
N<br />
V<br />
<br />
2 <br />
bei Normaldruck/25ºC für Luft: 70nm<br />
konsistent mit anfänglicher Annahme !<br />
v<br />
<br />
N<br />
V<br />
p<br />
kT
1. Eigenschaften <strong>der</strong> Materie in <strong>der</strong> Gasphase<br />
1.6. Stosszahl und mittlere freie Weglänge<br />
Praktische Anwendung: Vakuumtechnik<br />
Degree of vacuum<br />
Atmospheric<br />
Low<br />
medium<br />
High<br />
Ultra high<br />
Pressure [Torr]<br />
760<br />
1<br />
10 -3<br />
10 -6<br />
10 -10<br />
Gas density<br />
[molecules m-3 ]<br />
2 x 10 25<br />
3 x 10 22<br />
3 x 10 19<br />
3 x 10 16<br />
3 x 10 12<br />
Kollisionsfreie Bedingungen: p < 10-4 Torr<br />
Beibehaltung einer sauberen Oberfläche: p < 10-9 Torr<br />
Transport Mechanismus: Knudsendiffusion<br />
Mean free path [m]<br />
7 x 10 -8<br />
5 x 10 -5<br />
5 x 10 -2<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 47<br />
50<br />
5 x 10 5<br />
vornehmlich Kollosion mit <strong>der</strong> Wand statt mit an<strong>der</strong>en Gasmolekülen<br />
reduzierte Diffusionsgeschwindigkeit