PowerPoint-Präsentation - Proteine. - Israng.ch
PowerPoint-Präsentation - Proteine. - Israng.ch
PowerPoint-Präsentation - Proteine. - Israng.ch
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
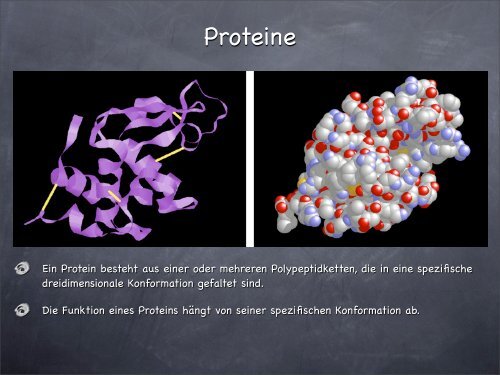
<strong>Proteine</strong><br />
Ein Protein besteht aus einer oder mehreren Polypeptidketten, die in eine spezifis<strong>ch</strong>e<br />
dreidimensionale Konformation gefaltet sind.<br />
Die Funktion eines Proteins hängt von seiner spezifis<strong>ch</strong>en Konformation ab.
<strong>Proteine</strong> sind die molekularen Werkzeuge für<br />
die meisten zellulären Funktionen<br />
Einführung <strong>Proteine</strong> 2
<strong>Proteine</strong>: Struktur und Funktion<br />
Ein Polypeptid ist ein Polymer aus Aminosäuren, die in bestimmter<br />
Reihenfolge miteinander verknüpft sind.<br />
Die Funktion eines Proteins hängt von seiner spezifis<strong>ch</strong>en<br />
Konformation ab.<br />
Die Struktur eines Proteins kann in drei beziehungsweise vier<br />
hierar<strong>ch</strong>is<strong>ch</strong>e Ebenen unterteilt werden.<br />
Einführung <strong>Proteine</strong> 3
<strong>Proteine</strong> sind aus<br />
20 vers<strong>ch</strong>iedenen<br />
Aminosäuren aufgebaut<br />
Jede Aminosäure wird<br />
dur<strong>ch</strong> ihre Seitenkette<br />
definiert, die<br />
von Aminosäure zu<br />
Aminosäure variiert.<br />
Einführung <strong>Proteine</strong> 4
Peptidbindung<br />
Die Carboxyl- und die Aminogruppe bena<strong>ch</strong>barter Aminosäuren gehen eine<br />
Peptidbindung ein, wodur<strong>ch</strong> lange Polymere entstehen können.<br />
Einführung <strong>Proteine</strong> 5
Primärstruktur<br />
Die Primärstruktur ist die erste Ebene und bes<strong>ch</strong>reibt die<br />
einzigartige Aminosäureabfolge des Proteins.<br />
Einführung <strong>Proteine</strong> 6
Änderung der Primärstruktur: Si<strong>ch</strong>elzellanämie<br />
Einführung <strong>Proteine</strong> 7
Die Sekundärstruktur<br />
bes<strong>ch</strong>reibt, wie die Primärstruktur<br />
lokal bestimmte<br />
Konformationen annimmt, die<br />
α-Helix und das β-Faltblatt, die<br />
dur<strong>ch</strong> Wasserstoffbrücken<br />
zwis<strong>ch</strong>en den Peptidbindungen<br />
stabilisiert werden.<br />
Sekundärstruktur<br />
Einführung <strong>Proteine</strong> 8
Tertiärstruktur<br />
Die Tertiärstruktur bes<strong>ch</strong>reibt die weniger glei<strong>ch</strong>mässigen räumli<strong>ch</strong>en Verwindungen des<br />
Moleküls, die dur<strong>ch</strong> die Beteiligung von Seitenketten an hydrophoben We<strong>ch</strong>selwirkungen<br />
(van-der-Waals-Kräften), Wasserstoffbrücken, Ionenbindungen und Disulfidbrücken<br />
zustande kommen.<br />
Einführung <strong>Proteine</strong> 9
Quartärstruktur<br />
Auf dieser Strukturebene assoziieren zwei oder mehr Polypeptiduntereinheiten zu<br />
einem funktionsfähigen Protein.<br />
zu a) Kollagen ist ein Faserprotein, das aus drei helikalen Polypeptiden besteht, die zu<br />
einer seilähnli<strong>ch</strong>en Struktur von großer Stärke superspiralisiert sind. Es ma<strong>ch</strong>t 40<br />
Prozent des Proteins im mens<strong>ch</strong>li<strong>ch</strong>en Körper aus und festigt das Bindegewebe in<br />
unserer Haut, unseren Kno<strong>ch</strong>en, Bändern, Sehnen und anderen Körperteilen.<br />
zu b) Hämoglobin ist ein globuläres Protein aus vier Untereinheiten: zwei α-Ketten<br />
und zwei etwas anders aufgebaute β-Ketten.<br />
Einführung <strong>Proteine</strong> 10
Einführung <strong>Proteine</strong> 11
Vers<strong>ch</strong>iedene Faktoren beeinflussen die<br />
Proteinkonformation<br />
Die Struktur und Funktion eines Proteins reagieren empfindli<strong>ch</strong> auf<br />
Milieubedingungen wie den pH-Wert, die Salzkonzentration und die<br />
Temperatur. Veränderungen dieser Bedingungen können zur Veränderung<br />
der Proteingestalt bis hin zur Denaturierung führen.<br />
Einführung <strong>Proteine</strong> 12
Bestimmung der 3D-Struktur von <strong>Proteine</strong>n<br />
Einführung <strong>Proteine</strong> 14
Das Proteinfaltungsproblem:<br />
Methoden zur Bestimmung höherer Strukturen<br />
• Entdeckung der Kernresonanz dur<strong>ch</strong> US-<br />
Amerikaner Felix Blo<strong>ch</strong> und Edward M. Purcell<br />
(Physik-Nobelpreis 1952)<br />
• Beiträge zur ho<strong>ch</strong>auflösenden Kernresonanz-Spektroskopie<br />
dur<strong>ch</strong><br />
Ri<strong>ch</strong>ard Ernst (Chemie-Nobelpreis 1991)<br />
• Ents<strong>ch</strong>lüsselung der 3D-Struktur<br />
grosser Biomoleküle mittels Kernresonanz<br />
dur<strong>ch</strong> Kurt Wüthri<strong>ch</strong><br />
(Chemie-Nobelpreis 2002)<br />
• 2003: Vierter Nobelpreis auf dem Gebiet der<br />
Kernresonanz: Medizin-Nobelpreis für Paul<br />
Lauterbur und Peter Mansfield<br />
Einführung <strong>Proteine</strong> 15
Hämoglobin: ein allosteris<strong>ch</strong>es Protein<br />
Einführung <strong>Proteine</strong> 16
Hämoglobin besteht aus vier Polypeptidketten<br />
Hämoglobinmodell: Die α-Ketten sind gelb, die ß-<br />
Ketten blau und die Hämgruppen rot dargestellt.<br />
Einführung <strong>Proteine</strong> 20
Die Hämoglobinuntereinheiten ähneln in ihrer<br />
dreidimensionalen Struktur stark dem Myoglobin<br />
Verglei<strong>ch</strong> der Konformationen der Myoglobinhauptkette und der ß-Kette von<br />
Hämoglobin. Die Ähnli<strong>ch</strong>keit ist offensi<strong>ch</strong>tli<strong>ch</strong>.<br />
Verglei<strong>ch</strong> der Aminosäuresequenzen des Pottwalmyoglobins sowie<br />
der α- und ß-Ketten von mens<strong>ch</strong>li<strong>ch</strong>em Hämoglobin für die Reste<br />
F1 bis F9. Die Aminosäuresequenzen dieser drei Polypeptidketten<br />
glei<strong>ch</strong>en si<strong>ch</strong> weit weniger als ihre dreidimensionalen Strukturen.<br />
Einführung <strong>Proteine</strong> 21
Myoglobin hat eine kompakte Struktur<br />
und einen hohen α-Helix-Anteil<br />
Modell des Myoglobins bei hoher Auflösung. Nur<br />
die Kohlenstoffatome sind dargestellt. Die<br />
Hämgruppe ist rot wiedergegeben, zwei wi<strong>ch</strong>tige<br />
Histidinreste grün.<br />
Dieses Kalottenmodell des Myoglobins zeigt die<br />
di<strong>ch</strong>te Packung von Aminosäureresten im<br />
Inneren des Moleküls. Die Hämgruppe ist rot<br />
dargestellt, das proximale Histidin (F8) blau,<br />
das distale Histidin (E7) grün und unpolare<br />
Reste gelb.<br />
Einführung <strong>Proteine</strong> 18
Die prosthetis<strong>ch</strong>e Gruppe, die den<br />
Sauerstoff bindet, ist das Häm<br />
Das Häm setzt si<strong>ch</strong> aus einem organis<strong>ch</strong>en Teil und einem Eisenatom zusammen. Der organis<strong>ch</strong>e Teil, das<br />
Protoporphyrin, besteht aus vier Pyrrolringen, die dur<strong>ch</strong> Methinbrücken zu einem Tetrapyrrolsystem verknüpft<br />
sind. Vier Methyl-. zwei Vinyl- und zwei Propionatseitenketten hängen an diesem Tetrapyrrolsystem.<br />
Das Eisenatom im Häm ist an die vier Stickstoffatome im Zentrum des Protoporphyrinringes gebunden.<br />
Es kann darüber hinaus zwei weitere Bindungen eingehen, die beidseitig senkre<strong>ch</strong>t auf der Hämebene stehen:<br />
diese Bindungsstellen bezei<strong>ch</strong>net man als fünfte und se<strong>ch</strong>ste Koordinationsstelle.<br />
Modell der Hämgruppe des<br />
Myoglobins. (Gelb steht für<br />
Eisen, Blau für Stickstoff, Rot<br />
für Sauerstoff und S<strong>ch</strong>warz<br />
für Kohlenstoff.)<br />
Das Eisenatom kann se<strong>ch</strong>s<br />
Bindungen eingehen<br />
Einführung <strong>Proteine</strong> 17
Die Umgebung der Hämgruppe ist für die<br />
reversible Oxygenierung unerlässli<strong>ch</strong><br />
Modell der Sauerstoffbindungsstelle des Myoglobins mit<br />
der Hämgruppe, dem proximalen Histidin (F8) und dem<br />
distalen Histidin (E7)<br />
S<strong>ch</strong>ematis<strong>ch</strong>e Darstellung des<br />
Sauerstoffbindungszentrums im Myoglobin.<br />
Zur Hämebene hin abgewinkelte<br />
Orientierung des gebundenen Sauerstoffs<br />
im Oxymyoglobin. Der Winkel zwis<strong>ch</strong>en der<br />
O 2 A<strong>ch</strong>se und der Fe-O-Bindung beträgt<br />
121°.<br />
Einführung <strong>Proteine</strong> 19
Sauerstoffdissoziationskurven des Hämoglobins<br />
Dies ist die Dissoziationskurve des Hämoglobins bei 37°C und pH 7,4. Die Kurve zeigt die prozentuale<br />
Sättigung des Hämoglobins mit Sauerstoff, wenn das Protein si<strong>ch</strong> in einer künstli<strong>ch</strong>en Pufferlösung<br />
befindet, deren Sauerstoffpartialdruck (PO2 ) si<strong>ch</strong> kontinuierli<strong>ch</strong> verändert. Bei einem PO2 von 100 mm<br />
Hg, wie er typis<strong>ch</strong>erweise in der Lunge herrs<strong>ch</strong>t, ist das Hämoglobin zu etwa 98% mit Sauerstoff<br />
gesättigt. Bei einem PO2 von 40 mm Hg, was der übli<strong>ch</strong>en Situation im Berei<strong>ch</strong> von Körpergeweben<br />
entspri<strong>ch</strong>t, ist das Hämoglobin nur zu 70% gesättigt; es gibt in dieser Situation somit 28% seines<br />
Sauerstoffs ab. Seinen übrigen Sauerstoff (die sogenannte venöse Reserve) kann es in besonders<br />
stoffwe<strong>ch</strong>selaktiven Geweben freisetzen, etwa in s<strong>ch</strong>wer arbeitenden Muskeln.<br />
Einführung <strong>Proteine</strong> 22
H + und CO 2 fördern die Freisetzung von Sauerstoff (Bohr Effekt)<br />
Protonen beeinflussen die Konformation des Hämoglobins, und dadur<strong>ch</strong> vers<strong>ch</strong>iebt ein sinkender PH-Wert die<br />
Dissoziationskurve na<strong>ch</strong> re<strong>ch</strong>ts. Wie Sie sehen, gibt das Hämoglobin bei glei<strong>ch</strong>em PO2 , beispielsweise 40 mm<br />
Hg, bei pH 7,2 mehr Sauerstoff ab als bei pH 7,4, dem normalen pH-Wert des mens<strong>ch</strong>li<strong>ch</strong>en Blutes. Dies<br />
ereignet si<strong>ch</strong> in sehr aktiven Geweben, da das in der Zellatmung produzierte CO2 mit Wasser reagiert und<br />
Kohlensäure (H2C03 ) bildet, die in H + und HC0 -<br />
3 dissoziiert und so den pH-Wert erniedrigt. Dann setzt<br />
Hämoglobin mehr 02 frei, wel<strong>ch</strong>es die hohe lokale Stoffwe<strong>ch</strong>selaktivität unterstützt.<br />
Einführung <strong>Proteine</strong> 23
Hämoglobin und Sauerstoffaffinität<br />
Einführung <strong>Proteine</strong> 24
Wenn Sauerstoff bindet, ändert si<strong>ch</strong> die Quartärstruktur,<br />
da er das Eisenatom in die Porphyrinebene hineinbewegt<br />
Konformationsänderungen, die von der<br />
Bewegung des Eisens bei der Oxygenierung<br />
verursa<strong>ch</strong>t werden. Die oxygenierte Form ist<br />
rot dargestellt, die desoxygenierte Form blau.<br />
Das Eisenatom bewegt si<strong>ch</strong><br />
bei der Oxygenierung in die<br />
Hämebene hinein. Das<br />
proximale Histidin (F8) wird<br />
vom Eisenatom mitgezogen<br />
und verliert seine Neigung.<br />
S<strong>ch</strong>ematis<strong>ch</strong>e Darstellung der<br />
Quartärstrukturänderung bei<br />
Oxygenierung. Ein Paar von αß-<br />
Untereinheiten vers<strong>ch</strong>iebt si<strong>ch</strong><br />
gegenüber dem anderen dur<strong>ch</strong> eine<br />
Rotation um 15° und eine<br />
Translation um 0,08 nm. Die<br />
Oxyform der vers<strong>ch</strong>obenen αß-<br />
Untereinheit ist rot dargestellt, die<br />
Desoxyform blau.<br />
Einführung <strong>Proteine</strong> 25
Na<strong>ch</strong> dem Sequenzmodell für allosteris<strong>ch</strong>e<br />
We<strong>ch</strong>selwirkungen ändert eine Untereinheit<br />
na<strong>ch</strong> der anderen ihre Konformation<br />
Einfa<strong>ch</strong>es Sequenzmodell für ein tetrameres allosteris<strong>ch</strong>es Protein. Die Bindung eines<br />
Liganden an eine Untereinheit verändert die Konformation eben dieser Untereinheit<br />
von der T(Quadrat) in die R-Form (Kreis). Dieser Übergang erhöht die Affinität der<br />
anderen Untereinheiten für den Liganden.<br />
Das Briefmarkenanalogie des einfa<strong>ch</strong>en Sequenzmodells. Für<br />
die Abtrennung der ersten Marke müssen zwei perforierte<br />
Kanten aufgerissen werden, für die zweite und dritte aber nur<br />
jeweils eine. Die vierte Marke ist dann frei. Na<strong>ch</strong> diesem Modell<br />
erhöht si<strong>ch</strong> die Affinität des Hämoglobins für na<strong>ch</strong>folgende 0 2 -<br />
Moleküle<br />
.<br />
Einführung <strong>Proteine</strong> 26