Jahresbericht 1990 - Eawag-Empa Library
Jahresbericht 1990 - Eawag-Empa Library
Jahresbericht 1990 - Eawag-Empa Library
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Die Bedeutung der Photolyse von Eisen(III) Verbindungen in atmosphärischen<br />
Wassern<br />
Gelöste und partikuläre Eisenverbindungen, die ubiquitär auch in atmosphärisChen Wassertropfen auftreten<br />
(aus Verbrennungsprozessen, Staub etc.) können die photochemischen und chemischen Transformationsprozesse<br />
in Wolken- und Nebelwasser signifikant beeinflussen. Die effiziente Absorption von Licht durch<br />
Eisen(III)-Komplexe organischer oder anorganisCher Liganden resultiert in der Bildung einer photoreduzierten<br />
Eisen(II)-Spezies und einem oxidierten Liganden, d.h. einem organischem Radikalion oder OH Radikal.<br />
In Gegenwart von Sauerstoff wird das organisChe Radikalion in Superoxidion (02) bzw. zu dessen<br />
konjugierter Säure, dem Hydroperoxyradikal (HO2) transformiert, was sich sekundär in der Bildung von<br />
Wasserstoffperoxid (H 2O2) manifestieren kann. Photolytisch gebildetes Eisen(II) und H 2O2 können dann<br />
via Fentonreaktion. zur Produktion von OH Radikalen und der RüCkbildung von Eisen(III) führen (R. Zepp,<br />
B. Faust und J. Hoigne; Publ. eingereicht).<br />
Die Berechnung der Eisenspeziierung für die in atmosphärischen Wassern häufig gemessenen Werte für<br />
Oxalat und pH zeigen, dass für die Photolyse die diversen Eisen(III)-Oxalat Komplexe in anthropogen<br />
belasteten Atmosphären wesentlich sind, während Fe(III)-Hydroxokomplexe in organisch weniger belasteten<br />
Gebieten dominieren.<br />
Aus photochemischen Laborversuchen an entsprechenden Modelllösungen geht hervor, dass solche photochemische/chemische<br />
Zyklen der Eisenverbindungen für die Bildung von H 2O2, HO2 oder OH bedeutungsvoller<br />
sein können als der in den heutigen Modellen berücksiChtigte Einfang dieser Photooxidantien<br />
aus der atmosphärischen Gasphase. AuCh lässt sich der Abbau der atmosphärischen Oxalsäure über solche<br />
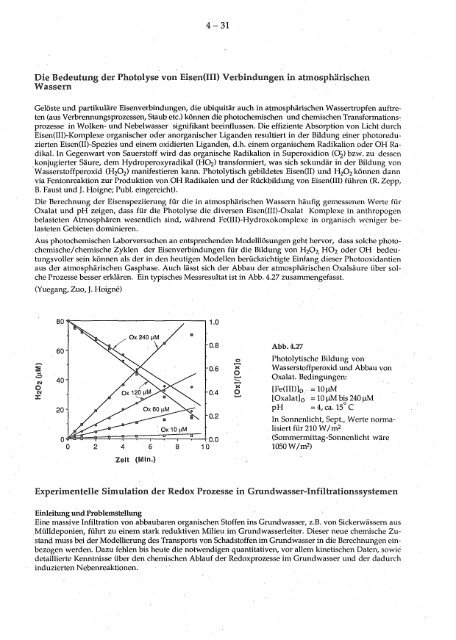
Prozesse besser erklären. Ein typisches Messresultat ist in Abb. 4.27 zusammengefasst.<br />
(Yuegang, Zuo, J. Hoigné)<br />
80 .,. 1.0<br />
60 -<br />
2 4 6<br />
Zelt (Min.)<br />
- 0.8 Abb. 4.27<br />
-0.6<br />
- 0.4<br />
Photolytische Bildung von<br />
Wasserstoffperoxid und Abbau von<br />
Oxalat. Bedingungen:<br />
[Fe(III)]o . =10µM<br />
[Oxalatio = 10 µM bis 240 µM<br />
pH 4, ca. 15°C<br />
In Sonnenlicht, Sept., Werte normalisiert<br />
für 210 W/m2<br />
(Sommermittag-Sonnenlicht wäre<br />
1050 W/m2)<br />
Experimentelle Simulation der Redox Prozesse in Grundwasser-Infiltrationssystemen<br />
Einleitung und Problemstellung<br />
Einemassive Infiltration von abbaubaren organischen Stoffen ins Grundwasser, z.B. von Sickerwässern aus<br />
Mülldeponien, führt zu einem stark reduktiven Milieu im Grundwasserleiter. Dieser neue chemische Zustand<br />
muss bei der Modellierung des Transports von Schadstoffen im Grundwasser in die Berechnungen einbezogen<br />
werden. Dazu fehlen bis heute die notwendigen quantitativen, vor allem kinetischen Daten, sowie<br />
detaillierte Kenntnisse über den chemischen Ablauf der Redoxprozesse im Grundwasser und der dadurch<br />
induzierten Nebenreaktionen.