Versuch 5.1.2
Versuch 5.1.2
Versuch 5.1.2
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
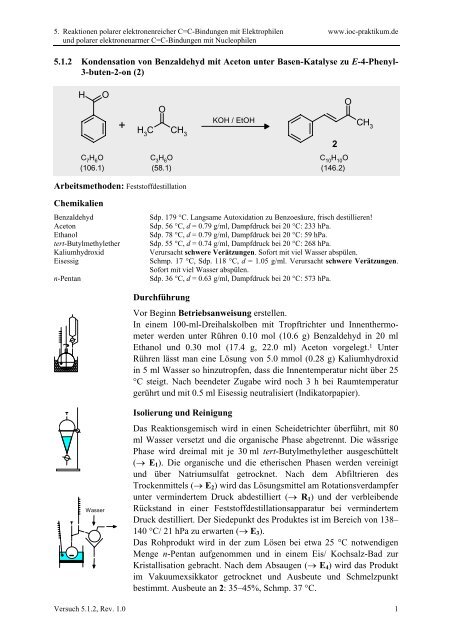
<strong>5.1.2</strong> Kondensation von Benzaldehyd mit Aceton unter Basen-Katalyse zu E-4-Phenyl-<br />
3-buten-2-on (2)<br />
H<br />
O<br />
+<br />
O<br />
H 3<br />
C CH 3<br />
KOH / EtOH<br />
2<br />
O<br />
CH 3<br />
C 7<br />
H 6<br />
O<br />
(106.1)<br />
C 3<br />
H 6<br />
O<br />
(58.1)<br />
C 10<br />
H 10<br />
O<br />
(146.2)<br />
Arbeitsmethoden: Feststoffdestillation<br />
Chemikalien<br />
Benzaldehyd<br />
Aceton<br />
Ethanol<br />
tert-Butylmethylether<br />
Kaliumhydroxid<br />
Eisessig<br />
n-Pentan<br />
Sdp. 179 °C. Langsame Autoxidation zu Benzoesäure, frisch destillieren!<br />
Sdp. 56 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 233 hPa.<br />
Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 59 hPa.<br />
Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa.<br />
Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen.<br />
Schmp. 17 °C, Sdp. 118 °C, d = 1.05 g/ml. Verursacht schwere Verätzungen.<br />
Sofort mit viel Wasser abspülen.<br />
Sdp. 36 °C, d = 0.63 g/ml, Dampfdruck bei 20 °C: 573 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 100-ml-Dreihalskolben mit Tropftrichter und Innenthermometer<br />
werden unter Rühren 0.10 mol (10.6 g) Benzaldehyd in 20 ml<br />
Ethanol und 0.30 mol (17.4 g, 22.0 ml) Aceton vorgelegt. 1 Unter<br />
Rühren lässt man eine Lösung von 5.0 mmol (0.28 g) Kaliumhydroxid<br />
in 5 ml Wasser so hinzutropfen, dass die Innentemperatur nicht über 25<br />
°C steigt. Nach beendeter Zugabe wird noch 3 h bei Raumtemperatur<br />
gerührt und mit 0.5 ml Eisessig neutralisiert (Indikatorpapier).<br />
Wasser<br />
Isolierung und Reinigung<br />
Das Reaktionsgemisch wird in einen Scheidetrichter überführt, mit 80<br />
ml Wasser versetzt und die organische Phase abgetrennt. Die wässrige<br />
Phase wird dreimal mit je 30 ml tert-Butylmethylether ausgeschüttelt<br />
(→ E 1 ). Die organische und die etherischen Phasen werden vereinigt<br />
und über Natriumsulfat getrocknet. Nach dem Abfiltrieren des<br />
Trockenmittels (→ E 2 ) wird das Lösungsmittel am Rotationsverdampfer<br />
unter vermindertem Druck abdestilliert (→ R 1 ) und der verbleibende<br />
Rückstand in einer Feststoffdestillationsapparatur bei vermindertem<br />
Druck destilliert. Der Siedepunkt des Produktes ist im Bereich von 138–<br />
140 °C/ 21 hPa zu erwarten (→ E 3 ).<br />
Das Rohprodukt wird in der zum Lösen bei etwa 25 °C notwendigen<br />
Menge n-Pentan aufgenommen und in einem Eis/ Kochsalz-Bad zur<br />
Kristallisation gebracht. Nach dem Absaugen (→ E 4 ) wird das Produkt<br />
im Vakuumexsikkator getrocknet und Ausbeute und Schmelzpunkt<br />
bestimmt. Ausbeute an 2: 35–45%, Schmp. 37 °C.<br />
<strong>Versuch</strong> <strong>5.1.2</strong>, Rev. 1.0 1
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
1 Warum werden die Edukte in diesem Molverhältnis eingesetzt?<br />
2 Bei höheren Reaktionstemperaturen tritt Polymerisation ein!<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 : Wässrige Lösung mit Spuren von organischen Verbindungen → Entsorgung (H 2 O mit RH).<br />
E 2 : Kontaminiertes Natriumsulfat → Entsorgung (Anorg. Feststoffe).<br />
E 3 : Destillationsrückstand in wenig Aceton lösen → Entsorgung (RH).<br />
E 4 : Mutterlauge mit organischen Verunreinigungen → Entsorgung (RH).<br />
R 1 : Abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether).<br />
Auswertung des <strong>Versuch</strong>s<br />
1 H-NMR-Spektrum von 2 (300 MHz, CDCl 3 ): δ = 2.35 (3 H), 6.69 (1 H), 7.33–7.41 (3 H), 7.45–7.56 (3 H).<br />
2256.4 Hz<br />
2240.0 Hz<br />
2017.1 Hz<br />
2000.7 Hz<br />
7.5 7.0<br />
6.5<br />
8.0 7.0 6.0 5.0 4.0<br />
3.0 2.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 2 (75.5 MHz, CDCl 3 ): δ = 27.54 (CH 3 ), 127.16 (CH), 128.28 (CH), 128.99 (CH),<br />
130.54 (CH), 134.42 (C), 143.45 (CH), 198.40 (C).<br />
LM<br />
200<br />
180<br />
160<br />
140<br />
120<br />
100 80 60 40 20 [ppm] 0<br />
<strong>Versuch</strong> <strong>5.1.2</strong>, Rev. 1.0 2
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
IR-Spektrum von 2 (Film):<br />
100<br />
T [%]<br />
50<br />
3000<br />
3060 3025<br />
2920<br />
1575<br />
1670 1690<br />
1610<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
* Formulieren Sie den zu 2 führenden Reaktionsmechanismus.<br />
* Vergleichen Sie das Ergebnis dieses <strong>Versuch</strong>s mit dem von <strong>Versuch</strong> 5.1.3.<br />
Weitere denkbare Reaktionsprodukte:<br />
HO<br />
O<br />
O<br />
O H 3<br />
C<br />
OH<br />
A<br />
CH 3<br />
H 3<br />
C<br />
B<br />
O CH 3<br />
C<br />
CH 3<br />
D<br />
* Mit welchen spektroskopischen Daten lassen sich A–D ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen 2/A und B/D?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Literatur, auf der dieser <strong>Versuch</strong> beruht: [1]. Aldolreaktionen zwischen Aldehyden und Ketonen führen nur dann<br />
zu einheitlichen Produkten, wenn der Aldehyd kein α-H besitzt und somit nur als Elektrophil reagieren kann<br />
(Benzaldehyd, Pivalaldehyd (Me 3 CCHO), Formaldehyd), das Keton muss das Nucleophil bilden können.<br />
Unter diesen Voraussetzungen besitzt die als Claisen-Schmidt-Reaktion bezeichnete "gekreuzte Aldolreaktion"<br />
eine große Anwendungsbreite. Die Produkte mit aromatischen Aldehyden unterliegen direkt der Wasserabspaltung<br />
(Aldolkondensation) zu α,β-ungesättigten Carbonylverbindungen, mit aliphatischen Aldehyden bleibt<br />
die Umsetzung auf der Aldoladditionsstufe stehen:<br />
Ph<br />
H<br />
C CH 2<br />
OH<br />
O<br />
C<br />
R<br />
+ OH<br />
- H 2<br />
O<br />
Ph<br />
H<br />
C CH<br />
OH<br />
O<br />
C<br />
R<br />
- OH<br />
O<br />
PhHC CH C<br />
R<br />
R'<br />
O<br />
H<br />
O<br />
H<br />
+ R' C CH 2<br />
H 3<br />
C R<br />
OH<br />
O<br />
C<br />
R<br />
R' = Alkyl<br />
[1] N.L. Drake, P. Allen in Organic Syntheses Coll. Vol. 1 (Hrsg. H. Gilman, A.H. Blatt), J. Wiley & Sons,<br />
New York, 1941, S. 77–78.<br />
<strong>Versuch</strong> <strong>5.1.2</strong>, Rev. 1.0 3