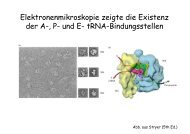
Enzym - Inhibitoren
Enzym - Inhibitoren
Enzym - Inhibitoren
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Enzym</strong> - <strong>Inhibitoren</strong><br />
• Wie wirkt Penicillin ?<br />
• Wie wirkt Aspirin ?<br />
• Welche Rolle spielt Methotrexat in der<br />
Chemotherapie ?<br />
• Welche Wirkstoffe werden gegen HIV<br />
entwickelt ?
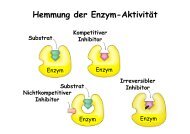
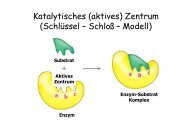
Hemmung der <strong>Enzym</strong>-Aktivität<br />
Substrat<br />
Kompetitiver<br />
Inhibitor<br />
<strong>Enzym</strong><br />
<strong>Enzym</strong><br />
Substrat<br />
Nichtkompetitiver<br />
Inhibitor<br />
Irreversibler<br />
Inhibitor<br />
<strong>Enzym</strong><br />
<strong>Enzym</strong>
<strong>Enzym</strong> - Kinetik<br />
Michaelis – Menten<br />
Gleichung<br />
V 0 = V max<br />
[ S ]<br />
[ S ] + K M<br />
Lineweaver - Burk<br />
Diagramm<br />
1/v 0<br />
1<br />
V 0<br />
=<br />
1 K M<br />
+ . 1<br />
V max [ S ]<br />
V max
Kompetitive <strong>Enzym</strong>-<strong>Inhibitoren</strong>
Kompetitive <strong>Inhibitoren</strong><br />
Dihydrofolat Reduktase und Chemotherapie<br />
- blockiert Thymin-<br />
Biosynthese<br />
- Bindet 1000x<br />
fester an die<br />
Dihydrofolat Red.
Nichtkompetitive <strong>Enzym</strong>-<strong>Inhibitoren</strong>
Irreversible <strong>Inhibitoren</strong><br />
• Gruppen-spezifische Reagenzien<br />
• Substrat-Analoga<br />
• Suizid-<strong>Inhibitoren</strong><br />
(Mechanismus-basierte <strong>Inhibitoren</strong>)
Gruppen-spezifische Reagenzien:<br />
z.B. Diisopropylfluorphosphofat (DIFP)<br />
z.B.: Serin-<br />
Protease<br />
Inaktiviertes<br />
<strong>Enzym</strong>
Gruppen-spezifische Reagenzien:<br />
z.B. Iodacetamid<br />
<strong>Enzym</strong><br />
Iodacteamid<br />
Inaktiviertes<br />
<strong>Enzym</strong>
Substrat-analoge <strong>Inhibitoren</strong><br />
Substrat für Chymotrypsin<br />
Spezifitäts-Gruppe<br />
Reaktive Gruppe<br />
Tosyl-L-phenylalanin-chlormethylketon (TPCK)
Substrat-analoge <strong>Inhibitoren</strong><br />
Triosephosphat<br />
Isomerase<br />
(TIM)<br />
Bromacetolphosphat<br />
Inaktives<br />
<strong>Enzym</strong><br />
ähnelt dem Substrat<br />
Dihydroxyacteonphosphat
Suizid <strong>Inhibitoren</strong>: Monoamin Oxidase<br />
Flavin (prosthetische Gruppe)<br />
Alkylierung<br />
Modifiziertes Flavin<br />
→ inaktives <strong>Enzym</strong>
Reaktive Peptid-<br />
Bindung im<br />
β-Lactamring<br />
Penicillin
Wirkung von Penicillin<br />
Peptidoglykan:<br />
Gelb = Zucker<br />
Rot = Tetrapeptide<br />
Blau = Pentaglycin-Brücke
Bildung der Querverbindungen im<br />
Peptidoglykan
Mechanismus der Glykopeptid-<br />
Transpeptidase
Ähnlichkeit zwischen Penicillin und dem<br />
Substrat
Bildung des Pencilloyl-<strong>Enzym</strong> Komplexes
Regulation von <strong>Enzym</strong>aktivität<br />
• Allosterische Kontrolle (Kooperativität,<br />
Rückkopplungshemmung)<br />
• Isoenzyme<br />
• Kovalente Modifikation<br />
• Aktivierung durch proteolytische<br />
Spaltung
Aspartat Transcarbamoylase (ATCase)<br />
(erster Schritt der Pyrimidin-Biosynthese)<br />
N-Carbamoylaspartat<br />
Carbamoylphosphat<br />
Aspartat<br />
Cytidintriphosphat (CTP)
Feedback- (Rückkopplungs-) Hemmung<br />
CTP hemmt die ATCase<br />
= Endprodukt-Hemmung<br />
Physiologisch sinnvoll:<br />
es wird nur soviel CTP<br />
synthetisiert, wie in der<br />
Zelle benötigt<br />
CTP bindet nicht im aktiven Zentrum,<br />
sondern an einer anderen (allos) Stelle<br />
(= allosterische oder regulatorische Zentren)<br />
CTP = allosterischer Inhibitor
ATCase<br />
Quartärstruktur:<br />
2 katalyt.Trimere<br />
(6 c-Ketten)<br />
3 regulat. Dimere<br />
(6 r-Ketten)<br />
(c 6 r 6 )
Bisubstratanalogon PALA<br />
(= starker kompetitiver Inhibitor)<br />
Substrat<br />
Reaktions-<br />
Intermediat<br />
N-(Phosphonacetyl)-L-aspartat<br />
(PALA)
Aminosäuren von benachbarten Untereinheiten<br />
bilden gemeinsam die katalytischn Zentren der<br />
ATCase
Änderung der Quartärstruktur<br />
T Zustand<br />
(Tense state)<br />
R Zustand<br />
(Relaxed state)
Endprodukt CTP<br />
bindet an die<br />
regulatorischen<br />
Untereinheiten<br />
im T – Zustand<br />
und stabilisiert den<br />
T - Zustand
Kontrolle der ATCase Aktivität<br />
(konzertierter Mechanismus)
Allosterisch regulierte <strong>Enzym</strong>e weichen von der Michaelis-<br />
Menten Kinetik ab<br />
Sigmoide<br />
Kurve
ATCase Aktivität in Anwesenheit allosterischer<br />
Effektoren
Allosterische Effekte mit<br />
sequentiellen Mechanismus<br />
Homo-tetrameres Protein<br />
Untereinheit im T-Zustand<br />
Untereinheit im R-Zustand
Regulation durch variable Isoenzym-Komplexe<br />
Beispiel: Lactat Dehydrogenase<br />
H 4<br />
H 3 M<br />
H 2 M 2<br />
HM 3<br />
M 4<br />
LDH Isoenzym<br />
Zusammensetzung in<br />
verschiedenen Geweben<br />
(M=Skelettmuskulatur,<br />
H=Herzmuskulatur)<br />
M 4<br />
H 4<br />
Änderung der LDH Zusammensetzung<br />
im Herz während der<br />
Entwicklung
Regulation der Proteinaktivität<br />
durch kovalente Modifiaktion
Regulation von <strong>Enzym</strong>aktivität durch Phosphorylierung<br />
Proteinkinase<br />
OH-Gruppe<br />
eines Serin-,<br />
Threonin- oder<br />
Tyrosinrest<br />
Phosphoryliertes<br />
Protein
Glycogen - Phosphorylase
Aktivierung durch proteolytische Spaltung<br />
eines Proenzyms (Zymogen)<br />
Nach der Spaltung durch<br />
Trypsin kommt es zu einer<br />
Konformationsänderung, die<br />
zur vollständigen Ausbildung<br />
des aktiven Zentrums führt
Blutgerinnungs-Kaskade<br />
(intravaskuläres System)<br />
(extravaskuläres System)
Struktur des Fibrinogen
Bildung eines Fibrin - Netzwerks