Dichlorethan -> Ethen - Chik.die-sinis.de
Dichlorethan -> Ethen - Chik.die-sinis.de
Dichlorethan -> Ethen - Chik.die-sinis.de
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Reihe „Alles Plastik? – Kleidung aus Kunststoffen“<br />
Reaktionsmechanismus <strong>de</strong>r Eliminierung<br />
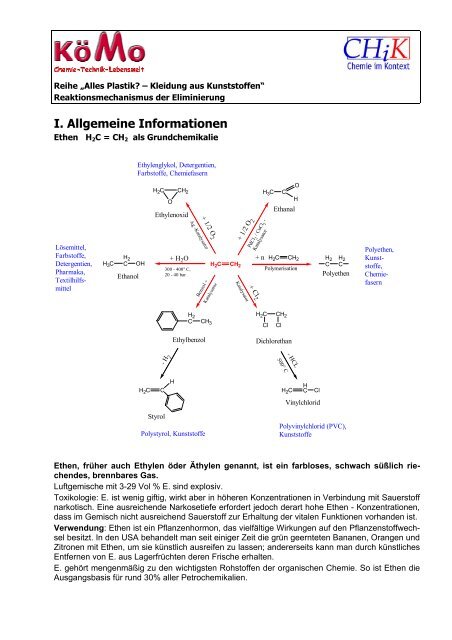
I. Allgemeine Informationen<br />
<strong>Ethen</strong> H 2 C = CH 2 als Grundchemikalie<br />
Ethylenglykol, Detergentien,<br />
Farbstoffe, Chemiefasern<br />
Lösemittel,<br />
Farbstoffe,<br />
Detergentien,<br />
Pharmaka,<br />
Textilhilfsmittel<br />
H 3 C<br />
H 2<br />
C<br />
Ethanol<br />
OH<br />
H 2 C CH 2<br />
O<br />
Ethylenoxid<br />
+ H 2 O<br />
300 - 400° C,<br />
20 - 40 bar<br />
Ag -Katalysator<br />
+ 1/2 O 2<br />
Benzol +<br />
H 2 C CH 2<br />
Katalysator<br />
Katalysator<br />
+ 1/2 O 2<br />
+ Cl 2<br />
H 3 C<br />
PdCl 2 / CuCl 2 -<br />
Katalysator<br />
C<br />
Ethanal<br />
O<br />
H<br />
+ n H 2 C CH 2 H 2 H 2<br />
C C<br />
Polymerisation<br />
Polyethen<br />
Polyethen,<br />
Kunststoffe,<br />
Chemiefasern<br />
H 2<br />
H 2 C CH 2<br />
C CH 3<br />
Cl Cl<br />
Ethylbenzol<br />
<strong>Dichlorethan</strong><br />
- H 2<br />
- HCL<br />
500° C<br />
H 2 C<br />
C<br />
H<br />
H 2 C<br />
H<br />
C<br />
Cl<br />
Vinylchlorid<br />
Styrol<br />
Polystyrol, Kunststoffe<br />
Polyvinylchlorid (PVC),<br />
Kunststoffe<br />
<strong>Ethen</strong>, früher auch Ethylen ö<strong>de</strong>r Äthylen genannt, ist ein farbloses, schwach süßlich riechen<strong>de</strong>s,<br />
brennbares Gas.<br />
Luftgemische mit 3-29 Vol % E. sind explosiv.<br />
Toxikologie: E. ist wenig giftig, wirkt aber in höheren Konzentrationen in Verbindung mit Sauerstoff<br />
narkotisch. Eine ausreichen<strong>de</strong> Narkosetiefe erfor<strong>de</strong>rt jedoch <strong>de</strong>rart hohe <strong>Ethen</strong> - Konzentrationen,<br />
dass im Gemisch nicht ausreichend Sauerstoff zur Erhaltung <strong>de</strong>r vitalen Funktionen vorhan<strong>de</strong>n ist.<br />
Verwendung: <strong>Ethen</strong> ist ein Pflanzenhormon, das vielfältige Wirkungen auf <strong>de</strong>n Pflanzenstoffwechsel<br />
besitzt. In <strong>de</strong>n USA behan<strong>de</strong>lt man seit einiger Zeit <strong>die</strong> grün geernteten Bananen, Orangen und<br />
Zitronen mit <strong>Ethen</strong>, um sie künstlich ausreifen zu lassen; an<strong>de</strong>rerseits kann man durch künstliches<br />
Entfernen von E. aus Lagerfrüchten <strong>de</strong>ren Frische erhalten.<br />
E. gehört mengenmäßig zu <strong>de</strong>n wichtigsten Rohstoffen <strong>de</strong>r organischen Chemie. So ist <strong>Ethen</strong> <strong>die</strong><br />
Ausgangsbasis für rund 30% aller Petrochemikalien.
Reihe „Alles Plastik? – Kleidung aus Kunststoffen“<br />
Reaktionsmechanismus <strong>de</strong>r Eliminierung<br />
Produktion: In Europa stellt Deutschland <strong>de</strong>n größten <strong>Ethen</strong> - Produzenten dar (2,9 Mio t<br />
1989), gefolgt von Frankreich (2,5 Mio t) und England (1,9 Mio t). Etwa <strong>die</strong> Hälfte <strong>de</strong>s <strong>Ethen</strong>s wird<br />
zur Herstellung von Polyethylen benutzt. Die an<strong>de</strong>re Hälfte wird zur Herstellung einer Vielzahl von<br />
chemischen Basischemikalien eingesetzt.<br />
Die Herstellung von <strong>Ethen</strong> erfolgte ursprünglich über Dehydratisierung von Ethanol o<strong>de</strong>r<br />
durch Isolierung aus Kokerei-Gas. Diese Verfahren sind heute in Län<strong>de</strong>rn mit einer gut entwickelten<br />
Petrochemie be<strong>de</strong>utungslos. Allerdings wird das Dehydratisierungsverfahren in Entwicklungslän<strong>de</strong>rn<br />
mit einer Produktion an Bioalkohol (wie z.B. in Südamerika, Asien und Afrika) zur Zeit noch<br />
durchgeführt.<br />
Heute wird <strong>Ethen</strong> überwiegend durch thermische Spaltung (Cracking) von Erdöl und Erdgas gewonnen.<br />
II. Allgemeines Reaktionsschema <strong>de</strong>r Eliminierung<br />
am Beispiel <strong>de</strong>r Dehydratisierung von Ethanol<br />
Versetzt man Ethanol mit konzentrierter Schwefelsäure und erhitzt auf 180 0 C, so entsteht ein<br />
farbloses, leicht süßlich riechen<strong>de</strong>s, brennbares Gas. Dieses ist in <strong>de</strong>r Lage, Bromwasser zu entfärben.<br />
C 2 H 5 OH C 2 H 4 + H 2 O<br />
Reaktionsmechanismus<br />
1. Die Schwefelsäure gibt Protonen ab, <strong>die</strong>se lagern sich an <strong>die</strong> OH-Gruppen <strong>de</strong>r Alkoholmoleküle<br />
an. Es bil<strong>de</strong>t sich jeweils ein Alkoholmolekül mit einer – OH2 + -Gruppe (Oxonium-<br />
Gruppe).<br />
2. Die C-O –Bindung wird dadurch so geschwächt, dass <strong>die</strong> Erwärmung auf 1800 C zur Spaltung<br />
<strong>die</strong>ser Bindung führt. Es entsteht ein Wassermolekül („Dehydratisierung“) und ein positiv<br />
gela<strong>de</strong>nes Carbeniumion*. *Erklärung: Da <strong>de</strong>r Sauerstoff stark elektronegativ ist, wird<br />
<strong>die</strong> C-O –Bindung heterolytisch gespalten, d.h. das bin<strong>de</strong>n<strong>de</strong> Elektronenpaar verbleibt beim<br />
Sauerstoff. Dem betreffen<strong>de</strong>n Kohlenstoffatom fehlt nun ein Elektron, es ist daher positiv<br />
gela<strong>de</strong>n.<br />
3. Carbeniumionen sind sehr reaktionsfreudig. Deshalb wird am benachbarten Kohlenstoffatom<br />
ein Proton abgespalten (Heterolyse!) und es bil<strong>de</strong>t sich eine Doppelbindung zwischen<br />
<strong>de</strong>n bei<strong>de</strong>n Kohlenstoffatomen, es entsteht <strong>Ethen</strong>. Das freigesetzte Proton kann nun <strong>die</strong><br />
nächste Reaktion in Gang setzen, es hat also <strong>die</strong> Funktion eines Katalysators.<br />
Aufgaben<br />
1. Bauen Sie mit <strong>de</strong>m Molekülbaukasten <strong>die</strong> einzelnen Reaktionsschritte nach.<br />
2. Formulieren Sie dann <strong>die</strong> Zwischenschritte mit Strukturformeln.
Reihe „Alles Plastik? – Kleidung aus Kunststoffen“<br />
Reaktionsmechanismus <strong>de</strong>r Eliminierung<br />
III. Versuch<br />
Bitte lesen Sie sich <strong>die</strong> Versuchsanleitung vor Beginn <strong>de</strong>s Versuches vollständig durch!<br />
Beachten Sie <strong>die</strong> R- und S-Sätze!<br />
Versuchsanleitung<br />
Geräte<br />
RG mit passen<strong>de</strong>m durchbohrtem Stopfen,<br />
Waschflasche<br />
Schlauchverbindung<br />
- zur Waschflasche o<strong>de</strong>r<br />
- zum Standzylin<strong>de</strong>r in <strong>de</strong>r pneumatischen Wanne<br />
Brenner, Stativmaterial<br />
Chemikalien Ethanol F R:11 S:7-16<br />
Sand<br />
Bromwasser (sehr verdünnt)<br />
T Xi R: 23-24-36/38 S: 1/2-7/9-26<br />
Aluminiumoxid<br />
Durchführung<br />
Entsorgung<br />
1. Man gibt in ein Reagenzglas ca. 5cm Sand.<br />
2. Der Sand wird mit Ethanol gut durchfeuchtet.<br />
3. Das Reagenzglas wird nahezu waagerecht eingespannt.<br />
4. Man gibt in <strong>de</strong>n vor<strong>de</strong>ren Teil <strong>de</strong>s Reagenzglases etwas Aluminiumoxid.<br />
5. Man füllt eine Waschflasche ca. 5 cm hoch mit verdünntem Bromwasser.<br />
6. Man setzt auf das Reagenzglas einen durchbohrten Stopfen auf, an<br />
<strong>de</strong>m ein Schlauch angeschlossen ist und verbin<strong>de</strong>t ihn mit <strong>de</strong>r<br />
Waschflasche.<br />
7. Man erhitzt mit <strong>de</strong>m Brenner zuerst das Aluminiumoxid und bringt<br />
dann <strong>de</strong>n Alkohol zum verdampfen.<br />
8. Das gasförmige Produkt wird durch Bromwasser geleitet.<br />
9. Alternativ kann man es auch in einem Standzylin<strong>de</strong>r auffangen (in einer<br />
mit Wasser gefüllten pneumatischen Wanne) und <strong>die</strong> Brennprobe<br />
machen. Halten Sie dann einen mit Kalkwasser benetzten Glasstab in<br />
<strong>die</strong> Flamme.<br />
Sand/Aluminiumoxid in <strong>de</strong>n Mülleimer<br />
Bromwasser/Reaktionsprodukt in <strong>de</strong>n Behälter mit organischen Flüssigkeiten
Reihe „Alles Plastik? – Kleidung aus Kunststoffen“<br />
Reaktionsmechanismus <strong>de</strong>r Eliminierung<br />
Aufgaben zum Versuch<br />
1. Notieren Sie <strong>die</strong> Beobachtungen zu <strong>de</strong>n einzelnen Schritten sorgfältig!<br />
2. Formulieren Sie <strong>die</strong> Reaktionsgleichung mit Strukturformeln.<br />
3. Welche Stoffgruppe weisen Sie mit <strong>de</strong>m Bromwasser nach?<br />
4. Welches Reaktionsprodukt entsteht im ersten Teil <strong>de</strong>s Versuchs?<br />
5. Formulieren Sie <strong>die</strong> Reaktionsgleichung <strong>de</strong>r Reaktion <strong>die</strong>ses Produktes mit Brom.<br />
6. Nach welchem Reaktionsmechanismus reagieren <strong>die</strong>se bei<strong>de</strong>n Stoffe?<br />
Evtl. Durchgeführte Brennprobe:<br />
7. Notieren Sie <strong>die</strong> Beobachtungen zum Teil 9 <strong>de</strong>s Versuches.<br />
8. Was weisen Sie mit <strong>de</strong>m Kalkwasser nach?<br />
9. Formulieren Sie <strong>die</strong> Reaktionsgleichung.<br />
Aufgaben zur Dehydratisierung<br />
1. Formulieren Sie <strong>die</strong> Dehydratisierung von 1-Butanol und vergleichen sie mit <strong>de</strong>r Dehydratisierung<br />
von 2-Butanol.<br />
2. Bei <strong>de</strong>r Dehydratisierung von 3-Methylhexan-3-ol können sich verschie<strong>de</strong>ne Alkene bil<strong>de</strong>n.<br />
Geben sie <strong>die</strong> Strukturformeln an und benennen Sie <strong>die</strong> verschie<strong>de</strong>nen Verbindungen.<br />
3. Ist je<strong>de</strong> Dehydratisierungsreaktion automatisch eine Eliminierung? Belegen Sie Ihre Antwort<br />
mit geeigneten Beispielen.<br />
4. Nach welchem Reaktionsmechanismus verläuft <strong>die</strong> Rückreaktion <strong>de</strong>r Dehydratisierung?<br />
5. Wenn man bei <strong>de</strong>r Dehydratisierung von Ethanol <strong>die</strong> Reaktionstemperatur bei ca. 140 0 C<br />
hält, entsteht Diethylether und Wasser. Formulieren Sie <strong>die</strong> Reaktionsgleichung mit Strukturformeln.<br />
Um welchen Reaktionstyp han<strong>de</strong>lt es sich bei <strong>die</strong>ser Reaktion?<br />
6. Wenn man bei <strong>de</strong>r Dehydratisierung von Ethanol <strong>die</strong> Reaktionstemperatur unter 140 0 C<br />
hält, entsteht Schwefelsäureethylester und Wasser. Formulieren Sie <strong>die</strong> Reaktionsgleichung<br />
mit Strukturformeln. Um welchen Reaktionstyp han<strong>de</strong>lt es sich bei <strong>die</strong>ser Reaktion?<br />
7. Nur intramolekulare Dehydratisierungen wer<strong>de</strong>n als Eliminierungen bezeichnet.<br />
Nennen Sie zwei grundsätzlich verschie<strong>de</strong>ne intermolekulare Dehydratisierungsreaktionen<br />
und vergleichen Sie.<br />
Aufgaben zur Eliminierung (lat. eliminare = vertreiben)<br />
1. Beschreiben Sie <strong>de</strong>n Reaktionsmechanismus (mit Strukturformeln aller Zwischenschritte)<br />
<strong>de</strong>r Dehalogenierung von <strong>Dichlorethan</strong> mit Zink (<strong>Dichlorethan</strong> reagiert zu <strong>Ethen</strong> und Chlor).<br />
Warum läuft <strong>die</strong>se Reaktion unter Einfluss von Hydroxidionen ab?<br />
2. Beschreiben Sie möglichst genau <strong>de</strong>n Reaktionsmechanismus folgen<strong>de</strong>r Eliminierungsreaktion:<br />
(CH 3 ) 3 C – Br - CH 2 = C(CH 3 ) 2 + HBr<br />
Wie können Sie <strong>die</strong> Entstehung von Bromwasserstoff nachweisen?<br />
3. Welche verschie<strong>de</strong>nen Reaktionsprodukte erwarten Sie bei <strong>de</strong>r Dehydrohalogenierung von<br />
2-Brompentan?
Reihe „Alles Plastik? – Kleidung aus Kunststoffen“<br />
Reaktionsmechanismus <strong>de</strong>r Eliminierung<br />
4. Auch <strong>die</strong> Dehalogenierung mit Zink gehört zu <strong>de</strong>n Eliminierungsreaktionen. Formulieren Sie<br />
alle Schritte <strong>de</strong>r Reaktion unter Berücksichtigung <strong>de</strong>r Tatsache, dass außer <strong>Ethen</strong> Zinkbromid<br />
entsteht.<br />
5. Definieren Sie allgemein <strong>de</strong>n Begriff Eliminierung.<br />
6. Formulieren Sie <strong>die</strong> Herstellung von 1-Buten, Cyclohexen, Isobuten, Malonsäureanhydrid<br />
(durch Erhitzen von Malonsäure) als Eliminierungsreaktionen.<br />
7. Formulieren Sie <strong>die</strong> Eliminierung von zwei Molekülen Wasser durch Erhitzen von<br />
1,2,3-Propantriol(Glycerin). Es entsteht Propenal (Acrolein).<br />
8. Füllen Sie folgen<strong>de</strong> Tabelle aus:<br />
Reaktionsschema<br />
Hal-H 2 C-CH 2 -Hal <br />
Hal-H 2 C-CH 2 -Hal <br />
H 3 C-CH 3 <br />
H 3 C-CH 2 -OH <br />
HO-H 2 C-CH 2 -OH <br />
Eliminiertes<br />
Molekül<br />
Reaktionsbezeichnung<br />
C 2 H 4 +ZnBr 2<br />
Literatur<br />
Liening Petrochemie<br />
Schroe<strong>de</strong>l Chemie heute SII<br />
Schroe<strong>de</strong>l Organische Chemie<br />
Volk und Wissen allg. und organische Chemie<br />
C.C.Buchner Chemie 2000+ Band 1+2<br />
C.C.Buchner organische Chemie<br />
www.umweltlexikon-online.<strong>de</strong><br />
Es gibt unter<br />
http://www.u-helmich.<strong>de</strong>/che/11/elim01.html<br />
eine kleine Animation über <strong>de</strong>n Mechanismus <strong>de</strong>r<br />
Elimination<br />
www.seilnacht.<strong>de</strong><br />
lexikon freenet.com