130703Geschäftsbericht-m.Abb_ copy - Axiogenesis
130703Geschäftsbericht-m.Abb_ copy - Axiogenesis
130703Geschäftsbericht-m.Abb_ copy - Axiogenesis
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
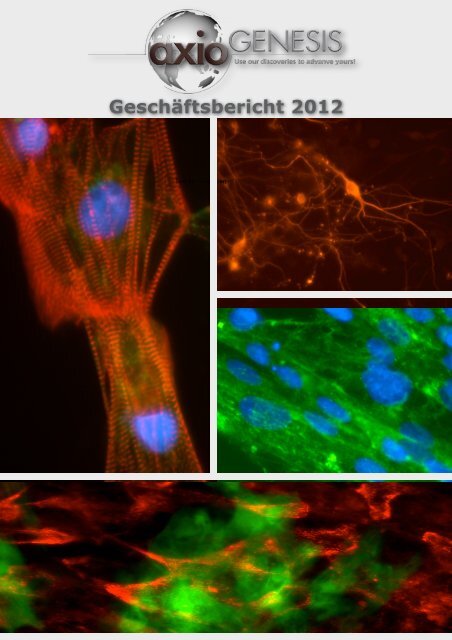
Geschäftsbericht 2012<br />
Text hier eingeben
Nervenzellen in der Organisation.<br />
Die Fotografie zeigt typische Nervenzellen.<br />
Es handelt sich hierbei um Zellen, die<br />
zunehmend in der Wirkungsforschung der<br />
Pharma- und Kosmetikindustrie zum Einsatz<br />
gelangen.<br />
Brief an die Aktionäre<br />
Liebe Aktionärinnen und Aktionäre,<br />
liebe Freunde der <strong>Axiogenesis</strong>,<br />
die <strong>Axiogenesis</strong> AG blickt auf ein äußerst schwieriges<br />
Geschäftsjahr 2012 zurück. Das Ziel bestand, die<br />
Entwicklung der humanen Herzzellen zur Jahresmitte<br />
abzuschliessen, in einen routinisierten Produktionsprozess<br />
zu überführen und in den Markt einzuführen.<br />
Dieses Ziel wurde nicht erreicht. Es wurde insbesondere<br />
nicht erreicht, eine gesicherte Überführung des<br />
Prototyps in einen vollfunktionsfähigen Produktionsprozess<br />
sicher zu stellen. Hinzu traten wiederholt<br />
Kontaminationen bei den Zellkulturen auf. Somit hat<br />
sich die geregelte Markteinführung der humanen<br />
Kardiomyozyten erneut verzögert.<br />
Wir haben uns daher Anfang dieses Jahres entschlossen,<br />
den kritischen Produktionsprozess grundlegend<br />
zu überarbeiten. Diese Arbeiten sind erfolgreich im<br />
Juni 2013 abgeschlossen worden. Im Ergebnis haben<br />
wir nunmehr einen gesicherten Produktionsprozess<br />
vorliegen. Die identifizierten Schwachstellen wurden<br />
beseitigt. Seit Juni 2013 wird das humane Herzzellprodukt<br />
erfolgreich im Markt platziert. Die Ausbringungsmenge<br />
der humanen Kardiomyozyten wird<br />
nunmehr sukzessive und kontinuierlich erhöht, um die<br />
steigende Nachfrage des Marktes nach dem Produkt<br />
zu befriedigen.<br />
Der Vorstand geht davon aus, dass wir im Laufe des<br />
2. Halbjahres 2013 eine deutliche Verbesserung der<br />
Geschäftssituation erreichen werden. Nach dem enttäuschenden<br />
Jahresergebnis 2012 sind gute Voraussetzungen<br />
dafür gegeben, dass die <strong>Axiogenesis</strong> AG<br />
ein verbessertes Jahresergebnis 2013 erreichen wird<br />
und für das Jahr 2014 insgesamt die Gewinnzone<br />
erreichen kann. Die gesicherten Produktionsbedingungen<br />
seit Juni 2013, die steigenden Verkaufszahlen<br />
für das humane Herzprodukt und erwartete Kooperationsabkommen<br />
mit strategischen Partnern in den<br />
nächsten Wochen sind Zeichen für diese Entwicklung.<br />
Ferner konnte den mit den Gläubigern aus dem Bereich<br />
der Stillen Beteiligungen und der Gesellschafterdarlehen<br />
Ende 2012 eine Vereinbarung zur Wandlung<br />
in Höhe von 60% der bestehenden Darlehen<br />
und Stillen Beteiligungen und eine mehrjährige Rückführungsvereinbarung<br />
der verbleibenden Darlehen<br />
unterzeichnet werden. Eine mehrjährige Rückführungsvereinbarung<br />
mit den übrigen Gläubigern der<br />
<strong>Axiogenesis</strong> AG wurde zudem getroffen.<br />
Wir bedanken uns bei unseren Kunden, Mitarbeitern<br />
und Geschäftspartnern für die gute Zusammenarbeit<br />
und freuen uns auf ein erfolgreiches Geschäftsjahr<br />
2013.<br />
Die Gesellschaft konnte im Jahr 2012 weitere Kapitalerhöhungen<br />
mit Altaktionären durchführen. Ferner<br />
haben Gesellschafterdarlehen und weitere Darlehen<br />
zur Absicherung der mittelfristigen Liquidität beigetragen.<br />
Für das Jahr 2013 sind weitere Maßnahmen<br />
zur Stärkung der Eigenkapitalbasis seitens des<br />
Vorstandes initiiert worden.<br />
Dr. Bernd Fronhoff<br />
Vorstand<br />
Dr. Heribert Bohlen<br />
Vorstand<br />
2
A<br />
B<br />
Herzstützgewebe<br />
Die beiden Aufnahmen zeigen das sogenannte Stützgewebe des Herzens. Hierbei handelt es sich um hochspezialisierte Fibroblasten,<br />
die in der Lage sind, die schlagenden Herzmuskelzellen elektrisch zu verschalten. Im vergangenen Jahr ist es der <strong>Axiogenesis</strong> gelungen,<br />
diese Zellen zu charakterisieren. Diese Zellen werden das Produktportfolio der Herzzellen ergänzen.<br />
Lagebericht 2012 der <strong>Axiogenesis</strong> AG<br />
A. Geschäftsverlauf und Lage der Gesellschaft<br />
1. Geschäftsstrategie<br />
Das Jahr 2012 war stark geprägt von den Entwicklungsarbeiten<br />
zu den humanen Herzzellen. Ein<br />
Großteil des technischen und wissenschaftlichen<br />
Headcounts der <strong>Axiogenesis</strong> hat sich auf diese Arbeiten<br />
konzentriert. Der deutliche Anstieg der Materialkosten<br />
ist in erster Linie durch die Arbeiten in<br />
diesem Bereich begründet. Trotz der intensivierten<br />
Anstrengungen konnte das Produkt bis Ende des<br />
Jahres 2012 nicht abschließend fertig gestellt werden.<br />
Es wurde insbesondere nicht erreicht, eine gesicherte<br />
Überführung des Prototyps in einen voll<br />
funktionsfähigen Produktionsprozess sicher zu stellen.<br />
Hinzu kamen größere Kontaminationen bei den<br />
Zellkulturen im Produktionsprozess.<br />
Die Markteinführung der humanen Kardiomyozyten<br />
hat sich somit erneut verzögert. Der vorgesehene<br />
Start der Markteinführung Anfang des 3. Quartals<br />
2012 musste abgebrochen werden, da eine gesicherte<br />
Nachfolgeproduktion der Produkte nicht sichergestellt<br />
werden konnte. Es konnten zwar vereinzelte<br />
Umsätze mit humanen Herzzellen erzielt werden,<br />
allerdings wurde ein planmäßiger Upscale der Produktion<br />
nicht erreicht. Der Vorstand hat im Januar<br />
2013<br />
2011<br />
entschieden, eine umfassende Überprüfung des<br />
gesamten Produktionsprozesses vorzunehmen. Das<br />
Ziel besteht, im Juli 2013 zu einer gesicherten<br />
Markteinführung der humanen Kardiomyozyten zu<br />
gelangen.<br />
Im Bereich der Mauszellen konnte nach Auflösung<br />
des Vertrages mit dem bestehenden Vertriebspartner<br />
Anfang 2012 im 2. Quartal 2012 ein Folgevertrag<br />
mit einem anderen Vertriebspartner abgeschlossen<br />
werden. Es war außerdem geplant, dass sich ein<br />
Folgevertrag für die humanen Herzzellen im Laufe<br />
des Jahres 2012 anschließen sollte. Zu diesem Folgevertrag<br />
kam es allerdings nicht, nachdem seitens<br />
des Vertriebspartners anlässlich einer dortigen Neustrukturierung<br />
Anfang des Jahres 2013 in der Organisation<br />
eine grundsätzliche Entscheidung gegen eine<br />
weitere Aufnahme von zellbasierten Produkten<br />
getroffen wurde.<br />
Abschließend war daher das Jahr 2012 außerordentlich<br />
herausfordernd aufgrund der Misserfolge in<br />
der internen Entwicklung und Produktion der humanen<br />
Herzzellen und aufgrund der fehlgeschlagenen<br />
Vermarktungsanstrengungen, insbesondere mit Blick<br />
auf einen potentiellen Distributionspartner.<br />
2. Geschäftsentwicklung 2012<br />
Die <strong>Axiogenesis</strong> konnte im Jahr 2012 Umsatzerlöse<br />
in Höhe von 631 T€ erzielen gegenüber 524 T€ im<br />
Jahre 2011. Diese Steigerung wurde maßgeblich<br />
hervorgerufen durch Umsätze bei Mauszellen von<br />
506 T€. Wesentlicher Abnehmer der Mauszellen war<br />
der neu gewonnene Vertriebspartner, der vertrags-<br />
3
<strong>Abb</strong>ildung:<br />
Leberzellen, die durch einen geeigneten Vektor<br />
isoliert wurden<br />
gemäß einen entsprechenden Vorratsstock aufbaut.<br />
58 T€ konnten durch humane Zellen (inkl. Services mit<br />
humanen Zellen) erzielt werden und 67 T€ entfielen<br />
auf einen weiteren Projektauftrag mit einem führenden<br />
Pharmaunternehmen. Wie in den Vorjahren konnte<br />
ein weiterer Kooperationsvertrag mit diesem<br />
Pharmaunternehmen gezeichnet werden. Die Arbeiten<br />
aus diesem Kooperationsvertrag haben sich im<br />
Jahre 2013 fortgesetzt.<br />
Bereits wie in den Vorjahren hat die <strong>Axiogenesis</strong> auch<br />
im Jahr 2012 ihre Produktentwicklungsaufwendungen<br />
gemäß Bilanzrechtsmodernisierungsgesetz (BilMoG)<br />
aktiviert. Die im Jahr 2012 aktivierten Eigenleistungen<br />
betrugen insgesamt 1.495 T€, wodurch sich das<br />
selbstgeschaffene immaterielle Vermögen der <strong>Axiogenesis</strong><br />
auf 4.808 T€ erhöhte. Hierbei ist zu berücksichtigen,<br />
dass Sonderabschreibungen des immateriellen<br />
Vermögens in Höhe von 553 T€ vorgenommen<br />
wurden aufgrund mangelnder Vermarktungsmöglichkeiten.<br />
Der Bestand an fertigen Erzeugnissen ist im<br />
Vergleich zum Vorjahr auf ca. 391 T€ gestiegen, die<br />
Bestandsveränderung gegenüber 2011 beträgt<br />
+ 226 T€.<br />
Auf folgende Aufwandsposition ist hinzuweisen:<br />
Die Personalkosten betrugen im Jahre 2012 insgesamt<br />
1.625 T€ (gegenüber 1.657 T€ in 2011). Aufgrund<br />
der bereits geschilderten Entwicklung im Laborbereich<br />
wurde bereits in der 2. Jahreshälfte der Headcount<br />
reduziert. Der Personalabbau wurde im übrigen Anfang<br />
2013 fortgesetzt.<br />
Die Abschreibungen betrugen 973 T€ (gegenüber<br />
451 T€ im Jahre 2011). Maßgeblich für die Abschreibungsgröße<br />
war eine Sonderabschreibung in Höhe<br />
von 553 T€ für immaterielle Vermögensgüter aufgrund<br />
mangelnder Vermarktungsmöglichkeiten. Die<br />
von der Sonderabschreibung betroffenen immateriellen<br />
Wirtschaftsgüter waren:<br />
•Cor.At Mitochondrial<br />
•Calzium Flux-Messung<br />
•Transfektion Nucleofactor<br />
•xCELLigence Mitochondrial<br />
•Customized Endothelzellen<br />
•Bioeffect Screening<br />
Die sonstigen betrieblichen Aufwendungen betrugen<br />
1.373 T€ (Vorjahr 1.137 T€). Innerhalb der sonstigen<br />
betrieblichen Aufwendungen wird auf folgende Positionen<br />
hingewiesen:<br />
a) Forschungs- und Entwicklungskosten<br />
Die Forschungs- und Entwicklungskosten stiegen<br />
von 453 T€ in 2011 auf 758 T€ im Jahr 2012.<br />
Hiervon betrugen die Materialkosten insgesamt<br />
505 T€ (Vorjahr 226 T€). Dieser Anstieg ist ausschließlich<br />
hervorgerufen durch die F + E– und<br />
Produktionsaktivitäten für die humanen Herzzellen.<br />
Die wesentliche Ursache des höheren Materialaufwandes<br />
ist begründet in der Entscheidung,<br />
die Produktion im Bereich der humanen Herzzellen<br />
bereits zu einem frühen Zeitpunkt durchzuführen,<br />
ohne dass ein abschließend gesicherter Hinweis<br />
für die Fertigstellung der F + E-Arbeiten vorgelegen<br />
hat. Konsequenterweise waren die Produktionsanstrengungen<br />
aufgrund des zu frühen<br />
Beginns nur mäßig erfolgreich. Mit dem Beschluss<br />
des Vorstands im Januar 2013, einen umfassenden<br />
Review der bisherigen F + E– und Produktionsarbeiten<br />
für humane Herzzellen vorzunehmen, wurden<br />
die Materialaufwendungen ab Februar 2013<br />
signifikant gekürzt.<br />
Die Kosten für Anmeldungen und für die Aufrechterhaltung<br />
von Patenten betrugen 253 T€ (Vorjahr<br />
227 T€). Maßgeblich wurde diese Steigerung<br />
verursacht durch höhere Jahresgebühren und<br />
durch die Etablierung der internationalen Phasen<br />
für erteilte Patente.<br />
4
) Verwaltungskosten<br />
Die Verwaltungskosten in Höhe von 198 T€ konnten<br />
gegenüber dem Vorjahr um 14 T€ reduziert<br />
werden trotz einer außerordentlichen Zahlung im<br />
Zuge der Auflösung eines Vertriebsvertrages.<br />
c) Vertriebskosten<br />
Die Vertriebskosten beliefen sich auf 111 T€ (Vorjahr<br />
119 T€).<br />
d) Übrige Betriebskosten<br />
Die übrigen Betriebskosten (Mieten, Mietnebenkosten,<br />
Reparaturen etc.) sind mit 307 T€ fast<br />
unverändert gegenüber dem Vorjahr.<br />
Der Zinsaufwand hat in Anbetracht neuer ausgereichter<br />
Gesellschafterdarlehen und anderer Darlehen<br />
zugenommen und beträgt für das Jahr 2012 391T€<br />
(Vorjahr 293 T€).<br />
Der Jahresfehlbetrag im Jahre 2012 beträgt -1.794T€<br />
(Vorjahr -1.476 T€).<br />
3. Überschuldungssituation<br />
Der Jahrsabschluss 2012 ist vom Vorstand unter der<br />
Prämisse der Unternehmensfortführung aufgestellt<br />
und weist einen nicht durch Eigenkapital gedeckten<br />
Fehlbetrag in Höhe von ca. 1.518 T€ (Vorjahr 623T€)<br />
aus.<br />
Aufgrund der weiter vorliegenden Rangrücktrittserklärung<br />
der stillen Gesellschafter liegt ferner keine<br />
Überschuldung der Gesellschaft in insolvenzrechtlichem<br />
Sinne bis zum 31.12.2012 vor. Mit Blick auf die<br />
Neufassung des insolvenzrechtlichen Überschuldungsbegriffes<br />
(§ 19 Abs. 2 InsO) im Rahmen des<br />
Finanzmarktstabilisierungsgesetzes ist festzuhalten,<br />
dass ohnehin keine Überschuldung vorliegt, wenn die<br />
Finanzkraft des Unternehmens nach überwiegender<br />
Wahrscheinlichkeit mittelfristig zur Fortführung ausreicht.<br />
Der Vorstand weist darauf hin, dass die bilanzielle<br />
Überschuldung der Unternehmung zu einem vollständigen<br />
Verzehr des Eigenkapitals geführt hat.<br />
B. Voraussichtliche Entwicklung der Gesellschaft<br />
Für das Jahr 2013 besteht das vorrangige Ziel, eine<br />
abgesicherte Produktion der humanen Herzzellen zu<br />
erreichen. Nach den jetzt vorliegenden Erkenntnissen<br />
werden wir dieses Ziel mit Ende des 2. Quartals 2013<br />
erreichen. Insofern liegt aus heutiger Sicht eine verlässliche<br />
Planung der Markteinführung der humanen<br />
Herzzellen zum 01.07.2013 vor. Die Zeit des Reviews<br />
des F + E- und Produktionsprozesses (Februar 2013 –<br />
Juni 2013) wurde parallel genutzt, um das Kaufinteresse<br />
bei den potentiell in Frage kommenden Kunden<br />
zu wecken. Eine Vielzahl von Gesprächen und Demonstrationen<br />
des Produktes hat bei den in Frage<br />
kommenden Kunden stattgefunden. Ferner liegen erste<br />
Bestellungen vor, die mit der Markteinführung des<br />
3. Quartals 2013 befriedigt werden. Außerdem wurde<br />
die operative Burnrate der Unternehmung maßgeblich<br />
gesenkt.<br />
Der Vorstand ist ferner in Verhandlungen mit in Frage<br />
kommenden Distributionspartnern. Das Ziel besteht in<br />
diesem Falle darin, sich zukünftig stärker auf die<br />
Neuentwicklung von Zellen zu konzentrieren und die<br />
Standard-/Routineproduktion an den Partner zu transferieren.<br />
Ferner befindet sich der Vorstand in Verhandlungen<br />
mit einem weiteren Kooperationspartner aus dem<br />
Pharmabereich für die Entwicklung von neuen Zelltypen.<br />
Ein erster Teilschritt für ein mögliches Projekt<br />
konnte bereits vereinbart werden.<br />
Insgesamt besteht nunmehr das Ziel, Ende des Jahres<br />
2013 eine deutliche Verbesserung der Situation zu<br />
erreichen. Nach dem enttäuschendem Jahresergebnis<br />
2012 sind nunmehr gute Voraussetzungen (gesicherte<br />
Produktionsbedingungen ab Mitte 2013, erwartbare<br />
Abschlüsse von Kooperationsabkommen mit einem<br />
strategischen Partner im Bereich Zellen und Services<br />
sowie mit einem Pharmaunternehmen in der<br />
2. Jahreshälfte 2013) dafür gegeben, dass ein verbessertes<br />
Jahresergebnis 2013 erreicht wird und für<br />
das Jahr 2014 insgesamt die Gewinnzone erreicht<br />
werden kann. Abhängig von der Zuführung neuer<br />
Beteiligungsgelder wird insbesondere auch das Geschäftsfeld<br />
Drug Discovery weiter vorangetrieben mit<br />
dem Ziel, relevante Wirkstoffkandidaten im Bereich<br />
Kardiomyopathie zu identifizieren.<br />
Innerhalb dieses Bereiches werden zur Zeit Gespräche<br />
mit interessierten Pharmaunternahmen vorangetrieben,<br />
zu entsprechenden Lizenzvereinbarungen zu<br />
gelangen. Die Auswirkungen aus diesen Verhandlungen<br />
sind allerdings erst für das Jahr 2014 zu erwarten.<br />
Die eingeleiteten Maßnahmen zur Kostensenkung mit<br />
Wirkung der Reduzierung der operativen Burnrate<br />
werden 2013 unverändert fortgesetzt.<br />
C. Chancen und Risiken der zukünftigen Entwicklung<br />
Stärkung Eigenkapital<br />
Im Jahre 2012 wurden weitere Kapitalerhöhungen<br />
durchgeführt. Ferner konnte mit den Gläubigern aus<br />
dem Bereich der Stillen Beteilungen und der Gesellschafterdarlehen<br />
Ende 2012 eine Vereinbarung zur<br />
Wandlung in Höhe von 60 % der bestehenden Darlehen<br />
und Stillen Beteiligungen und eine mehrjährige<br />
5
Rückführungsvereinbarung der verbleibenden Darlehen<br />
unterzeichnet werden. Ferner konnte auch eine<br />
mehrjährige Rückführungsvereinbarung mit den übrigen<br />
Gläubigern der <strong>Axiogenesis</strong> getroffen werden.<br />
Die notwendige Liquidität der Gesellschaft im Jahre<br />
2012 wurde durch weitere Darlehen auch von Gesellschaftern<br />
ausgewählter Altaktionäre gesichert. Für<br />
das Jahr 2013 wird die erforderliche Liquidität der<br />
Gesellschaft maßgeblich durch eine Vereinbarung<br />
bezüglich weiterer Kapitalerhöhungen mit einem Altaktionär<br />
sichergestellt. Das Vermarktungsrisiko hat<br />
sich aufgrund weiterer Anreichung des innovativen<br />
Produktportfolios tendenziell verringert. Mit der geplanten<br />
Markteinführung der humanen Kardiomyozyten<br />
wird dieses Risiko tendenziell weiter vermindert.<br />
D. Forschung und Entwicklung und Patentsituation<br />
E. Ausblick auf das Geschäftsjahr 2012<br />
Der Vorstand der <strong>Axiogenesis</strong> AG hat dem Aufsichtsrat<br />
ein Planbudget für das Geschäftsjahr 2012 vorgelegt.<br />
Der Aufsichtsrat hat dieses Budget genehmigt.<br />
Nach dem heutigen Stand geht der Vorstand davon<br />
aus, dass die im Rahmen des Planbudgets vorgelegten<br />
Ziele erreicht werden können. Köln, den 10. 05.<br />
2013<br />
gez.<br />
Dr. Bernd Fronhoff<br />
Vorstand <strong>Axiogenesis</strong><br />
gez.<br />
Dr. Heribert Bohlen<br />
Vorstand <strong>Axiogenesis</strong><br />
Die Patentanmeldung in Hypertrophie ist abschließend<br />
im Jahre 2012 erteilt worden. Somit liegt der<br />
Schutz aus diesem Patent für die wesentlichen Regionen<br />
EU, Japan und USA vor. Zur Zeit werden für dieses<br />
Patent weitere Divisionals in den USA und in Europa<br />
betrieben, um die Breite des erteilten Patentes<br />
zu vergrößern.<br />
Die <strong>Axiogenesis</strong> hat ferner in 2012 mit iPS Academia<br />
in Japan einen nicht exklusiven Lizenzvertrag für die<br />
Vermarktung der wesentlichen Patentfamilien der A-<br />
xiogenesis unterzeichnet.<br />
In 2013 wird das Ziel verfolgt, neue kundenorientierte<br />
Applikationen für die Nutzer unserer Zellen bereit<br />
zu stellen. Es hat sich als sinnvoll erwiesen, einen Anteil<br />
der Entwicklungsanstrengungen für die Etablierung<br />
der Zellprodukte in Laborhardware zu verwenden,<br />
mit denen unsere Kunden arbeiten. Der Anstieg<br />
von Applikationsprotokollen zu automatisierten Laborgeräten<br />
führt zu einem breiteren Anwendungsspektrum<br />
der Zellen und damit zu einer besseren<br />
Produktdurchdringung unserer Produkte im Markt.<br />
6
Bilanz zum 31. Dezember 2012<br />
31.12.2012 31.12.2011<br />
0,00 0,00<br />
7.544.795,97 5.758.243,69 7.544.795,97 5.758.243,69<br />
II. Sachanlagen IV. Bilanzverlust ( 8) 14.875.805,59 13.081.377,82<br />
Andere Anlagen, Betriebs- und Geschäftsausstattung 464.608,50 546.388,24 - davon Verlustvortrag<br />
5.334.455,79 4.760.953,40 ! 13.081.377,82 (Vorjahr ! 11.605.060,97)<br />
I. Immaterielle Vermögensgegenstände I. Gezeichnetes Kapital ( 5) 157.906,00 154.406,00<br />
1. Selbst geschaffene gewerbliche Schutzrechte<br />
und ähnliche Rechte und Werte 4.808.454,79 4.134.051,66 II. Zur Durchführung der beschlossenen<br />
2. Entgeltlich erworbene Konzessionen, gewerbliche Kapitalerhöhung geleistete Einlage ( 6) 200.000,00 0,00<br />
Schutzrechte und ähnliche Rechte und Werte<br />
sowie Lizenzen an solchen Rechten und Werten 61.392,50 4.869.847,29 80.513,50 4.214.565,16 III. Kapitalrücklage ( 7) 13.000.048,55 12.303.548,55<br />
C. Rechnungsabgrenzungsposten 9.965,56 9.769,90 1. Verbindlichkeiten gegenüber<br />
Kreditinstituten 239,63 8,34<br />
2. Verbindlichkeiten aus<br />
D. Nicht durch Eigenkapital gedeckter Fehlbetrag 1.517.851,04 623.423,27 Lieferungen und Leistungen 88.031,41 42.892,91<br />
3. Sonstige Verbindlichkeiten 4.664.992,93 2.872.165,44<br />
- davon aus Steuern<br />
! 22.740,18 (Vorjahr ! 19.518,45)<br />
- davon im Rahmen der sozialen Sicherheit<br />
! 0,00 (Vorjahr ! 2.803,13)<br />
4.753.263,97 2.915.066,69<br />
V. Nicht durch Eigenkapital<br />
B. Umlaufvermögen gedeckter Fehlbetrag 1.517.851,04 623.423,27<br />
0,00 0,00<br />
I. Vorräte<br />
Fertige Erzeugnisse 391.172,35 164.777,15<br />
B. Einlagen stiller Gesellschafter ( 9) 2.500.000,00 2.500.000,00<br />
II. Forderungen und<br />
sonstige Vermögensgegenstände<br />
1. Forderungen aus Lieferungen und Leistungen 59.026,51 63.844,04 C. Rückstellungen<br />
2. Sonstige Vermögensgegenstände ( 4) 75.875,42 134.901,93 50.000,28 113.844,32<br />
Sonstige Rückstellungen (10) 291.532,00 343.177,00<br />
III. Kassenbestand, Guthaben bei Kreditinstituten 156.449,30 85.475,65<br />
682.523,58 364.097,12<br />
D. Verbindlichkeiten (11)<br />
<strong>Axiogenesis</strong> AG, Köln I/1<br />
Anhang Anhang 31.12.2012 31.12.2011<br />
Tz. ! ! ! ! Tz. ! !<br />
A. Anlagevermögen ( 3) A. Eigenkapital<br />
AKTIVA PASSIVA
<strong>Axiogenesis</strong> AG, Köln I/2<br />
Gewinn- und Verlustrechnung<br />
für die Zeit vom 1. Januar bis 31. Dezember 2012<br />
Anhang<br />
2012 2011<br />
Tz. ! ! ! !<br />
1. Umsatzerlöse 631.053,94 523.575,59<br />
2. Erhöhung des Bestands<br />
an fertigen Erzeugnissen 226.395,20 678,15<br />
3. Andere aktivierte Eigenleistungen 1.495.189,51 1.504.513,71<br />
4. Sonstige betriebliche Erträge (12) 214.440,41 28.354,20<br />
5. Personalaufwand<br />
a) Löhne und Gehälter 1.378.167,36 1.385.768,28<br />
b) Soziale Abgaben 246.495,47 1.624.662,83 271.081,54 1.656.849,82<br />
6. Abschreibungen auf immaterielle<br />
Vermögensgegenstände des<br />
Anlagevermögens und Sachanlagen 972.999,60 450.653,59<br />
- davon außerplanmäßig<br />
! 552.921,59 (Vorjahr ! 96.969,23)<br />
7. Sonstige betriebliche Aufwendungen 1.373.479,02 1.136.953,59<br />
8. Sonstige Zinsen und ähnliche Erträge 252,45 4.367,76<br />
9. Zinsen und ähnliche Aufwendungen (13) 390.617,83 293.349,26<br />
10. Ergebnis der gewöhnlichen<br />
Geschäftstätigkeit/Jahresfehlbetrag - 1.794.427,77 - 1.476.316,85<br />
11. Verlustvortrag aus dem Vorjahr 13.081.377,82 11.605.060,97<br />
12. Bilanzverlust ( 8) 14.875.805,59 13.081.377,82<br />
0,00 0,00
Anhang für das Geschäftsjahr 2012<br />
(1) A. Allgemeine Angaben<br />
Der Jahresabschluss zum 31. Dezember 2012 ist freiwillig bzw. nach einer gesonderten Vereinbarung mit<br />
der stillen Gesellschafterin tbg unter Beachtung der Bilanzierungs- und Bewertungsvorschriften des HGB für<br />
große Kapitalgesellschaften im Sinne des § 267 Abs. 3 HGB aufgestellt. Entsprechend hat die Gesellschaft<br />
einen Lagebericht für das Geschäftsjahr 2012 aufgestellt.<br />
Der Ausweis der Einlagen stiller Gesellschafter erfolgt aus Gründen der Klarheit in einer gesonderten Position<br />
hinter dem Eigenkapital.<br />
Die Gewinn- und Verlustrechnung wird nach dem Gesamtkostenverfahren aufgestellt.<br />
(2)<br />
B. Bilanzierungs- und Bewertungsgrundsätze<br />
Die immateriellen Vermögensgegenstände sind zu Anschaffungs- und Herstellungskosten abzüglich planmäßiger<br />
linearer Abschreibungen entsprechend der voraussichtlichen Nutzungsdauer, welche drei<br />
bis acht Jahre beträgt, bewertet. Selbst geschaffene immaterielle Vermögensgegenstände werden ab Fertigstellung<br />
über fünf Jahre linear abgeschrieben. Notwendige Abschreibungen auf den niedrigeren beizulegenden<br />
Wert werden vorgenommen.<br />
Die Gegenstände des Sachanlagevermögens werden zu Anschaffungskosten bewertet, vermindert um<br />
planmäßige lineare Abschreibungen. Die Nutzungsdauer beträgt drei bis dreizehn Jahre. Geringwertige<br />
Anlagegüter mit Anschaffungskosten bis zu € 150,00 werden im Anschaffungsjahr voll abgeschrieben. Anlagegüter<br />
mit Anschaffungskosten zwischen € 150,00 und € 1.000,00 werden in einen Sammelposten eingestellt,<br />
der im Jahr der Bildung und den folgenden vier Jahren jeweils mit 20 % p. a. linear aufgelöst wird.<br />
Die Notwendigkeit zur Vornahme außerplanmäßiger Abschreibungen besteht nicht.<br />
Der Umfang der Anschaffungskosten entspricht § 255 Abs. 1 HGB. Sie umfassen demnach auch Anschaffungsnebenkosten<br />
sowie nachträgliche Anschaffungskosten unter Berücksichtigung von Anschaffungskostenminderungen.<br />
Die Herstellungskosten werden nach § 255 Abs. 2 und Abs. 2a HGB bemessen. Sie umfassen<br />
Materialkosten, Fertigungs- und Fertigungsgemeinkosten.<br />
9<br />
Das
Bei den Vorräten werden die fertigen Erzeugnisse mit den Herstellungskosten bewertet, soweit ihnen nicht ein<br />
niedrigerer Wert beizulegen ist. Die Herstellungskosten enthalten sämtliche Einzelkosten sowie angemessene<br />
Teile von Gemeinkosten.<br />
Die Forderungen und sonstigen Vermögensgegenstände werden unter Berücksichtigung aller erkennbaren<br />
Risiken bewertet.<br />
Das gezeichnete Kapital ist mit dem Nennbetrag bewertet.<br />
Die Guthaben der stillen Gesellschafter werden zum Nominalbetrag ausgewiesen.<br />
Bei der Bildung der Rückstellungen ist allen erkennbaren Risiken und ungewissen Verbindlichkeiten angemessen<br />
Rechnung getragen. Sie sind in der Höhe bemessen, die nach vernünftiger kaufmännischer Beurteilung<br />
notwendig ist.<br />
Die Verbindlichkeiten werden mit dem Erfüllungsbetrag angesetzt.<br />
10
<strong>Axiogenesis</strong> AG, Köln<br />
I/5<br />
C. Erläuterungen zur Bilanz<br />
( 3) Anlagevermögen<br />
Anschaffungs-/Herstellungskosten Abschreibungen Buchwerte<br />
Stand Stand Stand Stand<br />
1.1.2012 Zugänge Abgänge 31.12.2012 1.1.2012 Zugänge Abgänge 31.12.2012 31.12.2012 31.12.2011<br />
! ! ! ! ! ! ! ! ! !<br />
I. Immaterielle Vermögensgegenstände<br />
1. Selbst geschaffene gewerbliche Schutzrechte<br />
und ähnliche Rechte und Werte 4.473.798,40 1.495.189,51 696.295,43 5.272.692,48 339.746,74 820.786,38 696.295,43 464.237,69 4.808.454,79 4.134.051,66<br />
2. Entgeltlich erworbene Konzessionen, gewerbliche Schutzrechte<br />
und ähnliche Rechte und Werte<br />
sowie Lizenzen an solchen Rechten und Werten 209.129,14 10.067,30 0,00 219.196,44 128.615,64 29.188,30 0,00 157.803,94 61.392,50 80.513,50<br />
4.682.927,54 1.505.256,81 696.295,43 5.491.888,92 468.362,38 849.974,68 696.295,43 622.041,63 4.869.847,29 4.214.565,16<br />
II. Sachanlagen<br />
Andere Anlagen, Betriebs- und Geschäftsausstattung<br />
Betriebs- und Geschäftsausstattung 19.676,32 0,00 0,00 19.676,32 16.979,82 1.596,00 0,00 18.575,82 1.100,50 2.696,50<br />
Laborequipment 758.473,80 38.930,00 0,00 797.403,80 377.565,56 72.703,74 0,00 450.269,30 347.134,50 380.908,24<br />
Büroeinrichtung 24.163,28 0,00 0,00 24.163,28 12.846,28 2.365,00 0,00 15.211,28 8.952,00 11.317,00<br />
EDV-Hardware 422.714,26 2.315,18 0,00 425.029,44 277.124,76 43.019,18 0,00 320.143,94 104.885,50 145.589,50<br />
Geringwertige Vermögensgegenstände 18.767,69 0,00 0,00 18.767,69 12.890,69 3.341,00 0,00 16.231,69 2.536,00 5.877,00<br />
1.243.795,35 41.245,18 0,00 1.285.040,53 697.407,11 123.024,92 0,00 820.432,03 464.608,50 546.388,24<br />
5.926.722,89 1.546.501,99 696.295,43 6.776.929,45 1.165.769,49 972.999,60 696.295,43 1.442.473,66 5.334.455,79 4.760.953,40
(4)<br />
Sonstige Vermögensgegenstände<br />
Hierin sind Forderungen gegen Vorstandsmitglieder in Höhe von € 4.460,01 (Vorjahr € 0,00) enthalten.<br />
(5) Gezeichnetes Kapital<br />
Das Grundkapital beträgt € 157.906,00. Es setzt sich aus 157.906 Namensaktien im Nominalwert von € 1,00<br />
zusammen.<br />
Durch Beschluss der Hauptversammlung vom 15. Juni 2009 wurde der Vorstand ermächtigt, bis zum 16. Juni<br />
2014 das Grundkapital um bis zu € 20.000,00 durch Ausgabe von 20.000 neuen Inhaberaktien zu erhöhen<br />
(genehmigtes Kapital 2009). Aus dem genehmigten Kapital 2009 wurden im Jahr 2012 sieben Kapitalerhöhungen<br />
von insgesamt € 3.500,00 durch Ausgabe von 3.500 neuen Inhaberaktien durchgeführt.<br />
(6)<br />
Zur Durchführung der beschlossenen Kapitalerhöhung geleistete Einlage<br />
Die Eintragung der beschlossenen Kapitalerhöhung im Handelsregister des Amtsgerichts Köln ist am<br />
8. und 11. Januar 2013 erfolgt.<br />
(7)<br />
Kapitalrücklage<br />
Die Kapitalrücklage ergibt sich wie folgt:<br />
€<br />
Stand 1.1.2012 12.303.548,55<br />
Kapitalerhöhung vom 20. April 2012<br />
Aufgeld € 199,00 für 500 Aktien 99.500,00<br />
Kapitalerhöhung vom 23. Mai 2012<br />
Aufgeld € 199,00 für 500 Aktien 99.500,00<br />
Kapitalerhöhung vom 18. Juni 2012<br />
Aufgeld € 199,00 für 500 Aktien 99.500,00<br />
Kapitalerhöhung vom 14. August 2012<br />
Aufgeld € 199,00 für 500 Aktien 99.500,00<br />
Kapitalerhöhung vom 20. September 2012<br />
Aufgeld € 199,00 für 500 Aktien 99.500,00<br />
Kapitalerhöhung vom 19. Oktober 2012<br />
Aufgeld € 199,00 für 500 Aktien 99.500,00<br />
Kapitalerhöhung vom 8. November 2012<br />
Aufgeld € 199,00 für 500 Aktien<br />
99.500,00<br />
Stand 31.12.2012 13.000.048,55<br />
12
(8) Bilanzverlust<br />
Im Bilanzverlust ist der Verlustvortrag des Vorjahres wie folgt enthalten:<br />
€<br />
Stand 31.12.2011/1.1.2012 13.081.377,82<br />
Jahresfehlbetrag 2012 1.794.427,77<br />
Stand 31.12.2012 14.875.805,59<br />
(9) Einlagen stiller Gesellschafter<br />
Es bestehen Einlagen stiller Gesellschafter in Höhe von € 2.500.000,00 (Vorjahr € 2.500.000,00).<br />
Auf die stillen Gesellschafter entfällt ein Verzinsungsanspruch von 7 % und von erzielten Jahresüberschüssen<br />
eine feste Gewinnvergütung. An Verlusten nehmen die stillen Gesellschafter nicht teil. Die stillen Gesellschafter<br />
haben mit Erklärungen vom 27. März 2006, 31. Januar 2007 sowie 1. und 5. Februar 2007 Rangrücktritte in<br />
Höhe von insgesamt € 2.470.000,00 erklärt.<br />
Die Einlagen sind soweit allein aus künftigen Jahresüberschüssen, aus einem Liquidationsüberschuss oder aus<br />
weiterem, alle anderen Schulden der Gesellschaft übersteigendem Vermögen zurückzuzahlen.<br />
(10)<br />
Sonstige Rückstellungen<br />
Im Wesentlichen handelt es sich um ungewisse Verbindlichkeiten aus Aufsichtsratsvergütungen, für Personalkosten<br />
und ausstehende Rechnungen.<br />
(11) Verbindlichkeiten<br />
Die Restlaufzeiten der Verbindlichkeiten ergeben sich wie folgt:<br />
31.12.2012 einem Jahr gesichert 31.12.2011 einem Jahr gesichert<br />
€ € € € € €<br />
1.Verbindlichkeiten<br />
gegenüber<br />
Kreditinstituten 239,63 239,63 0,00 8,34 8,34 0,00<br />
2.Verbindlichkeiten<br />
aus Lieferungen<br />
und Leistungen 88.031,41 88.031,41 0,00 42.892,91 42.892,91 0,00<br />
3.Sonstige<br />
Verbindlichkeiten 4.664.992,93 3.714.992,93 950.000,00 1) 2.872.165,44 1.922.165,44 950.000,00 1)<br />
4.753.263,97 3.803.263,97 950.000,00 2.915.066,69 1.965.066,69 950.000,00<br />
1)<br />
Forderungsabtretung<br />
13
D. Angaben zur Gewinn- und Verlustrechnung<br />
(12)<br />
Sonstige betriebliche Erträge<br />
Die sonstigen betrieblichen Erträge betreffen im Wesentlichen Erträge aus Kraftfahrzeuggestellung und <br />
Erträge aus der Auflösung von Rückstellungen.<br />
(13)<br />
Zinsen und ähnliche Aufwendungen<br />
2012 2011<br />
€ €<br />
Zinsen auf Einlagen stiller Gesellschafter 175.000,00 175.000,00<br />
Übrige 215.617,83 118.349,26<br />
390.617,83 293.349,26<br />
E. Sonstige Angaben<br />
(14) Vergütung des Abschlussprüfers<br />
Für das Geschäftsjahr 2012 ergibt sich folgendes Gesamthonorar:<br />
€<br />
Abschlussprüfung 10.996,00<br />
Steuerberatung 2.667,20<br />
Sonstige Leistungen 5.055,00<br />
18.718,20<br />
(15) Forschungs- und Entwicklungskosten<br />
€<br />
Forschungs- und Entwicklungskosten 2012 2.253.031,08<br />
- davon aktiviert € 1.495.189,51<br />
(16)<br />
Ausschüttungssperre<br />
Der Ausschüttungssperre des § 268 Abs. 8 HGB unterliegen € 4.808.454,79. Dieser Betrag entfällt auf die<br />
Aktivierung selbst geschaffener immaterieller Vermögensgegenstände.<br />
(17) Ergebnisverwendungsvorschlag<br />
Vorstand und Aufsichtsrat schlagen der Hauptversammlung vor, den Bilanzverlust von € 14.875.805,59 auf<br />
neue Rechnung vorzutragen.<br />
14
(18) Organe<br />
Vorstand der Gesellschaft im Geschäftsjahr 2012 waren:<br />
Dr. Heribert Bohlen, Köln<br />
Dr. Bernd Fronhoff, Köln<br />
Aufsichtsratsmitglieder im Geschäftsjahr 2012 waren:<br />
Christian Graf Dürckheim-Ketelhodt, Kaufmann, London - Vorsitzender -<br />
Dr. Klaus Frobel, Chemiker, Wuppertal<br />
Dipl.-Ing. Carl-Peter Gerlach, Wirtschaftsingenieur, Krefeld<br />
Auf eine Angabe der Bezüge der Vorstandsmitglieder der Aktiengesellschaft wird gemäß § 286 Abs. 4<br />
HGB verzichtet.<br />
Für den Aufsichtsrat der Gesellschaft wurden für das Geschäftsjahr 2012 Vergütungen in Höhe von<br />
€ 15.000,00 passiviert.<br />
(19) Sonstige finanzielle Verpflichtungen<br />
31.12.2012 31.12.2011<br />
€ €<br />
Verpflichtung aus Mietvertrag 102.216,00 102.216,00<br />
Verpflichtungen aus Leasingverträgen 36.564,90 6.797,50<br />
(20) Mitarbeiterzahl<br />
Während des Geschäftsjahres 2012 waren durchschnittlich 21 Angestellte beschäftigt (Vorjahr 23).<br />
(21)<br />
Andere Unternehmensverträge<br />
Am 4. August 2005 erfolgte die Eintragung von stillen Gesellschaften als „andere Unternehmensverträge“<br />
im Sinne des § 292 Abs. 1 Nr. 2 AktG in das Handelsregister des Amtsgerichts Köln. Die Gesellschaft hat<br />
sich damit verpflichtet, aus bis zum 30. Juni 2015 erzielten Gewinnen Gewinnabführungen in Höhe von<br />
insgesamt 6,6 % an die Beteiligten vorzunehmen.<br />
Köln, den 10. Mai 2013<br />
<strong>Axiogenesis</strong> AG<br />
Vorstand<br />
gez.<br />
Dr. Bernd Fronhoff<br />
Vorstand<br />
gez.<br />
Dr. Heribert Bohlen<br />
Vorstand<br />
15
Bestätigungsvermerk<br />
An die <strong>Axiogenesis</strong> AG:<br />
Wir haben den Jahresabschluss - bestehend aus Bilanz, Gewinn- und Verlustrechnung sowie Anhang -<br />
unter Einbeziehung der Buchführung und den Lagebericht der <strong>Axiogenesis</strong> AG, Köln, für das Geschäftsjahr<br />
vom 1. Januar bis 31. Dezember 2012 geprüft. Die Buchführung und die Aufstellung von Jahresabschluss<br />
und Lagebericht nach den deutschen handelsrechtlichen Vorschriften liegen in der Verantwortung<br />
des Vorstands der Gesellschaft. Unsere Aufgabe ist es, auf der Grundlage der von uns durchgeführten<br />
Prüfung eine Beurteilung über den Jahresabschluss unter Einbeziehung der Buchführung und über den<br />
Lagebericht abzugeben.<br />
Wir haben unsere Prüfung nach § 317 HGB unter Beachtung der vom Institut der Wirtschaftsprüfer<br />
(IDW) festgestellten deutschen Grundsätze ordnungsmäßiger Abschlussprüfung vorgenommen. Danach<br />
ist die Prüfung so zu planen und durchzuführen, dass Unrichtigkeiten und Verstöße, die sich auf die Darstellung<br />
des durch den Jahresabschluss unter Beachtung der Grundsätze ordnungsmäßiger Buchführung<br />
und durch den Lagebericht vermittelten Bildes der Vermögens-, Finanz- und Ertragslage wesentlich auswirken,<br />
mit hinreichender Sicherheit erkannt werden. Bei der Festlegung der Prüfungshandlungen werden<br />
die Kenntnisse über die Geschäftstätigkeit und über das wirtschaftliche und rechtliche Umfeld der<br />
Gesellschaft sowie die Erwartungen über mögliche Fehler berücksichtigt. Im Rahmen der Prüfung werden<br />
die Wirksamkeit des rechnungslegungsbezogenen internen Kontrollsystems sowie Nachweise über<br />
die Angaben in Buchführung, Jahresabschluss und Lagebericht überwiegend auf der Basis von Stichproben<br />
beurteilt. Die Prüfung umfasst die Beurteilung der angewandten Bilanzierungsgrundsätze und der<br />
wesentlichen Einschätzungen der gesetzlichen Vertreter sowie die Würdigung der Gesamtdarstellung<br />
des Jahresabschlusses und des Lageberichts. Wir sind der Auffassung, dass unsere Prüfung eine hinreichend<br />
sichere Grundlage für unsere Beurteilung bildet.<br />
Unsere Prüfung hat zu keinen Einwendungen geführt.<br />
Nach unserer Beurteilung aufgrund der bei der Prüfung gewonnenen Erkenntnisse entspricht der Jahresabschluss<br />
den gesetzlichen Vorschriften und vermittelt unter Beachtung der Grundsätze ordnungsmäßiger<br />
Buchführung ein den tatsächlichen Verhältnissen entsprechendes Bild der Vermögens-, Finanz- und<br />
Ertragslage der Gesellschaft. Der Lagebericht steht in Einklang mit dem Jahresabschluss, vermittelt insgesamt<br />
ein zutreffendes Bild von der Lage der Gesellschaft und stellt die Chancen und Risiken der zukünftigen<br />
Entwicklung zutreffend dar.<br />
16
Ohne diesen Bestätigungsvermerk einzuschränken, weisen wir auf die bestehende buchmäßige Überschuldung<br />
der Gesellschaft in Höhe von T€ 623 hin, die jedoch durch Rangrücktritte in Höhe von T€ 2.470 keine<br />
Überschuldung in insolvenzrechtlichem Sinne darstellt. Wir verweisen auf die Ausführungen im Lagebericht.<br />
Der Fortbestand der <strong>Axiogenesis</strong> AG ist nur dann sichergestellt, wenn die Finanzierung bis zur vollständigen<br />
Marktreife der angebotenen Produkte und Verfahren sichergestellt werden kann und die Produkte die erwartete<br />
Marktakzeptanz finden.<br />
Köln, den 28. Mai 2013<br />
MSRG DORNBACH GmbH<br />
Wirtschaftsprüfungsgesellschaft<br />
Steuerberatungsgesellschaft<br />
Michels<br />
Wirtschaftsprüfer<br />
Brendt<br />
Wirtschaftsprüfer<br />
Bei Veröffentlichungen oder Weitergabe des Jahresabschlusses in einer von der bestätigten Fassung abweichenden Form (einschließlich<br />
der Übersetzung in andere Sprachen) bedarf es zuvor unserer erneuten Stellungnahme, sofern hierbei unser Bestätigungsvermerk zitiert<br />
oder auf unsere Prüfung hingewiesen wird; wir weisen insbesondere auf § 328 HGB hin.<br />
17
<strong>Axiogenesis</strong> AG<br />
Nattermannallee 1<br />
50829 Köln<br />
Telefon: +49 221 99 88 18-0<br />
Telefax: +49 221 99 88 18-10<br />
E-Mail: info@axiogenesis.com<br />
Web: www.axiogenesis.com