Mykotoxine in Futtermitteln - Wirkungen, Analytik, Grenzwerte
Mykotoxine in Futtermitteln - Wirkungen, Analytik, Grenzwerte
Mykotoxine in Futtermitteln - Wirkungen, Analytik, Grenzwerte
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Mykotox<strong>in</strong>e</strong> <strong>in</strong> <strong>Futtermitteln</strong> - <strong>Wirkungen</strong>, <strong>Grenzwerte</strong>, <strong>Analytik</strong><br />
1. Relevante <strong>Mykotox<strong>in</strong>e</strong><br />
<strong>Mykotox<strong>in</strong>e</strong> s<strong>in</strong>d natürliche, strukturell sehr unterschiedliche Gifte, die als<br />
Stoffwechselprodukte von Schimmelpilzen gebildet werden. Bekannt s<strong>in</strong>d mehrere Hundert<br />
Verb<strong>in</strong>dungen, aber nur e<strong>in</strong> kle<strong>in</strong>er Teil davon hat praktische Bedeutung. Folgende Tabelle<br />
listet die häufig <strong>in</strong> <strong>Futtermitteln</strong> vorkommenden Pilze, ihre Tox<strong>in</strong>e und deren <strong>Wirkungen</strong> auf.<br />
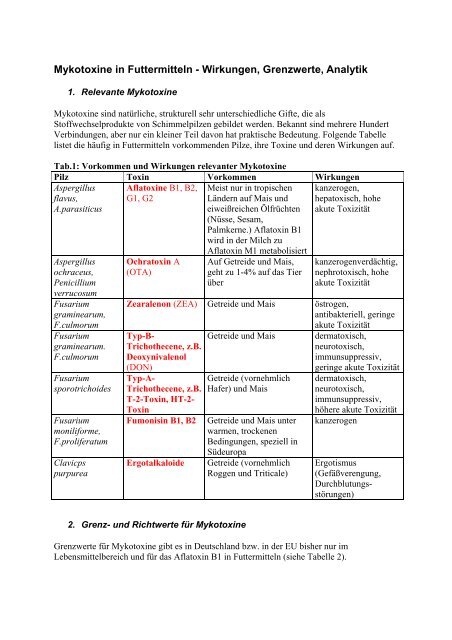
Tab.1: Vorkommen und <strong>Wirkungen</strong> relevanter <strong>Mykotox<strong>in</strong>e</strong><br />
Pilz Tox<strong>in</strong> Vorkommen <strong>Wirkungen</strong><br />
Aspergillus<br />
flavus,<br />
A.parasiticus<br />
Aflatox<strong>in</strong>e B1, B2,<br />
G1, G2<br />
Aspergillus<br />
ochraceus,<br />
Penicillium<br />
verrucosum<br />
Fusarium<br />
gram<strong>in</strong>earum,<br />
F.culmorum<br />
Fusarium<br />
gram<strong>in</strong>earum.<br />
F.culmorum<br />
Fusarium<br />
sporotrichoides<br />
Fusarium<br />
moniliforme,<br />
F.proliferatum<br />
Clavicps<br />
purpurea<br />
Ochratox<strong>in</strong> A<br />
(OTA)<br />
Meist nur <strong>in</strong> tropischen<br />
Ländern auf Mais und<br />
eiweißreichen Ölfrüchten<br />
(Nüsse, Sesam,<br />
Palmkerne.) Aflatox<strong>in</strong> B1<br />
wird <strong>in</strong> der Milch zu<br />
Aflatox<strong>in</strong> M1 metabolisiert<br />
Auf Getreide und Mais,<br />
geht zu 1-4% auf das Tier<br />
über<br />
kanzerogen,<br />
hepatoxisch, hohe<br />
akute Toxizität<br />
kanzerogenverdächtig,<br />
nephrotoxisch, hohe<br />
akute Toxizität<br />
Zearalenon (ZEA) Getreide und Mais östrogen,<br />
antibakteriell, ger<strong>in</strong>ge<br />
akute Toxizität<br />
Typ-B-<br />
Trichothecene, z.B.<br />
Deoxynivalenol<br />
(DON)<br />
Typ-A-<br />
Trichothecene, z.B.<br />
T-2-Tox<strong>in</strong>, HT-2-<br />
Tox<strong>in</strong><br />
Fumonis<strong>in</strong> B1, B2<br />
Ergotalkaloide<br />
Getreide und Mais<br />
Getreide (vornehmlich<br />
Hafer) und Mais<br />
Getreide und Mais unter<br />
warmen, trockenen<br />
Bed<strong>in</strong>gungen, speziell <strong>in</strong><br />
Südeuropa<br />
Getreide (vornehmlich<br />
Roggen und Triticale)<br />
dermatoxisch,<br />
neurotoxisch,<br />
immunsuppressiv,<br />
ger<strong>in</strong>ge akute Toxizität<br />
dermatoxisch,<br />
neurotoxisch,<br />
immunsuppressiv,<br />
höhere akute Toxizität<br />
kanzerogen<br />
Ergotismus<br />
(Gefäßverengung,<br />
Durchblutungsstörungen)<br />
2. Grenz- und Richtwerte für <strong>Mykotox<strong>in</strong>e</strong><br />
<strong>Grenzwerte</strong> für <strong>Mykotox<strong>in</strong>e</strong> gibt es <strong>in</strong> Deutschland bzw. <strong>in</strong> der EU bisher nur im<br />
Lebensmittelbereich und für das Aflatox<strong>in</strong> B1 <strong>in</strong> <strong>Futtermitteln</strong> (siehe Tabelle 2).
Tab.2: Höchstgehalte von Aflatox<strong>in</strong> B1 <strong>in</strong> <strong>Futtermitteln</strong> (VO (EU) 574 / 2011)<br />
unerwünschter Stoff<br />
zur Tierernährung<br />
bestimmtes Erzeugnis<br />
Höchstgehalt <strong>in</strong> mg/kg<br />
bei e<strong>in</strong>er TS von 88 %<br />
Aflatox<strong>in</strong> B1 Futtermittelausgangserzeugnisse 0,02<br />
Alle<strong>in</strong>-und Ergänzungsfuttermittel 0,01<br />
ausgenommen Mischfuttermittel<br />
für Milchr<strong>in</strong>der, Kälber,<br />
Milchschafe und Lämmer,<br />
Milchziegen und Ziegenlämmer,<br />
Ferkel und Junggeflügel 0,005<br />
Für die <strong>in</strong> Deutschland wesentlich häufiger vorkommenden Fusarientox<strong>in</strong>e Zearalenon und<br />
Deoxynivalenol, Ochratox<strong>in</strong> A und die Fumonis<strong>in</strong>e gelten seit Juni 2006 Richtwerte der EU,<br />
bei deren Unterschreitung e<strong>in</strong>e Gefährdung des Tierwohles nicht vorliegen soll (Tab.3).<br />
Tab.3: Richtwerte der EU (Empfehlung 2006 / 576 / EG)<br />
Mykotox<strong>in</strong> Futtermittel Werte Werte <strong>in</strong><br />
<strong>in</strong> mg/kg µg/kg<br />
für FM mit<br />
88%TS<br />
für FM mit<br />
88%TS<br />
DON<br />
Futter-Ausgangsmaterialien*:<br />
Getreide- und Getreideprodukte 8,00 8000<br />
Mais und Maisprodukte* 12,00 12000<br />
Ergänzungs- und Alle<strong>in</strong>futter 5,00 5000<br />
für Schwe<strong>in</strong>e 0,90 900<br />
für Kälber (4 Monate), Lämmer und<br />
Zickle<strong>in</strong> 20,00 20 000<br />
erwachsene Wiederkäuer, Nerze 50,00 50 000<br />
*die Futterausgangsmaterialien dürfen nur so e<strong>in</strong>gesetzt werden, dass sie <strong>in</strong> der Ration die Werte für<br />
die e<strong>in</strong>zelnen Tierarten nicht überschreiten
3. <strong>Analytik</strong> von <strong>Mykotox<strong>in</strong>e</strong>n<br />
Zum Nachweis von <strong>Mykotox<strong>in</strong>e</strong>n s<strong>in</strong>d mehrere Methoden im Gebrauch. Dabei werden die<br />
Verwendung von ELISA-Testsystemen und die der konventionellen Rückstandsanalytik<br />
(nach EU- und DIN-Methoden) kontrovers diskutiert.<br />
Tabelle 2 gibt e<strong>in</strong>en Überblick über die Vor- und Nachteile.<br />
Tab.4: Möglichkeiten zur <strong>Analytik</strong> von <strong>Mykotox<strong>in</strong>e</strong>n :<br />
Physikalisch-chemische<br />
Methoden<br />
Testsysteme auf ELISA-Basis<br />
(Konventionelle Methoden)<br />
Gaschromatografie (GC);<br />
Hochauflösende<br />
Flüssigkeitschromatografie<br />
(HPLC) mit Ultraviolett (UV) -<br />
bzw. Fluoreszenzdetektion<br />
(FLD) oder<br />
Massenspektrometrie (MS)<br />
Nach Erstellung e<strong>in</strong>er<br />
Kalibrierkurve sichere<br />
Quantifizierung möglich<br />
relativ teuer<br />
ger<strong>in</strong>gerer Probendurchsatz<br />
Langsamer<br />
Ergebnisse gut gesichert<br />
Qualitative Tests<br />
<strong>in</strong> Karten- , Streifen- o.<br />
Röhrchenform<br />
nur zum Screen<strong>in</strong>g ja/ne<strong>in</strong><br />
Entscheidung ke<strong>in</strong>e<br />
Quantifizierung<br />
kostengünstig<br />
Hoher Probendurchsatz<br />
Schnell<br />
Falsch-positives Ergebnis<br />
möglich<br />
Quantitative bzw.<br />
Semiquantitative Tests<br />
meist im Mikrotiterplatten-<br />
Format<br />
vorrangig zum Screen<strong>in</strong>g<br />
Nach Erstellung e<strong>in</strong>er<br />
Kalibrierkurve<br />
Quantifizierung möglich<br />
kostengünstig<br />
Hoher Probendurchsatz<br />
Schnell<br />
Falsch-positives Ergebnis<br />
möglich<br />
ELISA-Tests sollten vorrangig zum Screen<strong>in</strong>g e<strong>in</strong>gesetzt werden.<br />
Sie s<strong>in</strong>d schnell, kostengünstig und gewährleisten e<strong>in</strong>en hohen Probendurchsatz.<br />
Negative Ergebnisse mittels ELISA bedürfen ke<strong>in</strong>er weiteren Absicherung.<br />
Entsprechende Störfaktoren der Matrix s<strong>in</strong>d derzeit nicht bekannt.<br />
Positive Befunde s<strong>in</strong>d mittels konventioneller Verfahren zu überprüfen, da der ELISA auch<br />
falsch positiv se<strong>in</strong> kann.<br />
Soll mit dem ELISA quantitativ gemessen werden, so sollte vom Anwenderlabor e<strong>in</strong>e<br />
Validierung für die entsprechende Matrix durchgeführt werden, ähnlich der Validierung <strong>in</strong> der<br />
konventionellen Rückstandsanalytik.<br />
Angaben zur Nachweis- u. Bestimmbarkeitsgrenze, Arbeitsbereich, Präzision und<br />
Wiederholbarkeit müssen erarbeitet werden. Angaben der Hersteller zu diesen Punkten<br />
beziehen sich häufig nur auf Mykotox<strong>in</strong>-Standardlösungen.<br />
Jeder Positivwert bedarf e<strong>in</strong>er Interpretation.<br />
<strong>Mykotox<strong>in</strong>e</strong> <strong>in</strong> Getreide und <strong>Futtermitteln</strong> können im Fachbereich 62 "Futtermittel und<br />
Pflanzen" der BfUL nach konventionellen Rückstandsmethoden analysiert werden.<br />
Folgende <strong>Mykotox<strong>in</strong>e</strong> haben wir derzeit <strong>in</strong> unserem Untersuchungsprogramm:<br />
• Aflatox<strong>in</strong> B1 <strong>in</strong> Getreide und Futtermittel mittels HPLC-Fluoreszenz und<br />
Nachsäulenderivatisierung (DIN EN ISO 17375)
• Ochratox<strong>in</strong> A <strong>in</strong> Getreide und <strong>Futtermitteln</strong> mittels HPLC-Fluoreszenz (DIN EN<br />
16007)<br />
• Zearalenon <strong>in</strong> Getreide und <strong>Futtermitteln</strong> mittels HPLC-Fluoreszenz (DIN EN 15792)<br />
• Deoxynivalenol <strong>in</strong> Getreide und <strong>Futtermitteln</strong> mittels HPLC-Diodenarray (DIN EN<br />
15791)<br />
• Ergotalkaloide <strong>in</strong> Getreide und <strong>Futtermitteln</strong> mittels HPLC-MS/MS (<strong>in</strong> Validierung)<br />
und Fluoreszenz (§ 64-Methode, Lebensmitteluntersuchung)<br />
• Nivalenol, Deoxynivalenol (DON), 3-Acetyl-DON, 15-Acetyl-DON,<br />
Diacetoxyscirpenol, HT-2-Tox<strong>in</strong>, T-2-Tox<strong>in</strong> und Zearalenon mittels<br />
HPLC-LC/MS/MS (VDLUFA-Methodenbuch III, Methode 16.13.1<br />
Fumonis<strong>in</strong> B1 und B2 <strong>in</strong> Getreide und <strong>Futtermitteln</strong> mittels HPLC-LC/MS/MS<br />
(Hausmethode)<br />
Stand: 03/2013<br />
Für Rücksprachen zum Thema :<br />
Frau Hanschmann Tel.:035242 632 6210 (gudrun.hanschmann@smul.sachsen.de)<br />
Dr.Schönherr Tel.:035242 632 6200 (jens.schoenherr@smul.sachsen.de)


![Akkreditierungsurkunde 2013 [Download,*.pdf, 1,94 MB]](https://img.yumpu.com/26354245/1/184x260/akkreditierungsurkunde-2013-downloadpdf-194-mb.jpg?quality=85)




![Spitzenholz zu Spitzenpreisen [Download,*.pdf, 0,23 MB]](https://img.yumpu.com/26354210/1/184x260/spitzenholz-zu-spitzenpreisen-downloadpdf-023-mb.jpg?quality=85)






![können Sie den Bericht lesen [Download,*.pdf, 1,19 MB]](https://img.yumpu.com/26354181/1/184x260/kannen-sie-den-bericht-lesen-downloadpdf-119-mb.jpg?quality=85)
