Oxidation von Cysteinen: mehr als ein Artefakt der ... - Biospektrum
Oxidation von Cysteinen: mehr als ein Artefakt der ... - Biospektrum
Oxidation von Cysteinen: mehr als ein Artefakt der ... - Biospektrum
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
608 WISSENSCHAFT · SPECIAL: PROTEOMFORSCHUNG<br />
A<br />
B<br />
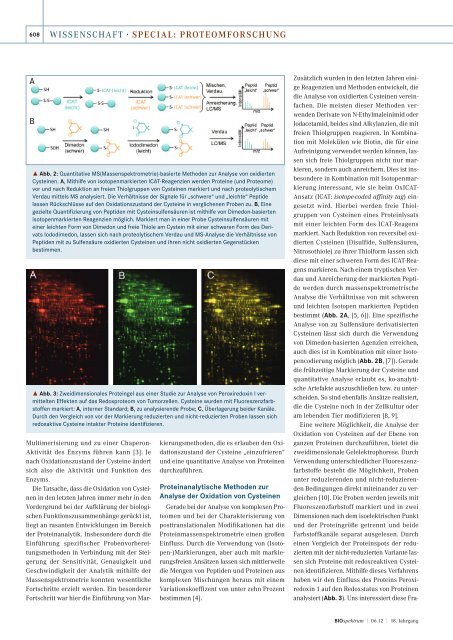
˚ Abb. 2: Quantitative MS(Massenspektrometrie)-basierte Methoden zur Analyse <strong>von</strong> oxidierten<br />
<strong>Cyst<strong>ein</strong>en</strong>. A, Mithilfe <strong>von</strong> isotopenmarkierten ICAT-Reagenzien werden Prot<strong>ein</strong>e (und Proteome)<br />
vor und nach Reduktion an freien Thiolgruppen <strong>von</strong> <strong>Cyst<strong>ein</strong>en</strong> markiert und nach proteolytischem<br />
Verdau mittels MS analysiert. Die Verhältnisse <strong>der</strong> Signale für „schwere“ und „leichte“ Peptide<br />
lassen Rückschlüsse auf den <strong>Oxidation</strong>szustand <strong>der</strong> Cyst<strong>ein</strong>e in verglichenen Proben zu. B, Eine<br />
gezielte Quantifizierung <strong>von</strong> Peptiden mit Cyst<strong>ein</strong>sulfensäuren ist mithilfe <strong>von</strong> Dimedon-basierten<br />
isotopenmarkierten Reagenzien möglich. Markiert man in <strong>ein</strong>er Probe Cyst<strong>ein</strong>sulfensäuren mit<br />
<strong>ein</strong>er leichten Form <strong>von</strong> Dimedon und freie Thiole am Cyst<strong>ein</strong> mit <strong>ein</strong>er schweren Form des Derivats<br />
Iododimedon, lassen sich nach proteolytischem Verdau und MS-Analyse die Verhältnisse <strong>von</strong><br />
Peptiden mit zu Sulfensäure oxidierten <strong>Cyst<strong>ein</strong>en</strong> und ihren nicht oxidierten Gegenstücken<br />
bestimmen.<br />
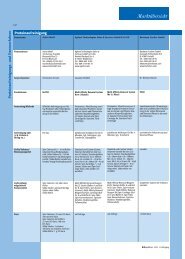
˚ Abb. 3: Zweidimensionales Prot<strong>ein</strong>gel aus <strong>ein</strong>er Studie zur Analyse <strong>von</strong> Peroxiredoxin I vermittelten<br />
Effekten auf das Redoxproteom <strong>von</strong> Tumorzellen. Cyst<strong>ein</strong>e wurden mit Fluoreszenzfarbstoffen<br />
markiert: A, interner Standard; B, zu analysierende Probe; C, Überlagerung bei<strong>der</strong> Kanäle.<br />
Durch den Vergleich <strong>von</strong> vor <strong>der</strong> Markierung reduzierten und nicht-reduzierten Proben lassen sich<br />
redoxaktive Cyst<strong>ein</strong>e intakter Prot<strong>ein</strong>e identifizieren.<br />
Multimerisierung und zu <strong>ein</strong>er Chaperon-<br />
Aktivität des Enzyms führen kann [3]. Je<br />
nach <strong>Oxidation</strong>szustand <strong>der</strong> Cyst<strong>ein</strong>e än<strong>der</strong>t<br />
sich <strong>als</strong>o die Aktivität und Funktion des<br />
Enzyms.<br />
Die Tatsache, dass die <strong>Oxidation</strong> <strong>von</strong> <strong>Cyst<strong>ein</strong>en</strong><br />
in den letzten Jahren immer <strong>mehr</strong> in den<br />
Vor<strong>der</strong>grund bei <strong>der</strong> Aufklärung <strong>der</strong> biologischen<br />
Funktionszusammenhänge gerückt ist,<br />
liegt an rasanten Entwicklungen im Bereich<br />
<strong>der</strong> Prot<strong>ein</strong>analytik. Insbeson<strong>der</strong>e durch die<br />
Einführung spezifischer Probenvorbereitungsmethoden<br />
in Verbindung mit <strong>der</strong> Steigerung<br />
<strong>der</strong> Sensitivität, Genauigkeit und<br />
Geschwindigkeit <strong>der</strong> Analytik mithilfe <strong>der</strong><br />
Massenspektrometrie konnten wesentliche<br />
Fortschritte erzielt werden. Ein beson<strong>der</strong>er<br />
Fortschritt war hier die Einführung <strong>von</strong> Mar-<br />
kierungsmethoden, die es erlauben den <strong>Oxidation</strong>szustand<br />
<strong>der</strong> Cyst<strong>ein</strong>e „<strong>ein</strong>zufrieren“<br />
und <strong>ein</strong>e quantitative Analyse <strong>von</strong> Prot<strong>ein</strong>en<br />
durchzuführen.<br />
Prot<strong>ein</strong>analytische Methoden zur<br />
Analyse <strong>der</strong> <strong>Oxidation</strong> <strong>von</strong> <strong>Cyst<strong>ein</strong>en</strong><br />
Gerade bei <strong>der</strong> Analyse <strong>von</strong> komplexen Proteomen<br />
und bei <strong>der</strong> Charakterisierung <strong>von</strong><br />
posttranslationalen Modifikationen hat die<br />
Prot<strong>ein</strong>massenspektrometrie <strong>ein</strong>en großen<br />
Einfluss. Durch die Verwendung <strong>von</strong> (Isotopen-)Markierungen,<br />
aber auch mit markierungsfreien<br />
Ansätzen lassen sich mittlerweile<br />
die Mengen <strong>von</strong> Peptiden und Prot<strong>ein</strong>en aus<br />
komplexen Mischungen heraus mit <strong>ein</strong>em<br />
Variationskoeffizent <strong>von</strong> unter zehn Prozent<br />
bestimmen [4].<br />
Zusätzlich wurden in den letzten Jahren <strong>ein</strong>ige<br />
Reagenzien und Methoden entwickelt, die<br />
die Analyse <strong>von</strong> oxidierten <strong>Cyst<strong>ein</strong>en</strong> ver<strong>ein</strong>fachen.<br />
Die meisten dieser Methoden verwenden<br />
Derivate <strong>von</strong> N-Ethylmal<strong>ein</strong>imid o<strong>der</strong><br />
Jodacetamid, beides sind Alkylanzien, die mit<br />
freien Thiolgruppen reagieren. In Kombination<br />
mit Molekülen wie Biotin, die für <strong>ein</strong>e<br />
Aufr<strong>ein</strong>igung verwendet werden können, lassen<br />
sich freie Thiolgruppen nicht nur markieren,<br />
son<strong>der</strong>n auch anreichern. Dies ist insbeson<strong>der</strong>e<br />
in Kombination mit Isotopenmarkierung<br />
interessant, wie sie beim OxICAT-<br />
Ansatz (ICAT: isotope-coded affinity tag) <strong>ein</strong>gesetzt<br />
wird. Hierbei werden freie Thiolgruppen<br />
<strong>von</strong> <strong>Cyst<strong>ein</strong>en</strong> <strong>ein</strong>es Prot<strong>ein</strong>lysats<br />
mit <strong>ein</strong>er leichten Form des ICAT-Reagens<br />
markiert. Nach Reduktion <strong>von</strong> reversibel oxidierten<br />
<strong>Cyst<strong>ein</strong>en</strong> (Disulfide, Sulfensäuren,<br />
Nitrosothiole) zu ihrer Thiolform lassen sich<br />
diese mit <strong>ein</strong>er schweren Form des ICAT-Reagens<br />
markieren. Nach <strong>ein</strong>em tryptischen Verdau<br />
und Anreicherung <strong>der</strong> markierten Peptide<br />
werden durch massenspektrometrische<br />
Analyse die Verhältnisse <strong>von</strong> mit schweren<br />
und leichten Isotopen markierten Peptiden<br />
bestimmt (Abb. 2A, [5, 6]). Eine spezifische<br />
Analyse <strong>von</strong> zu Sulfensäure <strong>der</strong>ivatisierten<br />
<strong>Cyst<strong>ein</strong>en</strong> lässt sich durch die Verwendung<br />
<strong>von</strong> Dimedon-basierten Agenzien erreichen,<br />
auch dies ist in Kombination mit <strong>ein</strong>er Isotopencodierung<br />
möglich (Abb. 2B, [7]). Gerade<br />
die frühzeitige Markierung <strong>der</strong> Cyst<strong>ein</strong>e und<br />
quantitative Analyse erlaubt es, ko-analytische<br />
<strong>Artefakt</strong>e auszuschließen bzw. zu unterscheiden.<br />
So sind ebenfalls Ansätze realisiert,<br />
die die Cyst<strong>ein</strong>e noch in <strong>der</strong> Zellkultur o<strong>der</strong><br />
am lebenden Tier modifizieren [8, 9].<br />
Eine weitere Möglichkeit, die Analyse <strong>der</strong><br />
<strong>Oxidation</strong> <strong>von</strong> <strong>Cyst<strong>ein</strong>en</strong> auf <strong>der</strong> Ebene <strong>von</strong><br />
ganzen Prot<strong>ein</strong>en durchzuführen, bietet die<br />
zweidimensionale Gelelektrophorese. Durch<br />
Verwendung unterschiedlicher Fluoreszenzfarbstoffe<br />
besteht die Möglichkeit, Proben<br />
unter reduzierenden und nicht-reduzierenden<br />
Bedingungen direkt mit<strong>ein</strong>an<strong>der</strong> zu vergleichen<br />
[10]. Die Proben werden jeweils mit<br />
Fluoreszenzfarbstoff markiert und in zwei<br />
Dimensionen nach dem isoelektrischen Punkt<br />
und <strong>der</strong> Prot<strong>ein</strong>größe getrennt und beide<br />
Farbstoffkanäle separat ausgelesen. Durch<br />
<strong>ein</strong>en Vergleich <strong>der</strong> Prot<strong>ein</strong>spots <strong>der</strong> reduzierten<br />
mit <strong>der</strong> nicht-reduzierten Variante lassen<br />
sich Prot<strong>ein</strong>e mit redoxreaktiven <strong>Cyst<strong>ein</strong>en</strong><br />
identifizieren. Mithilfe dieses Verfahrens<br />
haben wir den Einfluss des Prot<strong>ein</strong>s Peroxiredoxin<br />
1 auf den Redoxstatus <strong>von</strong> Prot<strong>ein</strong>en<br />
analysiert (Abb. 3). Uns interessiert diese Fra-<br />
BIOspektrum | 06.12 | 18. Jahrgang