Gynäkologie 1 - DocCheck Campus
Gynäkologie 1 - DocCheck Campus
Gynäkologie 1 - DocCheck Campus
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Gynäkologie</strong> 1<br />
Benigne und maligne Tumoren der weiblichen Geschlechtsorgane<br />
– Veränderungen und Tumoren von Vulva und Vagina:<br />
– benigne Veränderungen und Tumoren:<br />
– Vulvadystrophie:<br />
– Klassifikation:<br />
– Lichen sclerosus<br />
– squamöse Hyperplasie<br />
– Lichen simplex chronicus<br />
– Ätiologie und Epidemiologie:<br />
– Lichen sclerosus:<br />
– unklare Ätiologie<br />
– bei 20 % der Frauen mit chronischen Vulvabeschwerden<br />
– Auftreten in jeder Lebensphase<br />
– fortgeschrittene Bilder eher in der späten Menopause und im Senium<br />
– squamöse Hyperplasie:<br />
– Folge eines chronischen Reizzustandes<br />
– Manifestationsalter: 30. - 60. Lebensjahr<br />
– Lichen simplex chronicus:<br />
– Klinik:<br />
– unklare Ätiologie<br />
– Manifestationsalter: 30. - 60. Lebensjahr<br />
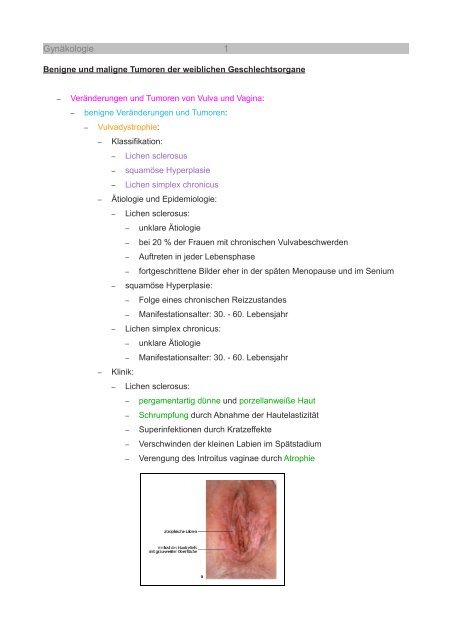
– Lichen sclerosus:<br />
– pergamentartig dünne und porzellanweiße Haut<br />
– Schrumpfung durch Abnahme der Hautelastizität<br />
– Superinfektionen durch Kratzeffekte<br />
– Verschwinden der kleinen Labien im Spätstadium<br />
– Verengung des Introitus vaginae durch Atrophie
<strong>Gynäkologie</strong> 2<br />
– squamöse Hyperplasie:<br />
– umschriebene, meist einseitige, rötlich-ödematöse Veränderungen mit<br />
weißlichen Plaques und erosiven Defekten und Rhagaden<br />
– Juckreiz<br />
– Lichen simplex chronicus:<br />
– Juckreiz<br />
– Pathologie:<br />
– Lichen sclerosus:<br />
– Hyperkeratose mit atrophischer Abflachung des Plattenepithels<br />
– Verwischung der dermo-epidermalen Junktionszone<br />
– subepidermale Hyalinose und Sklerose mit Infiltration durch Rundzellen<br />
– squamöse Hyperplasie und Lichen simplex chronicus:<br />
– hyperplastisches Epithel mit einer Akanthose<br />
– Diagnostik:<br />
– Gewebeentnahme (Punch-Biopsie) mit anschließender Histologie<br />
– DD: Candida-Infektion<br />
– Therapie (alle):<br />
– Zysten:<br />
– Kortikosteroide ausschleichend über 3 Monate<br />
– im Anschluss Langzeittherapie mit Vaseline oder Melkfett<br />
– Bartholin-Zysten:<br />
– entstehen durch Verklebung der Drüsenausführungsgänge im Bereich ihrer<br />
Mündung im Vestibulum vaginae<br />
– es resultiert ein Sekretstau mit zystischer Erweiterung des Ganges<br />
– Pathologie: von Übergangsepithel oder abgeflachtem Zylinderepithel<br />
ausgekleidet<br />
– Therapie: Marsupialisation
<strong>Gynäkologie</strong> 3<br />
– Talggefüllte Zysten (Atherome):<br />
– entstehen nur im behaarten Bereich der großen Labien durch Verlegung<br />
eines Follikelausführungsganges<br />
– muzinöse Zysten:<br />
– liegen im Bereich des Vestibulum<br />
– dysontogenetische Zysten aus dem Epithel des Urogenitalsinus<br />
– Gartner-Gang-Zysten:<br />
– entstehen aus Resten des Wolff-Ganges<br />
– dünnwandige Zysten mit klarem Inhalt<br />
– liegen oft in der seitlichen Wand von Vagina und Vulva<br />
– können multipel vorkommen<br />
– epidermale Inklusionszysten:<br />
– Folge einer traumatischen oder operativen Manipulation, bei der das Epithel<br />
unter die Oberfläche versenkt wurde<br />
– Adenosis vaginae:<br />
– Besetzung des oberen Teils der Vagina von zahlreichen kleinen Zysten<br />
– werden vom Drüsenepithel begrenzt<br />
– gelegentlich Vorläufer des seltenen Adenokarzinoms der Vagina<br />
– epitheliale Tumoren:<br />
– Papillome (Condylomata acuminata):<br />
– durch Infektion mit verschiedenen HPV-Typen induziert<br />
– warzenähnliche, oft bizarre Form von weißer oder blassrosa Farbe<br />
– Therapie: Laser- oder Elektrokoagulation<br />
– Hidradenome (Schweißdrüsenadenome):<br />
– derb, Ø unter 2 cm<br />
– im Bereich der großen Labien und an der lateralen Seite der kleinen Labien<br />
– sonstige Tumoren:<br />
– Leiomyome, Lipome, Fibrome, Neurofibrome, Hämangiome<br />
– atypische Veränderungen und maligne Tumoren der Vulva:<br />
– vulväre intraepitheliale Neoplasie (VIN):<br />
– Definition:<br />
– Präkanzerose des Vulvakarzinoms<br />
– Häufigkeitsgipfel: 40. sowie 60. - 70. Lebensjahr<br />
– Klassifikation:<br />
– VIN I (leichte Dysplasie):<br />
– Proliferation atypischer Basalzellen im basalen Epitheldrittel mit reifem,<br />
normalem Plattenepithel an der Oberfläche
<strong>Gynäkologie</strong> 4<br />
– VIN II (mittelgradige Dysplasie):<br />
– atypische Epithelproliferation in den basalen zwei Dritteln mit atypischen<br />
Mitosen und Einzelzellverhornung, aber weitgehend normalem Epithel<br />
an der Oberfläche<br />
– VIN III (schwere Dysplasie, Carcinoma in situ, früher: Morbus Bowen):<br />
– das gesamte Epithel besteht aus atypischen Basalzellen mit atypischen<br />
Mitosen, Einzelzellverhornungen und gelegentlich auftretenden Horn-<br />
perlen; die Basalmembran ist intakt<br />
– weitere Unterscheidung in 3 Typen:<br />
– kondylomatöser Typ<br />
– basaloider Typ<br />
– differenzierter Typ<br />
– Ätiologie und Epidemiologie:<br />
– Verdopplung der Prävalenz bei Frauen zwischen dem 30. - 40. Lebensjahr<br />
– Assoziation mit Human-Papilloma-Viren (16, 18)<br />
– Entzündungen der Vulva unterschiedlicher Genese<br />
– Nikotinabusus<br />
– Mangelernährung (z.B. Vit.-A-Mangel)<br />
– ungenügende Intimpflege<br />
– Immunsuppression<br />
– wechselnde Geschlechtspartner<br />
– Wachstum und Ausbreitung:<br />
– VIN I und II: Rückbildungstendenz<br />
– VIN III: Rückbildungstendenz mit einer Wahrscheinlichkeit von 10 – 40 %<br />
– Progression in 5 % der Fälle<br />
– Klinik:<br />
– oft symptomlos (ca. 50 %)<br />
– Juckreiz, Brennen und Schmerzen
<strong>Gynäkologie</strong> 5<br />
– hohe Koinzidenz mit anderen intraepithelialen Neoplasien:<br />
– in 25 % mit einer zervikalen intraepithelialen Neoplasie (CIN)<br />
– in 5 % mit einer vaginalen intraepithelialen Neoplasie (VAIN)<br />
– in 20 – 60 % mit einer perianalen intraepithelialen Neoplasie (PAIN)<br />
– Pathologie:<br />
– gehäufte und/oder atypische Mitosen<br />
– Dyskeratosen (Einzelzellverhornung) oder Kernatypie einschließlich<br />
Riesenzellbildung<br />
– Störung der Kern-Plasma-Relation zugunsten des Kerns<br />
– Hyperchromasie der Zellkerne<br />
– basale Hyperplasie<br />
– stellenweise große Nukleolen<br />
– Hyper- und Parakeratosen<br />
– Akanthosen<br />
– Zellverklumpungen<br />
– Erhalt der Basalmembran<br />
– Diagnostik:<br />
– Inspektion<br />
– Vulvoskopie (mittels Essigsäure oder Toluidin-Blau)<br />
– Punch-Biopsie mit anschließender Histologie<br />
– Zytologie (negative Zytologie schließt VIN III oder Karzinom nicht aus)<br />
– Therapie:<br />
– schonende lokale Exzision<br />
– CO2-Laserchirurgie<br />
– Morbus Paget:<br />
– Definition:<br />
– Sonderform der intraepithelialen Neoplasien dar, da er nicht von plattenepi-<br />
thelialen Anteilen seinen Ursprung nimmt, sondern von den Hautanhangs-<br />
drüsen abstammt<br />
– intraepidermales Adenokarzinom<br />
– manchmal von einem Schweißdrüsenkarzinom begleitet<br />
– Epidemiologie:<br />
– 2 % aller Vulvaneoplasien<br />
– Manifestationsalter: 65. Lebensjahr<br />
– Klinik:<br />
– Juckreiz, Wundheits- und Spannungsgefühl<br />
– ekzematöse Hautläsionen der großen Labien, Damm- oder Perianalregion
<strong>Gynäkologie</strong> 6<br />
– Pathologie:<br />
– zellulare Atypien, die einer intraepi-<br />
thelialen Neoplasie ähnlich sind<br />
– Paget-Zellen (in Nestern vorkommend<br />
oder als verstreute Zellen innerhalb des<br />
Epithels oder in Hautanhangsdrüsen,<br />
charakteristisch sind vakuolisiertes Zytoplasma und bläschenförmige Kerne)<br />
– Diagnostik:<br />
– Inspektion<br />
– Vulvoskopie (mittels Essigsäure oder Toluidin-Blau)<br />
– Stanzbiopsie mit anschließender Histologie<br />
– Therapie:<br />
– großzügige lokale Exzision<br />
– invasives Vulvakarzinom:<br />
– Definition:<br />
– invasives, verhornendes Plattenepithelkarzinom<br />
– Häufigkeitsgipfel: 40. und 60. Lebensjahr<br />
– Ätiopathogenese: siehe VIN<br />
– Wachstum und Ausbreitung:<br />
– 90 % solitäres und 10 % multifokales Wachstum<br />
– 1/3 der Patientinnen haben zusätzlich einen Lichen sclerosus<br />
– oft im Bereich der großen und kleinen Labien lokalisiert sowie an der Klitoris<br />
– häufig Abklatschmetastasen auf der dem Tumor gegenüberliegenden Seite<br />
– frühzeitige lymphogene Metastasierung entlang der inguinalen und pelvinen<br />
Lymphknoten bis hin zu den paraaortalen Lymphknoten<br />
– Beteiligung von Urethra, Vagina, Perineum und Anus bei Ausbreitung<br />
– gelegentlich Fisteln zu benachbarten Hohlorganen<br />
– später Infiltration von Blasen- und Rektumschleimhaut einschließlich der<br />
– Stadien:<br />
Beckenknochen
<strong>Gynäkologie</strong> 7<br />
– Klinik:<br />
– chronischer Pruritus und Schmerzen<br />
– lokale Schwellung, Brennen und Ausfluss bei fortgeschrittenen Stadien<br />
– Ulzera, die fötide übel riechende Sekrete absondern<br />
– Lymphknotenschwellung in der Leistenregion<br />
– kleine Vulvakarzinome:<br />
– rötliche Papeln<br />
– isolierte Verhärtungen mit warzen-<br />
ähnlichem Bild<br />
– erosive Defekte und Ulzerationen<br />
– fortgeschrittene Karzinome:<br />
– blumenkohlartige Tumoren (exophyt-<br />
isch oder papillomatös)<br />
– Ulzerationen mit induriertem Randwall<br />
(endophytisch wachsende Tumoren mit<br />
Ulzeration)<br />
– Morphologie:<br />
– makroskopisch:<br />
– ulzerierendes oder papilloma-<br />
töses Wachstum<br />
– Pruritus vulvae, Missempfind-<br />
ungen, Stechen, Brennen<br />
– mikroskopisch:<br />
– hoch differenziertes, verhorn-<br />
– Diagnostik:<br />
– Inspektion<br />
endes Plattenepithelkarzinom<br />
– Vulvoskopie (mittels Essigsäure oder Toluidin-Blau)<br />
– Knipsbiopsie mit anschließender Histologie<br />
– Therapie:<br />
– operativ:<br />
– lokale Resektion<br />
– Hemivulvektomie, Vulvektomie, Lymphonodektomie, ggf. Exenteration<br />
– neoadjuvante Strahlen-Chemotherapie:<br />
– bei größeren Tumoren und fortgeschrittenem Stadium (pT3)<br />
– bei Tumorremission sekundär Vulvektomie mit inguinaler Lymphonod-<br />
ektomie
<strong>Gynäkologie</strong> 8<br />
– systemisch:<br />
– Prognose:<br />
– schlechtes Ansprechen auf eine Chemotherapie<br />
– schlechte Prognose trotz langsamen Wachstums<br />
– 5-Jahresüberlebensrate: 70 % (bei Befall der inguinalen Lymphknoten 30 –<br />
60 %, bei Befall der pelvinen Lymphknoten 0 – 25 %)<br />
– oft Lokalrezidive<br />
– maligne Tumoren der Vagina:<br />
– Vaginalkarzinom:<br />
– Epidemiologie:<br />
– selten (1 – 2 %), vorwiegend im höheren Lebensalter<br />
– eher sekundärer Befall der Vagina durch Ausbreitung von Zervix-, Vulva-,<br />
– Ätiologie:<br />
Ovarial-, Rektum-, Blasen und Urethralkarzinom<br />
– gehäuftes Auftreten nach chronischer Irritation (Prolaps, längere Benutzung<br />
– Vorstufen:<br />
von Intrauterinpessaren) oderBeckenbestrahlung<br />
– vaginale intraepitheliale Neoplasien (VAIN):<br />
– milde Atypien = VAIN I<br />
– mäßige Atypien = VAIN II<br />
– schwere Atypien = VAIN III<br />
– Wachstum und Ausbreitung:<br />
– beginnen meist im hinteren oberen Drittel der Vagina<br />
– überwiegend exophytisches Wachstum<br />
– frühzeitiger Befall der anliegenden Organe durch kontinuierliche Ausbreitung<br />
– diskontinuierliche Aussaat hängt von der Lokalisation ab:<br />
– Sitz im oberen Drittel: Ausdehnung entspricht der des Zervixkarzinoms<br />
– Sitz im mittleren Drittel: Ausbreitung wie beim Zervix-, aber auch wie<br />
beim Vulvakarzinom<br />
– in 25 % der Fälle finden sich inguinale Lymphknoten, aber auch pelvine<br />
Lymphknoten können befallen sein<br />
– Sitz im unteren Drittel: zu mehr als 50 % inguinale Lymphknoten-<br />
metastasen
<strong>Gynäkologie</strong> 9<br />
– Pathologie:<br />
– Stadien:<br />
– Stadium 0: präinvasives Stadium<br />
– Stadium I: Tumor auf Vaginalwand begrenzt<br />
– Stadium II: Ausbreitung in das paravaginale Gewebe ohne Erreichen der<br />
Beckenwand<br />
– Stadium III: Tumor reicht bis zur Beckenwand<br />
– Stadium IV: Ausbreitung über kleines Becken hinaus mit Befall der Muko-<br />
– Klinik:<br />
– meist symptomlos<br />
sa von Blase oder Darm (IVa) oder mit Fernmetastasen (IVb)<br />
– vaginale Blutungen, fleischwasserfarbener Fluor und Miktionsstörungen bei<br />
fortgeschrittenem Karzinom<br />
– Diagnostik:<br />
– Inspektion<br />
– Kolposkopie<br />
– Zytologie<br />
– Therapie:<br />
– operativ:<br />
– Befall des oberen Drittels: radikale Hysterektomie mit oberer Kolpek-<br />
tomie und pelviner Lymphonodektomie<br />
– Befall des mittleren Drittels: radikale Hysterektomie mit totaler Kolpek-<br />
tomie, pelviner und inguinaler Lymphonodektomie<br />
– Befall des unteren Drittels: untere Kolpektomie mit eingeschränkter Vul-<br />
vektomie und inguinaler Lymphonodektomie<br />
– Strahlentherapie:<br />
– bei fortgeschrittenem infiltrierendem Vaginalkarzinom<br />
– ggf. perkutane Bestrahlung des Beckens und der inguinalen Region
<strong>Gynäkologie</strong> 10<br />
– Prognose:<br />
– 5-Jahrenüberlebensrate: 40 %<br />
– Lokalrezidive innerhalb von 2 Jahren nach Primärtherapie<br />
– Veränderungen und Tumoren der Cervix uteri:<br />
– benigne Tumoren und Pseudotumoren der Cervix uteri:<br />
– endozervikale Polypen:<br />
– Hyperplasie der Zervixschleimhaut<br />
– zwischen dem 50. - 60. Lebensjahr<br />
– ggf. vermehrter Ausfluss und Blutungsstörungen<br />
– selten Entartung<br />
– Pathologie: gefäßreiches Stroma, zahlreiche Drüsen, entzündliche Veränder-<br />
ungen, Plattenepithelmetaplasie<br />
– Therapie: Resektion mit anschließender Kürettage des Zervikalkanals<br />
– mikroglanduläre Hyperplasie der Zervixschleimhaut:<br />
– durch Gestagenwirkung der Ovulationshemmer hervorgerufen<br />
– epitheliale Einschlusszyste:<br />
– entspricht dem Ovulum Nabothi<br />
– Leiomyome:<br />
– Tumoren der glatten Muskulatur<br />
– solitäres Auftreten<br />
– bei großem Volumen Deformierung des Zervikalkanals und des äußeren Mutter-<br />
mundes sowie Schmerzen<br />
– atypische Veränderungen und maligne Tumoren der Cervix uteri:<br />
– Vorstadien der Cervixkarzinoms:<br />
– zervikale intraepitheliale Neoplasie (CIN):<br />
– Definition:<br />
– Präkanzerosen des Cervixkarzinoms<br />
– die Präkanzerosen sind reversibel<br />
– in der Grenzzone zwischen Plattenepithel und Zylinderepithel<br />
– während der Geschlechtsreife im Bereich der Ektozervix<br />
– Zone verschiebt sich mit dem Alter in den Zervikalkanal<br />
– Ätiopathogenese:<br />
– Human-Papilloma-Viren (16, 18)<br />
– frühzeitiger Sexualverkehr, hohe Promiskuität<br />
– Multipara<br />
– Nikotin<br />
– Ovulationshemmer
<strong>Gynäkologie</strong> 11<br />
– Morphologie:<br />
– makroskopisch:<br />
– keine Frühsymptome<br />
– später unregelmäßige Blutungen, blutiger oder fötider Fluor<br />
– mikroskopisch:<br />
– Einteilung:<br />
– typisch sind Koilozyten<br />
– CIN I (leicht Dysplasie):<br />
– erhaltene zonale Gliederung des Epithels<br />
– mäßige Verbreiterung der Basalis<br />
– typische, z.T. mehrkernige Koilozytosefelder in der intermediären<br />
Zellschicht<br />
– CIN II (mittelschwere Dysplasie):<br />
– Proliferation atypischer Zellen in der basalen Hälfte des Platten-<br />
epithels<br />
– CIN III (schwere Dysplasie und Carcinoma in situ):<br />
– aufgehobene Schichtung des Epithels<br />
– neoplastische Zellen in allen Schichten<br />
– atypische Mitosen<br />
Abb. 1: Normales Zervixepithel Abb. 2: CIN I<br />
Abb.3: CIN II<br />
Abb. 4: CIN III
<strong>Gynäkologie</strong> 12<br />
Einteilung CIN Bedeutung<br />
PAP 0 Zellabstrich technisch unbrauchbar<br />
PAP I normales Zellbild<br />
PAP II<br />
PAP III<br />
entzündliche, regenerative, metaplastische oder degenerative<br />
Veränderungen, normale Endometriumzellen<br />
schwere entzündliche oder degenerative Veränderungen<br />
mit nicht sicher beurteilbarer Dignität<br />
PAP III D I bzw. II Zellen einer leichten bis mäßigen Dysplasie (CIN 1 - 2)<br />
PAP III G II<br />
PAP IV a III<br />
PAP IV b III<br />
Drüsen- und Stromazellen des Endometriums nach der<br />
Menopause mit nicht sicher beurteilbarer Dignität<br />
Zellen einer mäßigen bis schweren Dysplasie oder eines<br />
Cis (CIN 2 - 3)<br />
Zellen einer schweren Dysplasie oder eines Cis, invasives<br />
Karzinom nicht auszuschließen<br />
PAP V Zellen eines invasiven Zervix- oder eines Adenokarzinoms<br />
– Therapie:<br />
– CIN I und II: spontane Rückbildung in mehr als 50 % der Fälle �<br />
Kontrollzytologie nach 3 Monaten<br />
– operative Therapie bei Fortbestehen der Veränderungen > 12 Monate oder<br />
bei schwer wiegenderen Veränderungen (CIN III)<br />
– Vorgehen:<br />
– Messer- oder Schlingenkonisation:<br />
– bei freien Resektionsrändern und vollkommen entfernter CIN liegt die<br />
Wahrscheinlichkeit einer erneuten Zellatypie bei 1 – 2 %<br />
– sind Abtragungsränder nicht frei von Zellatypien, erhöht sich die<br />
Wahrscheinlichkeit erneuter Zellatypien auf 15 – 20 %<br />
– Portioabschabung mit Zervixkürettage nach 3 Monaten:<br />
– wird hierbei wiederholt eine CIN festgestellt, sollte eine Zweit-<br />
konisation oder Hysterektomie erfolgen<br />
– Laserchirurgie:<br />
– bei der CO2-Lasertherapie wird mit einem steuerbaren Laserstrahl<br />
gezielt das pathologisch veränderte Gewebe zerstört<br />
– Hysterektomie:<br />
– Patientinnen mit abgeschlossener Familienplanung<br />
– Patientinnen in der Postmenopause<br />
– Patientinnen mit weiteren Erkrankung des Uterus
<strong>Gynäkologie</strong> 13<br />
– Frühstadien des Cervixkarzinoms:<br />
– Klassifikation:<br />
– Karzinom mit früher Stromainvasion (bis zu 3 mm Tiefe):<br />
– ausgehend vom Platten-<br />
epithel<br />
– im subepithelialen Binde-<br />
gewebe häufig multifokale<br />
kolbenförmige, atypische<br />
Plattenepithelausläufer<br />
– umliegendes aufgelocker-<br />
tes und leukozytär infil-<br />
triertes Stroma<br />
– Stromainvasion von der Basalmembran darf max. 3 mm betragen<br />
– infiltrierendes Wachstum innerhalb des Bindegewebes<br />
– Metastasierung ist extrem selten<br />
– Mikrokarzinom:<br />
– ausgehend vom Plat-<br />
tenepithel<br />
– umschriebener Netz-<br />
verband von atypisch-<br />
enPlattenepithelver- bänden mit eindeuti-<br />
ger Infiltration des präexistenten Bindegewebes<br />
– Tumoren mit einer Tiefeninfiltration bis zu 5 mm und einer Ausdehnung<br />
in Länge und Breite von bis zu 7 mm<br />
– infiltrierendes Wachstum innerhalb des Bindegewebes<br />
– Metastasierung ist extrem selten<br />
– Wachstum und Ausbreitung:<br />
– geschlechtsreife Frau: intraepithelialen Zervixatypien liegen an der Portio-<br />
oberfläche und dem äußeren Muttermund<br />
– postmenopausal: Atypien liegen wieder endozervikal<br />
– die Verschiebung ist Folge einer hormonell bedingten Form- und Struktur-<br />
wandlung der Zervix im Lebenslauf einer Frau<br />
– ¾ der Frühkarzinome werden an der Portiooberfläche, die restlichen<br />
Veränderungen im Zervikalkanal gefunden<br />
– kaum Lymphknotenmetastasierung bei Frühformen und low-risk-Fällen (kein<br />
Lymphbahn- und Gefäßeinbruch, überwiegend plumpes Wachstum)
<strong>Gynäkologie</strong> 14<br />
– Metastasierungsrate in die Lymphknoten von 5–10 % bei high-risk-Fällen<br />
– Therapie:<br />
(Lymphbahn- oder Blutgefäßeinbruch, netzartiges Wachstum)<br />
– Hysterektomie:<br />
– absolute Heilungsrate von 100 % bei Patientinnen mit früher Stroma-<br />
invasion, 95 % bei Patientinnen mit Mikrokarzinom<br />
– pelvine Lymphonodektomie bei Mikrokarzinomen der high-risk-Gruppe<br />
– regelmäßige Nachsorgeuntersuchungen (Kontrollabstriche)<br />
– invasives Zervixkarzinom:<br />
– Pathogenese:<br />
– Überschreitung der Größenordnung eines Mikrokarzinoms<br />
– ausgehend von einer CIN<br />
– 90 % Plattenepithelkarzinome, 10 % Adeno- und Mischkarzinome<br />
– Diagnostik:<br />
– Anamnese und klinische/gynäkologische Untersuchung<br />
– Zytologie:<br />
– Kolposkopie mit Jodprobe:<br />
– normales Plattenepithel wird durch die Reaktion von Jodid und Glykogen<br />
braun angefärbt, veränderte Bezirke bleiben hell, da hier das Gykogen<br />
fehlt und somit keine Glykogen-Jodid-Verbindung erfolgen kann<br />
– Histologie bzw. diagnostische Konisation<br />
– apparativ (Sonographie, Röntgen-Thorax, Zysto-, Rektoskopie, i.v.-Pyelo-<br />
graphie, CT, MRT)<br />
– Staging-Laparoskopie
<strong>Gynäkologie</strong> 15<br />
– Wachstum und Ausbreitung:<br />
– kontinuierliches Wachstum:<br />
– kontinuierlich wachsende Tumoren bleiben in einem Gewebeverband<br />
– exophytisches oder endophytisches Wachstum:<br />
– exophytisch:<br />
– Tumoren der Portiooberfläche (blumenkohlähnliches Bild)<br />
– endophytisch:<br />
– intrazervikale Karzinome<br />
– verbergen sich oft hinter intakt erscheinenden Portiooberfläche<br />
– Befall des Parametriums zu 15<br />
%, Befall der Scheide zu 30%,<br />
Befall des Corpus uteri zu 20 %<br />
– selten Befall von Harnblase und<br />
Rektum<br />
– diskontinuierliches Wachstum:<br />
– Stadien:<br />
– Verschleppung gelöster Karzi-<br />
nomzellen vom Primärtumor entlang der Lymph- und Gefäßbahnen<br />
– Befall der Beckenlymphknoten zu 30 %, Befall der paraaortalen<br />
Lymphknoten zu 5 – 10 %<br />
– sprunghafter Anstieg der lymphogenen Metastasierung auf über 50 %<br />
bei Infiltration des Parametriums<br />
– bei Vorliegen paraaortaler Metastasen liegt die Wahrscheinlichkeit auf<br />
eine schon bestehende hämatogene Metastasierung bei über 40 %, ist<br />
der supraklavikuläre Lymphknoten (Virchow-Lymphknoten) betroffen,<br />
liegen in über 60 % der Fälle schon hämatogene Metastasen vor<br />
– zu 5 – 10 % hämatogene Metastasen in Lunge, Leber und Skelett
<strong>Gynäkologie</strong> 16<br />
– Klinik:<br />
– intrazervikale Zervixkarzinome:<br />
– oft symptomlos<br />
– erreichen eine beträchtliche Größe und treiben die Zervix in Form einer<br />
Tonne auf (Tonnenkarzinome)<br />
– vowiegend postmenopausal<br />
– Karzinome an der Portiooberfläche:<br />
– eher in der Geschlechtsreife<br />
– exophytisches Wachstum: blumenkohlähnliches Bild<br />
– endophytisches Wachstum: ulzerierender, kraterförmiger Defekt mit<br />
derbem Randwall<br />
– azyklische Blutungen und Kohabitationsblutungen<br />
– übelriechender zervikaler Fluor<br />
– Ureterstenosen<br />
– Blut- und Lymphstau der unteren Extremitäten<br />
– Rücken- und Blasenschmerzen<br />
– Neuralgien der unteren Extremitäten<br />
– Ileussymptomatik<br />
– Fistelbildungen<br />
– Therapie:<br />
– operative Therapie:<br />
– Therapie der Wahl in den FIGO-Stadien IB bis IIB<br />
– erweiterte abdominale Radikaloperation (Wertheim-Meigs) mit Entfern-<br />
ung des Uterus mit einer Scheidenmanschette, des parametranen und<br />
parakolpischen Gewebes sowie der pelvinen Lymphknoten<br />
– Adnektomie bei intrazervikalem Adenokarzinom<br />
– paraaortale Lymphknotenentfernung<br />
– Lymphonodektomie nach Sentinel-Technik:
<strong>Gynäkologie</strong> 17<br />
– präoperativ Umspritzung der Zervix bei 12, 3, 6 und 9 Uhr mit einer<br />
radioisotopen Substanz (Technetium)<br />
– 2 Stunden später szintigraphische Darstellung des Lymphabflusses<br />
mit dem Wächterlymphknoten (Sentinel-Lymphknoten)<br />
– intraoperativ kann dieser mit der Gamma-Sonde detektiert und<br />
– Strahlentherapie:<br />
schonend operativ entfernt werden<br />
– bei Überschreitung der Zervixgrenzen oder Inoperabilität<br />
– postoperative Bestrahlung wird dann durchgeführt, wenn bei der<br />
Operation der Tumor nicht im Gesunden entfernt werden konnte<br />
– oft Kombination der adjuvanten Strahlentherapie mit einer synchronen<br />
Chemotherapie<br />
– Chemotherapie:<br />
– bei fehlender Sanierung durch Operation und Bestrahlung<br />
– Mittel: platinhaltige Zystostatika, Bleomycin, Cyclophosphamid, Ifosfamid<br />
und 5-Fluorouracil<br />
– Prognose und Prognosekriterien:<br />
– mittlere 5-Jahresüberlebensrate:<br />
– Stadium I: 80 %<br />
– Stadium II: 70 %<br />
– Stadium III: 45 %<br />
– Stadium IV: 15 %<br />
– Tumorgröße:<br />
– Zunahme der lymphogenen Metastasierung mit zunehmender Größe<br />
– Zunahme der lymphogenen und hämatogenen Metastasierung bei<br />
Überschreiten der Zervixgrenze sowohl in Richtung Parametrien als<br />
auch in Richtung Scheide<br />
– Art des Tumorwachstums:<br />
– deutliche Verschlechterung der 5-Jahresüberlebensrate bei Lymph-<br />
gefäß- und Blutgefäßeinbruch<br />
– diese beträgt bei Blutgefäßeinbruch 30 %, ohne Blutgefäßeinbruch<br />
80 %<br />
– Lymphknotenmetastasierung:<br />
– 5-Jahresüberlebensrate fällt von 85 % bei Nichtbefall auf 50 % bei<br />
metastatischem Befall der Lymphknoten<br />
– 75 % der Rezidive innerhalb der ersten 3 Jahre
<strong>Gynäkologie</strong> 18<br />
– Tumoren des Corpus uteri:<br />
– benigne Tumoren des Corpus uteri:<br />
– Leiomyome:<br />
– Definition:<br />
– gutartige mesenchymale Tumoren der glatten Muskulatur<br />
– Epidemiologie:<br />
– Altersgipfel: 35. - 45. Lebensjahr<br />
– häufiger bei Nulliparese<br />
– Myome sind östrogenabhängig � rapides Größenwachstum in Schwanger-<br />
schaft und Rückbildung in Postmenopause<br />
– eine Neubildung von Myomen postmenopausal gibt es nicht<br />
– Ätiologie:<br />
– Östrogenüberschuss<br />
– Pathologie:<br />
– aus sich durchflechtenden Bün-<br />
deln glatter Muskelzellen<br />
– atypische Mitosen selten, aber<br />
möglich<br />
– regressive Veränderungen (Vernarbung, Verkalkung, Zysten) möglich<br />
– Wachstum und Wachstumsformen:<br />
– langsam wachsende Tumoren<br />
– Formen:<br />
– intramurales Wachstum:<br />
– am häufigsten<br />
– innerhalb der Uteruswand<br />
– Vorwölbung der Mukosa und Serosa<br />
– subseröses Wachstum:<br />
– entwickeln sich in Richtung Serosa<br />
– Vorbuckelung des Uterus<br />
– submuköses Wachstum:<br />
– entwickeln sich in Richtung des Cavum uteri<br />
– Vorwölbung der Schleimhaut<br />
– verursachen früh klinische Beschwerden<br />
– bei Größenzunahme völlige Ausfüllung des Cavum uteri mit Vorwöl-<br />
bung zur Gegenseite möglich
<strong>Gynäkologie</strong> 19<br />
– Sekundärveränderungen:<br />
– durch eingeschränkte Blutversorgung kann es, je nach Ausmaß der<br />
– Klinik:<br />
Ischämie, zu unterschiedlichen degenerativen Veränderungen kommen:<br />
– hyaline Degeneration:<br />
– Vorkommen in fast allen Myomen<br />
– zystische Degeneration:<br />
– Bildung zystischer Hohlräume, die gelatinöses Material enthalten<br />
– Kalzifikation:<br />
– bei langsam entstandener Ischämie<br />
– v.a. postmenopausal<br />
– disseminierte Verkalkung<br />
– Infektion:<br />
– meist in submukösen Myomen<br />
– Nekrosen:<br />
– bei gestielten Myomen mit Torsion<br />
– parasitäre Myome:<br />
– bei entzündlichen Veränderungen verwachsen subseröse Myome mit<br />
dem Peritoneum oder dem Netz, welches die Gefäßversorgung<br />
übernimmt<br />
– oft asymptomatisch<br />
– Blutungsstörungen:<br />
– intramurale Myome: Menorrhagie (durch Abflussbehinderung des Blutes<br />
und durch verminderte Kontraktionsfähigkeit)<br />
– submuköse Myome: Metrorrhagie (durch Atrophie und mechanisch<br />
bedingte Schleimhauterosionen)<br />
– gestielte submuköse Myome: Dauerblutungen (durch venöse Stau-<br />
ungen)<br />
– Schmerzen<br />
– Verdrängungs- und Druckerscheinungen (Miktionsbeschwerden, Obstipat-<br />
ion, Kreuzschmerzen, Harnleiter- und Blutabflussstauungen der Beine)<br />
– Anämie<br />
– Sterilität, Infertilität<br />
– Diagnostik:<br />
– Anamnese und gynäkologische Untersuchung<br />
– Zytologie<br />
– fraktionierte Kürettage
<strong>Gynäkologie</strong> 20<br />
– Hysteroskopie<br />
– Sonographie<br />
– Staging<br />
– Therapie:<br />
– keine Therapie bei asymptomatischen Myomen<br />
– operativ:<br />
– Indikationen:<br />
– schwere Blutungsstörungen, Schmerzen, Harnleiterobstruktion<br />
– rasches Wachstum (V.a. Ovarialtumor oder Leiomyosarkom)<br />
– Diagnoseunsicherheiten<br />
– Sterilität, Infertilität<br />
– akute Komplikationen (Stieldrehung, Kapselruptur, Myominfektion)<br />
– Vorgehen:<br />
– bei Kinderwunsch: uteruserhaltende Operation<br />
– bei abgeschlossener Familienplanung: Hysterektomie<br />
– Myomausschälung<br />
– beidseitige Embolisation der A. uterina<br />
– medikamentös:<br />
– Danazole<br />
– GnRH-Analoga<br />
– GnRH-Antagonisten<br />
– Mifepriston<br />
– Endometriumpolypen:<br />
– Definition:<br />
– von der Basalis ausgehende Hyperplasie der Schleimhaut, die in das Cavum<br />
uteri hineinragt<br />
– Epidemiologie:<br />
– Auftreten in jedem Alter möglich<br />
– Altersgipfel: 30. - 60. Lebensjahr<br />
– Pathogenese:<br />
– treten einzeln oder multipel auf, häufig innerhalb eines Uterus myomatosus<br />
– Größe variiert von wenigen Millimetern bis hin zu Polypen, die das Cavum<br />
uteri ausfüllen und durch die Zervix in die Vagina hineinreichen<br />
– sind durch einen Stiel mit ihrem Ursprungsort verbunden, manche sitzen<br />
auch breitbasig auf<br />
– bis zu 30 % der Endometriumpolypen kommen mit einem simultanen Endo-<br />
metriumkarzinom vor
<strong>Gynäkologie</strong> 21<br />
– Diagnostik:<br />
– fraktionierte Kürettage (zur Abklärung der Blutungsstörungen)<br />
– Sonographie (Zufallsbefund)<br />
– Therapie:<br />
– Abtragung durch Korpuskürettage oder operative Hysteroskopie<br />
– atypische Veränderungen und maligne Tumoren des Corpus uteri:<br />
– Endometriumhyperplasie:<br />
– Epidemiologie:<br />
– Erkrankung der Peri- und Postmenopause<br />
– Pathogenese:<br />
– persistierende Östrogenstimulation ohne Kompensation durch Gestagene<br />
– Klinik:<br />
– Blutungsstörungen<br />
– Pathologie:<br />
– einfach Hyperplasie:<br />
– gleichmäßige Vermehrung von Drüsen und Stroma<br />
– typisch sind zystisch dilatierte Drüsen (Schweizer-Käse-Muster)<br />
– komplexe Hyperplasie:<br />
– stärkere Vermehrung der Drüsen gegenüber dem Stroma<br />
– Drüsen sind verzweigt und liegen Rücken an Rücken, nur von wenig<br />
Stroma getrennt<br />
– atypische Hyperplasie:<br />
– Therapie:<br />
– zeigt Veränderungen einer komplexen Hyperplasie<br />
– zusätzlich zelluläre Atypien (abgerundete, blasse Zellkerne mit deutlich-<br />
en Nukleolen und vergröbertem Chromatin, oft auch vermehrtes und<br />
stärker eosinophiles Zytoplasma)<br />
– Endometriumhyperplasie ohne Atypien: hoch dosierte Gestagen-Therapie<br />
– Endometriumhyperplasie mit Atypien: Hysterektomie
<strong>Gynäkologie</strong> 22<br />
– atypische adenomatöse Endometriumhyperplasie:<br />
– Vorstufe des Endometriumkarzinoms<br />
– Entartungsrisiko von 5 – 10 % bei der einfach<br />
Form, von 30 % bei der komplexen Form<br />
– Endometriumkarzinom:<br />
– Epidemiologie:<br />
– Inzidenz: 20 – 30/100.000<br />
– Manifestationsalter: 65. - 70. Lebensjahr<br />
– Ätiopathogenese:<br />
– entwickelt sich aus der Schleimhaut des Corpus uteri, wobei die Proliferation<br />
des Endometriums durch Östrogene stimuliert wird, die ihre Wirkung über<br />
Östrogenrezeptoren des Drüsenepithels entfalten<br />
– eine andauernde Stimulation des Endometriums regt die Proliferation<br />
maligne transformierter Zellen an, insbesondere bei Fehlen von Gestagenen<br />
– Risikofaktoren:<br />
– langjährige Applikation hoher Östrogendosen<br />
– Verlängerung der Geschlechtsreife bei früher Menarche und später Meno-<br />
pause und häufigen Zyklusanomalien<br />
– eingeschränkte Parität (ca. 30 % der Patientinnen sind Nulliparae)<br />
– hoher sozioökonomischer Status<br />
– Adipositas<br />
– höheres Lebensalter<br />
– gestörter Metabolismus (z. B. Leberzirrhose mit Leberfunktionsstörungen)<br />
– Tamoxifen-Therapie (bei Patientinnen mit Mammakarzinom)<br />
– Pathologie:<br />
Bezeichnung Häufigkeit Histologie 5-JÜR<br />
Adenokarzinom 60 % drüsig bis solide 75 %<br />
Adenoakanthom 21 %<br />
adenosquamöses<br />
Karzinom<br />
klarzelliges<br />
Karzinom<br />
papilläres<br />
Karzinom<br />
7 %<br />
drüsig mit gutartigen Plattenepithelmetaplasien<br />
drüsig bis solide mit atypischen<br />
Plattenepithelmetaplasien<br />
85 %<br />
45 %<br />
6 % pflanzenzellartiges Bild 35 %<br />
5 % zottenähnlicher Aufbau 50 %
<strong>Gynäkologie</strong> 23<br />
– Wachstum und Ausbreitung:<br />
– meist ausgehend vom Fundus uteri<br />
– exophytäres Wachstum in Richtung Uteruslumen<br />
– endophytäres Wachstum in die Uterusmuskulatur<br />
– kontinuierliche Ausbreitung auf die Zervix (10 %), kontinuierliche Über-<br />
schreitung der Uterusgrenzen (10 %)<br />
– bei Befall der Zervix weitere Ausdehnung in das angrenzende Parametrium<br />
und in die pelvinen Lymphknoten<br />
– diskontinuierliche Ausbreitung intrakanalikulär über die Tuben oder den<br />
Zervikalkanal<br />
– lymphogene Ausbreitung: 20 % der pelvinen und 10 % der paraaortalen<br />
Lymphknoten, Ovarialmetastasen 10 %<br />
– hämatogene Ausbreitung: Lunge, Leber und Knochen zu 5 %<br />
– Stadien:
<strong>Gynäkologie</strong> 24<br />
– Klinik:<br />
– Meno-Metrorrhagien<br />
– uteriner Fluor und Schmerzen als Folge einer Pyo- oder Hämatometra bei<br />
fortgeschrittenem Karzinom<br />
– Diagnostik:<br />
– Anamnese und klinische/gynäkologische Untersuchung<br />
– Zytologie<br />
– fraktionierte Kürettage<br />
– Hysteroskopie<br />
– Sonographie<br />
– Staging (CT, MRT, Röntgen)<br />
– Therapie:<br />
– operativ:<br />
– Allgemeines:<br />
– vor OP Einlage einer alkoholgetränkten Tamponade in die Zervix und<br />
Verschluss der Zervix durch Naht zur Vermeidung von intrauteriner<br />
Tumorverschleppung<br />
– mediane Laparotomie<br />
– Spülzytologie aus Douglas-Raum und parakolischen Rinnen<br />
– Abklemmen der Tubenabgänge zur Vermeidung von Tumorver-<br />
schleppung<br />
– Mitentfernung der Adnexen<br />
– Vorgehen:<br />
– Hysterektomie, Adnektomie, Omentektomie, Peritonealektomie<br />
– Strahlentherapie:<br />
– wenn eine OP nicht<br />
möglich ist<br />
– als intrakavitäre<br />
Kontaktbestrahlung<br />
– ergänzt durch eine<br />
perkutane Hochvolt-<br />
therapie<br />
– systemische Therapie:<br />
– Gestagentherapie<br />
(z.B. Medroxyprogesteronacetat)<br />
– Tamoxifen, GnRH-Analoga, Aromatasehemmer<br />
– Zytostatika (Anthrazykline, Platinderivate)
<strong>Gynäkologie</strong> 25<br />
– Prognose:<br />
– 5-Jahresüberlebensrate: Stadium I 85 %, Stadium II 70 %, Stadium III 50 %,<br />
– Uterussarkom<br />
Stadium IV 20 %<br />
– maligne mesodermale Mischtumoren<br />
– Tumoren der Tuben:<br />
– benigne Tumoren von Tube und Mesosalpinx:<br />
– Zysten:<br />
– sonstige Tumoren:<br />
– Adenomatoidtumoren, Polypen, Leiomyome, Hämangiome, Lymphangiome<br />
– maligne Tumoren von Tube und Mesosalpinx:<br />
– Tubenkarzinom:<br />
– Epidemiologie:<br />
– mittleres Erkrankungsalter: 50. - 60. Lebensjahr<br />
– 10 – 20 % der Pat., die an einem Tubenkarzinom erkranken, haben bereits<br />
eine andere Krebserkrankung eines anderen gynäkologischen Organs<br />
– Wachstum und Ausbreitung:<br />
– zu 10 – 30 % beidseitig<br />
– Wachstumsbeginn meist in der Ampulle<br />
– frühzeitige lymphogene Metastasierung mit Befall der pelvinen und para-<br />
– Stadien:<br />
aortalen Lymphknoten sowie frühzeitige hämatogene Metastasierung<br />
– ähnlich wie beim Ovarialkarzinom<br />
– Therapie:<br />
– operativ:<br />
– Prognose:<br />
– radikale Operation mit Entfernung beider Adnexen, des Uterus und des<br />
Netzes sowie pelvine und paraaortale Lymphonodektomie<br />
– 5-Jahresüberlebensrate: 30 – 40 %
<strong>Gynäkologie</strong> 26<br />
– Tumoren der Ovarien:<br />
– funktionelle Zysten:<br />
– Follikelzysten:<br />
– entwickeln sich in Follikelwachstums-<br />
phase oder in atretischer Phase auf-<br />
grund eines gestörten hypophysär-<br />
ovariellen Regelkreises infolge einer<br />
unphysiologisch hohen FSH-Sekret-<br />
ion oder als überschießende Reak-<br />
tion auf eine normale FSH-Sekretion<br />
– der normale Graaf-Follikel kann eine<br />
Größe bis zu 2 cm erreichen � fließ-<br />
ender Übergang zum zystischen<br />
Follikel � ab Ø von 3 cm sind nicht<br />
luteinisierte Follikel als pathologisch<br />
einzustufen<br />
– die in den Follikeln enthaltenen Gra-<br />
nulosazellen produzieren Östrogene,<br />
die eine glandulär-zystische Hyper-<br />
plasie des Endometriums bewirken �<br />
Dauerschmierblutungen<br />
– am häufigsten unmittelbar nach der Menarche oder in der Menopause<br />
– Corpus-luteum-Zysten:<br />
– solitäres Auftreten<br />
– oft bei Schwangeren oder nach einer ovulationsauslösenden Therapie<br />
– entstehen aus dem Corpus luteum durch eine übermäßige zentrale Blutung<br />
– Syndrom der polyzystischen Ovarien:<br />
– Ätiologie:<br />
– gestörter hypothalamisch-hypophysärer-ovarieller Regelkreis<br />
– mangelnde Aktivität von Aromatasen in der Granulosaschicht, die im<br />
gesunden Ovar durch FSH stimuliert werden<br />
– hyaline Verdichtung der Lamina basalis blockiert die FSH-Wirkung �<br />
mangelhafte Stimulation und somit Regression der Granulosazellen<br />
– gleichzeitig bestehender gonadotroper Dauerstimulus (LH �) � Entgleisung<br />
der Steriodbiosynthese im Ovar � vermehrte Androgenbildung � Androgen-<br />
exzess bedingt wiederum die hyaline Verdickung der Lamina basalis
<strong>Gynäkologie</strong> 27<br />
– Klinik:<br />
– Hirsutismus<br />
– Virilismus<br />
– Zyklusstörungen (Oligomenorrhoe, Amenorrhoe, anovulatorische Zyklen)<br />
– Seborrhoe, Akne<br />
– androgenetische Alopezie<br />
– Adipositas<br />
– Diagnostik:<br />
– Labor: Erhöhung von LH, Testosteron, Androstendion, DHEA(S) , Prolaktin<br />
– Sonographie<br />
– Histologie: multiple Mikrozysten mit atretischen und unreifen Follikeln sowie<br />
– Therapie:<br />
fibrös verdickte ovarielle Kapsel<br />
– Ovulationshemmer<br />
– Glukokortikoide<br />
– Spironolacton<br />
– Thekaluteinzysten:<br />
– Folge einer verlängerten oder verstärkten β-HCG-Wirkung<br />
– Ursache: Mehrlingsschwangerschaften, ovarielle Überstimulation, Blasenmole<br />
oder Chorionepitheliom<br />
– bis zu 30 cm große Zysten mit klarer, teilweise hämorrhagischer Flüssigkeit<br />
– als Folge eines allgemeinen Epitheldefekts kann zu einer Hypovolämie mit<br />
Aszites und Pleuraerguss kommen<br />
– ovarielle Inklusionszysten:<br />
– Einschlussdrüsen in der direkten Verlängerung der mesothelialen Fältelung der<br />
Ovaroberfläche<br />
– durch traumatisches Hineinverlagern dieser proliferativ aktiven Mesothelzellen,<br />
wobei die Ovulation als auslösendes Ereignis angesehen wird<br />
– auch durch Persistenz embryonaler Zellen, da die Epithelzellen mancher Zysten<br />
die gleiche Differenzierungsvielfalt wie primäres Müller-Epithel aufweisen<br />
– diese Strukuren zeigen vermehrte Proliferation und vereinzelte Dysplasien,<br />
weshalb sie als Matrix für die Entstehung epithelialer Neoplasien gelten<br />
– epitheliale Ovarialtumoren:<br />
– benigne epitheliale Ovarialtumoren:<br />
– seröse Ovarialtumoren:<br />
– Manifestationsalter: 40. - 50. Lebensjahr<br />
– man unterscheidet:
<strong>Gynäkologie</strong> 28<br />
– seröse Kystadenome:<br />
– 30 % aller benignen Ovarialtumoren<br />
– Altersgipfel: 30. - 50. Lebensjahr<br />
– oft doppelseitiges Auftreten, Ø bis zu 20 cm<br />
– einreihiges, zilientragendes Zylinderepithel (Flimmerhärchen)<br />
– ein- oder mehrkammerige, dünnwandige Zysten mit serösem Inhalt<br />
– seröse papilläre Zystadenofibrome:<br />
– blumenkohlartiges Wachstum<br />
– reich an kollagenem Bindegewebe<br />
– seröse Adenofibrome<br />
– Therapie:<br />
– junge Frauen: einseitige Adnektomie<br />
– postmenopausal: beidseitige Adektomie<br />
– muzinöse Ovarialtumoren:<br />
– Manifestationsalter: 30. - 50. Lebensjahr<br />
– häufigste Tumoren der Schwangerschaft<br />
– muzinöse Kystadenome:<br />
– 15 % aller benignen Ovarialtumoren<br />
– Altersgipfel: 30. - 50. Lebensjahr<br />
– oft einseitiges Auftreten, Ø bis zu 50 cm<br />
– einschichtiger Aufbau aus hohen Zylinderepithelzellen<br />
– von einer dicken Kapsel umgeben, meist einkammerig<br />
– enthalten dickflüssigen Schleim (Pseudomuzin) � enthält solide Areale<br />
aus vielen kleinen wabenförmig angelegten Zysten, sog. Tochterzysten<br />
– oft Auftreten in Verbindung mit einem Pseudomyxoma peritonei (Ausfül-<br />
lung des gesamten intraperitonealen Raums mit einer zähen, gelblichen<br />
Schleimmasse, die disseminierte muzinöse Drüsenkomplexe enthält)<br />
– Therapie: einseitige Adnektomie
<strong>Gynäkologie</strong> 29<br />
– endometroide Ovarialtumoren:<br />
– 5 % aller benignen Ovarialtumoren<br />
– 5 – 10 % stammen von einer Endometriose ab<br />
– endometroides Zystadenom<br />
– Zystadenofibrom vom Klarzelltyp<br />
– Brenner-Tumoren:<br />
– 2 % aller Ovarialtumoren<br />
– Altersgipfel: 50. Lebensjahr<br />
– oft einseitiges Auftreten<br />
– bestehen aus Übergangsepithel mit Hyperplasie des ovariellen Stromas<br />
– runde, urothelähnliche Epithelinseln und kollagenfaserreiches Stroma<br />
– solide, höckrige Tumoren mit einer weißlich-gelben Farbe, zur Hälfte verkalkt<br />
– maligne epitheliale Ovarialtumoren:<br />
– seröse Ovarialtumoren:<br />
– seröses Kystadenokarzinom:<br />
– 40 % der malignen Ovarialtumoren<br />
– Altersgipfel: 50. - 60. Lebensjahr<br />
– oft doppelseitiges Auftreten<br />
– ähnelt dem serösen Kystadenom,<br />
zerstört aber bereits die Gewenskapsel<br />
– papilläre Strukturen und Psammomkör-<br />
perchen<br />
– frühzeitige Metastasierung<br />
– schlechte Prognose
<strong>Gynäkologie</strong> 30<br />
– muzinöse Ovarialtumoren:<br />
– muzinöses Kystadenokarzinom:<br />
– 10 % der malignen Ovarialtumoren<br />
– Altersgipfel: 40. - 50. Lebensjahr<br />
– oft doppelseitiges Auftreten<br />
– entsteht fast immer sekundär<br />
– ähnelt dem muzinösen Kystadenom,<br />
zerstört aber bereits die Gewebskapsel<br />
– oft hämorrhagischer Zysteninhalt<br />
– endometroide Ovarialtumoren:<br />
– endometroides Karzinom:<br />
– 20 % der malignen Ovarialtumoren<br />
– Altersgipfel: 50. - 60. Lebensjahr<br />
– Vorliegen von sämtlichen histologischen Formen möglich (z.B. Adeno-<br />
– Klarzellkarzinom:<br />
karzinom, vgl. Endometriumkarzinom)<br />
– 5 % der malignen Ovarialtumoren<br />
– Altersgipfel: 50. - 60. Lebensjahr<br />
– große, helle, glykogenhaltige Zellen<br />
– teils solides, teils drüsenartiges Wachstum<br />
– sehr bösartig<br />
– Ovarialkarzinom:<br />
– Epidemiologie:<br />
– seröse, endometroide oder muzinöse Tumoren<br />
– Inzidenz: 15/100.000<br />
– Auftreten in jedem Lebensalter<br />
– Ätiologie:<br />
– familiäre Disposition, BRCA-1- und BRCA-2-Mutationen<br />
– Risikofaktoren:<br />
– Nullipara<br />
– Alter > 40 Jahre<br />
– weiße Rasse
<strong>Gynäkologie</strong> 31<br />
– seltene Einnahme von Ovulationshemmern<br />
– hoher sozioökonomischer Status<br />
– Mammakarzinom<br />
– Wachstum und Ausbreitung:<br />
– frühzeitige intraperitonale Ausbreitung den Druckverhältnissen im Bauch-<br />
raum folgend � überwiegend Absiedlung im unteren Teil des Beckens,<br />
im Oberbauch und Zwerchfell und im Bereich des Omentum majus<br />
– pelvine und paraaortale Lymphknotenmetastasierung<br />
– hämatogene Metastasierung in Leber, Knochen und Lunge (5 – 10 %)<br />
– Stadien:<br />
– Pathologie:
<strong>Gynäkologie</strong> 32<br />
– Klinik:<br />
– Miktionsstörungen<br />
– Defäkationsschmerzen<br />
– Harnleiterstauungen (Hydronephrose, sekundäre Pyelonephritis)<br />
– Uterusverdrängung (Zug an den Ligamenta rotunda)<br />
– Gastrointestinale Beschwerden ( Völlegefühl, Übelkeit, Obstipation)<br />
– Schmerzen im Lumbalbereich<br />
– B-Symptomatik<br />
– Blutungen<br />
– hormonell bedingte Symptomatik<br />
– Peritonealkarzinose<br />
– Diagnostik:<br />
– Anamnese und gynäkologische Untersuchung<br />
– Sonographie (Zeichen bei bösartigen Ovarialtumoren):<br />
– Oberflächenbegrenzung unscharf, unregelmäßig konfiguriert, höckrig<br />
– Wand dick, wechselnde Wandstärke<br />
– komplexe inhomogene (echoleere, echoreiche und echodichte) An-<br />
teile oder solides Reflexmuster der Binnenstruktur<br />
– solide und papilläre Strukturen innerhalb des Tumors<br />
– Darstellung von Septen unterschiedlicher Dicke<br />
– Befall beider Ovarien<br />
– Nachweis von Aszites<br />
– Staging (Röntgen, CT, MRT, Szintigraphie, ...)<br />
– Therapie:<br />
– operativ:<br />
– mediane Längslaparotomie<br />
– Entfernung von Adnexen, Uterus, pelvinem Peritoneum und Netz
<strong>Gynäkologie</strong> 33<br />
– Keimzelltumoren:<br />
– Allgemeines:<br />
– systemisch:<br />
– Chemotherapie:<br />
– Stadium Ia, Ib, G2, G3, Ic, Iia: 4 – 6 Zyklen Carboplatin<br />
– höhere Stadien: Carboplatin + Paclitaxel<br />
– Rezidive: Etoposid, Mitoxantron, Gemcitabin, Doxorubicin<br />
– Hormontherapie:<br />
– Gestagene<br />
– Antiöstrogene<br />
– GnRH-Analoga<br />
– Immunmodulation:<br />
– Interferone<br />
– Interleukine<br />
– TNF<br />
– Strahlentherapie<br />
– 20 % der Ovarialtumoren<br />
– Altersgipfel: 30. Lebensjahr<br />
– je jünger eine Frau mit Ovarialtumor ist, desto häufiger liegt ein maligner<br />
Keimzelltumor vor<br />
– Klassifikation:<br />
– Dysgerminome<br />
– Dottersacktumoren<br />
– Teratome<br />
– embryonale Karzinome und Polyembryome<br />
– Chorionkarzinome<br />
– benigne Keimzelltumoren:<br />
– Teratome:<br />
– entstehen aus pluripotenten embryonalen Stammzellen und enthalten Antei-<br />
le aller 3 Keimblätter<br />
– man unterscheidet:<br />
– reife Formen in zystischer oder solider Ausprägung (Dermoidzyste,<br />
solide Tumoren)<br />
– hochspezialisierte Sonderformen (z.B. Struma ovarii, Karzinoide)<br />
– unreife oder embryonale Teratome (meist maligne)
<strong>Gynäkologie</strong> 34<br />
– Dermoidzysten (reife Teratome):<br />
– Epidemiologie:<br />
– 15 % aller Ovarialtumoren<br />
– Auftreten während der produktiven<br />
Phase � 10 % treten während der<br />
Schwangerschaft auf<br />
– Pathogenese:<br />
– Anteile aller 3 Keimblätter mit Über-<br />
wiegen der ektodermalen Anteile<br />
– enthalten Haare (90 %), Öl, verhorn-<br />
endes Plattenepithel, Talgdrüsen,<br />
Zahnanlagen, Nervengewebe, Fett,<br />
Knorpel, Muskulatur und Knochen<br />
– Pathologie:<br />
– verhornendes Plattenepithel<br />
– muzinöse Drüsen<br />
– Klinik:<br />
– Unterbauchschmerzen<br />
– Zunahme des Bauchumfanges<br />
– vaginale Blutungen<br />
– Diagnostik:<br />
– Anamnese und gynäkologische Untersuchung (Zufallsbefund)<br />
– Sonographie, Röntgen<br />
– Therapie:<br />
– operativ:<br />
– Prognose:<br />
– einseitige Ovarektomie<br />
– keine alleinige Ausschälung � Rezidive zu 10 %<br />
– zu 1 % maligne Entartung (Plattenepithelkarzinom)<br />
– 5-Jahresüberlebensrate bei Begrenzung auf ein Ovar: 80 %, bei<br />
Kapseldurchbruch rapider Abfall<br />
– monophylitische Teratome:<br />
– isoliertes Wachstum einer<br />
Gewebeart (monophylitisches<br />
Wachstum)<br />
– Struma ovarii bei Ausbildung<br />
von Schilddrüsengewebe mit Symptomen einer Hyperthyreose
<strong>Gynäkologie</strong> 35<br />
– maligne Keimzelltumoren:<br />
– Dysgerminome:<br />
– Epidemiologie:<br />
– 2 – 5 % aller malignen Ovarialtumoren<br />
– 90 % der Patientinnen sind jünger als 30 Jahre<br />
– Auftreten meist während der Schwangerschaft<br />
– entspricht dem Seminom des Mannes<br />
– Klinik:<br />
– entsprechend anderer maligner Ovarialtumoren<br />
– Ausbreitung:<br />
– zu 70 – 80 % unilateral, zu 20 % bilateral<br />
– schnelles Wachstum und frühzeitige Metastasierung<br />
– Pathologie:<br />
– große Tumorzellen, die<br />
– Therapie:<br />
durch Stromasepten in Läp-<br />
pchen unterteilt sind<br />
– operativ:<br />
– Stadium IA: unilaterale Adnexektomie<br />
– Stadium IB: bilaterale Adnexektomie mit Hysterektomie und<br />
Omentektomie<br />
– Strahlentherapie:<br />
– postoperative Bestrahlung mit 30 – 40 Gy<br />
– Vollremission möglich<br />
– Chemotherapie:<br />
– Prognose:<br />
– gutes Ansprechen<br />
– 10-Jahresüberlebensrate: 75 – 90 %<br />
– Dottersacktumoren:<br />
– Epidemiologie:<br />
– selten, aber häufigste hochmaligne Ovarialtumoren in der Kindheit<br />
– mittleres Erkrankungsalter: 19. Lebensjahr<br />
– Pathologie:<br />
– weiche, häufig zystische Tumoren mit<br />
nekrotischen und hämorrhagischen Anteilen<br />
– retikuläres Muster<br />
– bilden α-Fetoprotein (Tumormarker)
<strong>Gynäkologie</strong> 36<br />
– Klinik:<br />
– Unterbauchschmerzen<br />
– akutes Abdomen bei Ruptur oder Torsion<br />
– Wachstum und Ausbreitung:<br />
– sehr schnelles Wachstum und frühzeitige Metastasierung<br />
– bei Diagnosestellung bereits Ø von 10 cm<br />
– Therapie:<br />
– operative:<br />
– Tumorresektion<br />
– Chemotherapie:<br />
– Prognose:<br />
– postoperativ aggressive Behandlung mit Zytostatika<br />
– in allen Stadien notwendig<br />
– 5-Jahresüberlebensrate: 50 %<br />
– zu 90 % Rezidive innerhalb eines Jahres<br />
– unreife Teratome:<br />
– 1 % aller Ovarialtumoren<br />
– Auftreten fast immer vor dem 20. Lebensjahr<br />
– ungeordnete und undifferenzierte Derivate der 3 Keimblätter mit Überwiegen<br />
von unreifem Neuralgewebe<br />
– oft Verwachsungen mit der Umgebung und Kapselrupturen<br />
– schlechte Prognose durch schnelles Wachstum und peritoneale Ausbreitung<br />
– 5-Jahresüberlebensrate: < 20 %<br />
– Therapie: unilaterale Adnektomie, anschließend Chemotherapie<br />
– Keimstrang- und Keimdrüsenstromatumoren:<br />
– Allgemeines:<br />
– 8 % aller Ovarialtumoren<br />
– ausgehend von den Keimsträngen oder vom Mesenchym<br />
– enthalten Zellen von Ovar und Hoden in Kombination mit einem bindegeweb-<br />
igen Anteil und produzieren Hormone<br />
– man unterscheidet:<br />
– Tumoren der Thekom-(Thekazell-)Fibromgruppe<br />
– Sertoli-Leydig-Zelltumoren<br />
– Gynandroblastome<br />
– Granulosazelltumoren
<strong>Gynäkologie</strong> 37<br />
– Tumoren der Thekom-(Thekazell-)Fibromgruppe:<br />
– Thekazelltumoren:<br />
– vorwiegend postmenopausal<br />
– immer unilaterales Auftreten<br />
– selten maligne Entartung<br />
– ausgehend von hormonaktiven Thekazellen des Bindegewebes<br />
– produzieren Östrogene � Endometriumhyperplasie � Blutungen<br />
– Pathologie: polygonale Zellen mit vakuolisiertem Zytoplasma und Lipid-<br />
tropfen<br />
– Therapie: unilaterale Ovarektomie<br />
– Ovarialfibrome:<br />
– 5 % aller Ovarialtumoren<br />
– Auftreten in jedem Lebensalter (90 % > 30 Jahre)<br />
– „ausgebrannte Thekome“ � entstehen aus ovariellem Stroma und produ-<br />
zieren kaum noch Hormone<br />
– Meigs-Syndrom: Ovarialfibrom, Aszites und Pleuraerguss<br />
– Therapie: unilaterale Ovarektomie<br />
– Sertoli-Leydig-Zelltumoren:<br />
– 0,5 % aller Ovarialtumoren, zu 90 % gutartig<br />
– bestehen aus einer Mischung aus Sertoli-Zellen, Leydig-Zellen und Fibroblasten<br />
– Symptome einer Androgenproduktion (Androblastome):<br />
– Oligomenorrhoe, Amenorrhoe<br />
– Rückbildung der weiblichen Geschlechtsmerkmale<br />
– zunehmende Maskulinisierung (Hirsutismus, Vermännlichung der Stimme,<br />
Klitorishypertrophie)<br />
– Therapie: operative Entfernung<br />
– Granulosazelltumoren:<br />
– Epidemiologie:<br />
– 2 % aller Ovarialtumoren<br />
– mittleres Erkrankungsalter: 52. Lebensjahr (postmenopausal)<br />
– Pathologie:<br />
– mikrofollikuläres, makrofollikuläres oder trabekuläres Muster<br />
– mikrofollikuläre Strukturen (Call-Exner-Körperchen) enthalten Lumensekret<br />
und pyknotische Zellkerne<br />
– kaffeebohnenähnliche Einkerbung der Zellkerne<br />
– produzieren Östrogene und α-Inhibin
<strong>Gynäkologie</strong> 38<br />
– Klinik:<br />
– Pseudopubertas praecox (bei Auftreten vor der Pubertät)<br />
– vaginale Blutungen durch eine Endometriumhyperplasie (bei Auftreten nach<br />
der Pubertät) � 4-fach erhöhtes Risiko für ein Endometriumkarzinom<br />
– Diagnostik:<br />
– Anamnese und gynäkologische Untersuchung<br />
– Sonographie<br />
– Wachstum und Ausbreitung:<br />
– Übergreifen auf Nachbarorgane und die paraaortalen und pelvinen Lymph-<br />
knoten<br />
– Therapie:<br />
– operativ:<br />
– Stadium IA, Beschränkung auf ein Ovar, in reproduktiver Phase:<br />
unilaterale Adnektomie, kontralaterale Keilexzision des kontralateralen<br />
Ovars und Uteruskürettage<br />
– kein Kinderwunsch, Ausdehnung über ein Ovar hinaus, postmenopausal:<br />
bilaterale Adnektomie, Hysterektomie und Omenektomie, ggf. Lympho-<br />
nodektomie<br />
– Strahlentherapie:<br />
– postoperativ bei Tumorrest<br />
– Chemotherapie:<br />
– Prognose:<br />
– Endometriose:<br />
– Definition:<br />
– bei Metastasierung<br />
– 10-Jahresüberlebensrate: 70 – 95 %<br />
– Lokalrezidive im kleinen Becken, Spätrezidive auch noch nach 20 Jahren<br />
– Vorkommen von endometrialem Drüsengewebe und Stroma außerhalb des Cavum<br />
uteri<br />
– Formen:<br />
– Endometriosis genitalis externa:<br />
– ektope Endometrioseinseln außerhalb des Uterus in den Organen des kleinen<br />
Beckens (Ovarien, Ligg. sacrouterinae, Douglasperitoneum, Blasenperitoneum)<br />
– Endometriosis genitalis interna:<br />
– Adenomyosis uteri<br />
– Endometrioseinseln innerhalb des Myometriums
<strong>Gynäkologie</strong> 39<br />
– Endometriosis extragenitalis:<br />
– Endometrioseinseln außerhalb des kleinen Beckens (Lunge, Blase, Ureteren,<br />
Darm)<br />
– Epidemiologie:<br />
– 8 – 10 % der Frauen zwischen dem 15. - 50. Lebensjahr<br />
– Ätiologie:<br />
– unbekannt, aber Theorien:<br />
– Stadien:<br />
– Transplantationstheorie:<br />
– während der Menstruation retrograde Wanderung von Endometriosegewebe<br />
durch die Tuben in den Bauchraum<br />
– Implantation auf dem Peritoneum<br />
– benigne Metastasierung über die Lymph- und Blutgefäße<br />
– Metaplasietheorie:<br />
– rezidiverende Irritationen des Zölomepithels induzieren Metaplasien mit<br />
Transfusion der pluripotenten Zölomzelle in endometriales Gewebe<br />
– immunologische Theorie:<br />
– Stadium I:<br />
– Endometriumfragmente im Douglas-Raum werden durch Makrophagen<br />
entfernt<br />
– bei einem Immundefekt gegen autologes Endometrium Implantation und<br />
Wachstum der Fragmente möglich<br />
– Endometrioseherde im kleinen Becken < 5 mm<br />
– Endometrioseherde an der Portio < 5 mm<br />
– beide Eileiter frei durchgängig<br />
– Stadium II:<br />
– Endometrioseherde im kleinen Becken >5 mm<br />
– Endometrioseherde an der Portio > 5 mm<br />
– Endometrioseherde am Dach der Harnblase<br />
– Verwachsungen der Eierstöcke oder Eileiter mit Verengung der Eileiter<br />
– Blutsee im Douglas-Raum<br />
– Stadium III:<br />
– Adenomyosis uteri<br />
– Endometriose am Tubenwinkel<br />
– Schokoladenzysten der Eierstöcke<br />
– Endometrioseknoten an den Ligamenta sacrouterinae
<strong>Gynäkologie</strong> 40<br />
– Stadium IV:<br />
– Klinik:<br />
– Endometriose außerhalb der inneren oder äußeren Geschlechtsorgane: Herde<br />
im gesamten Bauchraum möglich, seltener auch außerhalb der Bauchhöhle<br />
(Lunge, Darm, Bauchnabel, Leistenkanal, Harnblase, Haut, Gehirn)<br />
– sekundäre Dysmenorrhoe<br />
– Dyspareunie<br />
– zyklische Unterbauchschmerzen, Hämaturie, blutige Defäkation<br />
– Dysurie<br />
– prämenstruelle Schmierblutung/Hypermenorrhoe<br />
– Sterilität<br />
– Defäkationsbeschwerden<br />
– Lokalisation:<br />
– innere Genitalien:<br />
– Ovarien (50 %)<br />
– Sakrouterinligamente/Douglasperitoneum (60 %)<br />
– Tuben (10 %)<br />
– benachbarte Organe:<br />
– Blase (15 %)<br />
– Darm (8 %)<br />
– extragenital:<br />
– Lunge/Pleura<br />
– Laparotomiewunden<br />
– Extremitäten<br />
– Spinalkanal<br />
– Pathologie:<br />
– makroskopisch:<br />
– gruppiert<br />
– gelblich-bräunliche Färbung<br />
– polypös oder infiltrierend wachsend<br />
– „Schokoladenzysten“ bei Ovarialendometriose (dunkelbrauner Inhalt durch<br />
Einblutung)<br />
– mikroskopisch:<br />
– Endometriose mit hochdifferenzierten Drüsen und Stroma (50 %)<br />
– Endometriose mit Drüsenepithel unterschiedlicher Differenzierungsgrade (15 %)<br />
– Endometriose mit hochdifferenziertem Drüsenepithel ohne endometriumspezif-<br />
ische Differenzierung (Drüsenepithel der Zervix, 35 %)
<strong>Gynäkologie</strong> 41<br />
– Diagnostik:<br />
– Anamnese und gynäkologische Untersuchung:<br />
– schmerzhaftes Douglas-Peritoneum<br />
– Portiolüftungsschmerz<br />
– fixierte Retroflexio<br />
– teigige, druckdolente Ovarialzysten<br />
– Sonographie<br />
Adenomyosis uteri:<br />
unregelmäßige Endometriumnester mit oder<br />
ohne Drüsen innerhalb des Myometriums<br />
– Laparoskopie (Bestimmung von Ausmaß, Lokalisation, Aktivitätsgrad)<br />
– bei Befall von Nachbarorganen:<br />
– Therapie:<br />
– Zytoskopie, i.v.-Urographie, Kolonkontrasteinlauf, Koloskopie<br />
– medikamentös:<br />
– Analgetika<br />
– Östrogen-Gestagen-Kombination<br />
– Gestagen-Dauertherapie<br />
– Danazol<br />
– GnRH-Agonisten<br />
– operativ:<br />
– Lösung von Adhäsionen<br />
– Resektion von Herden und Zysten<br />
– Rekonstruktion der Ovarien<br />
– Wiederherstellung der Fertilität