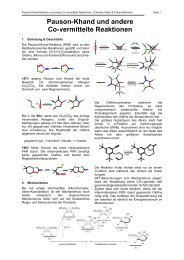
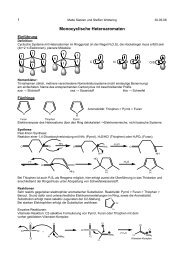
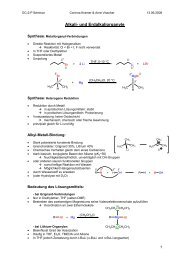
Schutzgruppen in der organischen Chemie
Schutzgruppen in der organischen Chemie
Schutzgruppen in der organischen Chemie
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
David Peter, Sabr<strong>in</strong>a Freye 04.07.2008<br />
<strong>Schutzgruppen</strong> <strong>in</strong> <strong>der</strong> <strong>organischen</strong> <strong>Chemie</strong><br />
Def<strong>in</strong>tion: E<strong>in</strong>e Schutzgruppe macht e<strong>in</strong>e bestimmte funktionelle Gruppe gegenüber Reagenzien und<br />
Bed<strong>in</strong>gungen unreaktiv, durch die sie normalerweise umgewandelt werden würde. Dabei kann an<br />
an<strong>der</strong>er Stelle im Molekül e<strong>in</strong>e Reaktion durchgeführt werden.<br />
Anfor<strong>der</strong>ungen:<br />
a) Leicht e<strong>in</strong>führbar mit bestimmter Selektivität für e<strong>in</strong>e funktionelle Gruppe<br />
b) Müssen nachfolgenden Reaktionsbed<strong>in</strong>gungen, Aufarbeitungs- und Re<strong>in</strong>igungsmethoden<br />
standhalten<br />
c) Leicht abspaltbar und an<strong>der</strong>e Gruppen dabei nicht bee<strong>in</strong>flussen<br />
Am<strong>in</strong>e<br />
a) t-Butyloxycarbonylgruppe (Boc)<br />
wichtigste Schutzgruppe für die Am<strong>in</strong>e<br />
Bildung: basische mit Boc2O, Boc-N3 o<strong>der</strong> Boc-ONH2<br />
O O<br />
O O O<br />
Boc2O + R<br />
R'<br />
N<br />
H<br />
Base<br />
- CO2 ~ H<br />
O<br />
R<br />
O N<br />
R'<br />
+<br />
Stabil gegen: kat. Hydrierung, Reduktion / Oxidation, Basische, nucleophile<br />
Reagenzien<br />
Spaltung: sauer mit Trifluoressigsäure o<strong>der</strong> HBr o<strong>der</strong> Neutral mit TMS-I<br />
O<br />
O<br />
N R<br />
H<br />
H<br />
O<br />
Weiterreaktion:<br />
b) 9-Fluorenylmethoxycarbonyl (Fmoc)<br />
O<br />
N R<br />
H H<br />
Nu<br />
Nu<br />
H<br />
N<br />
H<br />
Bildung: basische mit FmocOSu, Fmoc-Cl o<strong>der</strong> Fmoc-N3<br />
Stabil gegen: Säuren<br />
Spaltung: Stickstoffbasen (z.B. Piperid<strong>in</strong>)<br />
c) Benzyloxycarbonyl (Cbz/Z) (alt: Carbobenzoxy)<br />
Bildung: basisch<br />
Stabil gegen: Basen, Oxidation<br />
Spaltung: Säuren, Hydrierung, Reduktion mit Metallen<br />
Carboxyle<br />
durch Veresterung geschützt<br />
a) t-Butylester<br />
R<br />
+<br />
- H<br />
O<br />
+ CO 2<br />
O<br />
O<br />
O<br />
O<br />
N<br />
H<br />
O<br />
R<br />
OH<br />
O<br />
N<br />
H<br />
N R<br />
H<br />
R
Bildung: sauer mit Schwefelsäure<br />
H R O H<br />
Stabil gegen: Hydraz<strong>in</strong>, Basen, kat. Hydrierung<br />
Spaltung: sauer mit CF3COOH/CH2Cl2 o<strong>der</strong> HBr/Eisessig<br />
b) Benzylester<br />
Alkohole<br />
Bildung: basisch<br />
Stabil gegen: Säuren / Basen (pH 1-10), Oxidation, Reduktion<br />
Spaltung: hydrogenolytisch<br />
R<br />
Alkohole können z.T. aufgrund unterschiedlicher Reaktivität differenziell und somit selektiv geschützt<br />
werden.<br />
OH<br />
R<br />
R<br />
> R OH > OH > R' OH<br />
R'<br />
R''<br />
a) Alkylether<br />
Bildung:<br />
R = Me, Allyl, Benzyl, MOM<br />
X = Cl, Br, I, Dimethylsulfat<br />
Base = NaH/NaOH o<strong>der</strong> Stickstoffbase<br />
Stabil gegen: Basen, Grignardreagenzien, Hydride<br />
b) Silylether<br />
Bildung:<br />
X = Cl, Br, I, OTf<br />
Base = Pyrid<strong>in</strong>, Imidazol<br />
Stabil gegen: katalytische Hydrierung, Oxidationsmittel (z.B. OsO4/CrO3), Hydrolyse,<br />
Hydride, Grignardreagenzien, Base<br />
Spaltung: Basen, Säuren, Fluoridionen<br />
Carbonyle<br />
R'<br />
R''<br />
R OH + X R<br />
R'<br />
R''<br />
R OH + X SiR 3<br />
reagieren mit e<strong>in</strong>er Vielzahl von Reagenzien (Nucleophile, Elektrophile, Oxidation, Reduktion) �<br />
müssen sehr häufig geschützt werden<br />
O<br />
O<br />
O<br />
Base<br />
RT<br />
- H<br />
Stickstoffbase<br />
RT<br />
R'<br />
R<br />
R<br />
R<br />
R'<br />
O<br />
O<br />
R''<br />
O H<br />
O H<br />
O R<br />
R''<br />
R O SiR 3
acyclische Acetale Thioacetale<br />
O<br />
R R'<br />
Spaltung:<br />
MeOH, H<br />
- H2O MeO<br />
R<br />
OMe<br />
R'<br />
O<br />
R R'<br />
Spaltung:<br />
HS<br />
- H2O SH , H<br />
S<br />
R<br />
S<br />
R'<br />
Überschuss Wasser, Säure katalytisch wie O-Acetale, aber auch mit Hg(II)-Salzen<br />
cyclische Acetale<br />
O<br />
R R'<br />
Spaltung:<br />
Wasser & Säure, Aceton & Säure, weitere Spaltungsmöglichkeiten je nach Substitution<br />
Diole<br />
werden durch Carbonylverb<strong>in</strong>dungen geschützt<br />
a) Isopropyliden-Acetale:<br />
schützen bevorzugt 1,2-cis-Diole<br />
Stabil gegen : Basen, Oxidation, Reduktion<br />
Spaltung: hydrolytsch<br />
b) Benzylidenacetale<br />
schützen bevorzugt 1,3-Diole<br />
Spaltung: hydrolytisch, hydrogenolytisch, reduktiv, oxidativ<br />
a)+b) können ke<strong>in</strong>e 1,2-trans-Diole schützen, wegen zu hoher R<strong>in</strong>gspannung<br />
� dafür dann: Cyclohexan-1,2-diacetale (CDA), Dispiroketale (DISPOKE)<br />
C-C-Mehrfachb<strong>in</strong>dungen<br />
a) Alkene<br />
Schutz vor Oxidation und Reduktion durch Dibromierung <strong>der</strong> Doppelb<strong>in</strong>dung<br />
R 1<br />
R 3<br />
R 2<br />
R 4<br />
Br 2<br />
Erhalt <strong>der</strong> Konfiguration<br />
Diels-Al<strong>der</strong><br />
R 1<br />
R 3<br />
R 2 R 4<br />
HO<br />
+<br />
OH , H<br />
H<br />
R2 R1 Br<br />
Diels-Al<strong>der</strong> R1<br />
R 2<br />
Br<br />
R4 R3 R 3<br />
R 4<br />
O O<br />
Zn, HOAc<br />
Retro -<br />
Diels-Al<strong>der</strong><br />
R 1<br />
R 1<br />
R 3<br />
R 3<br />
R 2 R 4<br />
R 2<br />
R 4<br />
+
) Alk<strong>in</strong>e<br />
TMS zum Schutz des aciden Wasserstoffs<br />
Stabil gegen: Hydrierung, Bromierung<br />
Spaltung: hydrolytisch o<strong>der</strong> TBAF o<strong>der</strong> K2CO3/MeOH<br />
Komplexierung <strong>der</strong> Dreifachb<strong>in</strong>dung mit Co2(CO)8<br />
R R'<br />
Co 2(CO) 8<br />
(OC) 3Co Co(CO) 3<br />
Spaltung: milde Oxidation<br />
Aromaten<br />
- 2 CO<br />
R 1<br />
R 3<br />
R 2<br />
X<br />
- X -<br />
R 1<br />
R 3<br />
R 2<br />
(OC) 3Co Co(CO) 3<br />
Bei Synthese ortho-disubstituierter Benzole:<br />
Je nach sterischem Anspruch des Erstsubstituenten hauptsächlich para � Blockierung <strong>der</strong> para-<br />
Position durch leicht defunktionalisierbare (metadirigierende) Gruppen<br />
a) Nitrierung<br />
Defunktionalisierung durch Meerwe<strong>in</strong>-Reduktion<br />
b) Sulfonierung<br />
Defunktionalisierung durch Erhitzen <strong>in</strong> wässriger Säure<br />
Orthogonalitätspr<strong>in</strong>zip<br />
Orthogonale <strong>Schutzgruppen</strong> s<strong>in</strong>d solche, die nur unter ganz unterschiedlichen Reaktionsbed<strong>in</strong>gungen,<br />
die an<strong>der</strong>e <strong>Schutzgruppen</strong> nicht angreifen, abgelöst werden.<br />
� Jede Schutzgruppe kann zu jedem beliebigen Zeitpunkt <strong>der</strong> Reaktion selektiv entfernt werden<br />
Labilitätspr<strong>in</strong>zip<br />
Dabei verwendet man <strong>Schutzgruppen</strong>, die unter gleichen Reaktionsbed<strong>in</strong>gungen abgespalten werden,<br />
aber mit unterschiedlicher Empf<strong>in</strong>dlichkeit.<br />
� Die labilste Schutzgruppe kann selektiv abgespalten werden, ohne dass e<strong>in</strong>e an<strong>der</strong>e Schutzgruppe<br />
dabei angegriffen wird.<br />
� Zu beachten: Die stabilste Schutzgruppe kann nicht selektiv abgespalten werden.<br />
Quellen:<br />
K. P. C. Vollhardt, N. E. Schore, Organische <strong>Chemie</strong>, 4. Auflage, Wiley-VCH, We<strong>in</strong>heim, 2005<br />
Theodora W. Greene, Protective Groups <strong>in</strong> Organic Synthesis, John Wiley & Sons, New York, 1981<br />
H. Beyer, W. Walter, Lehrbuch <strong>der</strong> Organischen <strong>Chemie</strong>, 24. Auflage, Hirzel Verlag, Stuttgart, 2004<br />
R. Brückner, Reaktionsmechanismen, 3. Auflage, Spektrum Akademischer Verlag, 2004<br />
http://www.organic-chemistry.org/protectivegroups/protect<strong>in</strong>ggroups.htm<br />
(Zugriff: 26.06.08)<br />
Szymon Janicki, <strong>Schutzgruppen</strong> <strong>in</strong> <strong>der</strong> Kohlenhydratchemie, 2005<br />
(http://www.oci.uni-hannover.de/AK_Kalesse/OCF-vortraege04WS/24.01.05<br />
_schutzgruppen_korr.pdf) (Zugriff 26.06.08)<br />
Christian Krauss, <strong>Schutzgruppen</strong> <strong>in</strong> <strong>der</strong> <strong>organischen</strong> <strong>Chemie</strong>, 2001<br />
(http://www.fs-chemie.uni-hd.de/archiv/ocf/schutzgruppen.pdf) (Zugriff 26.06.08)<br />
<strong>Schutzgruppen</strong> <strong>in</strong> <strong>der</strong> <strong>organischen</strong> Synthesechemie<br />
(http://www.uni-marburg.de/fb15/studium/praktika/hauptfach/hauptstudium/ofp/synth/<br />
2schutzgruppen.pdf) (Zugriff 26.06.08)