Zellbiologie & Imaging - Laborwelt
Zellbiologie & Imaging - Laborwelt
Zellbiologie & Imaging - Laborwelt
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Wissenschaft Translationale Medizin<br />
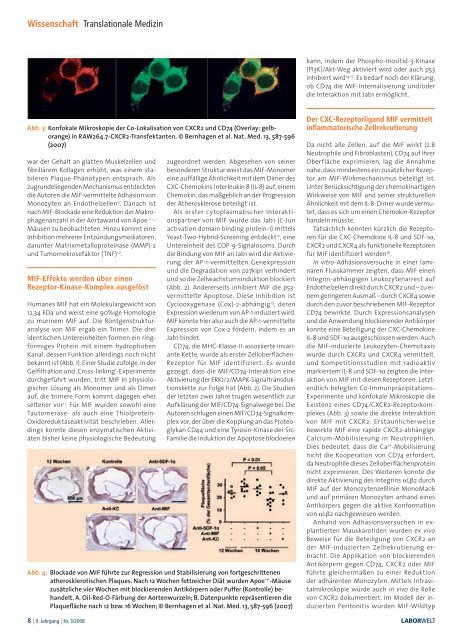
Abb. 3: Konfokale Mikroskopie der Co-Lokalisation von CXCR2 und CD74 (Overlay: gelborange)<br />
in RAW264.7-CXCR2-Transfektanten. © Bernhagen et al. Nat. Med. 13, 587-596<br />
(2007)<br />
war der Gehalt an glatten Muskelzellen und<br />
fibrillärem Kollagen erhöht, was einem stabileren<br />
Plaque-Phänotypen entsprach. Als<br />
zugrundeliegenden Mechanismus entdeckten<br />
die Autoren die MIF-vermittelte Adhäsion von<br />
Monozyten an Endothelzellen 9 . Danach ist<br />
nach MIF-Blockade eine Reduktion der Makrophagenanzahl<br />
in der Aortawand von Apoe –/– -<br />
Mäusen zu beobachteten. Hinzu kommt eine<br />
Inhibition mehrerer Entzündungsmediatoren,<br />
darunter Matrixmetalloproteinase (MMP)-2<br />
und Tumornekrosefaktor (TNF) 10 .<br />
MIF-Effekte werden über einen<br />
Rezeptor-Kinase-Komplex ausgelöst<br />
Humanes MIF hat ein Molekulargewicht von<br />
12,34 kDa und weist eine 90%ige Homologie<br />
zu murinem MIF auf. Die Röntgenstrukturanalyse<br />
von MIF ergab ein Trimer. Die drei<br />
identischen Untereinheiten formen ein ringförmiges<br />
Protein mit einem hydrophoben<br />
Kanal, dessen Funktion allerdings noch nicht<br />
bekannt ist (Abb. 1). Einer Studie zufolge, in der<br />
Gelfiltration und ‚Cross-linking’-Experimente<br />
durchgeführt wurden, tritt MIF in physiologischer<br />
Lösung als Monomer und als Dimer<br />
auf, die trimere Form kommt dagegen eher<br />
seltener vor 11 . Für MIF wurden sowohl eine<br />
Tautomerase- als auch eine Thiolprotein-<br />
Oxidoreduktaseaktivität beschrieben. Allerdings<br />
konnte diesen enzymatischen Aktiviäten<br />
bisher keine physiologische Bedeutung<br />
zugeordnet werden. Abgesehen von seiner<br />
besonderen Struktur weist das MIF-Monomer<br />
eine auffällige Ähnlichkeit mit dem Dimer des<br />
CXC-Chemokins Interleukin 8 (IL-8) auf, einem<br />
Chemokin, das maßgeblich an der Progression<br />
der Atherosklerose beteiligt ist.<br />
Als erster cytoplasmatischer Interaktionspartner<br />
von MIF wurde das Jab1 (C-Jun<br />
activation domain binding protein-1) mittels<br />
Yeast-Two-Hybrid-Screening entdeckt 12 , eine<br />
Untereinheit des COP-9-Signalosoms. Durch<br />
die Bindung von MIF an Jab1 wird die Aktivierung<br />
der AP-1-vermittelten Genexpression<br />
und die Degradation von p27kip1 verhindert<br />
und so die Zellwachstumsinduktion blockiert<br />
(Abb. 2). Andererseits inhibiert MIF die p53vermittelte<br />
Apoptose. Diese Inhibition ist<br />
Cyclooxygenase (Cox)-2-abhängig 13 , deren<br />
Expression wiederum von AP-1 induziert wird.<br />
MIF könnte hier also auch die AP-1-vermittelte<br />
Expression von Cox-2 fördern, indem es an<br />
Jab1 bindet.<br />
CD74, die MHC-Klasse-II-assoziierte invariante<br />
Kette, wurde als erster Zelloberflächen-<br />
Rezeptor für MIF identifiziert. Es wurde<br />
gezeigt, dass die MIF/CD74-Interaktion eine<br />
Aktivierung der ERK1/2/MAPK-Signaltransduktionskette<br />
zur Folge hat (Abb. 2). Die Studien<br />
der letzten zwei Jahre trugen wesentlich zur<br />
Aufklärung der MIF/CD74-Signalwege bei. Die<br />
Autoren schlugen einen MIF/CD74-Signalkomplex<br />
vor, der über die Kopplung an das Proteoglykan<br />
CD44 und eine Tyrosin-Kinase der Src-<br />
Familie die Induktion der Apoptose blockieren<br />
Abb. 4: Blockade von MIF führte zur Regression und Stabilisierung von fortgeschrittenen<br />
atherosklerotischen Plaques. Nach 12 Wochen fettreicher Diät wurden Apoe –|– -Mäuse<br />
zusätzliche vier Wochen mit blockierenden Antikörpern oder Puffer (Kontrolle) behandelt.<br />
A. Oil-Red-O-Färbung der Aortenwurzeln; B. Datenpunkte repräsentieren die<br />
Plaquefläche nach 12 bzw. 16 Wochen; © Bernhagen et al. Nat. Med. 13, 587-596 (2007)<br />
kann, indem der Phospho-Inositid-3-Kinase<br />
(PI3K)/Akt-Weg aktiviert wird oder auch p53<br />
inhibiert wird 14,15 . Es bedarf noch der Klärung,<br />
ob CD74 die MIF-Internalisierung und/oder<br />
die Interaktion mit Jab1 ermöglicht.<br />
Der CXC-Rezeptorligand MIF vermittelt<br />
inflammatorische Zellrekrutierung<br />
Da nicht alle Zellen, auf die MIF wirkt (z.B<br />
Neutrophile und Fibroblasten), CD74 auf ihrer<br />
Oberfläche exprimieren, lag die Annahme<br />
nahe, dass mindestens ein zusätzlicher Rezeptor<br />
am MIF-Wirkmechanismus beteiligt ist.<br />
Unter Berücksichtigung der chemokinartigen<br />
Wirkweise von MIF und seiner strukturellen<br />
Ähnlichkeit mit dem IL-8-Dimer wurde vermutet,<br />
dass es sich um einen Chemokin-Rezeptor<br />
handeln müsste.<br />
Tatsächlich konnten kürzlich die Rezeptoren<br />
für die CXC-Chemokine IL-8 und SDF-1a,<br />
CXCR2 und CXCR4 als funktionelle Rezeptoren<br />
für MIF identifiziert werden 16 .<br />
In vitro-Adhäsionsversuche in einer laminaren<br />
Flusskammer zeigten, dass MIF einen<br />
Integrin-abhängigen Leukozytenarrest auf<br />
Endothelzellen direkt durch CXCR2 und – zu einem<br />
geringeren Ausmaß – durch CXCR4 sowie<br />
durch den zuvor beschriebenen MIF-Rezeptor<br />
CD74 bewirkte. Durch Expressionsanalysen<br />
und die Anwendung blockierender Antikörper<br />
konnte eine Beteiligung der CXC-Chemokine<br />
IL-8 und SDF-1a ausgeschlossen werden. Auch<br />
die MIF-induzierte Leukozyten-Chemotaxis<br />
wurde durch CXCR2 und CXCR4 vermittelt,<br />
und Kompetitionsstudien mit radioaktiv<br />
markiertem IL-8 und SDF-1a zeigten die Interaktion<br />
von MIF mit diesen Rezeptoren. Letztendlich<br />
belegten Co-Immunpräzipitations-<br />
Experimente und konfokale Mikroskopie die<br />
Existenz eines CD74/CXCR2-Rezeptorkomplexes<br />
(Abb. 3) sowie die direkte Interaktion<br />
von MIF mit CXCR2. Erstaunlicherweise<br />
bewirkte MIF eine rapide CXCR2-abhängige<br />
Calcium-Mobilisierung in Neutrophilen.<br />
Dies bedeutet, dass die Ca 2+ -Mobilisierung<br />
nicht die Kooperation von CD74 erfordert,<br />
da Neutrophile dieses Zelloberflächenprotein<br />
nicht exprimieren. Des Weiteren konnte die<br />
direkte Aktivierung des Integrins aLb2 durch<br />
MIF auf der Monozytenzelllinie MonoMac6<br />
und auf primären Monozyten anhand eines<br />
Antikörpers gegen die aktive Konformation<br />
von aLb2 nachgewiesen werden.<br />
Anhand von Adhäsionsversuchen in explantierten<br />
Mauskarotiden wurden ex vivo<br />
Beweise für die Beteiligung von CXCR2 an<br />
der MIF-induzierten Zellrekrutierung erbracht.<br />
Die Applikation von blockierenden<br />
Antikörpern gegen CD74, CXCR2 oder MIF<br />
führte gleichermaßen zu einer Reduktion<br />
der adhärenten Monozyten. Mittels Intravitalmikroskopie<br />
wurde auch in vivo die Rolle<br />
von CXCR2 dokumentiert. Im Modell der induzierten<br />
Peritonitis wurden MIF-Wildtyp<br />
8 | 9. Jahrgang | Nr. 3/2008 LABORWElT