Preview Thiết kế hệ thống bài toán hóa học nhiều cách giải nhằm phát triển tư duy và nâng cao hiệu quả dạy học ở trường trung học phổ thông
https://app.box.com/s/djq0mphw7qqcy5nehpitrzbaa6b2d96k
https://app.box.com/s/djq0mphw7qqcy5nehpitrzbaa6b2d96k
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
76<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho <strong>học</strong> sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Các <strong>cách</strong> <strong>giải</strong>:<br />
Cách 1:<br />
a. Phương trình phản ứng:<br />
0,07<br />
2Al + 2H 2 O + 2NaOH → 2NaAlO 2 + 3 H 2<br />
Theo phương trình: Số mol Al = 2/3. Số mol H 2 = 0,1 (mol).<br />
→ m = 2,7 (gam).<br />
Phương trình hoá <strong>học</strong> của những phản ứng lần lượt xảy ra như sau:<br />
H + + H 2 O + AlO 2 - → Al(OH) 3 (1)<br />
3 H + + Al(OH) 3 → Al 3+ + 3 H 2 O (2)<br />
b. Theo giả thiết: Số mol Al(OH) 3 = 5,46 : 78 = 0,07 (mol)<br />
Trường hợp 1: Chỉ có phản ứng (1) ↔ AlO 2 - dư.<br />
Theo phương trình ta có:<br />
Số mol H + = Số mol Al(OH) 3 = 0,07 (mol).<br />
Số mol AlO 2 - (pư) = Số mol Al(OH) 3 < 0,1 (mol).<br />
Vậy, thể tích dung dịch HCl là: [HCl] =<br />
(lít).<br />
Trường hợp 2: Cả phản ứng (1) <strong>và</strong> (2) đều xảy ra ↔ AlO 2 - hết.<br />
Theo phương trình (1):<br />
Số mol Al(OH) 3 (1) = Số mol AlO 2 - = 0,1 (mol).<br />
→ Số mol Al(OH) 3 (2) = 0,1 - 0,07 = 0,03 (mol).<br />
Theo phương trình (1) <strong>và</strong> (2):<br />
Số mol H + = 0,1 + 3. 0,03 = 0,19 (mol)<br />
Vậy, nồng độ dung dịch HCl là: [HCl] =<br />
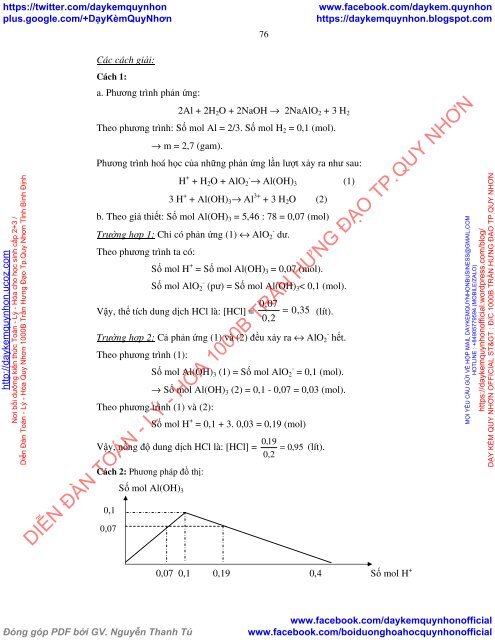
Cách 2: Phương pháp đồ thị:<br />
0,1<br />
Số mol Al(OH) 3<br />
0,07<br />
0,2<br />
= 0,35<br />
0,19<br />
= 0,95<br />
0,2<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
(lít).<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
0,07 0,1 0,19 0,4 Số mol H +<br />
Đóng góp PDF b<strong>ở</strong>i GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial