Linfoma no Hodgkin anaplásico de células T primario cutáneo rico ...
Linfoma no Hodgkin anaplásico de células T primario cutáneo rico ...
Linfoma no Hodgkin anaplásico de células T primario cutáneo rico ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Caso clínico<br />
<strong>Linfoma</strong> <strong>no</strong> <strong>Hodgkin</strong> <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> T <strong>primario</strong> <strong>cutáneo</strong> <strong>rico</strong> en<br />
neutrófilos y eosinófilos. Estudio inmu<strong>no</strong>histoquímico <strong>de</strong> una variante<br />
poco frecuente<br />
Nayeli Martínez Consuegra,* Clemente More<strong>no</strong> Collado,** Carlos Ortiz Hidalgo,* , *** Álvaro Lezid Padilla<br />
Rodríguez * , ***<br />
RESUMEN<br />
Dermatología Rev Mex Volumen 52, Núm. 1, enero-febrero, 2008<br />
Dermatología Rev Mex 2008;52(1):31-37<br />
El linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s (LACG) es un tumor <strong>de</strong> <strong>células</strong> T pleomórficas CD30-positivas. Éste se divi<strong>de</strong>, según la expresión<br />
<strong>de</strong> la proteína quimérica ALK, en tres grupos: LACG sistémico ALK-positivo o ALK-negativo, y LACG <strong>cutáneo</strong> <strong>primario</strong> ALK-negativo.<br />
La clasificación actual establece que el linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s <strong>primario</strong> <strong>cutáneo</strong> se incluye entre las alteraciones<br />
linfoproliferativas cutáneas <strong>de</strong> <strong>células</strong> T CD30+. Se comunica el caso <strong>de</strong> un hombre <strong>de</strong> 54 años <strong>de</strong> edad con una masa <strong>de</strong> 5 cm en el<br />
glúteo <strong>de</strong>recho <strong>de</strong> seis meses <strong>de</strong> evolución y ausencia <strong>de</strong> enfermedad sistémica. Los resultados histopatológicos revelaron infiltración<br />
cutánea difusa <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s T CD3, CD43, CD30-positivas y ALK-negativas. También se observó infiltrado profuso <strong>de</strong> neutrófilos<br />
y eosinófilos mezclado con las <strong>células</strong> neoplásicas. Se estableció el diagnóstico <strong>de</strong> linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s T <strong>primario</strong><br />
<strong>cutáneo</strong> <strong>rico</strong> en neutrófilos y eosinófilos. Los neutrófilos y eosinófilos en ausencia <strong>de</strong> necrosis, la ulceración o infección son hallazgos<br />
raros en los linfomas, y más aún su localización en la piel, pues sólo se han informado 16 casos. Deben i<strong>de</strong>ntificarse dichos hallazgos al<br />
consi<strong>de</strong>rar los diagnósticos diferenciales (procesos neoplásicos o reactivos) que se acompañan <strong>de</strong> infiltrado inflamatorio y que a<strong>de</strong>más<br />
tienen distinto pronóstico y tratamiento.<br />
Palabras clave: linfoma <strong>anaplásico</strong> <strong>cutáneo</strong>, neutrófilos, eosinófilos.<br />
ABSTRACT<br />
Anaplastic large cell lymphoma (LACG) is a T-cell lymphoma of pleomorphic CD30-positive cells. According to the expression of the chimeric<br />
protein ALK, LACG can be divi<strong>de</strong>d into three groups: systemic LACG ALK-positive, systemic LACG ALK-negative, and primary cutaneous<br />
LACG ALK-negative. According to the new WHO/EORTC classification, primary cutaneous LACG is inclu<strong>de</strong>d in the cutaneous T-cell lymphoproliferative<br />
disor<strong>de</strong>rs. We report an infrequent variant of primary cutaneous LACG. A 54-year old man presented with a 5 cm mass in<br />
the skin of his right gluteus, which had been present for six months without systemic involvement. Histological findings revealed a diffuse<br />
<strong>de</strong>rmal infiltration of large CD3, CD43, CD30-positive, ALK-negative T-cells. Mixed with the neoplastic cells, there was a profuse infiltrate<br />
of neutrophils and eosi<strong>no</strong>phils, establishing the diag<strong>no</strong>sis of neutrophil and eosi<strong>no</strong>phil-rich primary cutaneous LACG. The presence of an<br />
increased number of neutrophils and/or eosi<strong>no</strong>phils without necrosis, ulceration or infection is a rare finding in lymphomas, even more<br />
rare is the location in the skin of which only 16 cases have been reported in the literature. It is important to be aware of these findings in<br />
the differential diag<strong>no</strong>sis with other reactive or neoplastic entities that are more often accompanied by mixed inflammatory infiltrate, and<br />
with a different prog<strong>no</strong>sis and treatment.<br />
Key words: anaplastic lymphoma, cutaneous, neutrophils, eosi<strong>no</strong>phils.<br />
* Departamento <strong>de</strong> Patología.<br />
** Departamento <strong>de</strong> Dermatología-Dermatopatología.<br />
The American British Cowdray Medical Center, México, DF.<br />
*** Departamento <strong>de</strong> Biología Celular y Tisular. Universidad Pana-<br />
mericana. Mexico, DF.<br />
Correspon<strong>de</strong>ncia: Dra. Nayeli Martínez Consuegra, Departamento<br />
<strong>de</strong> Patología, Centro Médico ABC. Calle Sur 136 número 116, colonia<br />
Las Américas, México, DF, CP 01120. Tel./fax: (55) 5230-8171.<br />
E-mail: nmartinezc@abchospital.com<br />
Recibido: <strong>no</strong>viembre, 2007. Aceptado: diciembre, 2007.<br />
La versión completa <strong>de</strong> este artículo también está disponible en<br />
internet: www.actualizacionmedica.com.mx<br />
Artemisa<br />
medigraphic en línea<br />
El linfoma <strong>cutáneo</strong> <strong>primario</strong> es una proliferación<br />
neoplásica <strong>de</strong> <strong>células</strong> B o T <strong>de</strong> la<br />
piel, sin evi<strong>de</strong>ncia <strong>de</strong> enfermedad sistémica<br />
al momento <strong>de</strong> establecer el diagnóstico<br />
y por un periodo mayor a seis meses <strong>de</strong>spués <strong>de</strong> la<br />
evaluación clínica completa. 1-3<br />
Debido a las características clínicas y patológicas<br />
particulares, a<strong>de</strong>más <strong>de</strong> las dificulta<strong>de</strong>s diagnósticas<br />
que representan los procesos <strong>cutáneo</strong>s linfoproliferativos,<br />
se han consi<strong>de</strong>rado varias propuestas para<br />
clasificar los linfomas <strong>cutáneo</strong>s <strong>primario</strong>s.<br />
31
Martínez Consuegra N y col.<br />
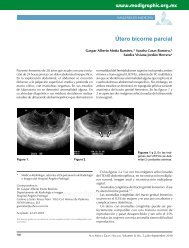
Figura 1. Aspecto macroscópico <strong>de</strong> la lesión <strong>de</strong>l glúteo.<br />
Con el propósito <strong>de</strong> establecer un consenso general<br />
y clasificarlo como una enfermedad clínico-patológica<br />
bien <strong>de</strong>finida, la OMS (2005) y la Organización<br />
Europea para la Investigación y el Tratamiento <strong>de</strong>l<br />
Cáncer (WHO/EORTC) <strong>de</strong>terminaron un sistema <strong>de</strong><br />
clasificación <strong>de</strong> los linfomas <strong>cutáneo</strong>s. 4<br />
En esta clasificación las alteraciones linfoproliferativas<br />
cutáneas primarias <strong>de</strong> <strong>células</strong> T CD30-positivas<br />
incluyen al linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s<br />
<strong>cutáneo</strong> <strong>primario</strong>, la papulosis linfomatoi<strong>de</strong> y los<br />
casos limítrofes. 4,5<br />
El linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s CD 30positivo<br />
(LACG) se <strong>de</strong>scribió por primera vez en<br />
1985 por Stain y colaboradores como una neoplasia<br />
<strong>de</strong> <strong>células</strong> pleomórficas con expresión <strong>de</strong>l marcador<br />
inmu<strong>no</strong>histoquímico CD30, consi<strong>de</strong>rado hasta entonces<br />
exclusivo <strong>de</strong> la enfermedad <strong>de</strong> <strong>Hodgkin</strong>. 6<br />
El reco<strong>no</strong>cimiento <strong>de</strong> la expresión <strong>de</strong> la proteína<br />
quimérica nucleofosmina (NPM)-cinasa <strong>de</strong>l linfoma<br />
<strong>anaplásico</strong> (ALK), asociado con la traslocación (2;5)<br />
(p23; q35) y su producto, inmu<strong>no</strong>histoquímicamente<br />
<strong>de</strong>tectable con anticuerpos p80 NPM/ALK, ALK-1,<br />
o ambos, es <strong>de</strong> gran importancia para establecer el<br />
diagnóstico <strong>de</strong> linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s<br />
(LACG), ya que se codifica en casi 80% <strong>de</strong> los<br />
casos. 7-9 La <strong>de</strong>tección <strong>de</strong> la expresión excesiva <strong>de</strong><br />
esta proteína ha originado tres diferentes grupos <strong>de</strong><br />
linfomas <strong>anaplásico</strong>s <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s: LACG sistémico<br />
<strong>primario</strong> ALK-positivo o negativo y LACG<br />
<strong>cutáneo</strong> <strong>primario</strong>, generalmente ALK-negativo. 10,11<br />
El linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s pue<strong>de</strong><br />
mostrar variantes morfológicas o genéticas aún más<br />
Figura 2. Hallazgos histopatológicos. A: campo <strong>de</strong> bajo po<strong>de</strong>r que<br />
<strong>de</strong>muestra la infiltración cutánea. B: <strong>de</strong>nso infiltrado <strong>de</strong> <strong>células</strong><br />
neoplásicas. C: pleomorfismo celular con núcleos irregulares,<br />
nucléolos prominentes y mitosis atípicas.<br />
32 Dermatología Rev Mex Volumen 52, Núm. 1, enero-febrero, 2008<br />
A<br />
B<br />
C
aras, a<strong>de</strong>más <strong>de</strong> poblaciones celulares distintas al<br />
componente neoplásico original. 12<br />
La coexistencia <strong>de</strong> neutrófilos o eosinófilos, en<br />
ausencia <strong>de</strong> necrosis geográfica, úlceras o infecciones<br />
agregadas, es un hallazgo poco frecuente en los linfomas,<br />
pues se han <strong>de</strong>scrito sólo en 2 a 3% <strong>de</strong> los pacientes, algu<strong>no</strong>s<br />
<strong>de</strong> éstos con SIDA y linfomas <strong>de</strong> <strong>células</strong> T. 10,12-14<br />
En 1995 Mann y colaboradores informaron un caso<br />
<strong>de</strong> linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s CD30-positivo<br />
con una variante morfológica particular rica en<br />
neutrófilos, 15 y en 1997 McCluggage y colaboradores<br />
observaron la coexistencia <strong>de</strong> eosinófilos. 16<br />
Des<strong>de</strong> su <strong>de</strong>scripción original se han informado<br />
pocos casos; sus manifestaciones cutáneas son aún<br />
más inusuales.<br />
Se comunica un caso <strong>de</strong> linfoma <strong>anaplásico</strong> <strong>de</strong><br />
<strong>células</strong> gran<strong>de</strong>s <strong>primario</strong> <strong>cutáneo</strong> <strong>rico</strong> en neutrófilos<br />
y eosinófilos atendido en el Centro Médico ABC <strong>de</strong><br />
la Ciudad <strong>de</strong> México.<br />
INFORME DEL CASO<br />
Hombre <strong>de</strong> 54 años <strong>de</strong> edad con un tumor <strong>de</strong> crecimiento<br />
lento en la piel <strong>de</strong>l glúteo <strong>de</strong>recho <strong>de</strong> seis meses<br />
<strong>de</strong> evolución. Des<strong>de</strong> el punto <strong>de</strong> vista macroscópico<br />
era cupuliforme, con erosión superficial y medía 5 cm<br />
<strong>de</strong> diámetro mayor y 8 mm <strong>de</strong> altura (figura 1). En la<br />
evaluación clínica <strong>no</strong> se <strong>de</strong>mostró alguna enfermedad<br />
sistémica.<br />
El examen histopatológico reveló un infiltrado<br />
<strong>cutáneo</strong> difuso caracterizado por <strong>células</strong> gran<strong>de</strong>s,<br />
A B<br />
Figura 3. <strong>Linfoma</strong> <strong>anaplásico</strong> <strong>rico</strong> en neutrófilos y eosinófilos. A:<br />
infiltración predominante <strong>de</strong> neutrófilos. B: infiltración predominante<br />
<strong>de</strong> eosinófilos.<br />
Dermatología Rev Mex Volumen 52, Núm. 1, enero-febrero, 2008<br />
<strong>Linfoma</strong> <strong>no</strong> <strong>Hodgkin</strong> <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> T <strong>primario</strong> <strong>cutáneo</strong> <strong>rico</strong> en neutrófilos y eosinófilos<br />
A<br />
B<br />
C<br />
Figura 4. Inmu<strong>no</strong>histoquímica. A: CD30, <strong>células</strong> neoplásicas positivas<br />
(recuadro: refuerzo paranuclear); B: CD4; C: CD8.<br />
33
Martínez Consuegra N y col.<br />
pleomórficas con núcleos excént<strong>rico</strong>s en forma <strong>de</strong> riñón<br />
o herradura, con u<strong>no</strong> o más nucléolos prominentes<br />
y escaso citoplasma eosi<strong>no</strong>fílico (<strong>células</strong> patog<strong>no</strong>mónicas).<br />
También se observó epi<strong>de</strong>rmotropismo focal y<br />
alto índice mitótico (figura 2). Las <strong>células</strong> neoplásicas<br />
se extendían al tejido celular sub<strong>cutáneo</strong> y <strong>no</strong> había<br />
formación <strong>de</strong> manguillos perivasculares. Se apreciaba<br />
infiltración profusa <strong>de</strong> neutrófilos y eosinófilos, entremezclado<br />
con las <strong>células</strong> neoplásicas, que se extendían<br />
a la <strong>de</strong>rmis profunda y al tejido celular sub<strong>cutáneo</strong>.<br />
No había necrosis, las <strong>células</strong> inflamatorias estaban<br />
en igual proporción y mostraban un patrón difuso<br />
(figura 3).<br />
Los resultados <strong>de</strong>l examen inmu<strong>no</strong>histoquímico<br />
mostraron <strong>células</strong> neoplásicas positivas para los marcadores<br />
T, CD30 (KI-1), CD3 y CD43. Los marcadores<br />
ALK-1 y CD20 resultaron negativos. La relación entre<br />
<strong>células</strong> CD4+ y CD9+ fue <strong>de</strong> 8:1 (figura 4). Los anticuerpos,<br />
fuentes, diluciones y resultados se resumen<br />
en el cuadro 1.<br />
El diagnóstico basado en la morfología y el examen<br />
inmu<strong>no</strong>histoquímico correspondió a linfoma <strong>no</strong><br />
<strong>Hodgkin</strong> <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> T <strong>primario</strong> <strong>cutáneo</strong><br />
<strong>rico</strong> en neutrófilos y eosinófilos.<br />
El paciente recibió radioterapia local y <strong>no</strong> muestra<br />
evi<strong>de</strong>ncia <strong>de</strong> la enfermedad 14 meses <strong>de</strong>spués <strong>de</strong> haber<br />
establecido el diagnóstico inicial.<br />
DISCUSIÓN<br />
Des<strong>de</strong> la primera <strong>de</strong>scripción <strong>de</strong>l linfoma <strong>anaplásico</strong><br />
<strong>de</strong> <strong>células</strong> gran<strong>de</strong>s CD30+, 6 se han informado<br />
diferentes variantes morfológicas inusuales, como la<br />
Cuadro 1. Anticuerpos utilizados en el estudio<br />
mo<strong>no</strong>mórfica, sarcomatoi<strong>de</strong>a, <strong>de</strong> “<strong>células</strong> en anillo<br />
<strong>de</strong> sello”, <strong>células</strong> pequeñas, <strong>células</strong> claras, linfohistiocítica,<br />
<strong>rico</strong> en <strong>células</strong> gigantes, en neutrófilos y<br />
eosinófilos. 9,11,12,15-21 Es importante reco<strong>no</strong>cer estas<br />
variantes, ya que pue<strong>de</strong>n conducir a errores al establecer<br />
el diagnóstico.<br />
El paciente <strong>de</strong> este estudio representó una <strong>de</strong> las<br />
variantes <strong>de</strong> linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s<br />
poco frecuente y más aún su localización (piel).<br />
En algunas áreas <strong>de</strong>l tumor se enmascararon las<br />
<strong>células</strong> neoplásicas por el infiltrado inflamatorio profuso,<br />
don<strong>de</strong> los neutrófilos y eosinófilos constituyeron<br />
90% <strong>de</strong> las <strong>células</strong> totales en un campo y objetivo <strong>de</strong><br />
alto po<strong>de</strong>r.<br />
En las áreas más evi<strong>de</strong>ntes <strong>de</strong> <strong>células</strong> tumorales<br />
hubo mayor expresión <strong>de</strong> CD30 positivas en la<br />
membrana citoplásmica, con un característico reforzamiento<br />
en forma <strong>de</strong> punto paranuclear. Todas las<br />
<strong>células</strong> neoplásicas fueron positivas para T CD3, cuya<br />
relación fue <strong>de</strong> 8:1 entre las <strong>células</strong> CD4+ y CD8+,<br />
tal como se espera en estos casos. 5 El antíge<strong>no</strong> <strong>de</strong><br />
membrana epitelial tuvo expresión débil y focal en las<br />
<strong>células</strong> neoplásicas, y el ALK-1 fue homogéneamente<br />
negativo. El diagnóstico se estableció con los hallazgos<br />
morfológicos e inmu<strong>no</strong>histoquímicos, a<strong>de</strong>más <strong>de</strong> la<br />
ausencia <strong>de</strong> enfermedad sistémica.<br />
Des<strong>de</strong> la primera <strong>de</strong>scripción <strong>de</strong>l linfoma <strong>anaplásico</strong><br />
<strong>de</strong> <strong>células</strong> gran<strong>de</strong>s <strong>rico</strong> en neutrófilos hasta hoy<br />
se han informado sólo 16 casos (nueve artículos) con<br />
afección cutánea (cuadro 2). 10,14,15,22-27<br />
Sólo 9 <strong>de</strong> los 16 casos <strong>de</strong> linfoma <strong>anaplásico</strong><br />
<strong>de</strong> <strong>células</strong> gran<strong>de</strong>s <strong>rico</strong> en neutrófilos (incluido el<br />
paciente <strong>de</strong> este estudio) se consi<strong>de</strong>raron <strong>primario</strong>s<br />
Anticuerpo Clona Dilución Casa comercial Recuperación Resultados<br />
CD30 Ber-H2 1:200 Cell Marque Trilogy +<br />
CD3 Policlonal 1:500 Dako Trilogy +<br />
CD43 DF-T1 1:50 Dako Trilogy +<br />
CD4 Ab-8(4B12) 1:20 Neo Markers Trilogy +<br />
CD8 C8/144B 1:100 Dako Trilogy +<br />
CD45 2B11-PD7/26 1:100 Cell Marque Declere +<br />
ALK1 ALK-1 1:30 Dako Trilogy -<br />
CD20 L-26 1:400 Dako Declere -<br />
EMA Mc-5 1:50 Bio Genex Trilogy +<br />
CD56 123C3D5 1:50 Cell Marque Trilogy -<br />
34 Dermatología Rev Mex Volumen 52, Núm. 1, enero-febrero, 2008
<strong>cutáneo</strong>s. 14,22,23 U<strong>no</strong> <strong>de</strong> éstos se manifestó, inicialmente,<br />
como <strong>primario</strong> <strong>cutáneo</strong>, pero seis meses <strong>de</strong>spués<br />
tuvo afección <strong>de</strong> un ganglio linfático, por lo que los<br />
autores lo consi<strong>de</strong>raron “limítrofe”. 10<br />
Tres casos fueron positivos para VIH. 14,15 Dos casos<br />
se manifestaron <strong>de</strong>spués <strong>de</strong>l trasplante renal 22 y u<strong>no</strong><br />
tenía antece<strong>de</strong>ntes <strong>de</strong> traumatismo en la región <strong>de</strong>l<br />
linfoma. 25,27 Sólo 2 <strong>de</strong> los 15 casos informados antes<br />
que el nuestro tuvieron infiltración <strong>de</strong> neutrófilos y<br />
eosinófilos, los <strong>de</strong>más <strong>de</strong>mostraron únicamente infiltración<br />
por neutrófilos.<br />
La <strong>de</strong>scripción <strong>de</strong> la <strong>de</strong>nsidad <strong>de</strong> neutrófilos y<br />
eosinófilos varía según el autor. Kato y McCluggage<br />
la <strong>de</strong>scriben en porcentaje, 10,16 mientras Mann y<br />
colaboradores proponen relacionar el porcentaje <strong>de</strong><br />
<strong>células</strong> en un campo con un objetivo <strong>de</strong> alto po<strong>de</strong>r y<br />
Cuadro 2. Número <strong>de</strong> casos informados en la bibliografía<br />
Dermatología Rev Mex Volumen 52, Núm. 1, enero-febrero, 2008<br />
<strong>Linfoma</strong> <strong>no</strong> <strong>Hodgkin</strong> <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> T <strong>primario</strong> <strong>cutáneo</strong> <strong>rico</strong> en neutrófilos y eosinófilos<br />
Autor Sexo Edad Localización anatómica Primario <strong>cutáneo</strong>-sistémico Infiltrado<br />
inflamatorio<br />
predominante<br />
Kato 1 Femeni<strong>no</strong> 47 Brazo izquierdo Cutáneo con diseminación<br />
ganglionar<br />
Observaciones<br />
Neutrófilos Limítrofe<br />
Primario <strong>cutáneo</strong>sistémico<br />
Jhala 14 Masculi<strong>no</strong> 44 Cuero cabelludo Primario <strong>cutáneo</strong> Neutrófilos VIH +<br />
Masculi<strong>no</strong> 41 Cuero cabelludo Primario <strong>cutáneo</strong> Neutrófilos VIH+<br />
Mann15 Femeni<strong>no</strong> 51 Piel, ganglio linfático Ganglionar con extensión<br />
a la piel<br />
Femeni<strong>no</strong> 36 Piel, ganglio linfático Ganglionar con extensión<br />
a la piel<br />
Masculi<strong>no</strong> 48 Piel, músculo ester<strong>no</strong>cleidomastoi<strong>de</strong>o<br />
Piel con extensión al ester<strong>no</strong>cleidomastoi<strong>de</strong>o<br />
Neutrófilos<br />
Neutrófilos<br />
Neutrófilos VIH +<br />
Salama 22 Masculi<strong>no</strong> 59 Pierna <strong>de</strong>recha Primario <strong>cutáneo</strong> Neutrófilos Postrasplante renal<br />
seis años antes<br />
Burg 23 Masculi<strong>no</strong> 60 Mejilla izquierda Primario <strong>cutáneo</strong> Neutrófilos -<br />
Masculi<strong>no</strong> 38 Mejilla <strong>de</strong>recha Primario <strong>cutáneo</strong> Neutrófilos y<br />
eosinófilos<br />
Masculi<strong>no</strong> 42 Nariz Primario <strong>cutáneo</strong> Neutrófilos -<br />
Femeni<strong>no</strong> 35 Nariz Primario <strong>cutáneo</strong> Neutrófilos y<br />
eosinófilos<br />
Simonart 24 Masculi<strong>no</strong> 59 Piel <strong>de</strong> la axila, ganglio<br />
linfático<br />
Sistémico con diseminación<br />
cutánea<br />
Parker 25 ? ? Cráneo Piel con diseminación<br />
craneal<br />
Tamiolakis<br />
27<br />
Femeni<strong>no</strong> 12 Cráneo Piel con diseminación<br />
craneal<br />
Neutrófilos -<br />
Boudova 26 Femeni<strong>no</strong> 57 Frente Primario <strong>cutáneo</strong> Neutrófilos e<br />
histiocitos<br />
Nuestro<br />
caso<br />
una escala <strong>de</strong> cruces: 50% = 4+. 15<br />
Algu<strong>no</strong>s informes relacionan la <strong>de</strong>nsidad <strong>de</strong>l infiltrado<br />
inflamatorio, específicamente en el linfoma<br />
<strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s sistémico, en sitios<br />
extra<strong>no</strong>dales, cuyo comportamiento clínico es más<br />
agresivo; sin embargo, <strong>no</strong> se ha <strong>de</strong>mostrado que dicho<br />
infiltrado se asocie con el <strong>de</strong>senlace clínico <strong>de</strong>l linfoma<br />
<strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s (LACG) <strong>cutáneo</strong>. 15<br />
La patogénesis <strong>de</strong> la neutrofilia en el LACG sigue<br />
siendo confusa. En algu<strong>no</strong>s casos pue<strong>de</strong> inducirse por<br />
irritación o traumatismo dirigido contra la lesión. 10,25<br />
También pue<strong>de</strong> atribuirse a una respuesta inmunitaria<br />
a la neoplasia, o a la producción <strong>de</strong> sustancias<br />
quimiotácticas originadas por las <strong>células</strong> neoplásicas,<br />
e incluso las <strong>células</strong> endoteliales o los macrófagos.<br />
Masculi<strong>no</strong> 54 Glúteo <strong>de</strong>recho Primario <strong>cutáneo</strong> Neutrófilos y<br />
eosinófilos<br />
Neutrófilos Postraumático<br />
Neutrófilos Postraumático<br />
-<br />
-<br />
-<br />
35
Martínez Consuegra N y col.<br />
Por ejemplo, la IL-8 juega un papel importante como<br />
quimioatrayente <strong>de</strong> neutrófilos y se expresa en diversas<br />
<strong>células</strong>, como mo<strong>no</strong>citos-macrófagos, <strong>células</strong> endoteliales,<br />
querati<strong>no</strong>citos y neutrófilos. La producción <strong>de</strong><br />
IL-8 pue<strong>de</strong> estimularse también por otras citocinas,<br />
como la IL-1 y el TNF. 10,15,28-30 La eosi<strong>no</strong>filia pue<strong>de</strong><br />
originarse por respuesta a la producción <strong>de</strong> IL-5 por<br />
las <strong>células</strong> tumorales, ya que induce la eosi<strong>no</strong>filopoyesis.<br />
16,31<br />
El diagnóstico <strong>de</strong> linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong><br />
gran<strong>de</strong>s <strong>primario</strong> <strong>cutáneo</strong> <strong>rico</strong> en neutrófilos y<br />
eosinófilos es difícil <strong>de</strong> establecer, pues las <strong>células</strong><br />
<strong>de</strong>l tumor pue<strong>de</strong>n enmascararse por el infiltrado<br />
inflamatorio profuso. Es importante consi<strong>de</strong>rar<br />
que existen enfermeda<strong>de</strong>s <strong>no</strong> neoplásicas comunes<br />
con elevado infiltrado inflamatorio <strong>de</strong> neutrófilos<br />
y eosinófilos.<br />
Debe realizarse un análisis histopatológico meticuloso,<br />
<strong>de</strong>bido a la relevancia en el pronóstico y<br />
tratamiento <strong>de</strong> diversas lesiones. El diagnóstico diferencial<br />
incluye infiltrados inflamatorios <strong>no</strong> neoplásicos,<br />
como picaduras <strong>de</strong> insecto, hidra<strong>de</strong>nitis supurativa,<br />
úlcera <strong>de</strong> estasis, quiste roto, e infecciones bacterianas,<br />
virales o fúngicas. Estas enfermeda<strong>de</strong>s, a<strong>de</strong>más<br />
<strong>de</strong> producir neutrófilos y eosinófilos, pue<strong>de</strong>n tener<br />
<strong>células</strong> linfoi<strong>de</strong>s <strong>no</strong> neoplásicas a<strong>no</strong>rmales CD30-positivas.<br />
32 Es importante evaluar la expresión <strong>de</strong> <strong>células</strong><br />
CD30, ya que algunas alteraciones cutáneas, distintas<br />
al linfoma <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s, pue<strong>de</strong>n<br />
tener esta expresión (<strong>de</strong>rmatitis atópica, reacciones<br />
medicamentosas, escabiasis y molusco contagioso, u<br />
otras enfermeda<strong>de</strong>s neoplásicas, como el linfoma <strong>de</strong><br />
<strong>Hodgkin</strong> y la papulosis linfomatoi<strong>de</strong>). 33-37<br />
Es importante distinguir un linfoma <strong>anaplásico</strong> <strong>de</strong><br />
<strong>células</strong> gran<strong>de</strong>s <strong>cutáneo</strong> <strong>primario</strong> <strong>de</strong> la diseminación<br />
cutánea <strong>de</strong> u<strong>no</strong> sistémico, pues dichos pa<strong>de</strong>cimientos<br />
tienen distinto mecanismo patogénico: el linfoma <strong>anaplásico</strong><br />
<strong>de</strong> <strong>células</strong> gran<strong>de</strong>s <strong>cutáneo</strong> tiene mejor <strong>de</strong>senlace<br />
clínico y su contraparte sistémica tiene un comportamiento<br />
biológico más agresivo y peor pronóstico. 38<br />
REFERENCIAS<br />
1. Willemze R, Kerl H, Sterry W, Berty E, et al. EORTC classification<br />
for primary cutaneous lymphomas: a proposal<br />
from the cutaneous lymphoma study group of the European<br />
Organization for Research and Treatment of Cancer. Blood<br />
1997;90:354-71.<br />
2. Willemze R. Primary cutaneous lymphomas. Curr Op Oncol<br />
2000;12:419-25.<br />
3. Fink-Puches R, Zenahlik P, Back B, Smolle J, et al. Primary<br />
cutaneous lymphomas: applicability of current classification<br />
schemes (European Organization for Research and Treatment<br />
of Cancer, World Health Organization) based on clinicopathologic<br />
features observed in a large group of patients. Blood<br />
2002;99:800-5.<br />
4. Willemze R, Jaffe ES, Burg G, Cerroni L, et al. WHO-EORTC<br />
classification for cutaneous lymphomas. Blood 2005;105:3768-<br />
85.<br />
5. Liu V, McKee PH. Cutaneous T-cell lymphoproliferative<br />
disor<strong>de</strong>rs: approach for the surgical pathologist: recent advances<br />
and clarification of confused issues. Adv Anat Pathol<br />
2002;9:79-100.<br />
6. Stein H, Mason D, Ger<strong>de</strong>s J, O’Con<strong>no</strong>r N, et al. The expression<br />
of the <strong>Hodgkin</strong>’s disease associated antigen Ki-1 in reactive<br />
and neoplastic lymphoid tissue: evi<strong>de</strong>nce that Reed-Sternberg<br />
cells and histiocytic malignancies are <strong>de</strong>rived from activated<br />
lymphoid cells. Blood 1985;66:848-58.<br />
7. Shiota M, Nakamura S, Ichi<strong>no</strong>hasama R, Abe M, et al.<br />
Anaplastic large cell lymphoma expressing the <strong>no</strong>vel chimeric<br />
protein p80NPM/ALK: a distinct clinicopathologic entity. Blood<br />
1995;86:1954-60.<br />
8. Nakamura S, Shiota M, Nakagawa A, Yabate M, et al. Anaplastic<br />
large cell lymphoma: a distinct molecular pathologic<br />
entity: a reappraisal with special reference to p80 (NPM/ALK)<br />
expression. Am J Surg Path 1997;21:1420-32.<br />
9. Pulford K, Lamant L, Morris SW, Butler LH, et al. Detection<br />
of anaplastic lymphoma kinase (ALK) and nucleolar protein<br />
nucleophosmin (NPM)-ALK proteins in <strong>no</strong>rmal and neoplastic<br />
cells with <strong>de</strong> mo<strong>no</strong>clonal antibody ALK1. Blood 1997;89:1394-<br />
404.<br />
10. Kato N, Mizu<strong>no</strong> O, Ito K, Kimura K, Shibata M. Neutrophil-rich<br />
anaplastic large cell lymphoma presenting in the skin. Am J<br />
Dermatopathol 2003;25:142-7.<br />
11. Stein H, Foss HD, Durkop H, Marafioti T, et al. CD30+ anaplastic<br />
large cell lymphoma: a review of its histopathology,<br />
genetics and clinical features. Blood 2000;96:3681-95.<br />
12. Kadin ME. Anaplastic large cell lymphoma and its morphological<br />
variants. Cancer Surv 1997;30:77-78.<br />
13. Kaplan LD, Abrams DI, Feigal E, McGrath M, et al. AIDS-associated<br />
<strong>no</strong>n-<strong>Hodgkin</strong>’s lymphoma in San Francisco. JAMA<br />
1989;261:719-24.<br />
14. Jhala DN, Me<strong>de</strong>iros LJ, López-Terrada D, Jhala NC, et al.<br />
Neutrophil-rich anaplastic large cell lymphoma of T-cell lineage.<br />
A report of two cases arising in HIV-positive patients. Am J Clin<br />
Pathol 2000;114:478-82.<br />
15. Mann KP, Hall B, Kami<strong>no</strong> H, Borowitz MJ, Ratech H. Neutrophil<br />
rich Ki-1 positive anaplastic large-cell malignant lymphoma.<br />
Am J Surg Pathol 1995;19:407-16.<br />
16. McCluggage WG, Walsh MY, Bharucha H. Anaplastic large cell<br />
malignant lymphoma with extensive eosi<strong>no</strong>philic or neutrophilic<br />
infiltration. Histopathology 1998;32:110-5.<br />
17. Kinney MC, Collins RD, Greer JP, Whitlock JA, et al. A small cell<br />
predominant variant of primary Ki-1 (CD30)+ T-cell lymphoma.<br />
Am J Surg Pathol 1993;17:859-68.<br />
18. Chan JKC, Buchanan R, Fletcher CDM. Sarcomatoid variant<br />
36 Dermatología Rev Mex Volumen 52, Núm. 1, enero-febrero, 2008
of anaplastic large cell Ki-1 lymphoma. Am J Surg Pathol<br />
1990;14:983-8.<br />
19. Pileri S, Falini B, Delsol G, Stein H, et al. Lymphohistiocytic<br />
T-cell lymphoma (anaplastic large cell lymphoma CD30+/Ki-<br />
1+ with a high content of reactive histocytes). Histopathology<br />
1990;16:383-91.<br />
20. Reis JS, Wal R, De Me<strong>de</strong>iros C, Bpiernagi LF. Neutrophil-rich<br />
anaplastic large cell lymphoma. Am J Clin Pathol<br />
2001;116:613-8.<br />
21. Cortés AD, More<strong>no</strong> JS, Falcón ER, Coronado H y col. <strong>Linfoma</strong><br />
<strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> gran<strong>de</strong>s CD30 positivo <strong>rico</strong> en neutrófilos.<br />
Estudio por inmu<strong>no</strong>histoquímica en dos niños. Acta Pediatr<br />
Mex 2000;21:204-9.<br />
22. Salama S. Primary “cutaneous” T-cell anaplastic large cell<br />
lymphoma, CD30+, neutrophil-rich variant with subcutaneous<br />
panniculitic lesions, in a post-renal transplant patient: report<br />
of unusual case and literature review. Am J Dermatopathol<br />
2005;27:217-23.<br />
23. Burg G, Kempf W, Kazakov DV, Dummer R, et al. Pyogenic<br />
lymphoma of the skin: a peculiar variant of primary cutaneous<br />
neutrophil-rich CD30+ anaplastic large-cell lymphoma. Clinicopathological<br />
study of four cases and review of the literature.<br />
Br J Dermatol 2003;148:580-6.<br />
24. Simonart T, Kentos A, Re<strong>no</strong>irte C, Vereecken P, et al. Cutaneous<br />
involvement by neutrophil-rich, CD30-positive anaplastic<br />
large cell lymphoma mimicking <strong>de</strong>ep pustules. Am J Surg<br />
Pathol 1999;23:244-6.<br />
25. Parker JR, Lopez-Terrada D, Gresik MV, Vogel H, et al. Neutrophil-rich<br />
anaplastic large cell lymphoma of the skull presenting<br />
after head trauma. Pediatr Develop Pathol 2001;4:397-401.<br />
26. Boudova L, Kazakov DV, Jindra P, et al. Primary cutaneous<br />
histiocyte and neutrophil-rich CD30+ and CD56+ anaplastic<br />
large-cell lymphoma with prominent angioinvasion and nerve<br />
involvement in the forehead and scalp of an immu<strong>no</strong>competent<br />
woman. J Cutan Pathol 2006;33:584-9.<br />
27. Tamiolakis D, Papadopolus N, Venizelos J, Kakagia D, et al.<br />
ALK-positive neutrophil-rich variant of anaplastic large cell lymphoma<br />
diag<strong>no</strong>sed after head trauma. Onkologie 2005;28:356-<br />
8.<br />
Páginas <strong>de</strong> la Sociedad Mexicana <strong>de</strong> Dermatología, A.C.<br />
www.promedicum.org (para la comunidad médica)<br />
www.medinet.net.mx (sólo para socios y se requiere registro sin costo)<br />
Dermatología Rev Mex Volumen 52, Núm. 1, enero-febrero, 2008<br />
<strong>Linfoma</strong> <strong>no</strong> <strong>Hodgkin</strong> <strong>anaplásico</strong> <strong>de</strong> <strong>células</strong> T <strong>primario</strong> <strong>cutáneo</strong> <strong>rico</strong> en neutrófilos y eosinófilos<br />
28. Hsu S, Waldron J, Hsu P, Hough AJ. Cytokines in malignant<br />
lymphomas: review and prospective evaluation. Hum Pathol<br />
1993;24:1040-57.<br />
29. Larsen CG, An<strong>de</strong>rson AO, Oppenheim JJ, Matsushima K.<br />
Production of interleukin-8 by human <strong>de</strong>rmal fibroblasts and<br />
kerati<strong>no</strong>cytes in response to interleukin-1 or tumor necrosis<br />
factor. Immu<strong>no</strong>logy 1989;68:31-36.<br />
30. Streiter R, Kasahara K, Allen RM, Standiford TJ, et al. Cytokine-induced<br />
neutrophil-<strong>de</strong>rived interleukin-8. Am J Pathol<br />
1992;141:397-407.<br />
31. Takimoto Y, Tanaka H, Tanabe O, Kuramoto A, et al. Anaplastic<br />
large-cell lymphoma (Ki-1 lymphoma) with expression<br />
of IL-5 mRNA and eosi<strong>no</strong>philic invasion. Acta Haematol<br />
1996;96:245-8.<br />
32. Cepeda LT, Pieretti M, Chapman SF, Horestein MG. CD-30<br />
positive atypical lymphoid cells in common <strong>no</strong>n-neoplastic<br />
cutaneous infiltrates rich in neutrophils and eosi<strong>no</strong>phils. Am J<br />
Surg Pathol 2003;27:912-8.<br />
33. Piletta PA, Wirth S, Hommel L, Saurat JH, Hauser C. Circulating<br />
skin-homing T cells in atopic <strong>de</strong>rmatitis: selective upregulation<br />
of HLA-DR, interleukin-2R, and CD30 and <strong>de</strong>crease<br />
after combined UV-A and UV-B phototherapy. Arch Dermatol<br />
1996;132:1171-6.<br />
34. Saeed SA, Bazza M, Zaman M, Ryatt KS. Cefuroxime induced<br />
lymphomatoid hypersensitivity reaction. Postgrad Med J<br />
2000;76:577-9.<br />
35. McCalmont TH, LeBoit PE. A lymphomatoid papule, but <strong>no</strong>t<br />
lymphomatoid papulosis! Am J Dermatopathol 2000;22:188-<br />
90.<br />
36. Guitart J, Hurt MA. Pleomorphic T-cell infiltrate associated with<br />
molluscum contagiosum. Am J Dermatopathol 1999;21:178-<br />
80.<br />
37. Kadin M, Nasu K, Sako D, Said J, Von<strong>de</strong>rheid E. Lymphomatoid<br />
papulosis: a cutaneous proliferation of activated helper T<br />
cells expressing <strong>Hodgkin</strong>’s disease-associated antigens. Am<br />
J Pathol 1985;119:315-25.<br />
38. Kadin ME, Carpenter C. Systemic and primary cutaneous<br />
anaplastic large cell lymphomas. Semin Hematol 2003;40:244-<br />
56.<br />
37