Ejercicios de repaso de formulación 1
Ejercicios de repaso de formulación 1
Ejercicios de repaso de formulación 1
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Curso 2008/2009: <strong>Ejercicios</strong> <strong>de</strong> <strong>repaso</strong> <strong>de</strong> <strong>formulación</strong> 1<br />
FORMULACIÓN FÍSICA – QUÍMICA 1º DE BACHILLERATO<br />
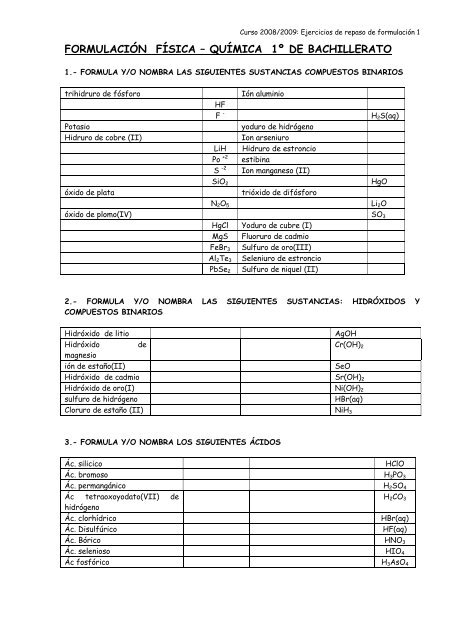
1.- FORMULA Y/O NOMBRA LAS SIGUIENTES SUSTANCIAS COMPUESTOS BINARIOS<br />
trihidruro <strong>de</strong> fósforo Ión aluminio<br />
HF<br />
F - H2S(aq)<br />
Potasio yoduro <strong>de</strong> hidrógeno<br />
Hidruro <strong>de</strong> cobre (II) Ion arseniuro<br />
LiH Hidruro <strong>de</strong> estroncio<br />
Po +2 estibina<br />
S -2 Ion manganeso (II)<br />
SiO2 HgO<br />
óxido <strong>de</strong> plata trióxido <strong>de</strong> difósforo<br />
N2O5 Li2O<br />
óxido <strong>de</strong> plomo(IV) SO3<br />
HgCl Yoduro <strong>de</strong> cubre (I)<br />
MgS Fluoruro <strong>de</strong> cadmio<br />
FeBr3 Sulfuro <strong>de</strong> oro(III)<br />
Al2Te3 Seleniuro <strong>de</strong> estroncio<br />
PbSe2 Sulfuro <strong>de</strong> niquel (II)<br />
2.- FORMULA Y/O NOMBRA LAS SIGUIENTES SUSTANCIAS: HIDRÓXIDOS Y<br />
COMPUESTOS BINARIOS<br />
Hidróxido <strong>de</strong> litio AgOH<br />
Hidróxido<br />
magnesio<br />
<strong>de</strong><br />
Cr(OH)2<br />
ión <strong>de</strong> estaño(II) SeO<br />
Hidróxido <strong>de</strong> cadmio Sr(OH)2<br />
Hidróxido <strong>de</strong> oro(I) Ni(OH)2<br />
sulfuro <strong>de</strong> hidrógeno HBr(aq)<br />
Cloruro <strong>de</strong> estaño (II) NiH3<br />
3.- FORMULA Y/O NOMBRA LOS SIGUIENTES ÁCIDOS<br />
Ác. silicico HClO<br />
Ác. bromoso H3PO3<br />
Ác. permangánico H2SO4<br />
Ác tetraoxoyodato(VII) <strong>de</strong><br />
H2CO3<br />
hidrógeno<br />
Ác. clorhídrico HBr(aq)<br />
Ác. Disulfúrico HF(aq)<br />
Ác. Bórico HNO3<br />
Ác. selenioso HIO4<br />
Ác fosfórico H3AsO4
4.- FORMULA LOS SIGUIENTES OXOANIONES<br />
Ion Trioxonitrato (V)<br />
Ion clorito<br />
Ion fosfito<br />
Ion tetraoxofosfato(V)<br />
Ion hipobromito<br />
Ion tetraoxocromato(VI)<br />
Ion nitrito<br />
Ion sulfito<br />
Ion dioxoclorato (III)<br />
Curso 2008/2009: <strong>Ejercicios</strong> <strong>de</strong> <strong>repaso</strong> <strong>de</strong> <strong>formulación</strong> 2<br />
5.- FORMULA LOS SIGUIENTES SALES BINARIAS Y TERNARIAS<br />
Recuerda:<br />
las sales ternarias (ITO;ATO) <strong>de</strong>bes formularlas por partes: Anión, catión , sal<br />
Las sales binarias (URO) pue<strong>de</strong>s formularlas directamente o utilizar el mismo proceso<br />
Trioxonitrato (V) <strong>de</strong><br />
bario<br />
Hipobromito <strong>de</strong> calcio<br />
Sulfuro <strong>de</strong> potasio<br />
tetraoxofosfato(V) <strong>de</strong><br />
cadmio<br />
Clorito <strong>de</strong> berilio<br />
Bromuro <strong>de</strong> hierro (II)<br />
Bromato <strong>de</strong> hierro (II)<br />
Fosfito <strong>de</strong> aluminio<br />
tetraoxocromato(VI) <strong>de</strong><br />
potasio<br />
Nitrito <strong>de</strong> zinc<br />
Fluoruro <strong>de</strong> niquel (II)<br />
Sulfito <strong>de</strong> sodio<br />
dioxoclorato (III) <strong>de</strong><br />
bario<br />
Oxobromato(I) <strong>de</strong> litio<br />
Nitrato <strong>de</strong> plomo (II)<br />
Nitruro <strong>de</strong> plomo (II)<br />
Tetraoxoseleniato(VI)<br />
bario<br />
Selenito <strong>de</strong> oro (III)<br />
Sulfato <strong>de</strong> aluminio<br />
Perbromato <strong>de</strong> rubidio<br />
<strong>de</strong><br />
Ioduro <strong>de</strong> cobalto (II)<br />
Hipoiodito<br />
(II)<br />
<strong>de</strong> cobalto<br />
Dicromato <strong>de</strong> estroncio<br />
ANION CATION SAL
Soluciones<br />
Curso 2008/2009: <strong>Ejercicios</strong> <strong>de</strong> <strong>repaso</strong> <strong>de</strong> <strong>formulación</strong> 3<br />
1.- FORMULA Y/0 NOMBRA LAS SIGUIENTES SUSTANCIAS: COMPUESTOS BINARIOS.<br />
soluciones<br />
trihidruro <strong>de</strong> fósforo PH3 Ión aluminio Al 3+<br />
fluoruro <strong>de</strong> hidrógeno HF<br />
Ion fluoruro F - Ácido sulfhídrico H2S(aq)<br />
Potasio K yoduro <strong>de</strong> hidrógeno HI<br />
Hidruro <strong>de</strong> cobre (II) Ion arseniuro As 3-<br />
hidruro <strong>de</strong> litio LiH Hidruro <strong>de</strong> estroncio SrH2<br />
ión <strong>de</strong> polonio (II) Po +2 estibina SbH3<br />
Ión sulfuro S -2 Ion manganeso (II) Mn 2+<br />
óxido <strong>de</strong> silicio(IV) o dióxido <strong>de</strong><br />
silicio<br />
SiO2<br />
Óxido <strong>de</strong> mercurio(II) o monóxido<br />
<strong>de</strong> mercurio<br />
óxido <strong>de</strong> plata Ag2O trióxido <strong>de</strong> difósforo P2O3<br />
óxido <strong>de</strong> nitógeno(V) o pentaóxido <strong>de</strong><br />
dinitrógeno<br />
N2O5 óxido <strong>de</strong> litio Li2O<br />
óxido <strong>de</strong> plomo(IV) PbO2 óxido <strong>de</strong> azufre(VI) o trióxido <strong>de</strong><br />
azufre<br />
SO3<br />
Cloruro <strong>de</strong> mercurio(I) o mono<br />
cloruro <strong>de</strong> mercurio<br />
HgCl Yoduro <strong>de</strong> cubre (I) CuI<br />
Sulfuro <strong>de</strong> magnesio MgS Fluoruro <strong>de</strong> cadmio CdF2<br />
Bromuro <strong>de</strong> hierro(III) o FeBr3 Sulfuro <strong>de</strong> oro(III) Au2S3<br />
tribromuro <strong>de</strong> hierro<br />
Telururo a<strong>de</strong> aluminio o tritelururo<br />
<strong>de</strong> dialuminio<br />
Al2Te3 Seleniuro <strong>de</strong> estroncio SrSe<br />
Seleniuro <strong>de</strong> plomo(IV) o diseleniuro<br />
<strong>de</strong> plomo<br />
PbSe2 Sulfuro <strong>de</strong> niquel (II) NiS<br />
2.- FORMULA Y/0 NOMBRA LAS SIGUIENTES SUSTANCIAS: HIDRÓXIDOS Y<br />
COMPUESTOS BINARIOS.(SOLUCIONES)<br />
Hidróxido <strong>de</strong> litio LiOH Hidróxido <strong>de</strong> plata AgOH<br />
Hidróxido <strong>de</strong><br />
magnesio<br />
Mg(OH)2<br />
Hidróxido <strong>de</strong> cromo (II) o<br />
dihidróxido <strong>de</strong> cromo<br />
Cr(OH)2<br />
ión <strong>de</strong> estaño(II) Sn 2+ Monóxido <strong>de</strong> selenio o óxido <strong>de</strong><br />
selenio (II)<br />
SeO<br />
Hidróxido <strong>de</strong> cadmio Cd(OH)2 Hidróxido <strong>de</strong> estroncio Sr(OH)2<br />
Hidróxido <strong>de</strong> oro(I) AuOH Hidróxido <strong>de</strong> níquel (II) o<br />
dihidróxido <strong>de</strong> níquel<br />
Ni(OH)2<br />
sulfuro <strong>de</strong> hidrógeno H2S Ácido bromihídrico HBr(aq)<br />
Cloruro <strong>de</strong> estaño<br />
(II)<br />
SnCl2<br />
Trihidruro <strong>de</strong> niquel o hidruro<br />
<strong>de</strong> niquel (III)<br />
NiH3<br />
HgO
3.- FORMULA Y/O NOMBRA LOS SIGUIENTES ÁCIDOS<br />
Curso 2008/2009: <strong>Ejercicios</strong> <strong>de</strong> <strong>repaso</strong> <strong>de</strong> <strong>formulación</strong> 4<br />
Ác. Silícico (Si excepción) H4SiO4 Monooxoclorato(I) <strong>de</strong> hidrógeno o ác.<br />
Hipocloroso<br />
Ác. bromoso HBrO2 Trioxofosfato(III) <strong>de</strong> hidrógeno o<br />
ác. Fosforoso<br />
Ác. permangánico HMnO4 Tetraoxosulfato (VII) <strong>de</strong> hidrógeno<br />
o ácido sulfúrico<br />
Ác tetraoxoyodato(VII) <strong>de</strong><br />
hidrógeno<br />
HIO4<br />
Trioxocarbonato (IV) <strong>de</strong> hidrógeno o<br />
ácido carbónico<br />
HClO<br />
H3PO3<br />
H2SO4<br />
H2CO3<br />
Ác. clorhídrico HCl(aq) Ác. Bromihídrico HBr(aq)<br />
Ác. Disulfúrico H2S2O7 Ác. Fluorhídrico HF(aq)<br />
Ác. Bórico (B excepción) H3BO3 Trioxnitrato (V) <strong>de</strong> hidrógeno o ác<br />
nítrico<br />
HNO3<br />
Ác. selenioso H2SeO3 Tetraoxoiodato (VII) <strong>de</strong> hidrógeno<br />
ác. periódico<br />
HIO4<br />
Ác fosfórico (P excepción) H3PO4 Tetraoxoarseniato(V) <strong>de</strong> hidrógeno o<br />
ác. arsénico<br />
H3AsO4<br />
4.- FORMULA LOS SIGUIENTES OXOANIONES<br />
Ion Trioxonitrato (V) NO3 -<br />
Ion clorito ClO2 -<br />
Ion fosfito H3PO3--- PO3 3-<br />
Ion tetraoxofosfato(V) PO4 3-<br />
Ion hipobromito HBrO BrO -<br />
Ion tetraoxocromato(VI) CrO4 2-<br />
Ion nitrito HNO2 NO2 -<br />
Ion sulfito H2SO3 SO3 2-<br />
Ion dioxoclorato (III) ClO2 -<br />
5.- FORMULA LOS SIGUIENTES SALES BINARIAS Y TERNARIAS<br />
ANION CATION SAL<br />
Trioxonitrato (V) <strong>de</strong> bario NO3 - Ba 2+<br />
Ba(NO3)2<br />
Hipobromito <strong>de</strong> calcio HBrOBrO - Ca 2+<br />
Ca(BrO)2<br />
Sulfuro <strong>de</strong> potasio S 2-<br />
K +<br />
K2S<br />
tetraoxofosfato(V) <strong>de</strong> cadmio PO4 3- Cd 2+<br />
Cd3(PO4)2<br />
Clorito <strong>de</strong> berilio ClO2 - Be 2+<br />
Be(ClO2)2<br />
Bromuro <strong>de</strong> hierro (II) Br -<br />
Fe 2+<br />
FeBr2<br />
Bromato <strong>de</strong> hierro (II) HBrO3 BrO3 - Fe 2+ Fe(BrO3)2<br />
Fosfito <strong>de</strong> aluminio PO3 3- Al 3+ Al PO3<br />
tetraoxocromato(VI) <strong>de</strong> potasio CrO4 2- K + K2 CrO4<br />
Nitrito <strong>de</strong> zinc HNO2 NO2 - Zn 2+<br />
Zn(NO2)2<br />
Fluoruro <strong>de</strong> niquel (II) F - Ni 2+ NiF2<br />
Sulfito <strong>de</strong> sodio H2SO3 SO3 2-<br />
Na +<br />
Na2 SO3<br />
dioxoclorato (III) <strong>de</strong> bario ClO2 - Ba 2+ Ba(ClO2)2<br />
Oxobromato(I) <strong>de</strong> litio BrO - Li + LiBrO<br />
Nitrato <strong>de</strong> plomo (II) HNO3 NO3 - Pb 2+ Pb(NO3)21<br />
Nitruro <strong>de</strong> plomo (II) N 3- Pb 2+ Pb3N2<br />
Tetraoxoseleniato(VI) <strong>de</strong> bario SeO4 2-<br />
Ba 2+ BaSeO4<br />
Selenito <strong>de</strong> oro (III) H2SeO3 SeO3 2- Au 3+<br />
Au2(SeO3)3
Curso 2008/2009: <strong>Ejercicios</strong> <strong>de</strong> <strong>repaso</strong> <strong>de</strong> <strong>formulación</strong> 5<br />
Sulfato <strong>de</strong> aluminio H2SeO4 SeO4 2- Al 3+ Al2(SeO4)3<br />
Perbromato <strong>de</strong> rubidio HBrO4 BrO4 - Rb +<br />
RbBrO4<br />
Ioduro <strong>de</strong> cobalto (II) I -1<br />
Co 2`+<br />
CoI2<br />
Hipoiodito <strong>de</strong> cobalto (II) HIO IO -<br />
Co 2`+ Co(IO)2<br />
Dicromato <strong>de</strong> estroncio H2Cr2O7 Cr2O7 2-<br />
Sr 2+<br />
SrCr2O7