- Page 1 and 2: INTRODUCCION A LA TERMODINAMICA CON
- Page 3 and 4: CONTENIDOS Contenidos i PREFACIO xi
- Page 5 and 6: Contenidos iii 3.8.4 Calores espec
- Page 7 and 8: Contenidos v 6.6.2 Estimación de e
- Page 9 and 10: Contenidos vii 9.7.3 Temperatura te
- Page 11 and 12: Contenidos ix 13.2.1 Ecuación de D
- Page 13 and 14: Contenidos xi 18.3.3.2 Intercambiad
- Page 15 and 16: PREFACIO Prefacio i Esta es la prim
- Page 17 and 18: Prefacio iii Primera edición Esta
- Page 19 and 20: Conceptos Fundamentales 2 námica t
- Page 21 and 22: Conceptos Fundamentales 4 1.1.3 Tem
- Page 23 and 24: Conceptos Fundamentales 6 T t + 273
- Page 25 and 26: BTU BTU Kcal cal , , , Lb ºF Lb º
- Page 27 and 28: Conceptos Fundamentales 10 El calor
- Page 29 and 30: ⎛ ∂x ⎞ 1 ⎜ ⎟ = ⎝ ∂y
- Page 31 and 32: ⎛ ∂x ⎞ ⎛ ∂y ⎞ ⎛ ∂z
- Page 33 and 34: Conceptos Fundamentales 16 a volume
- Page 35 and 36: Conceptos Fundamentales 18 De ordin
- Page 37 and 38: Kg m 2 Ec Kg m f (unidades usuales)
- Page 39 and 40: Conceptos Fundamentales 22 1.6.2 M
- Page 41 and 42: Conceptos Fundamentales 24 Esta est
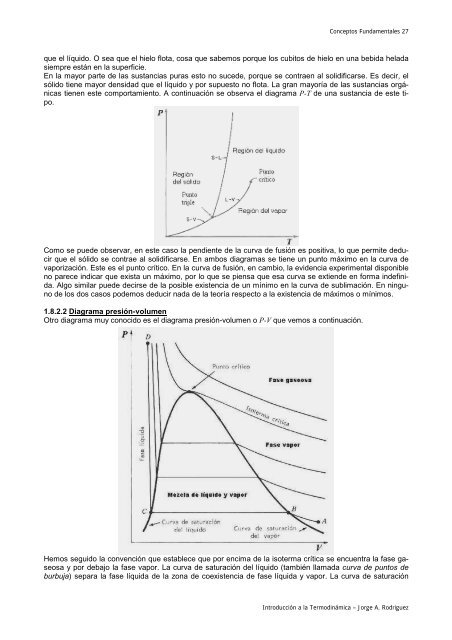
- Page 43: Conceptos Fundamentales 26 Supongam
- Page 47 and 48: Conceptos Fundamentales 30 1.8.2.4
- Page 49 and 50: Conceptos Fundamentales 32 1.8.3.2
- Page 51 and 52: Conceptos Fundamentales 34 En el pr
- Page 53 and 54: Conceptos Fundamentales 36 La mayor
- Page 55 and 56: Conceptos Fundamentales 38 1.10.1 B
- Page 57 and 58: Conceptos Fundamentales 40 El croqu
- Page 59 and 60: • “Calor y Termodinámica” -
- Page 61 and 62: P v′ R′ = T Sea × ( m = masa)
- Page 63 and 64: Propiedades P-V-T 46 La siguiente t
- Page 65 and 66: Propiedades P-V-T 48 El primer sect
- Page 67 and 68: Propiedades P-V-T 50 600 40 T r = =
- Page 69 and 70: Ejemplo 2.4 Cálculo del factor de
- Page 71 and 72: Z 0 y Z 1 son ambos función de Pr
- Page 73 and 74: Propiedades P-V-T 56 A continuació
- Page 75 and 76: Propiedades P-V-T 58 Ejemplo 2.6 C
- Page 77 and 78: a ⎞ ⎜ P ⎟ ′ ⎝ V ⎠ ( V
- Page 79 and 80: Propiedades P-V-T 62 Considerada de
- Page 81 and 82: Propiedades P-V-T 64 ⎡ 9 P ⎤⎡
- Page 83 and 84: PrV sr 1× Vsr Z c + b − a 2 Z c
- Page 85 and 86: Propiedades P-V-T 68 Pero debido a
- Page 87 and 88: Propiedades P-V-T 70 lados de líqu
- Page 89 and 90: Propiedades P-V-T 72 Volumen de vap
- Page 91 and 92: Propiedades P-V-T 74 h2) Ecuación
- Page 93 and 94: Propiedades P-V-T 76 En general est
- Page 95 and 96:
Propiedades P-V-T 78 nes cúbicas,
- Page 97 and 98:
Propiedades P-V-T 80 j2) Ecuación
- Page 99 and 100:
Propiedades P-V-T 82 Fallas La ecua
- Page 101 and 102:
1.0467 0.5783 A = 0.31506 − − T
- Page 103 and 104:
⎛ ω ⎞ Z = Z() 0 + ⎜ ⎟( Z(
- Page 105 and 106:
Propiedades P-V-T 88 Fallas La ecua
- Page 107 and 108:
La forma de la ecuación de Elliott
- Page 109 and 110:
Propiedades P-V-T 92 2.2.3 Propieda
- Page 111 and 112:
Propiedades P-V-T 94 Consultar en e
- Page 113 and 114:
Ejemplo 2.12 Cálculo de la densida
- Page 115 and 116:
Nótese que: ni Pi V PV xi = ni = y
- Page 117 and 118:
C ∑= i 1 C C C C m ′ i hi H = m
- Page 119 and 120:
c) N = n x N2 CO2 n = N N2 + = d) D
- Page 121 and 122:
Propiedades P-V-T 104 Las ecuacione
- Page 123 and 124:
P (ata) 13.609 27.218 40.827 54.436
- Page 125 and 126:
0. 08205 × 305. 4 a = 0. 42748 0.
- Page 127 and 128:
B1 12 0. 172 = 0. 139 − = 0.08118
- Page 129 and 130:
C C Tc m = ∑∑φi φ j Tcij Tcij
- Page 131 and 132:
CAPITULO 3 Primer Principio de la T
- Page 133 and 134:
Primer Principio de la Termodinámi
- Page 135 and 136:
Primer Principio de la Termodinámi
- Page 137 and 138:
Primer Principio de la Termodinámi
- Page 139 and 140:
Dividiendo por m& es: −∑ Pero m
- Page 141 and 142:
Primer Principio de la Termodinámi
- Page 143 and 144:
Primer Principio de la Termodinámi
- Page 145 and 146:
Primer Principio de la Termodinámi
- Page 147 and 148:
∑ ∑ 2 i m × Vi m = = ∑ 3l 3l
- Page 149 and 150:
Pero: Donde como antes n' es el nú
- Page 151 and 152:
Primer Principio de la Termodinámi
- Page 153 and 154:
Primer Principio de la Termodinámi
- Page 155 and 156:
Primer Principio de la Termodinámi
- Page 157 and 158:
Primer Principio de la Termodinámi
- Page 159 and 160:
Primer Principio de la Termodinámi
- Page 161 and 162:
∑ ∑ − = 2 ⎡ dV g ⎤ ⎢dh
- Page 163 and 164:
Primer Principio de la Termodinámi
- Page 165 and 166:
M 2 ( u + Ep + Ec) − M ( u + Ep +
- Page 167 and 168:
La ecuación (3-33’’’) se sim
- Page 169 and 170:
APENDICE Primer Principio de la Ter
- Page 171 and 172:
Primer Principio de la Termodinámi
- Page 173 and 174:
DIAGRAMA PRESION - ENTALPIA DEL OXI
- Page 175 and 176:
Primer Principio de la Termodinámi
- Page 177 and 178:
Primer Principio de la Termodinámi
- Page 179 and 180:
CAPITULO 4 Consecuencias y Aplicaci
- Page 181 and 182:
4.1.2 Transformaciones isobáricas
- Page 183 and 184:
10 × 0. 0858 = = 1. 033 2 ( Kg / c
- Page 185 and 186:
W P2V 2 − P1V 1 = 1− γ La segu
- Page 187 and 188:
Pero de la ecuación de los gases i
- Page 189 and 190:
Consecuencias y Aplicaciones del Pr
- Page 191 and 192:
Consecuencias y Aplicaciones del Pr
- Page 193 and 194:
Consecuencias y Aplicaciones del Pr
- Page 195 and 196:
Consecuencias y Aplicaciones del Pr
- Page 197 and 198:
Por estar sobre la adiabática 0→
- Page 199 and 200:
Consecuencias y Aplicaciones del Pr
- Page 201 and 202:
Consecuencias y Aplicaciones del Pr
- Page 203 and 204:
Q RT 78. 3 × 520 pie 102000 Lb m&
- Page 205 and 206:
Consecuencias y Aplicaciones del Pr
- Page 207 and 208:
Consecuencias y Aplicaciones del Pr
- Page 209 and 210:
Consecuencias y Aplicaciones del Pr
- Page 211 and 212:
Consecuencias y Aplicaciones del Pr
- Page 213 and 214:
BIBLIOGRAFIA • “Termodinámica
- Page 215 and 216:
Segundo Principio de la Termodinám
- Page 217 and 218:
El esquema es similar al anterior.
- Page 219 and 220:
Segundo Principio de la Termodinám
- Page 221 and 222:
Trazamos una gran cantidad de adiab
- Page 223 and 224:
Segundo Principio de la Termodinám
- Page 225 and 226:
T T Q T Q T − T Q − Q Segundo P
- Page 227 and 228:
eleve, con lo que adquiere una ener
- Page 229 and 230:
Segundo Principio de la Termodinám
- Page 231 and 232:
Solución a) Hemos demostrado que p
- Page 233 and 234:
∆Q1 ∆Q2 ⇒ < T T 1 2 ⇒ ∆Q1
- Page 235 and 236:
Segundo Principio de la Termodinám
- Page 237 and 238:
Segundo Principio de la Termodinám
- Page 239 and 240:
Segundo Principio de la Termodinám
- Page 241 and 242:
Segundo Principio de la Termodinám
- Page 243 and 244:
Segundo Principio de la Termodinám
- Page 245 and 246:
Segundo Principio de la Termodinám
- Page 247 and 248:
Segundo Principio de la Termodinám
- Page 249 and 250:
Segundo Principio de la Termodinám
- Page 251 and 252:
Segundo Principio de la Termodinám
- Page 253 and 254:
Segundo Principio de la Termodinám
- Page 255 and 256:
1 0 Segundo Principio de la Termodi
- Page 257 and 258:
Segundo Principio de la Termodinám
- Page 259 and 260:
Segundo Principio de la Termodinám
- Page 261 and 262:
( masa del sistema) × ( intensidad
- Page 263 and 264:
Segundo Principio de la Termodinám
- Page 265 and 266:
Segundo Principio de la Termodinám
- Page 267 and 268:
BIBLIOGRAFIA • “Termodinámica
- Page 269 and 270:
= P0∫ 2 o 0 ( V2 − V1 ) Wo W dV
- Page 271 and 272:
⎛ ∂G ⎞ S −⎜ ⎟ ⎝ ∂T
- Page 273 and 274:
Considerando S en función de V y T
- Page 275 and 276:
Energía libre 258 A seguir vemos l
- Page 277 and 278:
h′ = R′ T P ⎛ ∂Z ⎞ ⎜
- Page 279 and 280:
B) A partir de ecuaciones de estado
- Page 281 and 282:
⎡0. 675 0. 722 1 ⎛ 0. 422 ⎞
- Page 283 and 284:
Energía libre 266 También se pued
- Page 285 and 286:
v * * * * [ s ′ − ′ ] = ′ (
- Page 287 and 288:
* P,T P,T * P,T ( s ′ − s′ )
- Page 289 and 290:
0 ( ∆h′ ) ( ∆h′ ) R′ T c
- Page 291 and 292:
∆h′ R′ T c = 2. 078 = 2. 078
- Page 293 and 294:
Energía libre 276 Introducción a
- Page 295 and 296:
⎛ ∂v′ ⎞ ⎛ ∂P ⎞ Cp −
- Page 297 and 298:
⎛ ∂T ⎞ ⎜ ⎟ ⎝ ∂P ⎠ S
- Page 299 and 300:
Energía libre 282 También present
- Page 301 and 302:
∆Cv′ R′ o 3a 1 = 4b R′ T 3
- Page 303 and 304:
Energía libre 286 Esta distinción
- Page 305 and 306:
Energía libre 288 En consecuencia:
- Page 307 and 308:
BIBLIOGRAFIA Energía libre 290 •
- Page 309 and 310:
Sistemas Heterogéneos 292 interior
- Page 311 and 312:
1 1 2 2 C C Sistemas Heterogéneos
- Page 313 and 314:
Sistemas Heterogéneos 296 es cero.
- Page 315 and 316:
Sistemas Heterogéneos 298 7.5 Intr
- Page 317 and 318:
Retomando la ecuación (7-23), reco
- Page 319 and 320:
C Sistemas Heterogéneos 302 cm v
- Page 321 and 322:
( ln f ) ⎛ ∂ ⎞ ⎛ ∂lnP ⎞
- Page 323 and 324:
Sistemas Heterogéneos 306 Como ya
- Page 325 and 326:
Sistemas Heterogéneos 308 555 150
- Page 327 and 328:
Sistemas Heterogéneos 310 cidad pa
- Page 329 and 330:
Sistemas Heterogéneos 312 puede de
- Page 331 and 332:
C R T x d( ln f ) = 0 ⇒ i d( ln f
- Page 333 and 334:
C ∑i = 1 ⎛ ⎞ ⎜ ∂ ln γi n
- Page 335 and 336:
Sistemas Heterogéneos 318 En el ca
- Page 337 and 338:
7.11.2 Cambio de fase líquido-vapo
- Page 339 and 340:
Sistemas Heterogéneos 322 7.12 Equ
- Page 341 and 342:
Sistemas Heterogéneos 324 Dado que
- Page 343 and 344:
Sistemas Heterogéneos 326 Los rang
- Page 345 and 346:
Sistemas Heterogéneos 328 En la pr
- Page 347 and 348:
Sistemas Heterogéneos 330 Ejemplo
- Page 349 and 350:
Por último recordemos que la ecuac
- Page 351 and 352:
B ln 0. 7589 = 337. 76 2 ⎛ 0. 335
- Page 353 and 354:
Datos experimentales Ecuación de M
- Page 355 and 356:
Sistemas Heterogéneos 338 Notemos
- Page 357 and 358:
Reordenando y recordando que x1 + x
- Page 359 and 360:
Sistemas Heterogéneos 342 La corre
- Page 361 and 362:
Sistemas Heterogéneos 344 En la fi
- Page 363 and 364:
Sistemas Heterogéneos 346 etanol +
- Page 365 and 366:
f i ln f S puro L i puro F ∆H ti
- Page 367 and 368:
Sistemas Heterogéneos 350 Un siste
- Page 369 and 370:
BIBLIOGRAFIA • “Introducción a
- Page 371 and 372:
Vapores 354 Suponiendo un recipient
- Page 373 and 374:
Esto sugiere que una representació
- Page 375 and 376:
Vapores 358 8.8.2 Correlaciones emp
- Page 377 and 378:
0 1 2)Ecuación de Lee-Kesler: ln(
- Page 379 and 380:
Vapores 362 8.9 Correlaciones para
- Page 381 and 382:
λ T b [ ln( P −1) ] 2. 17 c = 0.
- Page 383 and 384:
λ = 7. − r + − r RTc Los resul
- Page 385 and 386:
BIBLIOGRAFIA • “Introducción a
- Page 387 and 388:
Ciclos de Vapor 370 En las diversas
- Page 389 and 390:
Ciclos de Vapor 372 la presencia de
- Page 391 and 392:
Ciclos de Vapor 374 Existe otra raz
- Page 393 and 394:
Ciclos de Vapor 376 Se pueden conec
- Page 395 and 396:
Ciclos de Vapor 378 El trabajo tota
- Page 397 and 398:
Ciclos de Vapor 380 cido por la con
- Page 399 and 400:
Ciclos de Vapor 382 Ejemplo 9.3 Cá
- Page 401 and 402:
Ciclos de Vapor 384 9.4.2 Vapor rec
- Page 403 and 404:
Ciclos de Vapor 386 En cambio en la
- Page 405 and 406:
Ciclos de Vapor 388 ∴H1 − H 2'
- Page 407 and 408:
Ciclos de Vapor 390 Imaginemos ento
- Page 409 and 410:
Ciclos de Vapor 392 que vimos mas a
- Page 411 and 412:
Ciclos de Vapor 394 Para el desaire
- Page 413 and 414:
Ciclos de Vapor 396 A continuación
- Page 415 and 416:
Ciclos de Vapor 398 Si bien los cro
- Page 417 and 418:
N ∆ ρ Ciclos de Vapor 400 a Wo =
- Page 419 and 420:
Ciclos de Vapor 402 en contacto el
- Page 421 and 422:
Ciclos de Vapor 404 livianos, requi
- Page 423 and 424:
Ciclos de Vapor 406 porcentaje en v
- Page 425 and 426:
Ciclos de Vapor 408 recalentador de
- Page 427 and 428:
Ppc Ciclos de Vapor 410 t f − te
- Page 429 and 430:
Ciclos de Vapor 412 Solución Hay v
- Page 431 and 432:
Ciclos de Vapor 414 El croquis que
- Page 433 and 434:
Ciclos de Vapor 416 9.8.2 Elementos
- Page 435 and 436:
Ciclos de Vapor 418 El agua ingresa
- Page 437 and 438:
Ciclos de Vapor 420 El vapor de 100
- Page 439 and 440:
Ciclos de Vapor 422 9.8.7 Calidad d
- Page 441 and 442:
Ciclos de Vapor 424 turas de hasta
- Page 443 and 444:
Ciclos de Vapor 426 peratura (como
- Page 445 and 446:
• “Termodinámica” - V. M. Fa
- Page 447 and 448:
Ciclos Frigoríficos 430 sario entr
- Page 449 and 450:
⎛ Pf ⎞ ⎛ Pf ⎞ η = − ⎜
- Page 451 and 452:
Ciclos Frigoríficos 434 5. Volumen
- Page 453 and 454:
Ciclos Frigoríficos 436 gas que se
- Page 455 and 456:
Ciclos Frigoríficos 438 (muy pelig
- Page 457 and 458:
El diagrama de flujo del sistema es
- Page 459 and 460:
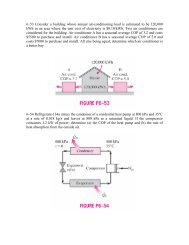
Ciclos Frigoríficos 442 Ejemplo 10
- Page 461 and 462:
Ciclos Frigoríficos 444 Nótese qu
- Page 463 and 464:
El sistema que se emplea en estos c
- Page 465 and 466:
La potencia frigorífica de la cám
- Page 467 and 468:
Ciclos Frigoríficos 450 El ciclo q
- Page 469 and 470:
Ciclos Frigoríficos 452 Entonces e
- Page 471 and 472:
Ciclos Frigoríficos 454 punto de l
- Page 473 and 474:
Ciclos Frigoríficos 456 bromuro de
- Page 475 and 476:
Ciclos Frigoríficos 458 La salmuer
- Page 477 and 478:
Ciclos Frigoríficos 460 El valor t
- Page 479 and 480:
Ciclos Frigoríficos 462 El punto a
- Page 481 and 482:
APENDICE DIAGRAMA H-P DEL FREON-12
- Page 483 and 484:
DIAGRAMA H-P DEL R-717 (AMONIACO) C
- Page 485 and 486:
DIAGRAMA H-P DEL CARE 50 DIAGRAMA H
- Page 487 and 488:
DIAGRAMA H-x DE LA MEZCLA R-23/R-13
- Page 489 and 490:
CAPITULO 11 CICLOS DE GAS Ciclos de
- Page 491 and 492:
Ciclos de Gas 474 La potencia y vel
- Page 493 and 494:
Ciclos de Gas 476 trópica) hasta l
- Page 495 and 496:
⎛ ⎞ En el ciclo Diesel además
- Page 497 and 498:
Ciclos de Gas 480 De tal modo los c
- Page 499 and 500:
η T T 2 1 ⎛ P ⎞ 2 = ⎜ ⎟
- Page 501 and 502:
Ciclos de Gas 484 regenerador viene
- Page 503 and 504:
e) T7 − T6 843 − 520 T7 ′ = T
- Page 505 and 506:
Ciclos de Gas 488 En cuanto al calo
- Page 507 and 508:
Ciclos de Gas 490 El aire entra en
- Page 509 and 510:
Ciclos de Gas 492 El generador de v
- Page 511 and 512:
Ciclos de Gas 494 11.9.2 Cogeneraci
- Page 513 and 514:
Ciclos de Gas 496 El análisis term
- Page 515 and 516:
Ciclos de Gas 498 Una variante de u
- Page 517 and 518:
Ciclos de Gas 500 11.10.2 Ciclo de
- Page 519 and 520:
• “Thermodynamics” - Lee y Se
- Page 521 and 522:
n = P v v H m = Pv + Pa = P ⇒ Pa
- Page 523 and 524:
Aire Húmedo 506 En general, para l
- Page 525 and 526:
Aire Húmedo 508 En la misma tabla
- Page 527 and 528:
Aire Húmedo 510 12.6 Diagrama enta
- Page 529 and 530:
Aire Húmedo 512 Componentes princi
- Page 531 and 532:
Aire Húmedo 514 El criterio a segu
- Page 533 and 534:
Aire Húmedo 516 frente a una salid
- Page 535 and 536:
Aire Húmedo 518 Se deben hacer alg
- Page 537 and 538:
Aire Húmedo 520 12.7.3 Bomba de ca
- Page 539 and 540:
Aire Húmedo 522 12.8 Torres de enf
- Page 541 and 542:
Aire Húmedo 524 12.8.2 Torres de t
- Page 543 and 544:
Aire Húmedo 526 • Para minimizar
- Page 545 and 546:
Aire Húmedo 528 El estanque de enf
- Page 547 and 548:
k g h c × H × PM v = C En consecu
- Page 549 and 550:
Aire Húmedo 532 L h2 − h1 = G T1
- Page 551 and 552:
Aire Húmedo 534 12.8.9 Operación
- Page 553 and 554:
Aire Húmedo 536 lula inferior. Si
- Page 555 and 556:
dP v v′ l dP v′ v Aire Húmedo
- Page 557 and 558:
Cp Cp 1 C m = m∑ i= 1 m − Cv m
- Page 559 and 560:
• “Termodinámica” - Holman.
- Page 561 and 562:
Flujo de fluidos 544 Si se estudia
- Page 563 and 564:
Flujo de fluidos 546 Hay tres magni
- Page 565 and 566:
⎛ a − b ⎞ 0 . 9 + 0. 6⎜ ⎟
- Page 567 and 568:
Flujo de fluidos 550 La gráfica de
- Page 569 and 570:
Flujo de fluidos 552 Sin embargo pr
- Page 571 and 572:
Flujo de fluidos 554 Ejemplo 13.3 C
- Page 573 and 574:
Flujo de fluidos 556 Por lo tanto i
- Page 575 and 576:
2 m seg [ v dP] = [ v][ dP] = = = 2
- Page 577 and 578:
Flujo de fluidos 560 Esta ecuación
- Page 579 and 580:
Flujo de fluidos 562 En el apartado
- Page 581 and 582:
2 2 2 V P ZRT ⎡ ⎛ P ⎞ ⎤ f V
- Page 583 and 584:
Flujo de fluidos 566 13.5.3 Flujo a
- Page 585 and 586:
2 γ −1 G v + γ 2 g 2 = P v 2 γ
- Page 587 and 588:
T P Flujo de fluidos 570 2 1 ∴V 2
- Page 589 and 590:
N P2 Y − Y P1 γ −1 2 ( Y −1)
- Page 591 and 592:
Flujo de fluidos 574 2 v dP = −
- Page 593 and 594:
∴ γ − 1 ⎛ Pg ⎞ = 1− ⎜
- Page 595 and 596:
Flujo de fluidos 578 Despreciando l
- Page 597 and 598:
BIBLIOGRAFIA • “Flujo de fluido
- Page 599 and 600:
Intercambio de Calor por Conducció
- Page 601 and 602:
Intercambio de Calor por Conducció
- Page 603 and 604:
Intercambio de Calor por Conducció
- Page 605 and 606:
Intercambio de Calor por Conducció
- Page 607 and 608:
Intercambio de Calor por Conducció
- Page 609 and 610:
Intercambio de Calor por Conducció
- Page 611 and 612:
Intercambio de Calor por Conducció
- Page 613 and 614:
t n h′′ t ∆x t ′′ + k t =
- Page 615 and 616:
t t 1 2 t = 0 t = 1 + t 2 1 + t 2 Y
- Page 617 and 618:
Intercambio de Calor por Conducció
- Page 619 and 620:
CAPITULO 15 Intercambio de Calor po
- Page 621 and 622:
Número de Péclet: Número de Stan
- Page 623 and 624:
Intercambio de Calor por Convecció
- Page 625 and 626:
En medidas inglesas: • Tubo horiz
- Page 627 and 628:
ke q& = ( t1 − t2 ) δ Esta ecuac
- Page 629 and 630:
Intercambio de Calor por Convecció
- Page 631 and 632:
Intercambio de Calor por Convecció
- Page 633 and 634:
N Num − 1 1 6 Intercambio de Calo
- Page 635 and 636:
Además: 2 ρ π D V m& = 4 ⇒ ⇒
- Page 637 and 638:
Intercambio de Calor por Convecció
- Page 639 and 640:
Intercambio de Calor por Convecció
- Page 641 and 642:
Intercambio de Calor por Convecció
- Page 643 and 644:
Intercambio de Calor por Convecció
- Page 645 and 646:
BIBLIOGRAFIA • “Elementos de Te
- Page 647 and 648:
vv vv v vdPv = vl dPl ⇒ dPl = dPv
- Page 649 and 650:
Intercambio de calor con cambio de
- Page 651 and 652:
Intercambio de calor con cambio de
- Page 653 and 654:
q& ⎛ q& ⎞ ⎛ q& ⎞ = ⎜ ⎟
- Page 655 and 656:
N Pr Cl ∆t ≥ 1 y < 1 h fg Inter
- Page 657 and 658:
⎛ g ⎞ = ∆t π r⎜ ⎟ ⎝ ν
- Page 659 and 660:
Intercambio de calor con cambio de
- Page 661 and 662:
BIBLIOGRAFIA • “Elementos de Te
- Page 663 and 664:
Intercambio de Calor por Radiación
- Page 665 and 666:
Intercambio de Calor por Radiación
- Page 667 and 668:
2000 BTU hora Intercambio de Calor
- Page 669 and 670:
Intercambio de Calor por Radiación
- Page 671 and 672:
HORNOS RECTANGULARES Longitud - anc
- Page 673 and 674:
Intercambio de Calor por Radiación
- Page 675 and 676:
Pw 0. 25 0.375 + 0.165 = 0.54 y = =
- Page 677 and 678:
Intercambio de Calor por Radiación
- Page 679 and 680:
BIBLIOGRAFIA • “Elementos de Te
- Page 681 and 682:
Intercambiadores de Calor 664 18.1.
- Page 683 and 684:
En forma muy general, podemos clasi
- Page 685 and 686:
Intercambiadores de Calor 668 En un
- Page 687 and 688:
Intercambiadores de Calor 670 18.3.
- Page 689 and 690:
Intercambiadores de Calor 672 Este
- Page 691 and 692:
Intercambiadores de Calor 674 El pr
- Page 693 and 694:
Intercambiadores de Calor 676 La ec
- Page 695 and 696:
Intercambiadores de Calor 678 18.6.
- Page 697 and 698:
Intercambiadores de Calor 680 Enfri
- Page 699 and 700:
Intercambiadores de Calor 682 18.7
- Page 701 and 702:
Intercambiadores de Calor 684 jo es
- Page 703 and 704:
Intercambiadores de Calor 686 fluya
- Page 705 and 706:
7) De la curva inferior (2) de la F
- Page 707 and 708:
Intercambiadores de Calor 690 ciert
- Page 709 and 710:
Intercambiadores de Calor 692 corre
- Page 711 and 712:
Intercambiadores de Calor 694 Los c
- Page 713 and 714:
Intercambiadores de Calor 696 18.11
- Page 715 and 716:
Intercambiadores de Calor 698 18.13
- Page 717 and 718:
FLUIDO DE TRABAJO Helio Nitrógeno
- Page 719 and 720:
Intercambiadores de Calor 702 APEND
- Page 721 and 722:
Intercambiadores de Calor 704 Enfri
- Page 723:
• “Intercambiadores de calor”