DM7orga
DM7orga
DM7orga
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Devoir Maison MathSpé PC 2012-2013<br />
DM 7<br />
Chimie organique<br />
A rendre le vendredi 8 février 2013<br />
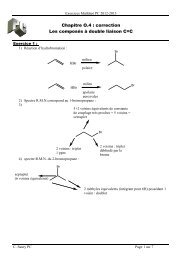
Probleme 1 : Agroveto :2011 Synthèse de la Venlafaxine<br />
La Venlafaxine est le nom courant du 1-[2-(diméthylamino)-1-(4-méthoxyphenyl)éthyl]cyclohexanol. Il<br />
s’agit d’un antidépresseur-anxiolytique apparu au milieu des années 90 et prescrit contre la dépression et<br />
le trouble panique.<br />
Première synthèse<br />
Une première synthèse de la Venlafaxine est proposée ci-après :<br />
1. Justifier succinctement la régio-sélectivité de la réaction A B. Aucune écriture de formules<br />
n’est demandée pour répondre à cette question.<br />
2. Quel est le rôle du chlorure d’aluminium AlCl3 ?<br />
3. Proposer (en le justifiant) un mécanisme pour la réaction B C. Pourquoi cette réaction estelle<br />
menée avec un large excès de diméthylamine ?<br />
Pour les questions suivantes, on pourra écrire :<br />
4. Proposer un réactif permettant la réaction C D. Écrire l’équation de la réaction.<br />
5. Proposer un réactif permettant la réaction D E. Écrire l’équation de la réaction.<br />
6. Détailler les conditions opératoires permettant de transformer E en F.<br />
7. Proposer un schéma réactionnel (ou mécanisme simplifié) de la réaction de F avec la<br />
cyclohexanone.<br />
Une voie de synthèse alternative<br />
La voie de synthèse la plus couramment utilisée passe par un nitrile D qui est par la suite<br />
hydrogéné puis méthylé.<br />
C. Saury PC Page 1 sur 11
Devoir Maison MathSpé PC 2012-2013<br />
Obtention du para-methoxyphenylacétonitrile H<br />
Le protocole est le suivant :<br />
a) À une solution de para-(chlorométhyl)anisole G dans de l’acétone est ajouté par petites portions<br />
du cyanure de sodium (NaCN) puis de l’iodure de sodium (NaI). Le mélange est chauffé à reflux<br />
pendant 16 heures.<br />
b) Le mélange réactionnel est filtré. La phase solide (essentiellement composée de chlorure de<br />
sodium NaCl) est jetée.<br />
c) La phase liquide est évaporée sous pression réduite de façon à éliminer l’acétone.<br />
d) L’huile obtenue est diluée dans un mélange bi-phasique benzène/eau. La phase organique est<br />
isolée, séchée et évaporée sous pression réduite.<br />
e) Le brut réactionnel est alors purifié par distillation sous pression réduite (Téb = 94-97°C sous<br />
une pression de 40 Pa). On mesure alors un indice de réfraction pour le produit de nD = 1,588.<br />
8. L’iodure de sodium (NaI) permet d’augmenter sensiblement la vitesse de la réaction. Comment<br />
appelle-t-on un tel composé ? Donner la structure de l’intermédiaire réactionnel faisant intervenir<br />
NaI et expliquant l’accroissement de la vitesse de réaction.<br />
9. Pourquoi est-il indispensable d’évaporer l’acétone avant d’effectuer la séparation liquideliquide<br />
?<br />
10. Que contiennent la phase organique et la phase aqueuse dans la partie d) du protocole ?<br />
11. Donner une méthode permettant d’assécher la phase organique.<br />
12. Proposer un schéma détaillé d’un montage de purification par distillation sous pression<br />
atmosphérique.<br />
13. Quel est l’appareil permettant de mesurer l’indice de réfraction d’un liquide ? Que permet cette<br />
mesure quant à la caractérisation du produit ?<br />
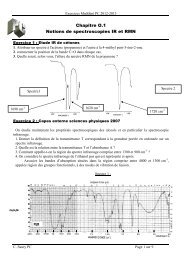
On donne les spectres IR des molécules G et H ainsi que le spectre RMN de H. (Les tables et<br />
RMN et IR sont en annexes en fin de sujet, pages 12 et 13).<br />
C. Saury PC Page 2 sur 11
Devoir Maison MathSpé PC 2012-2013<br />
Spectre infrarouge du composé G<br />
(abscisse : nombre d’onde en cm –1 / ordonnée : transmittance)<br />
Spectre infrarouge du composé H synthétisé<br />
(abscisse : nombre d’onde en cm –1 / ordonnée :transmittance)<br />
14. La réalisation de ces deux spectres nous permet-elle d’affirmer que la réaction s’est<br />
correctement produite (du para-methoxyphenylacetonitrile a bien été obtenu à partir de para-<br />
(chloromethyl)anisole) ?<br />
15. Donner la (les) valeur(s) des nombres d’onde correspondant à la liaison C–Cl pour le composé<br />
G.<br />
Spectre RMN du composé H (abscisse : déplacement chimique en ppm)<br />
16. Interpréter le spectre RMN obtenu pour le composé H.<br />
Obtention de J<br />
Une solution de H est refroidie à la température de –78°C. Une solution de n-butyllithium est<br />
ajoutée goutte à goutte. Le produit I obtenu n’est pas isolé, mais mis à réagir directement avec une<br />
C. Saury PC Page 3 sur 11
Devoir Maison MathSpé PC 2012-2013<br />
solution de cyclohexanone qui est elle aussi ajoutée goutte à goutte au mélange réactionnel.<br />
L’ensemble est mis au contact de l’eau puis le produit J est isolé.<br />
Le n-butyllithium joue ici le rôle de base forte selon l’équation suivante :<br />
C4H9Li + AH = C4H10 + A – + Li + (où AH/A – est un couple acido-basique quelconque)<br />
17. Écrire la structure de l’anion I en justifiant précisément sa stabilité particulière.<br />
18. La cyclohexanone possède-t-elle un ou des sites électrophiles ? On peut s’appuyer sur<br />
l’écriture de formules mésomères pour répondre à la question.<br />
19. Proposer un mécanisme de la réaction de I avec la cyclohexanone conduisant à l’obtention de<br />
J.<br />
20. Pourquoi est-il indispensable de respecter l’ordre d’introduction : H puis n-butyllithium puis<br />
cyclohexanone ? Donner la structure du produit secondaire obtenu si cet ordre n’est pas suivi.<br />
Obtention de la (-)-Venlafaxine.<br />
Données : Numéros atomiques : H : 1 ; C : 6 ; N : 7 ; O : 8<br />
La fin de la synthèse est rappelée ci-dessous :<br />
21. Quel nom peut-on donner à la réaction K L ?<br />
22. Localiser le (les) centre(s) stéréogènes(s) du composé L obtenu. Ce dernier possède-t-il des<br />
propriétés optiques ?<br />
23. Le composé NaBH3CN a une réactivité similaire (mais beaucoup moins forte) à celle de<br />
NaBH4. Pour transformer une mole de L en Venlafaxine, quelle quantité de méthanal doit on<br />
ajouter ?<br />
Par cristallisation en présence d’un dérivé (noté<br />
M) de l’acide tartrique, il est possible d’isoler la<br />
(–)-Venlafaxine avec un excès énantiomérique :<br />
ee = 98%.<br />
24. Donner la configuration absolue des atomes<br />
de carbone asymétriques de M. Justifier<br />
brièvement.<br />
25. Que signifie le (–) dans le nom (–)-Venlafaxine ? Avec quel appareil peut-on déterminer ce<br />
signe ?<br />
26. Le carbone asymétrique de la (–)-Venlafaxine est de configuration (R). Dessiner la (–)-<br />
Venlafaxine en utilisant la représentation de CRAM et en justifiant brièvement.<br />
27. Un excès énantiomérique est défini par la relation suivante :<br />
(concentration de ( ) -Venlafaxine) - (concentration de (+) -Venlafaxine)<br />
ee =<br />
(concentration de ( ) -Venlafaxine) + (concentration de (+) -Venlafaxine)<br />
Donner alors la fraction molaire de (–)-Venlafaxine du mélange obtenu.<br />
Annexes<br />
C. Saury PC Page 4 sur 11
Devoir Maison MathSpé PC 2012-2013<br />
Table de valeurs de déplacements chimiques en RMN 1 H<br />
C. Saury PC Page 5 sur 11
Devoir Maison MathSpé PC 2012-2013<br />
C. Saury PC Page 6 sur 11
Devoir Maison MathSpé PC 2012-2013<br />
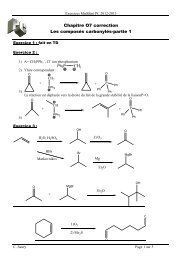
Problème 2 :<br />
La Sphingofungine F est un inhibiteur de l’enzyme Serinepalmitolyl transferase qui joue un rôle<br />
essentiel dans la biosynthèse des sphingolipides précurseurs des céramides de la peau qui restructurent<br />
la couche cornée comme un ciment et stimulent la fabrication naturelle des lipides. La Sphingofungine<br />
F dont la structure est précisée ci-dessous est un dérivé -substitué de l’alanine. Une synthèse<br />
stéréosélective à partir de l’acide tartrique en a été récemment publiée (G.Q. Lin et coll., J. Org. Chem.<br />
2000, 65, 9114) ; elle est basée sur une réaction de Wittig entre les deux fragments [C1-C6] et [C7-<br />
C20].<br />
O<br />
Sphingofungin F<br />
B : [ C7-C20] A : [C1-C6]<br />
Les deux séquences réactionnelles suivantes (indépendantes) décrivent la synthèse préliminaire des<br />
deux précurseurs de A (un époxyaldéhyde) et B (un alcool primaire) correspondant respectivement aux<br />
fragments [C1-C6] et [C7-C20].<br />
Synthèse du précurseur de A<br />
Cette synthèse est effectuée à partir du (+)-tartrate de diéthyle C énantiomériquement pur :<br />
C :<br />
EtO<br />
O<br />
OH<br />
OH<br />
OEt<br />
1- Que signifie « synthèse stéréosélective » ?<br />
O<br />
2- Donner la configuration absolue des carbones asymétriques de la molécule C. Combien existe-t-il de<br />
stéréoisomères de configuration de C ? Les représenter à l’aide de la représentation de Cram et<br />
préciser les relations de stéréochimie qui les lient.<br />
C est mis en présence d’acétone avec une catalyse acide réalisée par l’acide paratoluènesulfonique<br />
(noté TsOH), on obtient alors le composé D.<br />
3- Quel est le nom de cette réaction ? Quel est a priori son intérêt ? Quels sont les avantages de TsOH<br />
par rapport à HCl ?<br />
Préciser le mécanisme de cette réaction et donner une représentation développée spatiale de D.<br />
C. Saury PC Page 7 sur 11<br />
OH<br />
OH<br />
OH<br />
H 2N<br />
O<br />
CH 3<br />
OH
Devoir Maison MathSpé PC 2012-2013<br />
D est traité par de l’aluminohydrure de lithium en excès pour conduire au composé E. Cette réaction<br />
permet de réduire les fonctions ester en fonction alcool.<br />
4- En considérant LiAlH4 comme un donneur d’ions hydrures H - , proposer un mécanisme pour cette<br />
réaction. Donner la formule développée de E.<br />
5- Comment peut-on passer de E à la molécule F représentée ci-dessous ?<br />
O<br />
O O<br />
C. Saury PC Page 8 sur 11<br />
OH<br />
La fonction alcool de F est ensuite oxydée pour obtenir G selon une oxydation de Swern. Il s’agit d’une<br />
oxydation douce des alcools primaires et secondaires respectivement en aldéhyde et en cétone dans un<br />
milieu contenant du chlorure d’oxalyle dans le DMSO (diméthylesulfoxide) et de la triéthylamine.<br />
6- Citer un autre réactif possible pour cette oxydation. Représenter G.<br />
Le composé G est ensuite dissous dans le dichlorométhane à 0°C puis opposé au composé Z ci-dessous<br />
pour conduire à la molécule H obtenue majoritairement avec une configuration E. H est alors traité<br />
par LiAlH4 qui donne le composé I.<br />
Z : où Ph représente le groupe phényl C6H5.<br />
Ph 3P<br />
7- Proposer une synthèse de Z à partir de l’acide 2-bromopropanoïque.<br />
8- Comment appelle-t-on la réaction menant à H ? Représenter la molécule H.<br />
9- Représenter le produit I.<br />
L’équipe de Sharpless, prix Nobel de chimie 2001, a mis au point une technique d’époxydation<br />
énantiosélective des alcènes , utilisant un complexe chiral du titane. En appliquant cette méthode au<br />
composé I on obtient un produit J dont la configuration absolue des deux nouveaux atomes de carbone<br />
asymétriques est S.<br />
10- Citer un réactif classique d’époxydation des alcènes.<br />
11- Représenter le produit J.<br />
COOEt<br />
J est traité par le tert-butylchlorodiméthylsilyle (TBDMSCl) en solution dans le dichlorométhane, en<br />
présence d’imidazole. Il se forme alors le composé K.
TBDMSCl :<br />
Devoir Maison MathSpé PC 2012-2013<br />
Si<br />
Cl<br />
Imidazole :<br />
12- Montrer que l’imidazole est un ampholyte et identifier les couples acido-basiques correspondant aux<br />
valeurs de pKA de 7,0 et 14,5 ; justifier. Montrer que les deux atomes d’azote sont en fait<br />
équivalents.<br />
13- Où se trouve le silicium dans la classification périodique ? Quel est le type de réaction mise en jeu<br />
dans la formation du composé K ? Représenter K.<br />
Le groupe protecteur –OBn (Bn=benzyle) est ensuite ôté pour rétablir la liaison –OH, ce qui donne le<br />
composé L (C16H32O5Si). Le composé L est alors opposé au trioxyde de chrome dans la pyridine pour<br />
finalement conduire à la molécule A.<br />
14- Représenter A. Quel est l’intérêt du groupe TBDMS ?<br />
Synthèse du précurseur de B<br />
La synthèse de l’intermédiaire B nécessite l’intervention du 6-iodohexan-1-ol. Ce dernier est transformé<br />
en M. La préparation du composé M fait intervenir la réaction entre le groupe caractéristique OH d’un<br />
alcool et le 3,4-dihydro-2H-pyrane (dont le nom systématique est 3-oxacyclohéxène) noté DHP. On<br />
étudie la réaction modèle entre le méthanol et le DHP, qui conduit à la formation d’un produit<br />
d’addition du méthanol sur la double liaison du DHP, que l’on note H3C-OTHP.<br />
H<br />
H3C-OH + O<br />
H3C-OTHP Réaction (1)<br />
+<br />
DHP<br />
15- Donner la structure de l’espèce cationique majoritairement obtenue quand le DHP est placé au<br />
contact d’un milieu acide, si l’évolution du système est sous contrôle thermodynamique.<br />
Par action du méthanol en excès, en solution dans l’éthoxyéthane anhydre et en présence d’acide paratoluènesulfonique,<br />
le DHP est transformé en un composé H3C-OTHP de formule brute C6H12O2.<br />
16- Proposer un mécanisme pour la formation de H3C-OTHP.<br />
17- La réaction (1) constitue une étape de protection de la fonction alcool.<br />
Justifier cette remarque. Quels sont les produits obtenus lors de la déprotection ?<br />
18- Combien de stéréoisomères sont obtenus lors de la réaction (1) ? Les représenter.<br />
En quelles proportions les trouve-t-on ? Justifier le raisonnement..<br />
19- En déduire la structure de M.<br />
C. Saury PC Page 9 sur 11<br />
N<br />
NH
Devoir Maison MathSpé PC 2012-2013<br />
Le composé M est opposé au 3-oxononanoate de méthyle dans un mélange DMF (diméthylformamide) et<br />
acétone en présence de K2CO3, l’ensemble est porté à reflux pour obtenir le composé N. Ce dernier est<br />
ensuite mis à reflux dans un mélange de potasse alcoolique pour former O, on observe un dégagement<br />
gazeux.<br />
20- Donner la formule topologique de N et proposer un mécanisme pour sa formation.<br />
21- Quel est le gaz formé lors de l’obtention de O ? Justifier les conditions utilisées pour cette étape au<br />
lieu des conditions classiques [(1) HO - aq./ MeOH, 25°. (2) H3O + / reflux)].<br />
O est ensuite déprotégé en milieu acide pour donner B.<br />
L’analyse RMN du composé B fournit les résultats suivants :<br />
Déplacement chimique du spectre RMN du proton (dans CDCl3, 300 MHz) :<br />
22- Identifier les différents groupes de protons sur la molécule B.<br />
Synthèse de la Sphingofungine F<br />
Le composé B est transformé en P :<br />
P :<br />
23- Proposer un schéma de synthèse permettant d’obtenir P.<br />
P est ensuite couplé au composé A dans du THF ( tétrahydrofurane ) en présence de nBuLi à –78°C. On<br />
obtient le composé Q dont la double liaison présente une configuration Z.<br />
24- Donner la structure de Q. Comment réalise-t-on une température de -78°C en laboratoire ?<br />
Par une suite d’étapes non détaillées ici on prépare le composé R ci-dessous :<br />
C 6H 13<br />
N° Déplacement (ppm) intégration Allure du Couplage<br />
signal (Hz)<br />
(a) 0,87 3 H t 7,0<br />
(b) 1,26-1,60 18 H m<br />
(c) 2,37 4 H t 7,3<br />
(d) 3,62 2 H t 6<br />
O<br />
C 6H 13<br />
O<br />
O O<br />
C. Saury PC Page 10 sur 11<br />
Br<br />
PPh 3<br />
OH<br />
O<br />
O<br />
O<br />
NH<br />
CH 3
R :<br />
Devoir Maison MathSpé PC 2012-2013<br />
25- Préciser les conditions expérimentales de la dernière étape conduisant à la Sphingofungine F.<br />
C. Saury PC Page 11 sur 11