istchimorg/sitolodi2005/filepdf/alcheni alchini.pdf
istchimorg/sitolodi2005/filepdf/alcheni alchini.pdf
istchimorg/sitolodi2005/filepdf/alcheni alchini.pdf
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
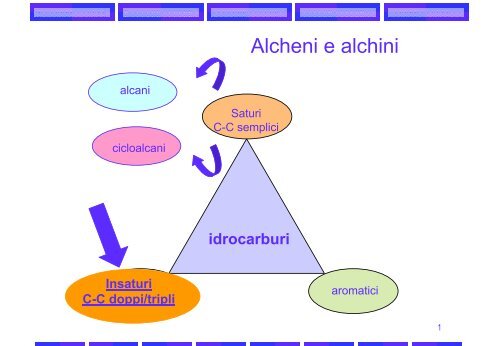
alcani<br />
cicloalcani<br />
Insaturi<br />
C-C doppi/tripli<br />
Saturi<br />
C-C semplici<br />
idrocarburi<br />
Alcheni e <strong>alchini</strong><br />
aromatici<br />
1
Alcheni e Alchini<br />
Alcheni e <strong>alchini</strong> sono idrocarburi che hanno rispettivamente un doppio<br />
legame C-C e un triplo legame C-C.<br />
Coniugati<br />
Dieni: composti contenenti due doppi legami<br />
Polieni: composti contenenti un elevato numero di doppi legami<br />
Quando i legami<br />
multipli sono alternati<br />
con legami semplici<br />
C C C C<br />
C C C C<br />
coniugati<br />
Isolati<br />
Quando i legami<br />
multipli sono separati<br />
da più di un legame<br />
semplice<br />
C C C C C<br />
C C C C C<br />
isolati<br />
Cumulati<br />
Quando i legami<br />
multipli si trovano<br />
in immediata<br />
successione<br />
C C C<br />
C C C C<br />
cumulati<br />
2
Etene (etilene), C 2 H 4<br />
Geometria trigonale<br />
planare intorno a ciascun<br />
carbonio<br />
3
Acetilene, C 2 H 2<br />
Geometria lineare intorno a ciascun<br />
carbonio<br />
4
Regole IUPAC per nomenclatura <strong>alcheni</strong> e ciclo<strong>alcheni</strong><br />
1. Il suffisso ene indica alchene o cicloalchene Il suffisso ino indica la<br />
presenza di un triplo legame (2 doppi legami : diene, 2 tripli legami: diino 3:<br />
triene etc etc). La desinenza -enino indica la presenza di un doppio e di un<br />
triplo legame.<br />
2. Si sceglie la catena più lunga contenente il doppio o triplo legame.<br />
3. La numerazione della catena deve iniziare dall’estremità più vicina al<br />
legame multiplo in modo che gli atomi di carbonio di questo legame<br />
vengano assegnati i numeri più bassi possibile. Se il legame multiplo è<br />
equidistante dalle estremità si inizia dalla estermità più vicina alla<br />
ramificazione.<br />
4. Per indicare la posizione del legame multiplo ci si deve riferire all’atomo<br />
di carbonio di questo legame che ha il numero più basso.<br />
5. Se un doppio legame e un triplo legame sono equidistanti dalle<br />
estremità della catena, è il doppio legame quello che prende il numero più<br />
basso.<br />
Nei ciclo<strong>alcheni</strong> si comincia a numerare l’anello dai carboni che portano il<br />
legame multiplo.<br />
6. Da ricordare:<br />
H2C=CH- gruppo vinile<br />
H2C=CH-CH2- gruppo allile HC C Gruppo propargile<br />
5
Alcheni<br />
La formula<br />
generale di un<br />
alchene è C n H 2n .<br />
Alchini<br />
La formula<br />
generale di un<br />
alchino è C n H 2n-2 .<br />
I primi cinque termini della serie:<br />
C 2 H 4 - etene<br />
C 3 H 6 - propene<br />
C 4 H 8 - butene<br />
C 5 H 10 – pentene<br />
I primi cinque termini della serie:<br />
C 2 H 2 - etino<br />
C 3 H 4 - propino<br />
C 4 H 6 - butino<br />
C 5 H 8 – pentino<br />
6
Viene prima in ordine alfabetico, quindi n° più basso<br />
2,5,5-trimetil-2-esene non<br />
2,2,5-trimetil-4-esene<br />
2-propil-1-pentene<br />
4-etil-2-metil-3-esene<br />
non 3-etil-5-metil-3-esene<br />
2-etil-3,4-dimetil-1,4-pentadiene<br />
non 2,3-dimetil-4-etil-1,4-pentadiene<br />
7
5,5,-dicloro-2-vinil-1,3,5-cicloottatriene<br />
4-isopropil-1-metilcicloesene<br />
1-ciclobutil-3-metil-1butino<br />
1-ciclodecen-4-ino<br />
8
5-etinil-1,3,6-eptatriene<br />
4-vinil-1-eptene-5-ino<br />
5-bromo-1-etilcicloesene<br />
9
Isomeria cis-trans<br />
Dal momento che introno ai doppi legami carbonio-carbonio la<br />
rotazione è impedita, l’isomeria geometrica cis-trans diventa possible<br />
negli <strong>alcheni</strong> opportunamente sostituiti<br />
Il requisito essenziale è che ciascuno dei carboni del doppio<br />
legame abbia due diversi sostituenti.<br />
Questi isomeri non sono facilmente interconvertibili a temperatura<br />
ambiente e possono essere quindi separati l’uno dall’altro.<br />
10
2-butene<br />
11
Br>Cl e CH 3 >H<br />
Configurazione E<br />
Ciclobutile>H e isopropile>etile<br />
Configurazione Z<br />
(Z)-1-bromo-3-cloro-4-isopropil-3-eptene Configurazione (Z)<br />
I gruppi con priorità più alta<br />
dalla stessa parte<br />
12
Cis o trans?<br />
Un sistema non ambiguo basato su un sistema di regole di priorità,<br />
assegna il simbolo Z (Tedesco, zusammen per insieme) o E (Tedesco,<br />
entgegen per opposto) per designare gli stereoisomeri.<br />
Regole per l’assegnazione della configurazione agli <strong>alcheni</strong><br />
Assegna le priorità ai sostituenti del doppio legame osservando<br />
l’atomo direttamente legato al Carbonio del doppio legame<br />
1. Maggiore è il numero atomico<br />
maggiore la priorità<br />
Per esempio: H- < C- < N- < O- < Cl-. (priorità aumenta da sinistra a<br />
destra)<br />
2. Se due sostituenti hanno lo stesso atomo legato al C del doppio<br />
legame, ci si sposta all’atomo successivo finchè non si trova un punto<br />
di differenza<br />
Per es., CH3-< C2H5- < ClCH2-< BrCH2-< CH3O-. 13
Br>Cl e CH 3 >H<br />
Configurazione E<br />
Ciclobutile>H e isopropile>etile<br />
Configurazione Z<br />
(Z)-1-bromo-3-cloro-4-isopropil-3-eptene Configurazione (Z)<br />
I gruppi con priorità più alta<br />
dalla stessa parte<br />
14
La vit. A o Retinolo è il<br />
precursore biochimico del<br />
Retinale, molecola<br />
importantissima per il<br />
meccanismo della visione.<br />
Il cis-retinale (11-12 cis) forma con una proteina di nome<br />
Opsina un complesso chiamato Rodopsina. Si tratta di<br />
pigmento contenuto nei bastoncelli della retina.<br />
15
Quando la luca visibile di energia opportuna viene<br />
assorbita dalla rodopsina, il cis-retinale isomerizza a<br />
trans-retinale. Il complesso trans-retinale-opsina è meno<br />
stabile e si dissocia. Questo cambiamento di geometria<br />
provoca nelle cellule nervose dei bastoncelli una risposta<br />
che viene trasmessa al cervello e percepita come<br />
immagine<br />
16
Il trans-retinale può isomerizzare sotto l’effetto di<br />
Isomerasi a cis-retinale (neoretinale)<br />
17
Reazioni degli <strong>alcheni</strong><br />
La più comune reazione del doppio legame C-C è la<br />
reazione di addizione. La maggior parte di queste reazioni<br />
sono esotermiche: il legame π è più debole rispetto ai legami<br />
σ che si formano durante la reazione.<br />
C C + A B C C<br />
Reagente<br />
elettrofilo<br />
Ricorda<br />
A B<br />
l’energia di legame di una molecola è l’energia richiesta<br />
per rompere tutti i legami covalenti della molecola.<br />
Quindi, se le energie di legame del prodotto sono<br />
maggiori delle energie di legame dei reagenti la reazione<br />
sarà esotermica.<br />
18
Nucleofilo: atomo o gruppo di atomi che può<br />
donare una coppia di elettroni ad un altro atomo o<br />
gruppo di atomi per formare un legame covalente<br />
Elettrofilo: qualsiasi molecola che può accettare un<br />
doppietto elettronico per formare un legame<br />
covalente<br />
19
Come avviene normalmente l’addizione elettrofila?<br />
E+ = Elettrofilo<br />
Nuc: = Nucleofilo<br />
Meccanismo Generale : Il primo step richiede l’intervento di un potente<br />
elettrofilo che attiri gli elettroni del legame π formando un carbocatione.<br />
Successivamente – secondo step- un nucleofilo reagisce rapidamente<br />
formando il prodotto.<br />
20
Tipi principali di Addizione elettrofila<br />
• Addizione di acidi alogenidrici<br />
• Addizione di Alogeni<br />
• Idratazione<br />
• Epossidazione<br />
• Formazione delle aloidrine<br />
•Orientazione della Addizione<br />
•l’addizione elettrofila fornisce il prodotto “secondo<br />
Markovnikov”, in cui il nucleofilo è legato al carbonio più<br />
sostituito. Questo si verifica perché il carbocatione<br />
intermedio corrispondente è maggiormente stabilizzato<br />
dalla presenza dei sostituenti alchilici.<br />
CH 3 (+) < CH 3 CH 2 (+) < (CH3 ) 2 CH (+) ≅ CH 2 =CH-CH 2 (+) < C 6 H 5 CH 2 (+) ≅ (CH3 ) 3 C (+)<br />
21
Addizione di acidi alogenidrici (HCl, HBr..)<br />
I step: formazione<br />
del carbocatione<br />
più stabile (più<br />
sostituito)<br />
II step: addizione<br />
del nucleofilo (Br - )<br />
H + = elettrofilo<br />
Br - = nucleofilo<br />
22
CH3 CH CH2 + HBr CH3 CH CH3 propene<br />
CH 3<br />
CH3 C CH2 + HCl CH3 C CH3 2-metilpropene<br />
Br<br />
CH 3<br />
Cl<br />
2-bromopropano<br />
(isopropilbromuro)<br />
2-cloro-2-metilpropano<br />
(ter-butilcloruro)<br />
+ HCl Cl<br />
ciclopentene 1-clorociclopentano<br />
(ciclopentilcloruro)<br />
Alogenuri<br />
alchilici<br />
Gruppo<br />
funzionale : X<br />
(Cl, Br, I, F)<br />
23
Addizione di alogeni (Cl 2, Br 2..)<br />
C C + Br Br C C<br />
Formazione del dialogenoderivato con stereochimica anti<br />
Br<br />
Br<br />
24
Br 2 in CCl 4<br />
Si aggiungono<br />
poche gocce di<br />
esene<br />
Si osserva una<br />
rapida<br />
decolorazione<br />
25
Addizione di acqua<br />
H2SO4 C C + H2O C C<br />
C C + H +<br />
C C + O H<br />
H<br />
H<br />
C C<br />
H<br />
C C<br />
H<br />
OH H<br />
OH 2 C C<br />
H<br />
Alcoli<br />
Gruppo<br />
funzionale<br />
caratteristico:<br />
OH<br />
OH + H +<br />
27
CH 3<br />
CH 3<br />
CH CH 2<br />
propene<br />
CH 3<br />
C CH 2<br />
2-metilpropene<br />
C 2H 5<br />
+ H 2O<br />
+ H 2O<br />
1-etilcicloesene<br />
+ H 2O<br />
H +<br />
H +<br />
H +<br />
CH 3<br />
CH 3<br />
CH CH 3<br />
OH<br />
2-propanolo<br />
(alcol isopropilico)<br />
CH 3<br />
C CH 3<br />
OH<br />
2-metil-2-propanolo<br />
(alcol ter-butilico)<br />
HO<br />
C 2H 5<br />
1-etil-1-cicloesanolo<br />
28
Formazione di aloidrine<br />
C C + HO-Cl C C<br />
CH 3<br />
CH 3 C CH<br />
CH 3<br />
δ -<br />
δ +<br />
OH Cl<br />
CH2 + HOCl<br />
CH3 C CH<br />
+ HOBr<br />
CH 3<br />
CH 3<br />
OH<br />
OH<br />
Br<br />
CHCl<br />
29
Altre importanti reazioni degli <strong>alcheni</strong>:<br />
Idrogenazione Ossidazione<br />
C C + H 2<br />
catalizzatore<br />
C C<br />
catalizzatore = nichel, platino, palladio..<br />
+ H 2<br />
Idrogenazione<br />
H<br />
Pt, 1 atm<br />
25°<br />
H<br />
addizione<br />
cis<br />
30
R R<br />
C C<br />
R R<br />
violetto<br />
+ ArCOOOH<br />
Ossidazione con permanganato<br />
Ossidazione con peracidi<br />
O<br />
R C C R<br />
R R<br />
epossido<br />
H +<br />
Precipitato<br />
bruno<br />
OH R<br />
R C C R<br />
R<br />
OH<br />
diolo trans<br />
Diolo cis<br />
(glicol)<br />
32
Metodi di ottenimento degli <strong>alcheni</strong><br />
1) Idrogenazione di <strong>alchini</strong><br />
2) Disidratazione degli alcoli<br />
3) Deidroalogenazione di alogenoderivati<br />
1) Idrogenazione di <strong>alchini</strong><br />
R-C≅C-R + H 2 + catalizzatore di Lindlar _____ > cis R-CH=CH-R<br />
R-C≅C-R + 2 Na in NH 3 (liq) _____ > trans R-CH=CH-R + 2NaNH 2<br />
33
2) Disidratazione degli alcoli<br />
cicloesanolo cicloesene terbutanolo<br />
2-metil-3-esanolo<br />
Prodotto maggioritario<br />
2-metilpropene<br />
Prodotto minoritario (trans>cis)<br />
34
Meccanismo<br />
di<br />
disidratazione<br />
La reazione viene definita<br />
reazione di β-eliminazione E1<br />
idratazione<br />
35
2) Deidroalogenazione di alogenoderivati<br />
R CH CH<br />
H<br />
Br<br />
R<br />
base forte<br />
R CH CH R<br />
CH 3CH 2CHBrCH 3 + NaOH CH 3 CH CH CH 3 + NaBr + H 2O<br />
2-bromobutano<br />
(sec-butilbromuro)<br />
CH 3<br />
CH 3 C CH 2CH 3<br />
Br<br />
2-bromo-2-metilbutano<br />
+ CH 3CH 2ONa<br />
2-butene<br />
CH 3<br />
CH 3<br />
C CHCH 3<br />
2-metil-2-butene<br />
+ CH 3CH 2OH + NaBr<br />
36
La reazione viene definita<br />
reazione di β-eliminazione E2<br />
37
Regola di Zaitsev: tra gli <strong>alcheni</strong> isomerici possibili, predomina<br />
l’alchene avente il maggior numero di sostituenti sul doppio legame<br />
38
L’eliminazione da una conformazione in cui l’idrogeno si trovi in anti<br />
rispetto al gruppo uscente risulta nettamente favorita<br />
39
Riarrangiamento del carbocatione<br />
40
1) Trasferimento di un protone con formazione del carbocatione<br />
CH 3<br />
CH 3 C CH<br />
H<br />
CH 2<br />
+ HCl<br />
CH 3 C CH<br />
II<br />
CH 3<br />
H<br />
CH 3<br />
CH 3 C CH<br />
III<br />
H<br />
CH 3<br />
CH 3<br />
veloce<br />
CH 3<br />
CH 3 C CH<br />
2) Riarrangiamento del carbocatione II a carbocatione III più stabile per<br />
migrazione di un idrogeno con i suoi elettroni di legame<br />
CH 3<br />
CH 3 C CH<br />
3) Reazione del carbocatione III con il nucleofilo<br />
H<br />
III<br />
H<br />
CH 3<br />
CH 3<br />
CH 3<br />
+ Cl CH 3 C CH<br />
Cl<br />
carbocatione<br />
secondario<br />
H<br />
CH 3<br />
41
1) Trasferimento di un protone con formazione del carbocatione<br />
CH 3<br />
CH 3 C CH<br />
CH 3<br />
CH 2<br />
+ HCl<br />
2) Riarrangiamento del carbocatione II a carbocatione III più stabile per<br />
migrazione di un gruppo CH 3 con i suoi elettroni di legame<br />
CH 3<br />
CH 3<br />
C CH<br />
CH 3<br />
CH 3<br />
CH 3 CH 3 C CH<br />
II III<br />
3) Reazione del carbocatione III con il nucleofilo<br />
CH 3<br />
CH 3 C CH<br />
III<br />
CH 3<br />
CH 3<br />
+ Cl<br />
CH 3<br />
CH 3 C CH<br />
CH 3<br />
II<br />
CH 3<br />
carbocatione<br />
secondario<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3 C CH<br />
Cl<br />
CH 3<br />
CH 3<br />
42
Somma di acidi<br />
alogenidrici<br />
Reazioni degli <strong>alchini</strong><br />
Somma di alogeni<br />
Reazioni di<br />
addizione<br />
elettrofila<br />
Somma<br />
di acqua<br />
43
Riduzione:<br />
addizione di H 2<br />
R-C≅C-R + H 2 + catalizzatore di Lindlar _____ > cis R-CH=CH-R<br />
R-C≅C-R + 2 Na in NH 3 (liq) _____ > trans R-CH=CH-R + 2 NaNH 2<br />
45
Acidità degli <strong>alchini</strong><br />
L’idrogeno legato al carbonio di un triplo legame è debolmente<br />
acido e può essere rimosso da basi molto forti:<br />
H-C≅C-H + NaNH 2 (in ammoniaca o etere) _____ > H-C≅C-Na + NH 3<br />
CH 3 -C≅C-H + NaNH 2 (in ammoniaca o etere) _____ > CH 3-C≅C-Na + NH 3<br />
RC≅C-H + C 2 H 5 MgBr (in ether) _____ > RC≅C-MgBr + C 2 H 6<br />
H-C≅C-Na + CH 3 -I _____ > H-C≅C-CH3 + NaI + NH 3<br />
CH 3 -C≅C-Na + C 2 H 5 -Br _____ > CH3 -C≅C-C 2 H 5 + NaBr<br />
46
Questa reazione avviene facilmente per gli idrogeni degli <strong>alchini</strong> mentre<br />
non avviene nel caso di idrogeni legati al carbonio di un doppio legame o<br />
di un legame semplice.<br />
sp 3<br />
C<br />
25% s<br />
75%p<br />
H<br />
H<br />
H<br />
sp 2<br />
C<br />
H<br />
H<br />
33% s<br />
66% p<br />
sp<br />
50% s<br />
50%p<br />
C H<br />
Quando il carbonio presenta una ibridazione con crescente carattere s e<br />
decrescente carattere p , l’acidità dell’idrogeno ad esso legato cresce:<br />
perché?<br />
gli orbitali s sono più vicini al nucleo rispetto ai p, quindi gli elettroni di<br />
legame sono più vicini all’atomo di carbonio nel legame C≅H: ciò facilita il<br />
distacco del protone da parte di una base sufficientemente forte.<br />
47
Devi essere in grado di:<br />
Descrivere le caratteristiche generali degli <strong>alcheni</strong> e <strong>alchini</strong> (tipo e angoli di legame,<br />
geometria della molecola…)<br />
Differenziare i legami multipli coniugati, isolati, cumulati<br />
Dare il nome corretto secondo la IUPAC a <strong>alcheni</strong> e <strong>alchini</strong><br />
Discutere l’isomeria cis/trans e sistema E/Z<br />
Discutere:<br />
Reazioni principali degli <strong>alcheni</strong>:<br />
•addizioni elettrofile di acidi alogenidrici, alogeni, acqua, aloidrine, epossidazione<br />
•regola di Markovnikov<br />
•reazioni di idrogenazione e di ossidazione<br />
Metodi di ottenimento degli <strong>alcheni</strong><br />
•disidratazione, deidroalogenazione, idrogenazione da <strong>alchini</strong><br />
Reazioni degli <strong>alchini</strong>:<br />
•idrogenazione<br />
•addizione di alogeni, acidi alogenidrici, acqua<br />
Acidità degli <strong>alchini</strong><br />
I carbocationi: stabilità e riarrangiamento<br />
48