Calor e 1a lei.pdf - Unidade Acadêmica de Física - UFCG
Calor e 1a lei.pdf - Unidade Acadêmica de Física - UFCG
Calor e 1a lei.pdf - Unidade Acadêmica de Física - UFCG
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Notas <strong>de</strong> aula – <strong>Física</strong> II; Profs Ricardo e Amauri<br />
<strong>Calor</strong> e Primeira Lei<br />
5 – Trabalho e Diagrama PV <strong>de</strong> um Gás<br />
Aplicações da 1 a Lei da Termodinâmica.<br />
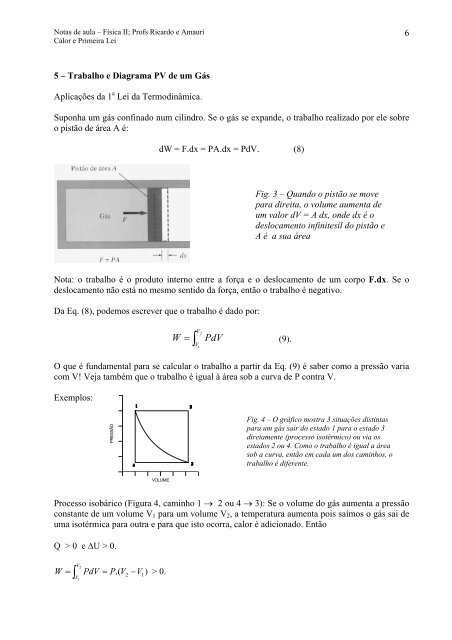
Suponha um gás confinado num cilindro. Se o gás se expan<strong>de</strong>, o trabalho realizado por ele sobre<br />
o pistão <strong>de</strong> área A é:<br />
dW = F.dx = PA.dx = PdV. (8)<br />
Nota: o trabalho é o produto interno entre a força e o <strong>de</strong>slocamento <strong>de</strong> um corpo F.dx. Se o<br />
<strong>de</strong>slocamento não está no mesmo sentido da força, então o trabalho é negativo.<br />
Da Eq. (8), po<strong>de</strong>mos escrever que o trabalho é dado por:<br />
V<br />
V PdV<br />
∫<br />
= f<br />
W (9).<br />
i<br />
O que é fundamental para se calcular o trabalho a partir da Eq. (9) é saber como a pressão varia<br />
com V! Veja também que o trabalho é igual à área sob a curva <strong>de</strong> P contra V.<br />
Exemplos:<br />
Processo isobárico (Figura 4, caminho 1 → 2 ou 4 → 3): Se o volume do gás aumenta a pressão<br />
constante <strong>de</strong> um volume V1 para um volume V2, a temperatura aumenta pois saímos o gás sai <strong>de</strong><br />
uma isotérmica para outra e para que isto ocorra, calor é adicionado. Então<br />
Q > 0 e ∆U > 0.<br />
V<br />
2<br />
W = ∫ PdV = P V −V<br />
) > 0.<br />
V<br />
1<br />
PRESSÃO<br />
.( 2 1<br />
VOLUME<br />
Fig. 3 – Quando o pistão se move<br />
para direita, o volume aumenta <strong>de</strong><br />
um valor dV = A dx, on<strong>de</strong> dx é o<br />
<strong>de</strong>slocamento infinitesil do pistão e<br />
A é a sua área<br />
Fig. 4 – O gráfico mostra 3 situações distintas<br />
para um gás sair do estado 1 para o estado 3<br />
diretamente (processo isotérmico) ou via os<br />
estados 2 ou 4. Como o trabalho é igual a área<br />
sob a curva, então em cada um dos caminhos, o<br />
trabalho é diferente.<br />
6