sp3, sp2 y sp - Docentes en UMSS
sp3, sp2 y sp - Docentes en UMSS
sp3, sp2 y sp - Docentes en UMSS
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
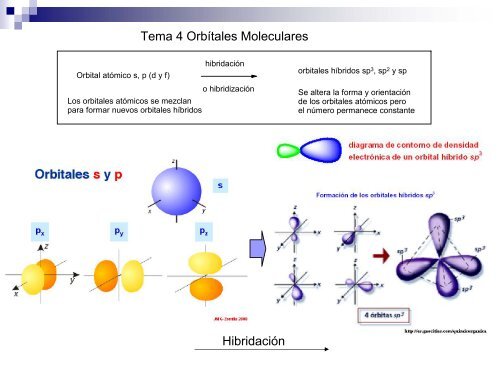
Orbital atómico s, p (d y f)<br />
Los orbitales atómicos se mezclan<br />
para formar nuevos orbitales híbridos<br />
Tema 4 Orbítales Moleculares<br />
hibridación<br />
o hibridización<br />
Hibridación<br />
orbitales híbridos <strong>sp</strong> 3 , <strong>sp</strong> 2 y <strong>sp</strong><br />
Se altera la forma y ori<strong>en</strong>tación<br />
de los orbitales atómicos pero<br />
el número permanece constante
Hibridación de orbitales.<br />
En algunas moléculas se pres<strong>en</strong>ta el problema de explicar cómo a partir de<br />
orbitales atómicos difer<strong>en</strong>tes se pued<strong>en</strong> formar <strong>en</strong>laces idénticos. Hay que suponer<br />
que durante la reacción se produce un proceso de hibridación o recombinación de<br />
orbitales atómicos puros, resultando unos nuevos orbitales atómicos híbridos.<br />
Dichos orbitales se caracterizan por:<br />
1. Se produce el mismo número de orbitales híbridos que orbitales atómicos de<br />
partida.<br />
2. Son todos iguales, <strong>en</strong>ergéticam<strong>en</strong>te y formalm<strong>en</strong>te. Sólo se difer<strong>en</strong>cian <strong>en</strong> su<br />
ori<strong>en</strong>tación e<strong>sp</strong>acial.<br />
3. Para que pueda existir hibridación, la <strong>en</strong>ergía de los orbitales atómicos de<br />
partida debe ser muy similar.<br />
4. Los ángulos <strong>en</strong>tre ellos son iguales.
Puede haber difer<strong>en</strong>tes combinaciones de orbitales atómicos<br />
Esa simbología indica el número de orbitales atómicos puros que<br />
se están combinando y el tipo de cada uno de ellos.<br />
<strong>sp</strong> significa que se combina un orbital s con un p<br />
<strong>sp</strong> 2 significa que se combina un orbital s con dos p<br />
<strong>sp</strong> 3 significa que se combina un orbital s con tres p<br />
<strong>sp</strong> 3d significa que se combina un orbital s tres p y un d<br />
<strong>sp</strong> 3 d 2 significa que se combina un orbital s tres p y dos d
Formas geométricas
orbitales atómicos<br />
2s<br />
s p x p y p z<br />
Formación de la hibridación <strong>sp</strong> 3<br />
2p<br />
hibridación<br />
X<br />
109.5 o<br />
cuatro orbitales<br />
<strong>sp</strong> 3<br />
geometría tetraédrica
orbitales atómicos<br />
2s<br />
s p x p y p z<br />
Formación de la hibridación <strong>sp</strong> 2<br />
2p<br />
hibridación<br />
geometría planar<br />
tres orbitales<br />
<strong>sp</strong> 2<br />
120 o<br />
orbital vacío<br />
2p
orbitales atómicos<br />
2s<br />
2p<br />
s p x p y p z<br />
Formación de la hibridación <strong>sp</strong><br />
hibridación<br />
180 o<br />
geometría lineal<br />
dos orbitales<br />
<strong>sp</strong><br />
dos orbitales<br />
vacíos 2p<br />
H C C H<br />
etino o acetil<strong>en</strong>o
2A<br />
Be <strong>sp</strong><br />
B C N O<br />
Hibridaciones <strong>sp</strong> 3 , <strong>sp</strong> 2 y <strong>sp</strong><br />
3A 4A 5A 6A 7A<br />
<strong>sp</strong> 2 <strong>sp</strong> 3<br />
<strong>sp</strong> 2<br />
<strong>sp</strong><br />
<strong>sp</strong> 3<br />
<strong>sp</strong> 2<br />
<strong>sp</strong><br />
<strong><strong>sp</strong>3</strong> <strong><strong>sp</strong>2</strong> Cl<br />
Br<br />
I<br />
<strong>sp</strong> 3<br />
<strong>sp</strong> 3<br />
<strong>sp</strong> 3<br />
<strong>sp</strong> 3<br />
<strong>sp</strong> 2<br />
<strong>sp</strong><br />
tipo y número de <strong>en</strong>laces<br />
4 <strong>en</strong>laces s<strong>en</strong>cillos<br />
un <strong>en</strong>lace doble y dos s<strong>en</strong>cillos<br />
un <strong>en</strong>lace triple y un s<strong>en</strong>cillo
Combinación de orbitales atómicos. Orbitales α (sigma) y π (pi):<br />
Enlace s<strong>en</strong>cillo formado por un <strong>en</strong>lace σ <strong>en</strong> la molécula de etano<br />
<strong>en</strong>lace sigma formado por<br />
dos orbitales <strong><strong>sp</strong>3</strong> - <strong><strong>sp</strong>3</strong> <strong>en</strong>lace sigma formado por<br />
dos orbitales <strong><strong>sp</strong>3</strong> - <strong><strong>sp</strong>3</strong>
Doble <strong>en</strong>lace formado por un <strong>en</strong>lace σ y un <strong>en</strong>lace μ <strong>en</strong> la molécula de et<strong>en</strong>o (etil<strong>en</strong>o)
H<br />
CH 4<br />
metano<br />
H<br />
C<br />
H<br />
H<br />
Ejemplos de hibridación <strong>sp</strong> 3 molécula de metano
<strong>sp</strong> 3<br />
Propano<br />
<strong><strong>sp</strong>3</strong><br />
CH 3 -CH 2 -CH 3<br />
<strong><strong>sp</strong>3</strong>
Molécula de agua (geometría tetraédrica)<br />
H 2 O<br />
H O H
Molécula de amoniaco (geometría tetraédrica)<br />
H<br />
NH 3<br />
N<br />
H<br />
H
BF 3<br />
F<br />
B<br />
Molécula de BF 3 (geometría trigonal planar)<br />
F<br />
F<br />
F<br />
F<br />
B<br />
orbitales 2p del Fluor<br />
F<br />
tres orbitales<br />
<strong>sp</strong> 2 del boro
Molécula de BeCl 2 (geometría lineal)<br />
BeCl 2<br />
Cl Be Cl
Molécula de dióxido de carbono (geometría lineal)<br />
Enlaces pi<br />
<strong>en</strong>lace sigma<br />
<strong>en</strong>lace sigma<br />
orbital p orbitales p orbitales p<br />
O<br />
C<br />
orbitales <strong><strong>sp</strong>2</strong> orbital <strong>sp</strong> orbitales <strong><strong>sp</strong>2</strong><br />
O<br />
<strong>en</strong>lace pi <strong>en</strong>lace pi<br />
CO 2<br />
par de e -<br />
Enlaces sigma
La molécula CO<br />
Conti<strong>en</strong>e 10 electrones de val<strong>en</strong>cia que forman una distribución electrónica de<br />
octetos: Un <strong>en</strong>lace triple y un par de electrones solitarios tanto <strong>en</strong> C como <strong>en</strong><br />
O. Esto requiere que ambos átomos sufran una hibridación <strong>sp</strong>.<br />
El <strong>en</strong>lace triple consiste <strong>en</strong>tonces de un sigma formado por los <strong>sp</strong> de ambos<br />
átomos y dos <strong>en</strong>laces pi productos del recubrimi<strong>en</strong>to de los orbitales 2p tanto <strong>en</strong><br />
C como <strong>en</strong> O . La molécula es forzosam<strong>en</strong>te lineal.
Hibridaciones del carbono, mostrando los electrones de val<strong>en</strong>cia<br />
estado<br />
basal<br />
2s 2p<br />
2s 2p<br />
2s 2p<br />
promoción de<br />
un electrón<br />
promoción de<br />
un electrón<br />
promoción de<br />
un electrón<br />
4 orbitales <strong>sp</strong> 3<br />
3 orbitales <strong>sp</strong> 2 y un orbital p<br />
2 orbitales <strong>sp</strong> y 2 orbitales p<br />
s + 3 p → 4 <strong>sp</strong> 3 s + 2 p → 3 <strong>sp</strong> 2 + 1 p<br />
s + p → 2 <strong>sp</strong> + 2 p
Hibridaciones del nitróg<strong>en</strong>o, mostrando los electrones de val<strong>en</strong>cia<br />
estado basal<br />
2s 2p<br />
2s 2p<br />
2s 2p<br />
promoción de<br />
un orbital<br />
promoción de<br />
un orbital<br />
promoción de<br />
un orbital<br />
4 orbitales <strong>sp</strong> 3<br />
3 orbitales <strong>sp</strong> 2 y un orbital p<br />
2 orbitales <strong>sp</strong> y 2 orbitales p
Hibridación: <strong>sp</strong> 3 d = s + 3 p + d → 5 <strong>sp</strong> 3 d + 4 d<br />
Geometría = bipiramidal Ejemplo: PCl 5
Hexafluoruro de azufre (SF 6 ); hibridación <strong>sp</strong> 3 d 2 :<br />
El Azufre ti<strong>en</strong>e de número atómico Z = 16 y su estructura electrónica es:<br />
ti<strong>en</strong>e dos electrones desapareados y puede formar dos <strong>en</strong>laces. Así es su<br />
configuración cuando actúa con val<strong>en</strong>cia 2. Pero, al t<strong>en</strong>er los orbitales 3d una <strong>en</strong>ergía<br />
similar a la de los 3s y 3p, con un poco más de <strong>en</strong>ergía, desaparea todos sus electrones<br />
adquiri<strong>en</strong>do la configuración:<br />
Los seis <strong>en</strong>laces que puede formar son iguales, produciéndose una<br />
homog<strong>en</strong>eización de un orbital s, tres p y dos d, es decir, se forman seis orbitales<br />
híbridos <strong>sp</strong> 3 d 2 :<br />
La molécula de hexafluoruro de azufre<br />
ti<strong>en</strong>e una estructura e<strong>sp</strong>acial octoédrica.