cito-2014-01
cito-2014-01
cito-2014-01
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
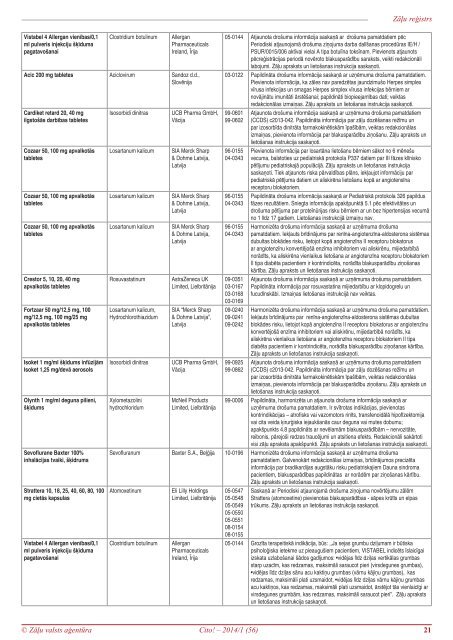
Zāļu reģistrs<br />
Vistabel 4 Allergan vienības/0,1<br />
ml pulveris injekciju šķīduma<br />
pagatavošanai<br />
Clostridium botulinum<br />
Allergan<br />
Pharmaceuticals<br />
Ireland, Īrija<br />
Acic 200 mg tabletes Aciclovirum Sandoz d.d.,<br />
Slovēnija<br />
Cardiket retard 20, 40 mg<br />
ilgstošās darbības tabletes<br />
Cozaar 50, 100 mg apvalkotās<br />
tabletes<br />
Cozaar 50, 100 mg apvalkotās<br />
tabletes<br />
Cozaar 50, 100 mg apvalkotās<br />
tabletes<br />
Crestor 5, 10, 20, 40 mg<br />
apvalkotās tabletes<br />
Fortzaar 50 mg/12,5 mg, 100<br />
mg/12,5 mg, 100 mg/25 mg<br />
apvalkotās tabletes<br />
Isoket 1 mg/ml šķīdums infūzijām<br />
Isoket 1,25 mg/devā aerosols<br />
Olynth 1 mg/ml deguna pilieni,<br />
šķīdums<br />
Sevoflurane Baxter 100%<br />
inhalācijas tvaiki, šķidrums<br />
Strattera 10, 18, 25, 40, 60, 80, 100<br />
mg cietās kapsulas<br />
Vistabel 4 Allergan vienības/0,1<br />
ml pulveris injekciju šķīduma<br />
pagatavošanai<br />
Isosorbidi dinitras<br />
Losartanum kalicum<br />
Losartanum kalicum<br />
Losartanum kalicum<br />
Rosuvastatinum<br />
Losartanum kalicum,<br />
Hydrochlorothiazidum<br />
Isosorbidi dinitras<br />
Xylometazolini<br />
hydrochloridum<br />
UCB Pharma GmbH,<br />
Vācija<br />
SIA Merck Sharp<br />
& Dohme Latvija,<br />
Latvija<br />
SIA Merck Sharp<br />
& Dohme Latvija,<br />
Latvija<br />
SIA Merck Sharp<br />
& Dohme Latvija,<br />
Latvija<br />
AstraZeneca UK<br />
Limited, Lielbritānija<br />
SIA “Merck Sharp<br />
& Dohme Latvija”,<br />
Latvija<br />
UCB Pharma GmbH,<br />
Vācija<br />
McNeil Products<br />
Limited, Lielbritānija<br />
05-<strong>01</strong>44 Atjaunota drošuma informācija saskaņā ar drošuma pamatdatiem pēc<br />
Periodiski atjaunojamā drošuma ziņojuma darba dalīšanas procedūras IE/H /<br />
PSUR/0<strong>01</strong>5/006 aktīvai vielai A tipa botulīna toksīnam. Pievienots atjaunots<br />
pēcreģistrācijas periodā novēroto blakusparādību saraksts, veikti redakcionāli<br />
labojumi. Zāļu apraksts un lietošanas instrukcija saskaņoti.<br />
03-<strong>01</strong>22 Papildināta drošuma informācija saskaņā ar uzņēmuma drošuma pamatdatiem.<br />
Pievienota informācija, ka zāles nav paredzētas jaundzimušo Herpes simplex<br />
vīrusa infekcijas un smagas Herpes simplex vīrusa infekcijas bērniem ar<br />
novājinātu imunitāti ārstēšanai; papildināti biopieejamības dati; veiktas<br />
redakcionālas izmaiņas. Zāļu apraksts un lietošanas instrukcija saskaņoti.<br />
99-06<strong>01</strong><br />
99-0602<br />
96-<strong>01</strong>55<br />
04-0343<br />
96-<strong>01</strong>55<br />
04-0343<br />
96-<strong>01</strong>55<br />
04-0343<br />
09-0351<br />
03-<strong>01</strong>67<br />
03-<strong>01</strong>68<br />
03-<strong>01</strong>69<br />
09-0240<br />
09-0241<br />
09-0242<br />
99-0925<br />
99-0862<br />
Atjaunota drošuma informācija saskaņā ar uzņēmuma drošuma pamatdatiem<br />
(CCDS) c2<strong>01</strong>3-042. Papildināta informācija par zāļu dozēšanas režīmu un<br />
par izosorbīda dinitrāta farmakokinētiskām īpašībām, veiktas redakcionālas<br />
izmaiņas, pievienota informācija par blakusparādību ziņošanu. Zāļu apraksts un<br />
lietošanas instrukcija saskaņoti.<br />
Pievienota informācija par losartāna lietošanu bērniem sākot no 6 mēnešu<br />
vecuma, balstoties uz pediatriskā protokola P337 datiem par III fāzes klīnisko<br />
pētījumu pediatriskajā populācijā. Zāļu apraksts un lietošanas instrukcija<br />
saskaņoti. Tiek atjaunots riska pārvaldības plāns, iekļaujot informāciju par<br />
pediatriskā pētījuma datiem un aliskirēna lietošanu kopā ar angiotensīna<br />
receptoru blokatoriem.<br />
Papildināta drošuma informācija saskaņā ar Pediatriskā protokola 326 papildus<br />
fāzes rezultātiem. Sniegta informācija apakšpunktā 5.1 pēc efektivitātes un<br />
drošuma pētījuma par proteīnūrijas risku bērniem ar un bez hipertensijas vecumā<br />
no 1 līdz 17 gadiem. Lietošanas instrukcijā izmaiņu nav.<br />
Harmonizēta drošuma informācija saskaņā ar uzņēmuma drošuma<br />
pamatdatiem. Iekļauts brīdinājums par renīna-angiotenzīna-aldosterona sistēmas<br />
dubultas blokādes risku, lietojot kopā angiotenzīna II receptoru blokatorus<br />
ar angiotenzīnu konvertējošā enzīma inhibitoriem vai aliskirēnu, mijiedarbībā<br />
norādīts, ka aliskirēna vienlaikus lietošana ar angiotenzīna receptoru blokatoriem<br />
II tipa diabēta pacientiem ir kontrindicēta, norādīta blakusparādību ziņošanas<br />
kārtība. Zāļu apraksts un lietošanas instrukcija saskaņoti.<br />
Atjaunota drošuma informācija saskaņā ar uzņēmuma drošuma pamatdatiem.<br />
Papildināta informācija par rosuvastatina mijiedarbību ar klopidogrelu un<br />
fucudīnskābi. Izmaiņas lietošanas instrukcijā nav veiktas.<br />
Harmonizēta drošuma informācija saskaņā ar uzņēmuma drošuma pamatdatiem.<br />
Iekļauts brīdinājums par renīna-angiotenzīna-aldosterona sistēmas dubultas<br />
blokādes risku, lietojot kopā angiotenzīna II receptoru blokatorus ar angiotenzīnu<br />
konvertējošā enzīma inhibitoriem vai aliskirēnu, mijiedarbībā norādīts, ka<br />
aliskirēna vienlaikus lietošana ar angiotenzīna receptoru blokatoriem II tipa<br />
diabēta pacientiem ir kontrindicēta, norādīta blakusparādību ziņošanas kārtība.<br />
Zāļu apraksts un lietošanas instrukcija saskaņoti.<br />
Atjaunota drošuma informācija saskaņā ar uzņēmuma drošuma pamatdatiem<br />
(CCDS) c2<strong>01</strong>3-042. Papildināta informācija par zāļu dozēšanas režīmu un<br />
par izosorbīda dinitrāta farmakokinētiskām īpašībām, veiktas redakcionālas<br />
izmaiņas, pievienota informācija par blakusparādību ziņošanu. Zāļu apraksts un<br />
lietošanas instrukcija saskaņoti.<br />
99-0006 Papildināta, harmonizēta un atjaunota drošuma informācija saskaņā ar<br />
uzņēmuma drošuma pamatdatiem. Ir svītrotas indikācijas, pievienotas<br />
kontrindikācijas – atrofisks vai vazomotors rinīts, transfenoidālā hipofīzektomija<br />
vai cita veida ķirurģiska iejaukšanās caur deguna vai mutes dobumu;<br />
apakšpunkts 4.8 papildināts ar nevēlamām blakusparādībām – nervozitāte,<br />
reibonis, pārejoši redzes traucējumi un atsitiena efekts. Redakcionāli sakārtoti<br />
visi zāļu apraksta apakšpunkti. Zāļu apraksts un lietošanas instrukcija saskaņoti.<br />
Sevofluranum Baxter S.A., Beļģija 10-<strong>01</strong>96 Harmonizēta drošuma informācija saskaņā ar uzņēmuma drošuma<br />
pamatdatiem. Galvenokārt redakcionālas izmaiņas, brīdinājumos precizēta<br />
informācija par bradikardijas augstāku risku pediatriskajiem Dauna sindroma<br />
pacientiem, blakusparādības papildinātas ar norādēm par ziņošanas kārtību.<br />
Zāļu apraksts un lietošanas instrukcija saskaņoti.<br />
Atomoxetinum<br />
Clostridium botulinum<br />
Eli Lilly Holdings<br />
Limited, Lielbritānija<br />
Allergan<br />
Pharmaceuticals<br />
Ireland, Īrija<br />
05-0547<br />
05-0548<br />
05-0549<br />
05-0550<br />
05-0551<br />
08-<strong>01</strong>54<br />
08-<strong>01</strong>55<br />
Saskaņā ar Periodiski atjaunojamā drošuma ziņojuma novērtējumu zālēm<br />
Strattera (atomoxetine) pievienotas blakusparādības - sāpes krūtīs un elpas<br />
trūkums. Zāļu apraksts un lietošanas instrukcija saskaņoti.<br />
05-<strong>01</strong>44 Grozīta terapeitiskā indikācija, būs: ,,Ja sejas grumbu dziļumam ir būtiska<br />
psiholoģiska ietekme uz pieaugušiem pacientiem, VISTABEL indicēts īslaicīgai<br />
izskata uzlabošanai šādos gadījumos: •vidējas līdz dziļas vertikālas grumbas<br />
starp uzacīm, kas redzamas, maksimāli saraucot pieri (virsdegunes grumbas),<br />
•vidējas līdz dziļas sānu acu kaktiņu grumbas (vārnu kājiņu grumbas), kas<br />
redzamas, maksimāli plati uzsmaidot, •vidējas līdz dziļas vārnu kājiņu grumbas<br />
acu kaktiņos, kas redzamas, maksimāli plati uzsmaidot, ārstējot tās vienlaicīgi ar<br />
virsdegunes grumbām, kas redzamas, maksimāli saraucot pieri”. Zāļu apraksts<br />
un lietošanas instrukcija saskaņoti.<br />
© Zāļu valsts aģentūra Cito! – <strong>2<strong>01</strong>4</strong>/1 (56) 21