Diagramas de equilibrio en cuerpos puros - Web del Profesor
Diagramas de equilibrio en cuerpos puros - Web del Profesor
Diagramas de equilibrio en cuerpos puros - Web del Profesor
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Diagramas</strong> <strong>de</strong> <strong>equilibrio</strong> <strong>en</strong> <strong>cuerpos</strong> <strong>puros</strong> Cátedra Física II (Lic<strong>en</strong>ciatura <strong>en</strong> Física)<br />
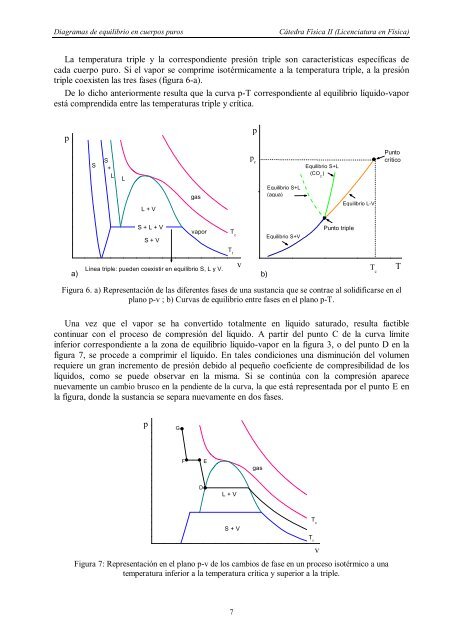
La temperatura triple y la correspondi<strong>en</strong>te presión triple son características específicas <strong>de</strong><br />
cada cuerpo puro. Si el vapor se comprime isotérmicam<strong>en</strong>te a la temperatura triple, a la presión<br />
triple coexist<strong>en</strong> las tres fases (figura 6-a).<br />
De lo dicho anteriorm<strong>en</strong>te resulta que la curva p-T correspondi<strong>en</strong>te al <strong>equilibrio</strong> líquido-vapor<br />
está compr<strong>en</strong>dida <strong>en</strong>tre las temperaturas triple y crítica.<br />
p<br />
a)<br />
S<br />
S<br />
+<br />
L<br />
L<br />
L + V<br />
S + L + V<br />
S + V<br />
gas<br />
vapor<br />
Línea triple: pue<strong>de</strong>n coexistir <strong>en</strong> <strong>equilibrio</strong> S, L y V.<br />
T c<br />
T t<br />
7<br />
v<br />
p<br />
p c<br />
b)<br />
Equilibrio S+L<br />
(agua)<br />
Equilibrio S+V<br />
Equilibrio S+L<br />
(CO 2 )<br />
Punto triple<br />
Equilibrio L-V<br />
T c<br />
Punto<br />
crítico<br />
Figura 6. a) Repres<strong>en</strong>tación <strong>de</strong> las difer<strong>en</strong>tes fases <strong>de</strong> una sustancia que se contrae al solidificarse <strong>en</strong> el<br />
plano p-v ; b) Curvas <strong>de</strong> <strong>equilibrio</strong> <strong>en</strong>tre fases <strong>en</strong> el plano p-T.<br />
Una vez que el vapor se ha convertido totalm<strong>en</strong>te <strong>en</strong> líquido saturado, resulta factible<br />
continuar con el proceso <strong>de</strong> compresión <strong>de</strong>l líquido. A partir <strong>de</strong>l punto C <strong>de</strong> la curva límite<br />
inferior correspondi<strong>en</strong>te a la zona <strong>de</strong> <strong>equilibrio</strong> líquido-vapor <strong>en</strong> la figura 3, o <strong>de</strong>l punto D <strong>en</strong> la<br />
figura 7, se proce<strong>de</strong> a comprimir el líquido. En tales condiciones una disminución <strong>de</strong>l volum<strong>en</strong><br />
requiere un gran increm<strong>en</strong>to <strong>de</strong> presión <strong>de</strong>bido al pequeño coefici<strong>en</strong>te <strong>de</strong> compresibilidad <strong>de</strong> los<br />
líquidos, como se pue<strong>de</strong> observar <strong>en</strong> la misma. Si se continúa con la compresión aparece<br />
nuevam<strong>en</strong>te un cambio brusco <strong>en</strong> la p<strong>en</strong>di<strong>en</strong>te <strong>de</strong> la curva, la que está repres<strong>en</strong>tada por el punto E <strong>en</strong><br />
la figura, don<strong>de</strong> la sustancia se separa nuevam<strong>en</strong>te <strong>en</strong> dos fases.<br />
p<br />
G<br />
F E<br />
D<br />
L + V<br />
S + V<br />
Figura 7: Repres<strong>en</strong>tación <strong>en</strong> el plano p-v <strong>de</strong> los cambios <strong>de</strong> fase <strong>en</strong> un proceso isotérmico a una<br />
temperatura inferior a la temperatura crítica y superior a la triple.<br />
gas<br />
T c<br />
Tt v<br />
T