Tema 6: equilibrio ácido-base
Tema 6: equilibrio ácido-base
Tema 6: equilibrio ácido-base
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Tema</strong> 6: <strong>equilibrio</strong> <strong>ácido</strong>-<strong>base</strong><br />
33. El pH de una disolución saturada de hidróxido de Pb(II) es 9,9 a 25ºC. Calcula el producto de solubilidad a la<br />
misma temperatura.<br />
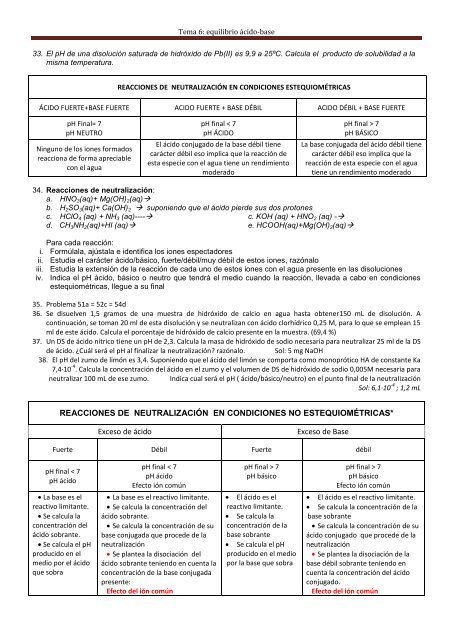
REACCIONES DE NEUTRALIZACIÓN EN CONDICIONES ESTEQUIOMÉTRICAS<br />
ÁCIDO FUERTE+BASE FUERTE ACIDO FUERTE + BASE DÉBIL ACIDO DÉBIL + BASE FUERTE<br />
pH Final= 7<br />
pH NEUTRO<br />
Ninguno de los iones formados<br />
reacciona de forma apreciable<br />
con el agua<br />
pH final < 7<br />
pH ÁCIDO<br />
El <strong>ácido</strong> conjugado de la <strong>base</strong> débil tiene<br />
carácter débil eso implica que la reacción de<br />
esta especie con el agua tiene un rendimiento<br />
moderado<br />
34. Reacciones de neutralización:<br />
a. HNO3(aq)+ Mg(OH)2(aq)<br />
b. H2SO3(aq)+ Ca(OH)2 suponiendo que el <strong>ácido</strong> pierde sus dos protones<br />
c. HClO4 (aq) + NH3 (aq)---- c. KOH (aq) + HNO2 (aq) -<br />
d. CH3NH2(aq)+HI (aq) e. HCOOH(aq)+Mg(OH)2(aq)<br />
pH final > 7<br />
pH BÁSICO<br />
La <strong>base</strong> conjugada del <strong>ácido</strong> débil tiene<br />
carácter débil eso implica que la<br />
reacción de esta especie con el agua<br />
tiene un rendimiento moderado<br />
Para cada reacción:<br />
i. Formúlala, ajústala e identifica los iones espectadores<br />
ii. Estudia el carácter <strong>ácido</strong>/básico, fuerte/débil/muy débil de estos iones, razónalo<br />
iii. Estudia la extensión de la reacción de cada uno de estos iones con el agua presente en las disoluciones<br />
iv. Indica el pH <strong>ácido</strong>, básico o neutro que tendrá el medio cuando la reacción, llevada a cabo en condiciones<br />
estequiométricas, llegue a su final<br />
35. Problema 51a = 52c = 54d<br />
36. Se disuelven 1,5 gramos de una muestra de hidróxido de calcio en agua hasta obtener150 mL de disolución. A<br />
continuación, se toman 20 ml de esta disolución y se neutralizan con <strong>ácido</strong> clorhídrico 0,25 M, para lo que se emplean 15<br />
ml de este <strong>ácido</strong>. Calcula el porcentaje de hidróxido de calcio presente en la muestra. (69,4 %)<br />
37. Un DS de <strong>ácido</strong> nítrico tiene un pH de 2,3. Calcula la masa de hidróxido de sodio necesaria para neutralizar 25 ml de la DS<br />
de <strong>ácido</strong>. ¿Cuál será el pH al finalizar la neutralización? razónalo. Sol: 5 mg NaOH<br />
38. El pH del zumo de limón es 3,4. Suponiendo que el <strong>ácido</strong> del limón se comporta como monoprótico HA de constante Ka<br />
7,4·10 -4 . Calcula la concentración del <strong>ácido</strong> en el zumo y el volumen de DS de hidróxido de sodio 0,005M necesaria para<br />
neutralizar 100 mL de ese zumo. Indica cual será el pH ( <strong>ácido</strong>/básico/neutro) en el punto final de la neutralización<br />
Sol: 6,1·10 -4 ; 1,2 mL<br />
REACCIONES DE NEUTRALIZACIÓN EN CONDICIONES NO ESTEQUIOMÉTRICAS*<br />
Exceso de <strong>ácido</strong> Exceso de Base<br />
Fuerte Débil Fuerte débil<br />
pH final < 7<br />
pH <strong>ácido</strong><br />
La <strong>base</strong> es el<br />
reactivo limitante.<br />
Se calcula la<br />
concentración del<br />
<strong>ácido</strong> sobrante.<br />
Se calcula el pH<br />
producido en el<br />
medio por el <strong>ácido</strong><br />
que sobra<br />
pH final < 7<br />
pH <strong>ácido</strong><br />
Efecto ión común<br />
La <strong>base</strong> es el reactivo limitante.<br />
Se calcula la concentración del<br />
<strong>ácido</strong> sobrante.<br />
Se calcula la concentración de su<br />
<strong>base</strong> conjugada que procede de la<br />
neutralización<br />
Se plantea la disociación del<br />
<strong>ácido</strong> sobrante teniendo en cuenta la<br />
concentración de la <strong>base</strong> conjugada<br />
presente:<br />
Efecto del ión común<br />
pH final > 7<br />
pH básico<br />
El <strong>ácido</strong> es el<br />
reactivo limitante.<br />
Se calcula la<br />
concentración de la<br />
<strong>base</strong> sobrante<br />
Se calcula el pH<br />
producido en el medio<br />
por la <strong>base</strong> que sobra<br />
pH final > 7<br />
pH básico<br />
Efecto ión común<br />
El <strong>ácido</strong> es el reactivo limitante.<br />
Se calcula la concentración de la<br />
<strong>base</strong> sobrante<br />
Se calcula la concentración de su<br />
<strong>ácido</strong> conjugado que procede de la<br />
neutralización<br />
Se plantea la disociación de la<br />
<strong>base</strong> débil sobrante teniendo en<br />
cuenta la concentración del <strong>ácido</strong><br />
conjugado.<br />
Efecto del ión común
<strong>Tema</strong> 6: <strong>equilibrio</strong> <strong>ácido</strong>-<strong>base</strong><br />
39 Determina el pH de la mezcla que resulta de mezclar 20mL de HCl 0,4 M y 30 mL de Ca(OH)2 0,2 M sol: pH=12,9<br />
40 Determina el pH de la mezcla que resulta de mezclar 50 mL de DS de HNO2 0,2 M (ka= 4,5.10 -4 ) y 20 mL de hidróxido de<br />
calcio 0,2 M Sol: 3,95<br />
41 Determina el pH de la mezcla que resulta de mezclar 30 mL de DS 0,5 M de etilamina (Kb= 5,6.10 -4 ) y 30 mL de DS 0,4 M<br />
de HNO3. Sol: pH=10,15<br />
42 Determina el pH que resulta de mezclar 20 mL de HCl 0,4 M y 5 mL de Ca(OH)2 0,2 M sol: pH=0,6<br />
Valoración:<br />
43 Problema 55b y c;<br />
44 Problema 56a Justifica ¿ por qué es básico el pH en el punto de equivalencia? ¿Qué indicadores podrías utilizar?<br />
45 Problemas 59,60,61b<br />
46 Un refresco de frutas utiliza <strong>ácido</strong> tartárico para conseguir un sabor <strong>ácido</strong> refrescante. Se valoran 25 mL de refresco con<br />
disolución de NaOH 0,15 M, de la que se gastan 18,6 mL. ¿Qué masa de <strong>ácido</strong> tartárico (C4H6O6, <strong>ácido</strong> diprótico) hay<br />
disuelta en cada litro de refresco? ¿Cómo será el pH en el punto de equivalencia? ¿Qué indicadores se podrían utilizar?<br />
Sol: 8,37 g<br />
47 Se desea valorar 50 mL de hidróxido de calcio, Ca(OH)2 de concentración 0,25 M. Para ello se utiliza una disolución de<br />
<strong>ácido</strong> clorhídrico, HCl, que es 0,30 M. ¿Qué volumen de disolución de <strong>ácido</strong> clorhídrico se necesita para alcanzar el<br />
punto de neutralización? (83,3 mL)