NOMENCLATURA Y FORMULACIÓN QUÍMICA.
NOMENCLATURA Y FORMULACIÓN QUÍMICA.
NOMENCLATURA Y FORMULACIÓN QUÍMICA.
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>FORMULACIÓN</strong> Y <strong>NOMENCLATURA</strong>ºººººººººººººººººººººººººººººººººººº<br />
<strong>QUÍMICA</strong> INORGÁNICA<br />
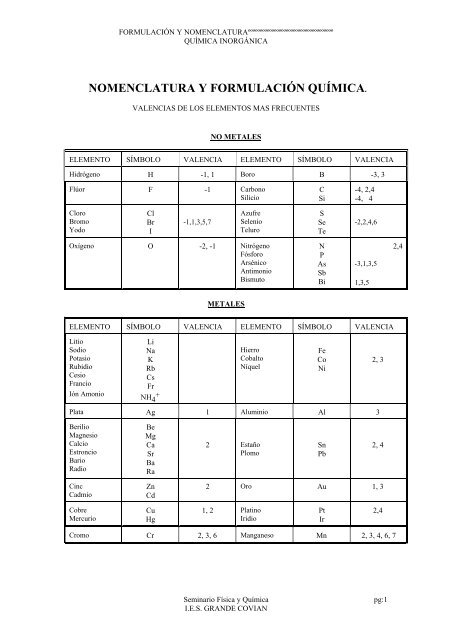
<strong>NOMENCLATURA</strong> Y <strong>FORMULACIÓN</strong> <strong>QUÍMICA</strong>.<br />
VALENCIAS DE LOS ELEMENTOS MAS FRECUENTES<br />
NO METALES<br />
ELEMENTO SÍMBOLO VALENCIA ELEMENTO SÍMBOLO VALENCIA<br />
Hidrógeno H -1, 1 Boro B -3, 3<br />
Flúor F -1 Carbono<br />
Silicio<br />
Cloro<br />
Bromo<br />
Yodo<br />
Cl<br />
Br<br />
I<br />
-1,1,3,5,7<br />
Azufre<br />
Selenio<br />
Teluro<br />
Oxígeno O -2, -1 Nitrógeno<br />
Fósforo<br />
Arsénico<br />
Antimonio<br />
Bismuto<br />
METALES<br />
Seminario Física y Química pg:1<br />
I.E.S. GRANDE COVIAN<br />
C<br />
Si<br />
S<br />
Se<br />
Te<br />
N<br />
P<br />
As<br />
Sb<br />
Bi<br />
-4, 2,4<br />
-4, 4<br />
-2,2,4,6<br />
-3,1,3,5<br />
ELEMENTO SÍMBOLO VALENCIA ELEMENTO SÍMBOLO VALENCIA<br />
Litio<br />
Sodio<br />
Potasio<br />
Rubidio<br />
Cesio<br />
Francio<br />
Ión Amonio<br />
Li<br />
Na<br />
K<br />
Rb<br />
Cs<br />
Fr<br />
NH 4 +<br />
Hierro<br />
Cobalto<br />
Níquel<br />
Plata Ag 1 Aluminio Al 3<br />
Berilio<br />
Magnesio<br />
Calcio<br />
Estroncio<br />
Bario<br />
Radio<br />
Cinc<br />
Cadmio<br />
Cobre<br />
Mercurio<br />
Be<br />
Mg<br />
Ca<br />
Sr<br />
Ba<br />
Ra<br />
Zn<br />
Cd<br />
Cu<br />
Hg<br />
2<br />
Estaño<br />
Plomo<br />
Fe<br />
Co<br />
Ni<br />
Sn<br />
Pb<br />
1,3,5<br />
2, 3<br />
2, 4<br />
2 Oro Au 1, 3<br />
1, 2 Platino<br />
Iridio<br />
Cromo Cr 2, 3, 6 Manganeso Mn 2, 3, 4, 6, 7<br />
Pt<br />
Ir<br />
2,4<br />
2,4
<strong>FORMULACIÓN</strong> Y <strong>NOMENCLATURA</strong>ºººººººººººººººººººººººººººººººººººº<br />
<strong>QUÍMICA</strong> INORGÁNICA<br />
COMPUESTOS BINARIOS<br />
Se da este nombre a los compuestos formados<br />
por dos clases de átomos: Y a X b .<br />
FÓRMULA.-<br />
La fórmula de estos compuestos representa<br />
la relación mas sencilla de sus constituyentes<br />
para la que se da la neutralidad eléctrica.<br />
<strong>FORMULACIÓN</strong>.-<br />
Para formular un compuesto binario se<br />
escribe el símbolo del elemento menos electronegativo<br />
(más a la izquierda en el S.P.) y, a<br />
continuación, el del otro elemento. Además se<br />
escriben los subíndices que representan el numero<br />
de átomos de cada uno presentes en la<br />
mínima cantidad de materia con las propiedades<br />
de la sustancia.<br />
Los subíndices coinciden con los valores<br />
absolutos de las valencias intercambiadas;<br />
cuando no son primos entre sí, se simplifican.<br />
<strong>NOMENCLATURA</strong>.- NORMA GENERAL.-<br />
Los compuestos binarios se nombran<br />
así:<br />
-nombre del elemento más electronegativo<br />
terminado en "-uro" excepto si es el oxígeno.<br />
-"...de..."<br />
-nombre del elemento menos electronegativo<br />
TOLERANCIA.-<br />
Se tolera el uso de las terminaciones<br />
"-oso" (menor valencia) e "-ico" (mayor valencia)<br />
en el elemento menos electronegativo. En<br />
ese caso se suprime la preposición "...de...".<br />
EJEMPLOS:<br />
CaS sulfuro cálcico o (mejor) sulfuro de calcio<br />
ZnCl 2 cloruro de cinc;<br />
KBr bromuro de potasio, etc.<br />
CASOS PARTICULARES<br />
I.- CON HIDRÓGENO.-<br />
Los compuestos binarios del hidrógeno<br />
se pueden nombrar de otras formas:<br />
A.- Con los halógenos (elementos del grupo del<br />
F) o con el S, Se y Te,<br />
- "ácido ..."<br />
- nombre apocopado del otro elemento terminado<br />
en "HÍDRICO"<br />
EJEMPLO:<br />
H 2 S, sulfuro de hidrógeno ó ácido sulfhídrico.<br />
B.- Con C o Si o un elemento del grupo del N.<br />
Se pueden nombrar siguiendo la norma general,<br />
pero es mejor con sus nombres tradicionales.<br />
EJEMPLOS:<br />
CH 4 hidruro de carbono o, mejor, metano<br />
PH 3 hidruro de fósforo o, mejor, fosfina<br />
NH 3 debe llamarse amoníaco.<br />
II.- SI PUEDEN FORMAR MÁS DE UN<br />
COMPUESTO BINARIO.-<br />
Se nombrarán indicando, a continuación<br />
del nombre del elemento menos electronegativo,<br />
su valencia en números romanos entre<br />
paréntesis (Sistema de Stock)<br />
EJEMPLOS:<br />
FeCl 2 cloruro de hierro(II) o (tolerado)<br />
ferroso.<br />
FeCl 3 cloruro de hierro(III) o (tolerado) férrico.<br />
III.- ENTRE DOS NO-METALES.-<br />
Cuando los compuestos binarios estén<br />
formados por dos no-metales se nombran expresando<br />
sus subíndices mediante los prefijos<br />
griegos, di, tri, tetra, penta, etc.- No se nombra<br />
el subíndice 1.<br />
EJEMPLOS.:<br />
ClF 3 trifluoruro de cloro<br />
PCl 5 pentacloruro de fósforo.<br />
Sb 2 S 3 trisulfuro de diantimonio<br />
ÓXIDOS<br />
Llamaremos óxidos a los compuestos<br />
binarios del oxígeno con cualquier otro elemento,<br />
tanto metálico como no metálico.<br />
A.- <strong>NOMENCLATURA</strong><br />
Distinguiremos entre óxidos metálicos<br />
y no metálicos.<br />
1.- ÓXIDOS METÁLICOS<br />
Se nombran así:<br />
- "óxido de..."<br />
- nombre del metal, sin modificación alguna. Si<br />
no basta para evitar ambigüedad se sigue con<br />
el numero de valencia con que actúa, en<br />
números romanos entre paréntesis:<br />
Li 2 O óxido de litio<br />
BeO óxido de berilio<br />
Na 2 O óxido de sodio<br />
CaO óxido de calcio<br />
Al 2 O 3 óxido de aluminio<br />
NiO óxido de níquel (II)<br />
Seminario Física y Química pg:2<br />
I.E.S. GRANDE COVIAN
<strong>FORMULACIÓN</strong> Y <strong>NOMENCLATURA</strong>ºººººººººººººººººººººººººººººººººººº<br />
<strong>QUÍMICA</strong> INORGÁNICA<br />
Co 2 O 3 óxido de cobalto (III)<br />
SnO 2 óxido de estaño (IV), etc.<br />
2.- ÓXIDOS NO METÁLICOS<br />
Los óxidos de los no metales se<br />
nombran así:<br />
- "óxido...<br />
precedido del prefijo de cantidad correspondiente,<br />
salvo si fuese "mono" en cuyo caso<br />
debe omitirse.<br />
- preposición "de"<br />
- nombre del otro elemento sin modificar y precedido<br />
del prefijo de cantidad adecuado, salvo<br />
si es "mono" que conviene omitir. Ejemplos:<br />
B2O3 trióxido de diboro<br />
Cl 2 O óxido de dicloro, etc.<br />
ÚNICA EXCEPCIÓN:<br />
H 2 O, se llamará siempre agua.<br />
B.- <strong>FORMULACIÓN</strong><br />
Los óxidos se formarán escribiendo el<br />
símbolo del oxígeno en último lugar, tanto si el<br />
elemento acompañante es metálico como si no<br />
lo es.<br />
Los subíndices son los necesarios<br />
para la saturación de todas las valencias de<br />
ambos elementos, teniendo presente que la del<br />
oxígeno es siempre 2. Tal como se recoge en la<br />
relación que se da en el párrafo sobre<br />
nomenclatura.<br />
C.- TOLERANCIA<br />
En el caso de los óxidos metálicos se<br />
tolera el uso de las modificaciones -oso e -ico,<br />
siempre que se empleen correctamente.<br />
CaO óxido cálcico<br />
FeO óxido ferroso<br />
CuO óxido cúprico<br />
Hg 2 O óxido mercurioso<br />
Ni 2 O 3 óxido niquélico<br />
HIDRÓXIDOS<br />
Se llaman HIDRÓXIDOS a los compuestos<br />
ternarios formados por un metal y uno o<br />
más grupos oxhidrilo, OH - . O sea, grupos<br />
constituidos por oxígeno e hidrógeno enlazados<br />
entre sí de modo que el hidrógeno satura una<br />
de las valencias del oxígeno quedando libre la<br />
otra.<br />
NOMBRE.-<br />
Los hidróxidos se nombran siempre de<br />
la misma forma:<br />
- "hidróxido de ... "<br />
- nombre del metal, sin modificación y seguido<br />
de su valencia en numero romano entre paréntesis<br />
, cuando es necesario para romper<br />
ambigüedades (Stock).<br />
<strong>FORMULACIÓN</strong>.-<br />
Se formulan escribiendo el símbolo<br />
del metal sin ningún subíndice y, a su derecha<br />
el símbolo OH, sin más si la valencia del<br />
metal es 1. Si el metal actúa con valencia<br />
superior el OH debe ir entre paréntesis seguido<br />
de un subíndice igual a la valencia del metal,<br />
ahora en caracteres arábigos.<br />
EJEMPLOS:<br />
LiOH hidróxido de litio<br />
Be(OH) 2 " berilio<br />
Al(OH)3 " aluminio<br />
Sn(OH) 4 " estaño (IV)<br />
ÁCIDOS.<br />
1. ÁCIDOS HIDRÁCIDOS<br />
Algunos de los compuestos binarios<br />
formados por la unión de un no metal con hidrógeno<br />
tienen propiedades ácidas al disolverse<br />
en agua. Estos no metales son los del grupo de<br />
los halógenos (F, Cl, Br e I) y de los anfígenos<br />
(S, Se y Te). Así, la disolución de cloruro de hidrógeno<br />
(gas) en agua presenta un marcado carácter<br />
ácido.<br />
Para nombrar estos ácidos se utiliza el<br />
sufijo hídrico. Así, por ejemplo:<br />
HCl ácido clorhídrico<br />
2. ÁCIDOS OXOÁCIDOS.<br />
Son compuestos formados por oxígeno,<br />
hidrógeno y un elemento no metálico que<br />
manifiestan carácter ácido y que responden a la<br />
siguiente fórmula general:<br />
H a X b O c<br />
donde X, es casi siempre un no metal, pero, a<br />
veces, puede ser un metal de transición.<br />
Este curso vamos a ver solamente la<br />
formulación funcional de los ácidos más corrientes<br />
(admitida por la IUPAC) dejando para<br />
más adelante la formulación de otros ácidos y la<br />
formulación sistemática.<br />
nomenc95 Seminario Física y Química pg:3<br />
I.E.S. GRANDE COVIAN
<strong>FORMULACIÓN</strong> Y <strong>NOMENCLATURA</strong>ºººººººººººººººººººººººººººººººººººº<br />
<strong>QUÍMICA</strong> INORGÁNICA<br />
Los ácidos oxoácidos se nombran<br />
mediante la palabra genérica ÁCIDO y una específica<br />
que contiene la raíz del elemento central,<br />
normalmente no metálico, y prefijos y<br />
que tiene la excepción del grupo del carbono y<br />
silicio, cuyos ácidos se nombran con la terminación<br />
ico a pesar de tener valencia + 4.<br />
Cuando solo existe una valencia posible, sea<br />
cual sea, la terminación es ico.<br />
Se formulan colocando en primer lugar<br />
el hidrógeno en número de 1 si la valencia<br />
del elemento central es impar y de 2 si es par. A<br />
continuación el elemento no metálico (en los<br />
ácidos sencillos un solo átomo) y finalmente el<br />
oxígeno. Para saber el número de oxígenos que<br />
hay en la molécula de cada ácido hay que tener<br />
en cuenta que en estos compuestos siempre el<br />
hidrógeno tiene valencia +1, el oxígeno -2 y la<br />
molécula de ácido es neutra (valencia 0). Por<br />
ejemplo:<br />
Ácido nítrico HN0 3<br />
según la tabla, el nitrógeno tiene valencia +5 ya<br />
que acaba en ico, lo que implica 1 hidrógeno y<br />
llamando c al nº de oxígenos:<br />
1 + 5 + c(-2) = 0<br />
6 - 2c = 0<br />
6 = 2c<br />
c = 3<br />
Otra forma de actuar consiste en considerar<br />
los ácidos oxoácidos como derivados de<br />
los óxidos no metálicos y agua (en unos casos la<br />
reacción se produce efectivamente y en otros<br />
SALES NEUTRAS<br />
Para su formulación, se sustituyen<br />
todos los hidrógenos de los ácidos por cationes<br />
metálicoscomo , por ejemplo:<br />
Del HCl AgCl<br />
Del H2S Del H2SO4 Del,H3PO4 CaS<br />
MgSO4 AlPO4 1. SALES BINARIAS NEUTRAS<br />
sufijos que indican la valencia de dicho<br />
elemento central de acuerdo con la siguiente<br />
tabla:<br />
Valencias Prefi. Sufijo Ejemplo<br />
+ 1 hipo oso HClO ácido hipocloroso<br />
+ 4 + 3 oso H 2 SO 3 ácido sulfuroso<br />
HNO 2 ácido nitroso<br />
+ 6 + 5 ico H 2 SO 4 ácido sulfúrico<br />
HBrO 3 ácido brómico<br />
+ 7 per ico HIO 4 ácido peryódico<br />
no). En el ejemplo anterior, como la<br />
terminación ico indica valencia +5,:<br />
N 2 0 5 + H 2 0 -------> H 2 N 2 0 6 -------> 2 HN0 3<br />
Los óxidos de fósforo, arsénico y antimonio,<br />
reaccionan, sin embargo, con tres moléculas<br />
de agua para formar los ácidos oxoácidos<br />
más corrientes de estos elementos que se nombran<br />
con el prefijo orto, que se puede omitir<br />
aunque conviene no hacerlo. Así:<br />
P 2 0 5 + 3 H 2 0 = 2 H 3 P0 4 ácido (orto)fosfórico<br />
En el caso del silicio, el ácido<br />
(orto)silícico se formaría al añadir dos<br />
moléculas de agua al óxido correspondiente:<br />
Si0 2 + 2 H 2 0 = H 4 Si0 4<br />
Sin embargo, el ácido carbónico es<br />
H2C03 Como ejemplos de ácidos importantes<br />
(dan lugar a sales muy utilizadas en química) en<br />
los que el elemento central es un elemento metálico,<br />
con valencias elevadas, tenemos:<br />
H2Cr04 ácido crómico<br />
H2Cr207 ácido dicrómico<br />
H2Mn04 ácido mangánico<br />
HMn04 ácido permangánico<br />
que siguen las reglas de formulación expresadas<br />
en el cuadro anterior.<br />
Formadas por un mettal y un no metal.<br />
Se nombran como cualquier compuesto binario<br />
y por tanto terminados en URO.<br />
Los elementos no metálicos tiene los<br />
siguientes estados de oxidación:<br />
F, Cl, Br, I, -1<br />
S, Se, Te : -2<br />
EJEMPLOS:<br />
nomenc95 Seminario Física y Química pg:4<br />
I.E.S. GRANDE COVIAN
NaF Fluoruro de sodio<br />
NaCl Cloruro de sodio<br />
KBr Bromuro de potasio<br />
MgI 2 Yoduro de magnesio<br />
Na 2 S Sulfuro de sodio<br />
CaSe Seleniuro de calcio<br />
Fe 2 Te 3 Telururo de sodio<br />
<strong>FORMULACIÓN</strong> Y <strong>NOMENCLATURA</strong>ºººººººººººººººººººººººººººººººººººº<br />
<strong>QUÍMICA</strong> INORGÁNICA<br />
2. SALES TERNARIAS u OXOSALES<br />
Ejemplos de Fórmulas y Nomenclatura<br />
As2O3<br />
LiClO4<br />
BaO<br />
RaO<br />
NH OH4<br />
Na2Te<br />
Pt(OH)4<br />
MgO<br />
NiCl2<br />
Cd(OH)2<br />
trióxido de diarsénico<br />
perclorato de litio<br />
óxido de bario<br />
óxido de radio<br />
hidróxido de amonio<br />
telururo de sodio<br />
hidróxido de platino (IV)<br />
óxido de magnesio<br />
cloruro de níquel (II)<br />
hidróxido de cadmio<br />
MnO2<br />
CaO<br />
Cs2O<br />
SO3<br />
Na2S<br />
CoO<br />
Fe(NO2)2<br />
I2O7<br />
HBrO3<br />
FeO<br />
Br2O7<br />
HClO<br />
HgO<br />
HF(aq)<br />
NaF<br />
Cl2O3<br />
HNO2<br />
Na2O<br />
PbS<br />
HClO2<br />
I2O5<br />
Hg2O<br />
(NH4)Cl<br />
H2CO3<br />
Be(OH)2<br />
óxido de manganeso (IV)<br />
óxido de calcio<br />
óxido de cesio<br />
triòxido de azufre<br />
sulfuro de sodio<br />
óxido de cobalto (II)<br />
nitrito de hierro (II)<br />
heptaóxido de diyodo<br />
ácido brómico<br />
óxido de hierro (II)<br />
heptaóxido de dibromo<br />
ácido hipocloroso<br />
óxido de mercurio (II)<br />
ácido fluorhídrico<br />
fluoruro de sodio<br />
trióxido de dicloro<br />
ácido dioxonítrico (III)<br />
óxido de sodio<br />
seleniuro de plomo (II)<br />
ácido cloroso<br />
pentaóxido de diyodo<br />
óxido de mercurio (I)<br />
cloruro de amonio<br />
ácido carbónico<br />
hidróxido de berilio<br />
N2O5<br />
ZnO<br />
CaSO3<br />
Pb(ClO2)2<br />
pentaóxido de dinitrógeno<br />
óxido de cinc<br />
sulfito de calcio<br />
clorito de plomo (II)<br />
Si el ácido termino en OSO, la sal<br />
termina en ITO.<br />
Si el ácido termina en ICO, la sal<br />
termina en ATO.<br />
De ácido hipocloroso (HClO) deriva<br />
hipoclorito de sodio (Na ClO)<br />
De ácido sulfúrico (H 2 SO 4 ) deriva sulfato de<br />
calcio (CaSO 4 )<br />
EJEMPLOS:<br />
MgSO3 Zn(IO4 ) 2<br />
Ca3 (PO4 ) 2<br />
Sulfito de magnesio<br />
peryodato de cinc<br />
(orto)fosfato de calcio<br />
HF<br />
Rb2O<br />
Sr(OH)2<br />
(NH4)2S<br />
Ca(OH)2<br />
fluoruro de hidrógeno<br />
óxido de rubidio<br />
hidróxido de estroncio<br />
sulfuro de amonio<br />
hidróxido de calcio<br />
Co(NO3)3<br />
AuOH<br />
Fe2O3<br />
SnCl2<br />
Cl2O<br />
Fe(OH)2<br />
PbI2<br />
Bi(OH)3<br />
nitrato de cobalto (III)<br />
hidróxido de oro (I)<br />
óxido de hierro (III)<br />
cloruro de estaño (II)<br />
monóxido de dicloro<br />
hidróxido de hierro (II)<br />
yoduro de plomo (II)<br />
hidròxido de bismuto<br />
SrH2<br />
HBr<br />
SeO3<br />
HNO2<br />
Br2O3<br />
Au2O<br />
Cu2O<br />
Na2SO4<br />
Al2(SO4)3<br />
SbH3<br />
Na3AsO4<br />
FeCl2<br />
Ag2O<br />
NaOH<br />
NaI<br />
CO<br />
H2Te(aq)<br />
hidruro de estroncio<br />
bromuro de hidrógeno<br />
trióxido de selenio<br />
ácido nitroso<br />
trióxido de dibromo<br />
óxido de oro (I)<br />
óxido de cobre (I)<br />
sulfato de sodio<br />
sulfato de aluminio<br />
estibina<br />
arseniato de sodio<br />
cloruro de hierro (II)<br />
óxido de plata<br />
hidróxido de sodio<br />
yoduro de sodio<br />
monóxido de carbono<br />
ácido telurhidríco<br />
Ni(OH)3<br />
H2SO4<br />
H2SeO4<br />
SnH4<br />
H3AsO3<br />
PbO<br />
Mn(OH)2<br />
Zn(OH)2<br />
hidróxido de níquel (III)<br />
ácido sulfúrico<br />
ácido selénico<br />
hidruro de estaño (IV)<br />
ácido arsenioso<br />
óxido de plomo (II)<br />
hidróxido de manganeso (II)<br />
hidróxido de cinc<br />
Mg(OH)2<br />
BaCO3<br />
Cu(BrO3)2<br />
hidróxido de magnesio<br />
carbonato de bario<br />
bromato de cobre (II)<br />
nomenc95 Seminario Física y Química pg:5<br />
I.E.S. GRANDE COVIAN
<strong>FORMULACIÓN</strong> Y <strong>NOMENCLATURA</strong>ºººººººººººººººººººººººººººººººººººº<br />
<strong>QUÍMICA</strong> INORGÁNICA<br />
CdO<br />
H3PO4<br />
H2O2<br />
CrCl3<br />
H2CrO4<br />
Ni(OH)2<br />
Pb(OH)4<br />
HCl<br />
MgSO4<br />
(NH4)2SO3<br />
LiBrO2<br />
HBrO4<br />
Au2O3<br />
I2O5<br />
CH4<br />
Au(OH)3<br />
AgCl<br />
AuCl3<br />
AgOH<br />
H2Se(aq)<br />
óxido de cadmio<br />
acido ácido fosfórico<br />
agua oxigenada<br />
cloruro de cromo (III)<br />
ácido crómico<br />
hidróxido de níquel (II)<br />
hidróxido de plomo (IV)<br />
cloruro de hidrógeno<br />
sulfato de magnesio<br />
sulfito de amonio<br />
bromito de litio<br />
ácido perbrómico<br />
óxido de oro (III)<br />
pentaóxido de diyodo<br />
metano<br />
hidróxido de oro (III)<br />
cloruro de plata<br />
cloruro de oro (III)<br />
hidróxido de plata<br />
ácido selenhídrico<br />
PbO2<br />
AgClO4<br />
HCl(aq)<br />
Zn(NO3)2<br />
Co2O3<br />
Li2O<br />
SrO<br />
CoTe<br />
H3AsO3<br />
H2Te<br />
KNO2<br />
KCl<br />
FeCl3<br />
HNO3<br />
I2O<br />
KH<br />
Ba(OH)2<br />
óxido de plomo (IV)<br />
perclorato de plata<br />
ácido clorhídrico<br />
nitrato de cinc<br />
óxido de cobalto (III)<br />
óxido de litio<br />
óxido de estroncio<br />
telururo de cobalto (II)<br />
ácido arsenioso<br />
telururo de hidrógeno<br />
nitrito de potasio<br />
cloruro de potasio<br />
cloruro de hierro (III)<br />
ácido nítrico<br />
monóxido de diyodo<br />
hidruro de potasio<br />
hidróxido de bario<br />
H2O<br />
LiNO2<br />
CsH<br />
Sn(OH)2<br />
CaCl2<br />
KHSO4<br />
Cd(ClO)2<br />
Cl2O7<br />
Ag2CO3<br />
K2O<br />
BiCl3<br />
NH4ClO4<br />
H3PO3<br />
CoBr2<br />
CaF2<br />
CdI2<br />
AgBr<br />
HBrO2<br />
SrF2<br />
CaI2<br />
HIO3<br />
HI<br />
agua<br />
nitrito de litio<br />
hidruro de cesio<br />
hidróxido de estaño (II)<br />
cloruro de calcio<br />
hidrógenosulfato de potasio<br />
hipoclorito de cadmio<br />
heptaóxido de dicloro<br />
carbonato de plata<br />
óxido de potasio<br />
cloruro de bismuto (III)<br />
perclorato de amonio<br />
ácido ácido fosforoso<br />
bromuro de cobalto (II)<br />
fluoruro de calcio<br />
yoduro de cadmio<br />
bromuro de plata<br />
ácido bromoso<br />
fluoruro de estroncio<br />
yoduro de calcio<br />
ácido yódico<br />
yoduro de hidrógeno<br />
Pt(OH)2 hidróxido de platino (II)<br />
HClO4 ácido perclórico<br />
CO2<br />
dióxido de carbono<br />
Sb2O3 trióxido de diantimonio<br />
CaH2 hidruro de calcio<br />
Cu2SO4 sulfato de cobre (I)<br />
H2SeO3 ácido selenioso<br />
KBr bromuro de potasio<br />
Au(NO2)3 nitrito de oro (III)<br />
Ag2SeO4 seleniato de plata<br />
AuCl3 cloruro de oro (III)<br />
H2TeO3 ácido teluroso<br />
SO3<br />
trióxido de azufre<br />
Al2O3 óxido de alumnio<br />
H2S (aq) ácido sulfhídrico<br />
Na3PO4 fosfato de sodio<br />
HIO4 ácido peryódico<br />
NaH hidruro de sodio<br />
Fe(OH)3 hidróxido de hierro (III)<br />
SiO2<br />
dióxido de silicio<br />
HBr(aq) ácido bromhídrico<br />
NiBr2 bromuro de níquel (II)<br />
SrS sulfuro de estroncio<br />
P2O5 pentaóxido de difósforo<br />
NiO óxido de níquel (II)<br />
Cl2O5 pentaóxido de dicloro<br />
(NH4)2Se selenito de amonio<br />
AlH3<br />
hidruro de aluminio<br />
BaTeO3 telurito de bario<br />
FeI3<br />
yoduro de hierro (III)<br />
SnO óxido de estaño (II)<br />
HBrO ácido hipobromoso<br />
Co(OH)3 hidróxido de cobalto (III)<br />
Cs2S sulfuro de cesio<br />
AgI yoduro de plata<br />
BeH2 hidruro de berilio<br />
MnCl2 cloruro de manganeso (II)<br />
H2Se seleniuro de hidrógeno<br />
Zn(OH)2 hidróxido de cinc<br />
CrO óxido de cromo (II)<br />
H2TeO4 ácido telúrico<br />
Hg(OH)2 hidróxido de mercurio (II)<br />
MgH2 hidruro de magnesio<br />
KOH hidróxido de potasio<br />
HI(aq) ácido yodhídrico<br />
H2SO3 ácido sulfuroso<br />
Bi2O3 óxido de bismuto (III)<br />
SeO2 dióxido de selenio<br />
RbOH hidróxido de rubidio<br />
Cr(OH)3 hidróxido de cromo (III)<br />
Al(OH)3 hidróxido de aluminio<br />
MnO óxido de manganeso (II)<br />
SO2<br />
dióxido de azufre<br />
PbH4 hidruro de plomo (IV)<br />
BH3<br />
hidruro de boro<br />
BeO óxido de berilio<br />
SnO2 óxido de estaño (IV)<br />
PtO óxido de platino (II)<br />
HClO3 àcido clórico<br />
Ni2O3 óxido de níquel (III)<br />
NOME3ESO.DOC Seminario Física y Química pg:6<br />
I.B. GRANDE COVIAN
<strong>FORMULACIÓN</strong> Y <strong>NOMENCLATURA</strong>ºººººººººººººººººººººººººººººººººººº<br />
<strong>QUÍMICA</strong> INORGÁNICA<br />
H2S sulfuro de hidrógeno<br />
CuO óxido de cobre (II)<br />
Pb(OH)2 hidróxido de plomo (II)<br />
Cu(OH)2 hidróxido de cobre (II)<br />
BaSO4 sulfato de bario<br />
HIO ácido hipoyodoso<br />
NH3<br />
amoniaco<br />
(NH4)I yoduro de amonio<br />
Fe2S3 sulfuro de hierro (III)<br />
SnO2 óxido de estaño (IV)<br />
Cr2O3 óxido de cromo (III)<br />
BaH2 hidruro de bario<br />
CuSO4 sulfato de cobre (II)<br />
Ordenadas por funciones.<br />
H2S (aq) ácido sulfhídrico<br />
H2S<br />
H2Se<br />
H2Se(aq)<br />
sulfuro de hidrógeno<br />
seleniuro de hidrógeno<br />
ácido selenhídrico<br />
H2Te<br />
H2Te(aq)<br />
telururo de hidrógeno<br />
ácido telurhidríco<br />
HBr<br />
HBr(aq)<br />
HCl<br />
HCl(aq)<br />
HF<br />
HF(aq)<br />
HI<br />
HI(aq)<br />
AgOH<br />
Al(OH)3<br />
Au(OH)3<br />
AuOH<br />
Ba(OH)2<br />
bromuro de hidrógeno<br />
ácido bromhídrico<br />
cloruro de hidrógeno<br />
ácido clorhídrico<br />
fluoruro de hidrógeno<br />
ácido fluorhídrico<br />
ioduro de hidrógeno<br />
ácido iodídrico<br />
hidróxido de plata<br />
hidróxido de aluminio<br />
hidróxido de oro (III)<br />
hidróxido de oro (I)<br />
hidróxido de bario<br />
Be(OH)2 hidróxido de berilio<br />
Ca(OH)2 hidróxido de calcio<br />
Cd(OH)2 hidróxido de cadmio<br />
Co(OH)3<br />
CsOH<br />
Cu(OH)2<br />
Fe(OH)2<br />
Fe(OH)3<br />
Hg(OH)2<br />
KOH<br />
Mg(OH)2<br />
NaOH<br />
Ni(OH)2<br />
Ni(OH)3<br />
Pb(OH)2<br />
Pb(OH)4<br />
Pt(OH)2<br />
Pt(OH)4<br />
RbOH<br />
Sn(OH)2<br />
Sr(OH)2<br />
Zn(OH)2<br />
hidróxido de cobalto (III)<br />
hidróxido de cesio<br />
hidróxido de cobre (II)<br />
hidróxido de hierro (II)<br />
hidróxido de hierro (III)<br />
hidróxido de mercurio (II)<br />
hidróxido de potasio<br />
hidróxido de magnesio<br />
hidróxido de sodio<br />
hidróxido de níquel (II)<br />
hidróxido de níquel (III)<br />
hidróxido de plomo (II)<br />
hidróxido de plomo (IV)<br />
hidróxido de platino (II)<br />
hidróxido de platino (IV)<br />
hidróxido de rubidio<br />
hidróxido de estaño (II)<br />
hidróxido de estroncio<br />
hidróxido de cinc<br />
AlH3<br />
hidruro de aluminio<br />
LiH hidruro de litio<br />
PdO óxido de paladio (II)<br />
KI yoduro de potasio<br />
NH4Br bromuro de amonio<br />
Sr(NO2)2 nitrito de estroncio<br />
H3AsO4 ácido arsénico<br />
CsOH hidróxido de cesio<br />
Na2CO3 carbonato de sodio<br />
Ni(ClO2)2 clorito de níquel(II)<br />
TeO2 dióxido de teluro<br />
H3AsO4 ácido arsénico<br />
KIO4<br />
peryodato de potasio<br />
N2O3 trióxido de dinitrógeno<br />
BaH2 hidruro de bario<br />
BeH2 hidruro de berilio<br />
CaH2 hidruro de calcio<br />
CsH hidruro de cesio<br />
KH hidruro de potasio<br />
LiH hidruro de litio<br />
MgH2 hidruro de magnesio<br />
NaH hidruro de sodio<br />
PbH4 hidruro de plomo (IV)<br />
SnH4 hidruro de estaño (IV)<br />
SrH2<br />
hidruro de estroncio<br />
BH3<br />
hidruro de boro<br />
CH4<br />
metano<br />
H2O agua<br />
NH3<br />
amoniaco<br />
Ag2O óxido de plata<br />
Al2O3 óxido de aluminio<br />
Au2O óxido de oro (I)<br />
Au2O3 óxido de oro (III)<br />
BaO óxido de bario<br />
BeO óxido de berilio<br />
Bi2O3 óxido de bismuto (III)<br />
CaO óxido de calcio<br />
CdO óxido de cadmio<br />
Co2O3 óxido de cobalto (III)<br />
CoO óxido de cobalto (II)<br />
Cs2O óxido de cesio<br />
Cu2O óxido de cobre (I)<br />
CuO óxido de cobre (II)<br />
Fe2O3 óxido de hierro (III)<br />
FeO óxido de hierro (II)<br />
Hg2O óxido de mercurio (I)<br />
HgO óxido de mercurio (II)<br />
K2O óxido de potasio<br />
Li2O óxido de litio<br />
MgO óxido de magnesio<br />
Na2O óxido de sodio<br />
Ni2O3 óxido de níquel (III)<br />
NiO óxido de níquel (II)<br />
PbO óxido de plomo (II)<br />
PbO2 óxido de plomo (IV)<br />
PdO óxido de paladio (II)<br />
PtO óxido de platino (II)<br />
RaO óxido de radio<br />
Rb2O óxido de rubidio<br />
Sb2O3 trióxido de diantimonio<br />
SnO óxido de estaño (II)<br />
NOME3ESO.DOC Seminario Física y Química pg:7<br />
I.B. GRANDE COVIAN
3/4/08 <strong>FORMULACIÓN</strong> Y <strong>NOMENCLATURA</strong><br />
<strong>QUÍMICA</strong> INORGÁNICA<br />
SnO2 óxido de estaño (IV)<br />
SnO2 óxido de estaño (IV)<br />
SrO óxido de estroncio<br />
ZnO óxido de cinc<br />
As2O3 trióxido de diarsénico<br />
Br2O3 trióxido de dibromo<br />
Br2O7 heptaóxido de dibromo<br />
Cl2O monóxido de dicloro<br />
Cl2O3 trióxido de dicloro<br />
Cl2O5 pentaóxido de dicloro<br />
Cl2O7 heptaóxido de dicloro<br />
CO monóxido de carbono<br />
CO2<br />
dióxido de carbono<br />
I2O monóxido de diyodo<br />
I2O5<br />
pentaóxido de diyodo<br />
I2O5<br />
pentaóxido de diyodo<br />
I2O7<br />
heptaóxido de diyodo<br />
N2O3 trióxido de dinitrógeno<br />
N2O5 pentaóxido de dinitrógeno<br />
P2O5 pentaóxido de difósforo<br />
SeO2 dióxido de selenio<br />
SeO3 trióxido de selenio<br />
SiO2<br />
dióxido de silicio<br />
SO2<br />
dióxido de azufre<br />
SO3<br />
trióxido de azufre<br />
TeO2 dióxido de teluro<br />
H2CO3 ácido carbónico<br />
H2SeO3 ácido selenioso<br />
H2SeO4 ácido selénico<br />
H2SO3 ácido sulfuroso<br />
H2SO4 ácido sulfúrico<br />
H2TeO3 ácido teluroso<br />
H2TeO4 ácido telúrico<br />
H3AsO3 ácido arsenioso<br />
H3AsO3 ácido arsenioso<br />
H3AsO4 ácido arsénico<br />
H3PO3 ácido fosforoso<br />
H3PO4 ácido fosfórico<br />
HBrO ácido hipobromoso<br />
HBrO2 ácido bromoso<br />
HBrO3 ácido brómico<br />
HBrO4 ácido perbrómico<br />
HClO ácido hipocloroso<br />
HClO2 ácido cloroso<br />
HClO3 àcido clórico<br />
HClO4 ácido perclórico<br />
HIO ácido hipoyodoso<br />
HIO3 ácido yódico<br />
HIO4 ácido peryódico<br />
HNO2 ácido nitroso<br />
HNO3 ácido nítrico<br />
(NH4)2SO3 sulfito de amonio<br />
Ag2CO3 carbonato de plata<br />
Ag2SeO4 seleniato de plata<br />
AgClO4 perclorato de plata<br />
Al2(SO4)3 sulfato de aluminio<br />
Au(NO2)3 nitrito de oro (III)<br />
BaCO3 carbonato de bario<br />
BaSO4 sulfato de bario<br />
BaTeO3 telurito de bario<br />
CaSO3 sulfito de calcio<br />
Cd(ClO)2 hipoclorito de cadmio<br />
Co(NO3)3 nitrato de cobalto (III)<br />
CrCl3 cloruro de cromo (III)<br />
Cu(BrO3)2 bromato de cobre (II)<br />
Cu2SO4 sulfato de cobre (I)<br />
CuSO4 sulfato de cobre (II)<br />
Fe(NO2)2 nitrito de hierro (II)<br />
KIO4<br />
peryodato de potasio<br />
KNO2 nitrito de potasio<br />
LiBrO2 bromito de litio<br />
LiClO4 perclorato de litio<br />
LiNO2 nitrito de litio<br />
MgSO4 sulfato de magnesio<br />
MnCl2 cloruro de manganeso (II)<br />
Na2CO3 carbonato de sodio<br />
Na2SO4 sulfato de sodio<br />
Na3AsO4 arseniato de sodio<br />
Na3PO4 fosfato de sodio<br />
Ni(ClO2)2 clorito de níquel(II)<br />
Pb(ClO2)2 clorito de plomo (II)<br />
Sr(NO2)2 nitrito de estroncio<br />
Zn(NO3)2 nitrato de cinc<br />
H2O2 agua oxigenada<br />
AgBr bromuro de plata<br />
AgCl cloruro de plata<br />
AgI yoduro de plata<br />
AuCl cloruro de oro (I)<br />
AuCl3 cloruro de oro (III)<br />
BiCl3 cloruro de bismuto (III)<br />
CaCl2 cloruro de calcio<br />
CaF2 fluoruro de calcio<br />
CaI2<br />
yoduro de calcio<br />
CdI2<br />
yoduro de cadmio<br />
CoBr2 bromuro de cobalto (II)<br />
CoTe telururo de cobalto (II)<br />
Cs2S sulfuro de cesio<br />
Fe2S3 sulfuro de hierro (III)<br />
FeCl2 cloruro de hierro (II)<br />
FeCl3 cloruro de hierro (III)<br />
FeI3<br />
yoduro de hierro (III)<br />
KBr bromuro de potasio<br />
KCl cloruro de potasio<br />
KI yoduro de potasio<br />
Na2S sulfuro de sodio<br />
Na2Te telururo de sodio<br />
NaF fluoruro de sodio<br />
NaI yoduro de sodio<br />
NiBr2 bromuro de níquel (II)<br />
NiCl2 cloruro de níquel (II)<br />
PbI2<br />
yoduro de plomo (II)<br />
PbS seleniuro de plomo (II)<br />
SnCl2 cloruro de estaño (II)<br />
SrF2<br />
fluoruro de estroncio<br />
SrS sulfuro de estroncio<br />
NOME3ESO.DOC Seminario Física y Química pg:8<br />
I.B. GRANDE COVIAN