Tema 3: Isomería en compuestos de coordinación ... - Repositori UJI
Tema 3: Isomería en compuestos de coordinación ... - Repositori UJI
Tema 3: Isomería en compuestos de coordinación ... - Repositori UJI
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
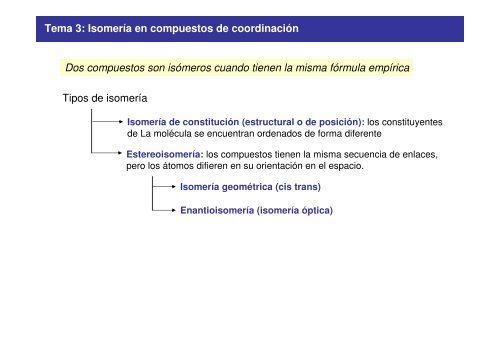
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
Dos <strong>compuestos</strong> son isómeros cuando ti<strong>en</strong><strong>en</strong> la misma fórmula empírica<br />
Tipos <strong>de</strong> isomería<br />
<strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición): los constituy<strong>en</strong>tes<br />
<strong>de</strong> La molécula se <strong>en</strong>cu<strong>en</strong>tran ord<strong>en</strong>ados <strong>de</strong> forma difer<strong>en</strong>te<br />
Estereoisomería: los <strong>compuestos</strong> ti<strong>en</strong><strong>en</strong> la misma secu<strong>en</strong>cia <strong>de</strong> <strong>en</strong>laces,<br />
pero los átomos difier<strong>en</strong> <strong>en</strong> su ori<strong>en</strong>tación <strong>en</strong> el espacio.<br />
<strong>Isomería</strong> geométrica (cis trans)<br />
Enantioisomería (isomería óptica)
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
Dos <strong>compuestos</strong> son isómeros cuando ti<strong>en</strong><strong>en</strong> la misma fórmula empírica<br />
Tipos <strong>de</strong> isomería<br />
<strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición): los constituy<strong>en</strong>tes<br />
<strong>de</strong> La molécula se <strong>en</strong>cu<strong>en</strong>tran ord<strong>en</strong>ados <strong>de</strong> forma difer<strong>en</strong>te<br />
H3C CH2 CH CH2 H3C CH CH CH3 1-but<strong>en</strong>o<br />
2-but<strong>en</strong>o<br />
O<br />
H 3C C CH 3<br />
acetona<br />
O<br />
H 3C CH 2 CH<br />
propanal
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
Dos <strong>compuestos</strong> son isómeros cuando ti<strong>en</strong><strong>en</strong> la misma fórmula empírica<br />
Tipos <strong>de</strong> isomería<br />
<strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición): los constituy<strong>en</strong>tes<br />
<strong>de</strong> La molécula se <strong>en</strong>cu<strong>en</strong>tran ord<strong>en</strong>ados <strong>de</strong> forma difer<strong>en</strong>te<br />
Estereoisomería: los <strong>compuestos</strong> ti<strong>en</strong><strong>en</strong> la misma secu<strong>en</strong>cia <strong>de</strong> <strong>en</strong>laces,<br />
pero los átomos difier<strong>en</strong> <strong>en</strong> su ori<strong>en</strong>tación <strong>en</strong> el espacio.<br />
O 2N<br />
H 2O<br />
Pt<br />
cis<br />
Cl<br />
Cl<br />
Cl<br />
H 2O<br />
Pt<br />
trans<br />
<strong>Isomería</strong> geométrica (cis trans)<br />
NO 2<br />
Cl
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
Dos <strong>compuestos</strong> son isómeros cuando ti<strong>en</strong><strong>en</strong> la misma fórmula empírica<br />
Tipos <strong>de</strong> isomería<br />
<strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición): los constituy<strong>en</strong>tes<br />
<strong>de</strong> La moléclua se <strong>en</strong>cu<strong>en</strong>tran ord<strong>en</strong>ados <strong>de</strong> forma difer<strong>en</strong>te<br />
Estereoisomería: los <strong>compuestos</strong> ti<strong>en</strong><strong>en</strong> la misma secu<strong>en</strong>cia <strong>de</strong> <strong>en</strong>laces,<br />
pero los átomos difier<strong>en</strong> <strong>en</strong> su ori<strong>en</strong>tación <strong>en</strong> el espacio.<br />
H<br />
Br<br />
CH(CH 3) 2<br />
C<br />
Enantioisomería (isomería óptica)<br />
CH(CH 3) 2<br />
C<br />
C2H5 Br<br />
R<br />
H<br />
S<br />
C 2H 5
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
El agua pue<strong>de</strong> actuar como ligando o como molécula <strong>de</strong> cristalización<br />
CrCl 3 . 6H2 O<br />
3 isómeros<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
[CrCl 2 (H 2 O) 4 ]Cl . 2H 2 O<br />
[CrCl(H 2 O) 5 ]Cl 2 . H2 O<br />
[Cr(H 2 O) 6 ]Cl 3
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
-Cambio <strong>de</strong> iones <strong>de</strong> la esfera <strong>de</strong> <strong>coordinación</strong> con contraion (semejante a hidratación)<br />
Co(NH 3 ) 5 (Br)(SO 4 ) 2 isómeros (A y B). A es violeta oscuro y da pptado con BaCl 2.<br />
B es <strong>de</strong> color violeta-rojo y da pptado con AgNO 3.<br />
A = [Co(NH 3 ) 5 Br](SO 4 )<br />
B = [Co(NH 3 ) 5 (SO 4 )]Br
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
-Cambio <strong>de</strong> iones <strong>de</strong> la esfera <strong>de</strong> <strong>coordinación</strong> con contraion (semejante a hidratación)<br />
trans-[Co(<strong>en</strong>) 2 Cl 2 ](NO 2 ) (ver<strong>de</strong>)<br />
trans-[Co(<strong>en</strong>) 2 (NO 2 )Cl]Cl (rojo)
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
-Implica moléculas cuyo anión y catión son iones complejos. La isomería<br />
se basa <strong>en</strong> la difer<strong>en</strong>te distribución <strong>de</strong> ligandos <strong>en</strong>tre los dos c<strong>en</strong>tros metálicos<br />
[Co(NH 3 ) 6 ] 3+ [Cr(CN) 6 ] 3- y [Cr(NH 3 ) 6 ] 3+ [Co(CN) 6 ] 3-<br />
[Co(<strong>en</strong>) 3 ][Cr(C 2 O 4 ) 3 ] y [Co(<strong>en</strong>) 2 (C 2 O 4 )][Cr(<strong>en</strong>)(C 2 O 4 ) 2 ]<br />
[Co(NH 3 ) 6 ][Co(NO 2 ) 6 ] y [Co(NH 3 ) 4 (NO 2 ) 2 ][Co(NH 3 ) 2 (NO 2 ) 4 ]<br />
[Pt II (NH 3 ) 4 ][Pt IV Cl 6 ] y [Pt IV (NH 3 ) 4 Cl 2 ][Pt II Cl 4 ]<br />
[(NH 3 ) 4 Co-µ-(OH) 2 -CoCl 2 (NH 3 ) 2 ] y [Cl(NH 3 ) 3 Co-µ-(OH) 2 -CoCl(NH 3 ) 3 ]
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
-Compuestos cuya fórmula molecular es múltiplo <strong>de</strong> una fórmula más simple<br />
Fórmula múltiplo<br />
[PtCl2(NH3)2] 1<br />
[Pt(NH3)4][PtCl4] 2 Isómeros <strong>de</strong> <strong>coordinación</strong><br />
[Pt(NH3)3Cl][Pt(NH3)Cl3] 2<br />
[Pt(NH3)4][Pt(NH3)Cl3]2<br />
[Pt(NH3)3Cl]2[PtCl4] 3<br />
3 Isómeros <strong>de</strong> <strong>coordinación</strong>
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
- Es el tipo <strong>de</strong> isomería constitucional que más interés ha suscitado<br />
- Afecta a ligandos que pued<strong>en</strong> funcionar como ambid<strong>en</strong>tados.<br />
- En 1894 Jorg<strong>en</strong>s<strong>en</strong> preparó dos isómeros <strong>de</strong> [Co(NO 2)(NH 3) 5]Cl 2, pero su naturaleza<br />
se <strong>de</strong>terminó <strong>en</strong> 1960<br />
O<br />
M N<br />
O<br />
nitro<br />
M O N<br />
nitrito<br />
O
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
- Es el tipo <strong>de</strong> isomería constitucional que más interés ha suscitado<br />
- Afecta a ligandos que pued<strong>en</strong> funcionar como ambid<strong>en</strong>tados.<br />
- En 1894 Jorg<strong>en</strong>s<strong>en</strong> preparó dos isómeros <strong>de</strong> [Co(NO 2)(NH 3) 5]Cl 2, pero su naturaleza<br />
se <strong>de</strong>terminó <strong>en</strong> 1960<br />
[CoCl(NH3) 5] 2+ + H2O [Co(NH3) 5(H2O)] 3+<br />
- Cl- [Co(ONO)(NH 3) 5] 2+<br />
H +<br />
[Co(NO 2)(NH 3) 5] 2+<br />
NO 2-<br />
ion p<strong>en</strong>taminnitrocobalto (2+)<br />
[Co(ONO)(NH 3) 5] 2+ + H 2O<br />
p<strong>en</strong>taaminnitritocobalto (2+)
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
-Típicos ligandos ambid<strong>en</strong>tados: SCN - , DMSO<br />
-Efectos que <strong>de</strong>terminan el átomo dador <strong>de</strong>l ligando:<br />
1) naturaleza <strong>de</strong>l ion metálico<br />
2) efectos electrónicos y estéricos <strong>de</strong>l ligando ambid<strong>en</strong>tado<br />
3) el disolv<strong>en</strong>te utilizado <strong>en</strong> la síntesis <strong>de</strong>l complejo<br />
-En g<strong>en</strong>eral, metales <strong>de</strong> la izquierda <strong>de</strong>l S.P. <strong>en</strong> altos e.o. (ácidos duros) se un<strong>en</strong><br />
por el átomo más duro.
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
Coordinación <strong>de</strong> SCN - : efectos electrónicos<br />
Pd(II)-SCN (tiocianato o sulfocianuro) (Pd(II) es blando)<br />
Cd(II)-NCS El Cd es intermedio; SCN- coordina como tiocianato o isotiocianato<br />
Cd(II)-SCN<br />
Co(III)-NCS (el Co(III) es duro)
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
2. <strong>Isomería</strong> <strong>de</strong> constitución (estructural o <strong>de</strong> posición)<br />
<strong>Isomería</strong> <strong>de</strong><br />
hidratación ionización <strong>coordinación</strong> polimerización <strong>en</strong>lace<br />
Coordinación <strong>de</strong> SCN - : efectos estéricos<br />
H3N S<br />
C<br />
N<br />
NH3 H3N Co<br />
NH3 NH 3<br />
2+<br />
NC<br />
S<br />
C N<br />
CN<br />
NC<br />
Co<br />
CN<br />
CN<br />
3-
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3. Esteroisomería: misma fórmula empírica y misma secu<strong>en</strong>cia <strong>de</strong> <strong>en</strong>laces, pero difer<strong>en</strong>te<br />
distribución <strong>de</strong> átomos alre<strong>de</strong>dor <strong>de</strong>l átomo c<strong>en</strong>tral.<br />
Esteroisómeros: dos o más moléculas con la misma fórmula empírica y misma secu<strong>en</strong>cia<br />
<strong>de</strong> <strong>en</strong>laces, pero con difer<strong>en</strong>te ord<strong>en</strong>ación espacial<br />
Enantiómero: un estereoisómero que no pue<strong>de</strong> superponerse con su imag<strong>en</strong> especular.<br />
Diastereoisómeros (diasterómeros): estereoisómeros que no son <strong>en</strong>antiómeros<br />
(p. ej. isómeros cis-trans).<br />
Moléculas asimétricas: aquellas que carec<strong>en</strong> <strong>de</strong> elem<strong>en</strong>tos <strong>de</strong> simetría.<br />
Moléculas disimétricas: Moléculas que no ti<strong>en</strong><strong>en</strong> ejes <strong>de</strong> rotación reflexión S n.<br />
Para que una molécula sea <strong>en</strong>antiómera, no <strong>de</strong>be <strong>de</strong> t<strong>en</strong>er ni plano <strong>de</strong> simetría (S 1)<br />
ni c<strong>en</strong>tro <strong>de</strong> inversión (S 2).<br />
Compuesto quiral: Una molécula quiral es una molécula asimétrica o disimétrica, que<br />
no pue<strong>de</strong> superponerse con su imag<strong>en</strong> especular (es un <strong>en</strong>antiómero).<br />
Actividad óptica: capacidad que pose<strong>en</strong> las moléculas quirales para producir un giro <strong>de</strong>l plano<br />
<strong>de</strong> la luz polarizada.
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3. Esteroisomería: misma fórmula empírica y misma secu<strong>en</strong>cia <strong>de</strong> <strong>en</strong>laces, pero difer<strong>en</strong>te<br />
distribución <strong>de</strong> átomos alre<strong>de</strong>dor <strong>de</strong>l átomo c<strong>en</strong>tral.<br />
Actividad óptica: capacidad que pose<strong>en</strong> las moléculas quirales para producir un giro <strong>de</strong>l plano<br />
<strong>de</strong> la luz polarizada.
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.1 Esteroisomería: Compuestos tetracoordinados<br />
- A principios <strong>de</strong>l s. XIX se conocían dos isómeros <strong>de</strong> fórmula PtCl 2(NH 3) 2<br />
- Jorg<strong>en</strong>s<strong>en</strong> propuso:<br />
Pt<br />
- Werner propuso:<br />
NH 3<br />
Cl<br />
NH 3 Cl<br />
Pt<br />
NH 3<br />
Cl<br />
NH 3 Cl
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.1 Esteroisomería: Compuestos tetracoordinados<br />
-Grinberg (1931) confirmó la predicción <strong>de</strong> Werner al hacer reaccionar los dos <strong>compuestos</strong><br />
con ácido oxálico:<br />
Cl<br />
Cl<br />
H 3N<br />
Cl<br />
Pt<br />
Pt<br />
Cl<br />
NH 3<br />
NH 3<br />
NH 3<br />
+ (HCOOH) 2 Pt<br />
+ 2 (HCOOH) 2<br />
O<br />
O<br />
C<br />
C<br />
O<br />
O<br />
H 3N<br />
HOOC-COO<br />
Pt<br />
NH 3<br />
NH 3<br />
OOC-COOH<br />
-Los <strong>compuestos</strong> cuadrados planos ti<strong>en</strong><strong>en</strong> un plano (no pued<strong>en</strong> dar <strong>en</strong>antiómeros).<br />
cis y trans son diasterómeros<br />
NH 3
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.1 Esteroisomería: Compuestos tetracoordinados<br />
- La imposibilidad <strong>de</strong> dar <strong>compuestos</strong> quirales constituyó la prueba <strong>de</strong> que los <strong>compuestos</strong><br />
<strong>de</strong> Pt(II) son cuadrado planos.<br />
- Ghernyaev (1926). Obtuvo los tres isómeros <strong>de</strong> [Pt(NO 2)(NH 3)(NH 2OH)(py)] +<br />
- Con esta síntesis formuló el concepto <strong>de</strong> efecto trans.<br />
HOH 2N<br />
N<br />
Pt<br />
NH 3<br />
NO 2<br />
O 2N<br />
N<br />
Pt<br />
-Los <strong>compuestos</strong> cuadrados planos ti<strong>en</strong><strong>en</strong> un plano (no pued<strong>en</strong> dar <strong>en</strong>antiómeros).<br />
cis y trans son diasterómeros<br />
NH 3<br />
NH 2OH<br />
O 2N<br />
N<br />
Pt<br />
NH 2OH<br />
NH 3
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.1 Esteroisomería: Compuestos tetracoordinados<br />
- La única forma <strong>de</strong> que un compuesto cuadrado plano sea quiral, es que la quiralidad<br />
resida <strong>en</strong> el ligando.<br />
Ph 2P<br />
+<br />
H 3CCN Rh P Ph2<br />
*<br />
NCCH 3<br />
*
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.1 Esteroisomería: Compuestos tetracoordinados<br />
- Los <strong>compuestos</strong> tetraédricos sólo son quirales cuando ti<strong>en</strong><strong>en</strong> los cuatro ligandos difer<strong>en</strong>tes.<br />
- Para <strong>de</strong>finir la quiralidad se usan las reglas <strong>de</strong> Cahn-Ingold-Prelog (CIP)<br />
CIP: reglas para asignar secu<strong>en</strong>cia <strong>de</strong> prioridad: Z↑, prioridad ↑<br />
CIP=1 es el <strong>de</strong> mayor número atómico<br />
4<br />
H<br />
2<br />
CH(CH 3) 2<br />
C<br />
Br<br />
C 2H 5<br />
R<br />
(s<strong>en</strong>tido agujas <strong>de</strong>l reloj)<br />
1<br />
3<br />
C<br />
C 2H 5 Br<br />
3<br />
2<br />
CH(CH 3) 2<br />
1<br />
H<br />
4<br />
S<br />
(s<strong>en</strong>tido inverso<br />
agujas <strong>de</strong>l reloj)
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
-Pued<strong>en</strong> dar isomería geométrica y óptica<br />
<strong>Isomería</strong> geométrica:<br />
a) Dos ligandos iguales<br />
b) Tres ligandos iguales<br />
Ma 3 b 3<br />
Cl<br />
H3N Cl<br />
Co<br />
H3N Cl<br />
NH 3<br />
H3N Cl<br />
Co<br />
Cl<br />
Cl<br />
Fac- Mer-<br />
trans- cis-<br />
NH 3<br />
NH 3
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
-Pued<strong>en</strong> dar isomería geométrica y óptica<br />
<strong>Isomería</strong> geométrica:<br />
a) Dos ligandos iguales<br />
b) Tres ligandos iguales<br />
c) Los <strong>compuestos</strong> Ma 5b no ti<strong>en</strong><strong>en</strong> isómeros
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Predicción <strong>de</strong> número <strong>de</strong> isómeros <strong>de</strong> un compuesto octaédrico<br />
Método <strong>de</strong> Bailar: lista sistemática <strong>de</strong> diasterómeros posibles para una fórmula dada
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar Supongamos la molécula Mabc<strong>de</strong>f (6L distintos)<br />
a) Se escoge un ligando <strong>de</strong> refer<strong>en</strong>cia. El diasterómero se repres<strong>en</strong>ta agrupando<br />
alfabéticam<strong>en</strong>te a los ligandos que están <strong>en</strong> posición relativa trans.<br />
e<br />
a<br />
c f<br />
M<br />
b<br />
d<br />
ab<br />
cd<br />
ef
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar Supongamos la molécula Mabc<strong>de</strong>f (6L distintos)<br />
a) Se escoge un ligando <strong>de</strong> refer<strong>en</strong>cia. El diasterómero se repres<strong>en</strong>ta agrupando<br />
alfabéticam<strong>en</strong>te a los ligandos que están <strong>en</strong> posición relativa trans.<br />
b) Mant<strong>en</strong>i<strong>en</strong>do fijos los ligandos a, b y c, se g<strong>en</strong>eran los dos isómeros restantes.<br />
Los 3 isómeros son los que ti<strong>en</strong><strong>en</strong> los ligandos e, d y f trans a c.<br />
e<br />
d<br />
a<br />
c f<br />
M<br />
b<br />
a<br />
c f<br />
M<br />
b<br />
d<br />
e<br />
ab<br />
ce<br />
df<br />
ab<br />
cd<br />
ef<br />
d<br />
a<br />
c e<br />
M<br />
b<br />
f<br />
ab<br />
cf<br />
<strong>de</strong><br />
(mant<strong>en</strong>i<strong>en</strong>do a y b fijos<br />
se obti<strong>en</strong><strong>en</strong> 3 diaterómeros)
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar Supongamos la molécula Mabc<strong>de</strong>f (6L distintos)<br />
a) Se escoge un ligando <strong>de</strong> refer<strong>en</strong>cia. El diasterómero se repres<strong>en</strong>ta agrupando<br />
alfabéticam<strong>en</strong>te a los ligandos que están <strong>en</strong> posición relativa trans.<br />
b) Mant<strong>en</strong>i<strong>en</strong>do fijos los ligandos a, b y c se intercambian, g<strong>en</strong>erándose los dos isómeros<br />
restantes, que son los que ti<strong>en</strong><strong>en</strong> los ligandos e, d y f trans a e.<br />
c) Repetir la operación permutando el ligando que está trans a a. Como hay 5 ligandos<br />
t<strong>en</strong>dremos un total <strong>de</strong>: 5 x 3 = 15 diasterómeros
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar Supongamos la molécula Mabc<strong>de</strong>f (6L distintos)<br />
Todas las combinaciones se pued<strong>en</strong> repres<strong>en</strong>tar <strong>en</strong> forma <strong>de</strong> tabla:<br />
1<br />
2<br />
3<br />
4<br />
5<br />
A<br />
ab<br />
cd<br />
ef<br />
ac<br />
bd<br />
ef<br />
ad<br />
bc<br />
ef<br />
ae<br />
bc<br />
df<br />
af<br />
bc<br />
<strong>de</strong><br />
B<br />
ab<br />
ce<br />
df<br />
ac<br />
be<br />
df<br />
ad<br />
be<br />
cf<br />
ae<br />
bd<br />
cf<br />
af<br />
bd<br />
ce<br />
C<br />
ab<br />
cf<br />
<strong>de</strong><br />
ac<br />
bf<br />
<strong>de</strong><br />
ad<br />
bf<br />
ce<br />
ae<br />
bf<br />
cd<br />
af<br />
be<br />
cd<br />
Ninguno ti<strong>en</strong>e σ <strong>de</strong> simetría ni i<br />
Todos son quirales (pares <strong>de</strong> <strong>en</strong>antiómeros)<br />
15 x 2 = 30 esteroisómeros <strong>en</strong> total
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar Ma 2c 2ef La misma tabla que la anterior, con<br />
b = a, d = c<br />
1<br />
2<br />
3<br />
4<br />
5<br />
A<br />
aa<br />
cc<br />
ef<br />
ac<br />
ac<br />
ef<br />
ac<br />
ac<br />
ef<br />
ae<br />
ac<br />
cf<br />
af<br />
ac<br />
ce<br />
B<br />
aa<br />
ce<br />
cf<br />
ac<br />
ae<br />
cf<br />
ac<br />
ae<br />
cf<br />
ae<br />
ac<br />
cf<br />
af<br />
ac<br />
ce<br />
C<br />
aa<br />
cf<br />
ce<br />
ac<br />
af<br />
ce<br />
ac<br />
af<br />
ce<br />
ae<br />
af<br />
cc<br />
af<br />
ae<br />
cc<br />
6 diasterómeros<br />
¿Hay alguno quiral?
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar Ma 2c 2ef La misma tabla que la anterior, con<br />
b = a, d = c<br />
c<br />
a<br />
c f<br />
M<br />
a<br />
c<br />
a<br />
e c<br />
M<br />
a<br />
ti<strong>en</strong>e plano <strong>de</strong> simetría (no es quiral)<br />
e<br />
f<br />
ac<br />
ce<br />
cf<br />
a<br />
f<br />
1B<br />
c a<br />
M<br />
e<br />
c<br />
e<br />
ti<strong>en</strong><strong>en</strong> plano <strong>de</strong> simetría<br />
aa<br />
cc<br />
ef<br />
a<br />
a f<br />
ae<br />
af<br />
cc<br />
M<br />
c<br />
c<br />
4C<br />
1A<br />
ac<br />
ac<br />
ef<br />
2A
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar Ma 2c 2ef La misma tabla que la anterior, con<br />
b = a, d = c<br />
c<br />
a<br />
a f<br />
M<br />
c<br />
ac<br />
ae<br />
cf<br />
e<br />
e<br />
2B<br />
a<br />
f a<br />
M<br />
c<br />
c<br />
No ti<strong>en</strong><strong>en</strong><br />
plano <strong>de</strong> simetría<br />
f<br />
a<br />
e a<br />
En total hay: 4 + 2x2 = 8 esteroisómeros<br />
M<br />
c<br />
ac<br />
af<br />
ce<br />
c<br />
c<br />
a e<br />
2C<br />
a<br />
M<br />
c<br />
f
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar Compuestos quelato MA2c2ef; A2 = ligando quelato<br />
El ligando A 2 ti<strong>en</strong>e que ocupar posiciones cis:<br />
1<br />
2<br />
3<br />
4<br />
5<br />
A<br />
AA<br />
cc<br />
ef<br />
Ac<br />
Ac<br />
ef<br />
Ac<br />
Ac<br />
ef<br />
Ae<br />
Ac<br />
cf<br />
Af<br />
Ac<br />
ce<br />
B<br />
AA<br />
ce<br />
cf<br />
Ac<br />
Ae<br />
cf<br />
Ac<br />
Ae<br />
cf<br />
Ae<br />
Ac<br />
cf<br />
Af<br />
Ac<br />
ce<br />
C<br />
AA<br />
cf<br />
ce<br />
Ac<br />
Af<br />
ce<br />
Ac<br />
Af<br />
ce<br />
Ae<br />
Af<br />
cc<br />
Af<br />
Ae<br />
cc<br />
Restricción cis <strong>de</strong>l quelato<br />
4 diasterómeros<br />
(2 ti<strong>en</strong><strong>en</strong> <strong>en</strong>antiómero)<br />
Isómeros repetidos<br />
6 esteroisómeros
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar<br />
Compuestos quelato con ligando asimétrico (AB)<br />
Dos ligandos quelato asimétricos: M(AB)(A’B’)e 2<br />
H 2N CH 2 COO -<br />
A B<br />
N'<br />
N<br />
O OH 2<br />
M<br />
O'<br />
OH 2<br />
[Cu(H 2NCH 2COO) 2(H 2O) 2]<br />
[Cu(AB)(A'B')e 2]
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.2 Compuestos hexacoordinados<br />
Método <strong>de</strong> Bailar<br />
1<br />
2<br />
3<br />
4<br />
5<br />
Compuestos quelato con ligando asimétrico (AB)<br />
Dos ligandos quelato asimétricos: M(AB)(A’B’)e 2<br />
A<br />
AB<br />
A’B’<br />
ee<br />
AA’<br />
BB’<br />
ee<br />
AB’<br />
BA’<br />
ee<br />
Ae<br />
BA’<br />
B’e<br />
Ae<br />
BA’<br />
B’e<br />
B<br />
AB<br />
A’e<br />
B’e<br />
AA’<br />
Be<br />
B’e<br />
AB’<br />
Be<br />
A’e<br />
Ae<br />
BB’<br />
A’e<br />
Ae<br />
BB’<br />
A’e<br />
C<br />
AB<br />
A’e<br />
B’e<br />
AA’<br />
Be<br />
B’e<br />
AB’<br />
Be<br />
A’e<br />
Ae<br />
Be<br />
A’B’<br />
Ae<br />
Be<br />
A’B’<br />
Restricción cis <strong>de</strong>l quelato<br />
Isómeros repetidos<br />
5 diasterómeros (3 quirales)<br />
2 + 3x2 = 8 esterisómeros
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.3.-<strong>Isomería</strong> por conformación y quiralidad <strong>de</strong>l ligando<br />
La <strong>coordinación</strong> <strong>de</strong> un ligando bid<strong>en</strong>tado que pueda dar más <strong>de</strong> una conformación,<br />
pue<strong>de</strong> g<strong>en</strong>erar quiralidad<br />
Ejemplo: etil<strong>en</strong>diamina (<strong>en</strong>) g<strong>en</strong>era un anillo no plano con un eje C 2.<br />
C 2<br />
M<br />
N<br />
C<br />
N C<br />
Para <strong>de</strong>signar este tipo <strong>de</strong> quiralidad se usan las letras δ y λ (quiralidad<br />
<strong>de</strong> anillos quelato individuales). La quiralidad se <strong>de</strong>termina mirando la molécula<br />
<strong>de</strong>s<strong>de</strong> el eje C 2 y <strong>de</strong>terminando el s<strong>en</strong>tido <strong>de</strong> giro <strong>de</strong> los ejes para superponer<br />
AA con BB.<br />
λ = levo (izquierda)<br />
δ = <strong>de</strong>xtro (<strong>de</strong>recha)<br />
C 2<br />
C<br />
C<br />
N<br />
N<br />
M
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.3.-<strong>Isomería</strong> por conformación y quiralidad <strong>de</strong>l ligando<br />
C 2<br />
B<br />
A N N A<br />
δ<br />
C<br />
M<br />
N<br />
C<br />
B<br />
C<br />
N C<br />
Para <strong>de</strong>signar este tipo <strong>de</strong> quiralidad se usan las letras δ y λ (quiralidad<br />
<strong>de</strong> anillos quelato individuales). La quiralidad se <strong>de</strong>termina mirando la molécula<br />
<strong>de</strong>s<strong>de</strong> el eje C 2 y <strong>de</strong>terminando el s<strong>en</strong>tido <strong>de</strong> giro <strong>de</strong> los ejes para superponer<br />
AA con BB.<br />
λ = levo (izquierda)<br />
δ = <strong>de</strong>xtro (<strong>de</strong>recha)<br />
C 2<br />
A N N A<br />
C<br />
C<br />
B<br />
N<br />
C<br />
N<br />
λ<br />
M<br />
C<br />
B
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.3.-<strong>Isomería</strong> por conformación y quiralidad <strong>de</strong>l ligando<br />
La nom<strong>en</strong>clatura λ y δ se refiere a quiralidad <strong>de</strong>l ligando.<br />
La quiralidad absoluta <strong>de</strong>l complejo se indica por Λ y ∆.<br />
-La quiralidad estará c<strong>en</strong>trada <strong>en</strong> el metal si el complejo ti<strong>en</strong>e dos o más ligandos quelato.<br />
Por ejemplo, molécula <strong>de</strong> tipo M(N-N) 2 Cl 2 :<br />
Son quirales<br />
Inorganic Chemistry-3rd Ed.. Shriver & Atkins. Oxford Uiversity Press. (1999) Oxford.
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.3.-<strong>Isomería</strong> por conformación y quiralidad <strong>de</strong>l ligando
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.3.-<strong>Isomería</strong> por conformación y quiralidad <strong>de</strong>l ligando<br />
Configuraciones absolutas: S<strong>en</strong>tido <strong>de</strong>l giro <strong>de</strong> ejes AA (inferior) sobre BB (superior)<br />
N<br />
N<br />
N<br />
N<br />
N<br />
N<br />
N<br />
N<br />
giro 90º<br />
giro 90º<br />
A<br />
B<br />
B<br />
B<br />
A<br />
A<br />
A<br />
B<br />
∆<br />
Λ
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.3.-<strong>Isomería</strong> por conformación y quiralidad <strong>de</strong>l ligando<br />
Moléculas <strong>de</strong> tipo M(N-N) 3: Se mira la molécula por el eje C 3 y se <strong>de</strong>termina el s<strong>en</strong>tido<br />
<strong>de</strong> giro <strong>de</strong> los ligandos.<br />
N<br />
N<br />
N N<br />
Co<br />
N<br />
N<br />
3+<br />
N<br />
N<br />
N N<br />
Co<br />
N<br />
N<br />
3+<br />
El triángulo superior gira hasta<br />
superponerse con el inferior (fijo)<br />
Inorganic Chemistry-3rd Ed.. Shriver & Atkins. Oxford Uiversity Press. (1999) Oxford.
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.3.-<strong>Isomería</strong> por conformación y quiralidad <strong>de</strong>l ligando<br />
Moléculas <strong>de</strong> tipo M(N-N) 3: Se mira la molécula por el eje C 3 y se <strong>de</strong>termina el s<strong>en</strong>tido<br />
<strong>de</strong> giro <strong>de</strong> los ligandos.<br />
Inorganic Chemistry-3rd Ed.. Shriver & Atkins. Oxford Uiversity Press. (1999) Oxford.
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.3.-<strong>Isomería</strong> por conformación y quiralidad <strong>de</strong>l ligando<br />
-Las mayúsculas ∆ y Λ d<strong>en</strong>otan la quiralidad <strong>de</strong> la molécula.<br />
-Si la conformación <strong>de</strong>l ligando da configuraciones δ y λ <strong>de</strong>bemos t<strong>en</strong>erlas <strong>en</strong> cu<strong>en</strong>ta<br />
Por ejemplo: [Co(<strong>en</strong>) 3 ] 3+ :<br />
∆δδδ<br />
∆δδλ<br />
∆δλλ<br />
∆λλλ<br />
Λλλλ<br />
Λλλδ<br />
Λλδδ<br />
Λδδδ<br />
Pares <strong>de</strong> <strong>en</strong>antiómeros <strong>de</strong> [Co(<strong>en</strong>) 3] 3+
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.4.-Recom<strong>en</strong>dación <strong>de</strong> Chemical Abstracts nombrar esteroisómeros<br />
-A la hora <strong>de</strong> nombrar esteroisómeros Chem. Abst. recomi<strong>en</strong>da usar los sigui<strong>en</strong>tes factores:<br />
a) Simetría <strong>de</strong>l c<strong>en</strong>tro metálico: se d<strong>en</strong>ota la geometría aproximada, según:<br />
Geometría Notación<br />
tetraédrica T-4<br />
plano cuadrada SP-4<br />
bipirámi<strong>de</strong> trigonal TB-5<br />
Pirámi<strong>de</strong> <strong>de</strong> base cuadrada SP-5<br />
Octaédrica OC-6<br />
prisma trigonal TP-6
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.4.-Recom<strong>en</strong>dación <strong>de</strong> Chemical Abstracts nombrar esteroisómeros<br />
-A la hora <strong>de</strong> nombrar esteroisómeros Chem. Abst. recomi<strong>en</strong>da usar los sigui<strong>en</strong>tes factores:<br />
a) Simetría <strong>de</strong>l c<strong>en</strong>tro metálico: se d<strong>en</strong>ota la geometría aproximada, según:<br />
b) Índice <strong>de</strong> configuración: consta <strong>de</strong> 2 dígitos:<br />
1er dígito: número prioridad CIP <strong>de</strong>l ligando trans al que t<strong>en</strong>ga el número <strong>de</strong> prioridad 1.<br />
2º dígito: número CIP <strong>de</strong>l ligando trans al que t<strong>en</strong>ga el m<strong>en</strong>or número CIP <strong>en</strong> el plano<br />
perp<strong>en</strong>dicular al eje principal.<br />
eje principal: <strong>de</strong>finido por el ligando que t<strong>en</strong>ga una prioridad CIP = 1 y su ligando trans.<br />
Si hay dos ligandos con CIP = 1, el eje lo establece el que cont<strong>en</strong>ga al ligando<br />
trans con un mayor número <strong>de</strong> prioridad CIP
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.4.-Recom<strong>en</strong>dación <strong>de</strong> Chemical Abstracts nombrar esteroisómeros<br />
Ejemplo: Ma 2 bc<strong>de</strong><br />
Isómero trans<br />
Ma 2bc<strong>de</strong><br />
Prioridad CIP :<br />
a = 1<br />
b = 2<br />
c = 3<br />
d = 4<br />
e = 5<br />
b c<br />
M<br />
e<br />
a<br />
a<br />
d<br />
mayor prioridad<br />
<strong>en</strong> plano<br />
2 3<br />
M<br />
5<br />
eje<br />
principal<br />
1<br />
1<br />
OC-6 14<br />
4<br />
trans a mayor CIP<br />
<strong>en</strong> plano
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.4.-Recom<strong>en</strong>dación <strong>de</strong> Chemical Abstracts nombrar esteroisómeros<br />
Ejemplo: Ma 2 bc<strong>de</strong><br />
Isómero cis<br />
Ma 2bc<strong>de</strong><br />
Prioridad CIP :<br />
a = 1<br />
b = 2<br />
c = 3<br />
d = 4<br />
e = 5<br />
e a<br />
M<br />
b<br />
a<br />
d<br />
c<br />
5 1<br />
M<br />
2<br />
trans a mayor CIP<br />
<strong>en</strong> plano<br />
1<br />
4<br />
eje<br />
principal<br />
OC-6-42<br />
3<br />
mayor prioridad<br />
<strong>en</strong> plano
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.4.-Recom<strong>en</strong>dación <strong>de</strong> Chemical Abstracts nombrar esteroisómeros<br />
-Por ejemplo: <strong>en</strong> ocasiones la nom<strong>en</strong>clatura cis/trans pue<strong>de</strong> ser ambigua<br />
H 3N NO 2<br />
H 3N<br />
Cl<br />
Pt<br />
Cl<br />
3 2<br />
M<br />
3<br />
1<br />
1<br />
eje<br />
principal<br />
NO 2<br />
(OC-6-13)-diamminodiclorodinitroplatino (II)<br />
2<br />
O 2N Cl<br />
O 2N<br />
NH 3<br />
Pt<br />
NH 3<br />
2 1<br />
M<br />
2<br />
3<br />
3<br />
1<br />
Cl<br />
(OC-6-22)-diamminodiclorodinitroplatino (II)
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.4.-Recom<strong>en</strong>dación <strong>de</strong> Chemical Abstracts nombrar esteroisómeros<br />
c) Símbolo <strong>de</strong> quiralidad: si hay <strong>en</strong>antiómeros. Des<strong>de</strong> el ligando <strong>de</strong> m<strong>en</strong>or valor CIP <strong>en</strong><br />
el plano perp<strong>en</strong>dicular al eje principal, para llegar al ligando <strong>de</strong> mayor CIP <strong>en</strong> cis por el<br />
camino más largo, si el giro es <strong>en</strong> el s<strong>en</strong>tido <strong>de</strong> las agujas <strong>de</strong>l reloj, C (clockwise).<br />
Si es inverso A (anticlockwise).<br />
4 1<br />
M<br />
2<br />
1<br />
3<br />
OC-6-32-A<br />
eje<br />
principal<br />
5<br />
1 4<br />
M<br />
5<br />
1<br />
3<br />
eje<br />
principal<br />
OC-6-32-C<br />
Cuestión: Utilizar la nom<strong>en</strong>clatura Chem. Abstr. para nombrar todos los isómeros<br />
posibles <strong>de</strong> [PtCl 3(NH 3)(NO 2)(py)].<br />
2
<strong>Tema</strong> 3: <strong>Isomería</strong> <strong>en</strong> <strong>compuestos</strong> <strong>de</strong> <strong>coordinación</strong><br />
3.5.-Resum<strong>en</strong><br />
Clasificación <strong>de</strong> complejos por quiralidad:<br />
a) Se utilizan las letras mayúsculas ∆ y Λ para <strong>de</strong>finir la configuración absoluta <strong>de</strong> la molécula.<br />
b) Las conformaciones <strong>de</strong> los anillos formados por los ligandos quelato se <strong>de</strong>fin<strong>en</strong> por las<br />
letras minúsculas δ y λ.<br />
c) En <strong>compuestos</strong> tetraédricos, o <strong>en</strong> ligandos <strong>de</strong> tipo quiral, se usa el sistema<br />
Cahn-Ingold-Prelog (CIP), utilizado normalm<strong>en</strong>te <strong>en</strong> química orgánica.<br />
d) Se utilizan los signos (+) y (-) para <strong>de</strong>signar el signo <strong>de</strong> rotación <strong>de</strong>l plano <strong>de</strong> polarización<br />
<strong>de</strong> la luz polarizada a una longitud <strong>de</strong> onda específica (medida por dicroismo circular DC).