EstructurasLewis
EstructurasLewis
EstructurasLewis
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Las propiedades químicas de un elemento dependende los electrones de la configuración electrónicaexterna de los átomos. Esos electrones más externosson llamados electrones de valencia.Una forma de representar esos electrones de valenciaEs usar los símbolos (puntos) de Lewis.Por ejemplo, los símbolos de Lewis para el flúorse muestran debajo:FEl flúor, del grupo 17 ( o 7A), tiene siete electronesde valencia indicados por los 7 puntos
Dos átomos podrían combinarse para formar unamolécula, y cuando lo hacen, una unión se formaentre ellos. La unión entre los átomos resulta decompartir los electrones. Este compartir electroneses llamado unión covalente.Considérese la formación de la molécula de flúor:FFCada átomo de flúor tiene 7 electrones de valencia.Cuando dos átomos forman una molécula compartenun par de electrones.
De acuerdo con Lewis cuando los átomos secombinan para formar moléculas, lo hacen de tal formaque llenan sus orbitales de valencia. De esta manera losátomos obtienen una configuración electrónica estableequivalente a la del gas noble más cercano.Para los elementos del período 2, este hecho es denominadocomo regla del octeto.Para el hidrógeno, en el período 1, la configuración establees un par de electrones. Para otros elementos, en elperíodo 3 y superiores, el número de electrones quepueden acomodarse en los orbitales de valencia puede sersuperior a 8.
Los electrones de valencia que se encuentraninvolucrados entre los átomos se denominan paresligantes. El resto de los pares de electrones sedenominan pares solitarios o pares libres.FF
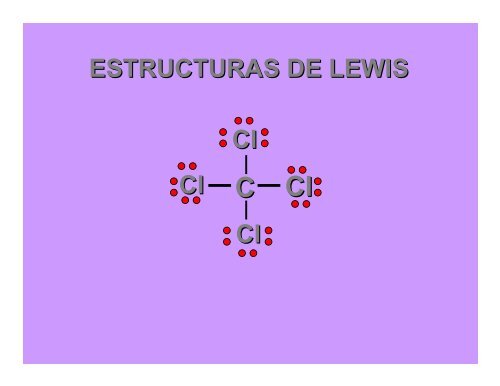
Veámos como dibujar una estructura de Lewis.Tomaremos de ejemplo el tetracloruro de carbonoCl 4 C. En éste el carbono está en el centro rodeado decuatro átomos de cloro.ClCl C ClCl
El carbono tiene 4 electrones de valencia y cadacloro tiene 7 electrones de valencia. Así hay4 + (4x7) = 32 electrones de valencia para acomodarentre los átomos. Formaremos una unión covalenteentre el átomo de carbono central y cada átomo de cloro.Los electrones remanentes serán dispuestos como paressolitarios.ClCl C ClClClCl C ClCl
UNIONES MÚLTIPLESMSi dos átomos se mantienen juntos compartiendo unpar de electrones se dice que están unidos por unaunión simple. Sin embargo, en muchas moléculas,dos átomos comparten más de un par de electrones. Sedice de tales moléculas que poseen uniones múltiples.Si los átomos comparten dos pares de electrones, launión covalente es una doble unión. Si los dos átomoscomparten tres pares de electrones, entonces se haformado una triple unión.
CARGA FORMALEn algunos casos es posible dibujar varias estructurasde Lewis distintas para una misma sustancia.¿Cómo decidimos cuál es la más adecuada?.Una estrategia consiste en calcular la carga formal delos átomos.Las cargas formales de los átomos en unarepresentación de Lewis describe la distribuciónaproximada de los electrones en la molécula pero norepresentan las cargas reales de los átomos.La estructura de Lewis más estable será aquella en laque: (1) los átomos tengan la carga formal máscercana a cero y (2) las que poseen las cargasnegativas sobre los átomos más electronegativos.
La estructura de Lewis del ozono. ( 18 electrones devalencia) se muestra abajo. Vamos a determinar la cargaformal, comenzando con el átomo de la izquierda.O O O
Un átomo aislado de oxígeno tiene 6 electrones devalencia. En el ozono, el átomo en el circulo tiene 8 electrones.O O ONúmero de electronesde valencia del átomoNúmero deelectrones no ligantes½ Número deelectrones ligantesCargaformal6 6 1 -1
NC S_N_C S N_C S
ESTRUCTURA DE LEWIS DEL AMONIACO1- El átomo de nitrógeno es el átomo central.2- Se cuentan todos los electrones de valencia,5 electrones de N + (3 x 1) electrones de H = 8 electrones3- Se forman enlaces entre el átomo central y losperiféricos. Los electrones restantes se sitúan comopares libres (no enlazantes) para completar el octeto delnitrógenoH N HHCarga formal de nitrógeno, 5 -2 -3= 0
ESTRUCTURA DE LEWIS DEL IÓN I N SULFITO1- El átomo de azufre es el átomo central.2- Se cuentan todos los electrones de valencia,6 electrones de S + (3 x 6) electrones de O + 2 electrones del ión =26 (13 pares de electrones)3- Se forman enlaces simples entre el átomo central y losperiféricos. Los electrones restantes se sitúan como pareslibres (no enlazantes) para completar el octeto del azufre.O S OO2-Carga formal de azufre, 6 -2 -3= + 1Carga formal de los oxígenos, 6 – 6 – 1 = -1
ESTRUCTURA DE LEWIS DEL CO 21- El átomo de carbono es el átomo central.2- Se cuentan todos los electrones de valencia,4 electrones de C + (2 x 6) electrones de O = 16 (8 pares de electrones)3- Se forman enlaces múltiples entre el átomo central ylos periféricos para completar el octeto de los átomos.OC OCarga formal de carbono, 4 - 4 = 0Carga formal de los oxigenos, 6 – 4 – 2 = 0
ESTRUCTURA DE LEWIS DEL SO 21- El átomo de azufre es el átomo central.2- Se cuentan todos los electrones de valencia,6 electrones de S + (2 x 6) electrones de O = 18 (9 pares de electrones)3- Se forman enlaces simples para completar el octeto de losátomos unidos al átomo central.4- Se forman enlaces múltiples para que el átomo central tenga suocteto.OS OCarga formal del azufre, 6 – 2 – 3 = +1Carga formal de los oxígenos, 6 – 6 – 1 = -16 – 4 – 2 = 0
ESTRUCTURAS DE RESONANCIAOS O O S OOS O O S O
ESTRUCTURA DE LEWIS DEL IÓN I N SULFATO6 electrones de S + (4 x 6) electrones de O + 2 electrones del ión =32 (16 pares de electrones)O2-O S OOCarga formal de azufre, 6 -4= + 2Carga formal de los oxígenos, 6 – 6 – 1 = -1
ESTRUCTURA DE LEWIS DEL IÓN I N SULFATOEstructura más probable!!!O2-O S OOCarga formal de azufre, 6 -6= 0Carga formal de los oxígenos con enlace múltiple, 6 – 4 – 2 = 0Carga formal de los oxígenos con enlace simple: 6 – 6 – 1 = -1
EXCEPCIONES A LA REGLA DEL OCTETO1- Moléculas con un número impar de electrones.En moléculas como el ClO 2 , NO y NO 2 el número deelectrones es impar. Por lo tanto es imposible aparearestos electrones y tampoco puede lograrse un octeto entorno a todos los átomos.N ON O
EXCEPCIONES A LA REGLA DEL OCTETO5 electrones del nitrógeno + (2 x 6) electrones de O = 17 electronesON OLos átomos que tienen uno o máselectrones sin aparear son atraídospor un campo magnético y sedenominan paramagnéticosOON ON OEl NO 2a 0 o C se dimeriza en N 2O 4y el fenómeno se revierte.
EXCEPCIONES A LA REGLA DEL OCTETO2- Moléculas en las que un átomo tiene menos de unoctetoEsta situación se encuentra en compuestos que tienenboro o berilio. Ej: BF 3 , trifluoruro de boroF B FF
EXCEPCIONES A LA REGLA DEL OCTETO3- Moléculas en las que un átomo tiene más de un octetoEsta situación se encuentra en algunas moléculas oiones en las que hay un elemento central que perteneceal tercer período o superior. Ej: PCl 5 , AsF 6- , ICl 4- ,XeF 2 ,PO 42-.ClClPClClCl
ESTRUCTURA DE LEWIS DEL ÁCIDO H 2 SO 46 electrones de S + (4 x 6) electrones de O + 2 electrones del ión = 32electronesOHO S OOH
ESTRUCTURA DE LEWIS DEL IÓN I N CARBONATO4 electrones de C + (3 x 6) electrones de O + 2 electrones del ión = 24O C OO2-O C OO2-O C O2-O
ESTRUCTURA DE LEWIS DEL H 2 CO 34 electrones de C + (3 x 6) electrones de O + 2 electrones del H = 24NO posee RESONANCIA!!O C OHOH
HIDRÓXIDOSESTRUCTURA DE LEWIS DECOMPUESTOS IÓNICOSIO H2 Ca_Ca 2+
OXOSALES, son sales oxigenadas formadas porretículos cristalinos que contienen cationes metálicos yaniones formados por un no metal y oxígeno. Paraescribir la estructura de Lewis de una oxosal debemostener en cuenta que el metal cede electronestransformándose en un catión y estos electrones, a suvez generan un anión.O2-Na +O S OONa +
ESTRUCTURA DE LEWIS DEL CLORATODE POTASIOO_O Cl OK +
SALES IÓNICAS INO OXIGENADASF_Ca 2+F__ClNa +Cl_Ca 2+Cl_