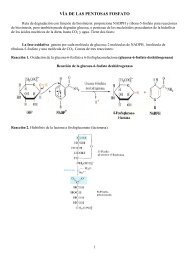
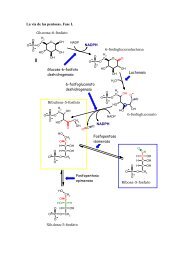
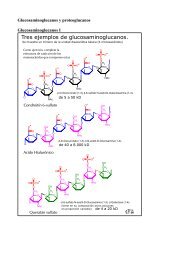
La transcripción en eucariótas
La transcripción en eucariótas
La transcripción en eucariótas
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>La</strong> <strong>transcripción</strong> <strong>en</strong> <strong>eucariótas</strong>
RNA polimerasas de los eucariotasTipo Localización Transcritos Efecto de la α-amanitinaI Nucleolo rRNA de 18 S, 5.8 S y 28 S Ins<strong>en</strong>sibleII Nucleoplasma Precursores del mRNA y snRNA Fuertem<strong>en</strong>te inhibidaIII Nucleoplasma tRNA y rNA de 5 S Inhibida a altasconc<strong>en</strong>traciones<strong>La</strong>s tres polimerasas de las levaduras pose<strong>en</strong> cuatro subunidades c<strong>en</strong>trales que pres<strong>en</strong>tanalguna homología con las subunidades β, β’ y α de la RNA polimerasa de E. coli. <strong>La</strong>subunidad más grande 1 (β’) de la RNA polimerasa II también conti<strong>en</strong>e un dominio C-terminal (CTD) es<strong>en</strong>cial. <strong>La</strong>s RNA polimerasas I y III pose<strong>en</strong> las mismas dossubunidades α-símiles no idénticas, mi<strong>en</strong>tras que la polimerasa II ti<strong>en</strong>e dos copias deuna subunidad α-símil difer<strong>en</strong>te. <strong>La</strong>s tres polimerasas compart<strong>en</strong> otras 5 subunidadescomunes. Además cada polimerasa de levadura conti<strong>en</strong>e cuatro a siete subunidadessingulares más pequeñas.
Structural similarity betwe<strong>en</strong> prokaryotic and eukaryotic RNAPsααωβ’βX-Ray structure of Taq RNAP core <strong>en</strong>zyme. αsubunits are yellow and gre<strong>en</strong>, β subunit is cyan, β´subunit is pink, ω subunit is gray.The X-Ray structure of yeast RNAP II that lacksits Rpb4 and Rpb7 subunits.
RNA POLIMERASA I<strong>La</strong> Pol I es un <strong>en</strong>zima que conti<strong>en</strong>e 13 subunidades y un peso molecular de 600 Kd.Se sabe que necesita al m<strong>en</strong>os de dos factores de <strong>transcripción</strong>. Transcribe los RNAribosómicos 28 S 18 S y 5.8 S. EL g<strong>en</strong> que codifica el precursor de 45 S se <strong>en</strong>cu<strong>en</strong>tra <strong>en</strong> elnucléolo <strong>en</strong> multiples copias dispuestas <strong>en</strong> tándem.Micrografía electrónica de unidades de <strong>transcripción</strong>de pre-rRNA del nucléolo de un oocito de batracio.Cada pluma repres<strong>en</strong>ta una molécula de pre-rRNAasociadas con proteínas <strong>en</strong> una pre-rRNP que surge de unaunidad de <strong>transcripción</strong>. <strong>La</strong>s unidades de <strong>transcripción</strong> depre-rRNA están dispuestas <strong>en</strong> tándem, separadas porregiones espaciadoras no transcriptas de cromatinanucleolar.1-Metilación <strong>en</strong> los 2’ OH2-Escisión
AIGSIGSB150 pbComplejo de iniciación de la RNApolimerasa I (Levaduras)UAFRm5p, Rm9p10p, Uaf30pH 3 y H 4Core factorRm6p, Rm7p, 11pTBP
Transcription factors associated with rRNA transcriptionUPE-binding factors Core-bind. fact. Enhancer-bind. fact. Termination fact.UAF (S.cerevisiae) CF (yeast) Reb1p (S.cerevisiae) Reb1p (S.cerevisiae)UBF (human, mouse, rat,X<strong>en</strong>opus)SLI (human, rat)UBF (human, mouse, rat,X<strong>en</strong>opusTTF-1 (mouse, human)Rib1 (X<strong>en</strong>opus)E 1 BF (rat)TIF-IB (mouse,A.castellani)EBF (A.castellani)• Promoter Elem<strong>en</strong>ts (see Handout)oBipartite promoter• Core sequ<strong>en</strong>ce elem<strong>en</strong>t = -45 to +20 in humans (+10 on average in other systems)• Absolutely required for Tx• Upstream control elem<strong>en</strong>t (UCE) = -156 -107 in humans (~-145 to core in other systems)• Affects effici<strong>en</strong>cy of transcription, but not absolutely required for Tx• Deleletion of UCE drops Tx 10-20 fold• Both elem<strong>en</strong>ts G/C-rich and ~85% similar to each other in humans• Core Factors• UBF1 and SL-1• UBF1 binds core promoter and UCE• UBF1 improves binding of SL-1 to core promoter• SL-1 (Selectivity factor 1) binds core promoter• These two factors position polymerase so that it binds and initiates at +1• TBP (transcription binding protein) is ess<strong>en</strong>tial positioning factor and compon<strong>en</strong>t of SL-1• Mutations in yeast TBP id<strong>en</strong>tified that do not affect pol I but do affect pol II or polIII Tx• Mutations likely alter regions in TBP that interact with polymerasespecific TAFs• TBP common to all RNA polymerases and critical positioning factor• SL-1 is an analog of TFIID in Pol II containing TBP and 3 TAFs (transcription bindingprotein activating factors) specific and unique to pol Io UBF1 binds core sequ<strong>en</strong>ce elem<strong>en</strong>t------->> th<strong>en</strong> SL-1 (4 proteins, one is TBP) ------->> Pol I binds andtranscription• UBF1 binding to core and UCE increases affinity and how tightly bound to site• Polymerase footprinting on promotero Does not footprint on its owno Polymerase-dep<strong>en</strong>d<strong>en</strong>t footprint shows no sequ<strong>en</strong>ce dep<strong>en</strong>d<strong>en</strong>ce• Mutations in region of footprint do not alter footprinto Polymerase-dep<strong>en</strong>d<strong>en</strong>t footprint is ext<strong>en</strong>ded by UBF footprint and bound SL-1• Region bound by polymerase is same as UBF and is ext<strong>en</strong>ded by UBF/SL-1• In some cases, an <strong>en</strong>hancer-like elem<strong>en</strong>t may be pres<strong>en</strong>t further upstream in form of repeated sequ<strong>en</strong>ceo In X<strong>en</strong>opus, repeats resemble the promoter• Take up 50% of NTS• 75% similarity to UCE (-114 to -72)• Occassional repeats with 90% similarity to full promoter (-147 to +4)o In yeast, repeats are differ<strong>en</strong>to Mechanism of action of <strong>en</strong>hancer unknown• UBF1 and RNA pol I from any eukaryote can function on a heterologous DNA template• SL1 confers species specificity on the initiation reactionTermination*Discrete termination site ~1000 bp 3' of mature rRNA terminus (mature 3' <strong>en</strong>d g<strong>en</strong>erated by RNA cleavages)*Involves recognition of 18 bp elem<strong>en</strong>t pres<strong>en</strong>t in multiple copies (AGGTCGACCA/TT/ANTCCG termed “Sal Box”)*T-rich elem<strong>en</strong>t located upstream of the terminator (mouse)*Transcription termination factor (TTF-I) binds to elem<strong>en</strong>ts and facilitates termination*TTF-I that stops elongating Pol I and PTRF (Pol I and transcrip release factor, a 44 KDa protein that interacts with Pol I,TTF-I and the 3´ <strong>en</strong>d of pre-rRNA) that dissociates TTF-1-paused transcription complexes.*TTF specific for pol I and no effect on pol II or E.coli RNA polymerase
Complejo de iniciación de la RNA polimerasa I MamiferosAmplificomaRegulation of the basal Factors. Black arrowsindicate interactions, gre<strong>en</strong> indicate activatingand red indicate repressive interactions orposttranslational modifications.Assembly of the pol I initiation complexMamiferos Levaduras1 UBF (dímero) ~ UAF2 SL1 (tetrámero) ~ CFa) TBP95/110b) TAFs: 68/6348
Promotores de la RNA polimerasa IIIOrganisation of the three g<strong>en</strong>eral types of promoter used by polIII. The site of transcriptioninitiation is indicated by +1 and the site of termination is indicated by Tn. Also shown are thepositions of various promoter elem<strong>en</strong>ts, including the intermediate elem<strong>en</strong>t (IE), proximal sequ<strong>en</strong>ceelem<strong>en</strong>t (PSE) and distal sequ<strong>en</strong>ce elem<strong>en</strong>t (DSE).TFIIIC subunits in S. cerevisiaeSubunit G<strong>en</strong>e Refer<strong>en</strong>ce Remarksτ138 TFC3 (346) Two regions of weak HMG homologyτ131 TFC4 (347) Multiple TPR repeats; HLH homologyτ95 TFC1 (348) HTH homologyτ91 TFC6 (349) No significant homologiesτ60 TFC8 (351) No significant homologiesτ55 TFC7 (350) Chimeric protein g<strong>en</strong>erated by chromosomalrearrangem<strong>en</strong>tTFIIIB subunits in S. cerevisiaeTBP90 KDa (B)70KDa(Tx binding protein)TFIIIB , no ability to bind to a g<strong>en</strong>e in abs<strong>en</strong>ce of either TFIIIA or TFIIICTFIIIA40 KDa Binds 5S ICR sequ<strong>en</strong>ce specific fashion also binds 5S RNA facilitating feecbackregulation only required for Tx of 5S g<strong>en</strong>es
Human U6 snRNA G<strong>en</strong>eTFIIIC1OCT-1PTF/SNAPc(P<strong>en</strong>támero)?TBP ó TFIIIBDSE PSE TATA+1RNA POLIMERASA III<strong>La</strong> pol III ti<strong>en</strong>e 14 subunidades y un peso molecular de 700 kDa. Todos los g<strong>en</strong>es que transcribe sonpequeños y están regulados por secu<strong>en</strong>cias que se <strong>en</strong>cu<strong>en</strong>tran d<strong>en</strong>tro de la región transcrita. De todos losg<strong>en</strong>es transcritos por la pol III, el que más se conoce es el del RNA 5 S. Este g<strong>en</strong> está pres<strong>en</strong>te también <strong>en</strong>multiples copias, aunque g<strong>en</strong>eralm<strong>en</strong>te no se agrupan <strong>en</strong> tand<strong>en</strong>, ni se localizan <strong>en</strong> una zona concreta delnúcleo.Factores de <strong>transcripción</strong> de la pol III para la síntesis del RNA 5 STF III A, específico para la síntesis del RNA 5 S, monómero, reconoce la secu<strong>en</strong>cia bipartita de 12nucleótidos <strong>en</strong> el DNA, además se fija también a TF III B , TF III C, y al RNA 5S. <strong>La</strong> fijación al DNA lohace mediante dedos de zinc.TF III B, también para la síntesis de tRNA , es un trímeroTF III C, también para la síntesis de tRNA , es un hexámero• Termination of pol III g<strong>en</strong>eso occurs in a run of 4 Us located in a G/C-rich regiono some heterog<strong>en</strong>eity in 3' <strong>en</strong>d formed within the Us
Procesami<strong>en</strong>to de los tRNA <strong>en</strong> eucariotas
<strong>La</strong> síntesis difer<strong>en</strong>cial de proteínas específicas de un tejido, implica uncontrol de la <strong>transcripción</strong> de los g<strong>en</strong>es correspondi<strong>en</strong>tes, específico paracada tejido.
Secu<strong>en</strong>cias reguladoras <strong>en</strong> los g<strong>en</strong>es eucariontes codificadores de proteínas<strong>La</strong> expresión de los g<strong>en</strong>es eucariontes codificadores de proteínas suele estar regulada por medio demúltiples regiones de control de la <strong>transcripción</strong> de acción cis. Algunos elem<strong>en</strong>tos de controlestán ubicados cerca del inicio (elem<strong>en</strong>tos proximales del promotor) mi<strong>en</strong>tras que otros se<strong>en</strong>cu<strong>en</strong>tran más distantes (amplificadores).Los promotores determinan el sitio de iniciación de la <strong>transcripción</strong> y dirig<strong>en</strong> la unión de la RNApolimerasa II. En el DNA eucarionte se han id<strong>en</strong>tificado tres tipos de secu<strong>en</strong>cias promotoras. <strong>La</strong>caja TATA, que es la más común, prevalece <strong>en</strong> los g<strong>en</strong>es de <strong>transcripción</strong> rápida. Los promotoresiniciadores se <strong>en</strong>cu<strong>en</strong>tran con poca frecu<strong>en</strong>cia <strong>en</strong> algunos g<strong>en</strong>es y las islas CpG son característicasde los g<strong>en</strong>es que se transcrib<strong>en</strong>.Los elem<strong>en</strong>tos proximales del promotor aparec<strong>en</strong> a no más de 200 bp del sitio de inicio. Varios deestos elem<strong>en</strong>tos, con hasta 20 bp, contribuirían a regular un g<strong>en</strong> <strong>en</strong> particular.Los amplificadores que suel<strong>en</strong> t<strong>en</strong>er una longitud de 100 – 200 bp, conti<strong>en</strong><strong>en</strong> múltiples elem<strong>en</strong>tosde control de 8 a 20 bp. Pued<strong>en</strong> estar ubicados desde 200 bp hasta dec<strong>en</strong>as de kilobases hacia 5’ ohacia 3’ de un promotor, <strong>en</strong> un intrón o hacia 3’ del exón final de un g<strong>en</strong>.Los elem<strong>en</strong>tos proximales del promotor y los amplificadores a m<strong>en</strong>udo son específicos de tipocelular y sólo funcionan <strong>en</strong> tipos celulares difer<strong>en</strong>ciados específicos.Promotores eucarióticosa) caja TATAb) iniciador(5’) Y-Y-A +1 -N-T/A-Y-Y-Y (3’)A +1 = comi<strong>en</strong>za la <strong>transcripción</strong>Y = cualquiera de las pirimidinas (C o T)N = cualquiera de las 4 basesT/A = es T o Ac) islas CpG
Modelo g<strong>en</strong>eral de los elem<strong>en</strong>tos de control de acción cis que regulan la expresión génica <strong>en</strong>levaduras y organismos multicelulares. (a) Los g<strong>en</strong>es de los organismos multicelulares conti<strong>en</strong><strong>en</strong>tanto elem<strong>en</strong>tos proximales del promotor como amplificadores y también una caja TATA u otroelem<strong>en</strong>to promotor. Los amplificadores pued<strong>en</strong> estar hacia 5’ o hacia 3’ y hasta 50 kb de distanciadesde el sitio de inicio. (b) <strong>La</strong> mayoría de los g<strong>en</strong>es de levadura conti<strong>en</strong>e una sola regiónreguladora, llamada secu<strong>en</strong>cia activadora hacia 5’ (UAS), y una caja TATA que se <strong>en</strong>cu<strong>en</strong>tra a ~ 90pares de bases hacia 5’ del sitio de inicio.Complejo de iniciación de la <strong>transcripción</strong> de la RNA polimerasa II(Factores de <strong>transcripción</strong> g<strong>en</strong>erales)
<strong>La</strong> pol II requiere varios factores de <strong>transcripción</strong> g<strong>en</strong>erales para localizar el sitio de inicioadecuado <strong>en</strong> un molde de DNA e iniciar la <strong>transcripción</strong>. Entre ellos se <strong>en</strong>cu<strong>en</strong>tra el TF IID,que se une a una caja TATA a través de su subunidad TBP.<strong>La</strong> pol II puede iniciar la <strong>transcripción</strong>”In Vitro” mediante la unión secu<strong>en</strong>cial de lossigui<strong>en</strong>tes elem<strong>en</strong>tos <strong>en</strong> el ord<strong>en</strong> indicado: TBP, que se une al DNA, TF IIB, un complejo depol II y TF IIF, TF II E y TF II H<strong>La</strong>s actividades de helicasa de dos subunidades de TF IIH separan la hebra molde a laaltura del sitio de inicio <strong>en</strong> la mayoría de los promotores, un proceso que requiere elconsumo de ATP. Conforme la pol II comi<strong>en</strong>za a alejarse del sitio de inicio, su CTD esfosforilado por otra subunidad del TF IIH.<strong>La</strong> iniciación por la pol II in vivo requiere el complejo mediador multiproteico. Este seasocia con el CTD no fosforilado de la pol II para formar un complejo holo<strong>en</strong>zimático muygrande, que también incluye la mayoría de los factores de <strong>transcripción</strong> g<strong>en</strong>erales. Se creeque “In Vivo” esta holo<strong>en</strong>zima prearmada se une al DNA promotor <strong>en</strong> un solo paso.El complejo de iniciación de la <strong>transcripción</strong> de la pol II que “In Vivo” se <strong>en</strong>sambla <strong>en</strong> lospromotores cont<strong>en</strong>dría hasta 60 –70 polipéptidos con una masa total semejante a la de unribosoma.Fase de elongación
Regulación de la expresión génica <strong>en</strong> eucariotas: Iniciación
Activación. Schematic summary of yeast coactivators and their activities. Transcriptional activation bya UAS-activator complex can occur by direct interaction betwe<strong>en</strong> an acidic activator protein andcompon<strong>en</strong>ts of the core transcriptional machinery or can be indirect, mediated by coactivators that interacteither with compon<strong>en</strong>ts of the core transcriptional machinery (TFIIA, TAFs, SRB/mediator) or withnucleosomes (SWI/SNF, HATs). TFIIA interacts with the core transcriptional machinery through TBP,functioning as either an antirepressor or coactivator. TAFs also interact with TBP as compon<strong>en</strong>ts of theTFIID complex. Although initially thought to be requisite coactivators of transcription, TAFs now appearto be required for activation of only a subset of g<strong>en</strong>es with noncanonical TATA elem<strong>en</strong>ts. SRB/mediatoris a compon<strong>en</strong>t of an RNA pol II holo<strong>en</strong>zyme complex, interacting with RNA pol II through the CTD ofRpb1. The SRB/mediator includes subunits that function in transcriptional repression as well as activation.Several HATs have be<strong>en</strong> id<strong>en</strong>tified in yeast, including the Gcn5-containing SAGA complex. HATs appearto mediate transcriptional activation by acetylation of nucleosomal histones, resulting in chromatinremodeling. The SWI/SNF complex also appears to facilitate chromatin remodeling, in this case bypromoting nucleosome displacem<strong>en</strong>t in an ATP-dep<strong>en</strong>d<strong>en</strong>t manner.Represión. Schematic summary of g<strong>en</strong>eral transcriptional repressors and their activities. Comparable tocoactivators, g<strong>en</strong>eral repressors can interact either with the core transcriptional machinery or withnucleosomes. Mot1, Dr1-DRAP1 (NC2), and the Ccr4-Not complex confer transcriptional repression byinteraction with compon<strong>en</strong>ts of the core machinery. Mot1 interacts directly with TBP and promotesTATA-TBP dissociation in an ATP-dep<strong>en</strong>d<strong>en</strong>t manner. Dr1-DRAP1 also interacts directly with TBP but,in contrast to Mot1, represses transcription by blocking TBP interaction with TFIIA and TFIIB rather thanby displacing TBP from DNA. The Ccr4-NOT complex also targets the core machinery. Whereas Mot1promotes TBP-DNA dissociation, the Ccr4/NOT complex has be<strong>en</strong> proposed to negatively regulate theactivity of factors (e.g., TFIIA) that facilitate TBP-TATA association. In contradistinction to HATs(Fig.4), HDA complexes repress transcription by deacetylation of histones or other factors, presumablyallowing reestablishm<strong>en</strong>t of repressive chromatin structures. HDAs do not bind DNA directly but aretargeted by URS-repressor complexes. Ssn6-Tup1 is also targeted by URS-repressor complexes and wasrec<strong>en</strong>tly reported to interact with histones H3 and H4. Thus, HDAs and Ssn6/Tup1 are similar in theirmodes of transcriptional repression, although Ssn6/Tup1 is not an HDA. The BUR proteins, includingBur1, Bur2, Bur4, and Bur5, appear to mediate repression by affecting chromatin structure. (BUR5 isid<strong>en</strong>tical to HHT1/SIN2, which <strong>en</strong>codes histone H3.) The Spt4-Spt5 complex also regulates transcriptionby affecting the chromatin structure. Rec<strong>en</strong>tly, a human Spt4-Spt5 complex, d<strong>en</strong>oted DSIF, was id<strong>en</strong>tifiedas a transcription elongation factor. Spt6 is functionally related to Spt4 and Spt5 but does not appear to bea compon<strong>en</strong>t of the Spt4-Spt5 complex. An important characteristic of several g<strong>en</strong>eral transcriptionalrepressors is that they can also function in transcriptional activation.
TFIID: TAFsA model of functions associated with TFIID and its subunits. Activator-targeting is indicated by TAF 130interaction with the Sp1 transactivator (purple). Several TFIID subunits have be<strong>en</strong> implicated in DNAbinding, including TBP (yellow), which binds to the TATA sequ<strong>en</strong>ce; TAF 150 (blue), which interactswith the initiator elem<strong>en</strong>t (INR); and TAF 70 (red) and TAF 31 (red), which interact with a downstreampromoter elem<strong>en</strong>t (DPE). A submodule of TAFs (in red) has be<strong>en</strong> found associated with other coactivatorcomplexes. The largest subunit of TFIID, TAF250 (gre<strong>en</strong>), exhibits a number of activities, includingprotein kinase, ubiquitin ligase, histone acetyltransferase (HAT), and histone-interacting tandembromodomains (2xBromo). (Ac, acetyl; H1, histone H1; Ub, ubiquitin.) TFIID has be<strong>en</strong> proposed tonucleate the formation of a pre-initiation complex by recruiting RNA polymerase II (pol II) and the otherg<strong>en</strong>eral transcription factors (GTFs) (orange). The molecular weights of TAFs shown here repres<strong>en</strong>thuman TFIID subunits, although some functions depicted have be<strong>en</strong> described only for Drosophila TFIID.
A model for the pot<strong>en</strong>tial role of histone acetylation in stabilizing TFIID interaction with active chromatinregions via the TAF250 tandem bromodomains.
SRB/MediatorSRB/mediator is functionally defined by three activities:• Stimulation of basal transcription in a highly purified system.• Response to transcriptional activators “in vitro”·• Stimulation of phosphorylation of the RNA pol II CTD by the TFIIH Kinase.• In contrast to TAFs, which appear to function as coactivators in a g<strong>en</strong>e-specific manner,SRB/mediator appears to play a more g<strong>en</strong>eral role in transcriptional activation.
Pol II Holo<strong>en</strong>zyme and Mediator• Holo<strong>en</strong>zyme– Pol II + (TFIIB, E, F, H )+ (Srb2, 4, 5, 6) + (Rgr1, Gal11, others)– Correct initiation in pres<strong>en</strong>ce of TBP (TFIID)– Responds to transcriptional activators• Mediator– Complex needed for a response to transcriptional activators by purifiedPol II plus GTFs– Yeast Mediator has 20 subunits, including Srb2, 4, 5, 6; Srb7, Rgr1,Gal11, Med 1, 2, 6, 7, Pgd1, Nut 1, 2, and others• Pol II + Mediator (+ some GTFs?) = Holo<strong>en</strong>zymeDirect BindingofHolo<strong>en</strong>zymemodel forassembly ofthe PIC
Estado de la cromatinaURS1, UAS = elem<strong>en</strong>tos de controlUm6 = represorSin3 = fijaciónRpd3 = desacetilasaGcn4 = activadorGcn5 = acetilasa
Yeast and human PCAF/GCN5 and TFIID coactivator complexes are assembled in a modular fashion.TAFs or TAF paralogs that appear to constitute a core module pres<strong>en</strong>t in all PCAF/GCN5 and TFIIDcomplexes are colored red. All complexes also harbor subunits (gre<strong>en</strong>) mediating histone acetyltransferase(HAT) activity [arrow to acetyl (Ac) on nucleosome, d<strong>en</strong>oted chromatin]. (Top) Comparison of humancomplexes containing either the human PCAF or hGCN5 HATs (gre<strong>en</strong>), and the yeast SAGA coactivatorcomplex containig the yeast GCN5 HAT (gre<strong>en</strong>). Besides containig GCN5 homologs and TAFs or TAFparalogs, these complexes also share some ADA polypeptides (light blue), SPT proteins (beige/peach),and a TraI/TRRAP homolog (mauve), distantly related to PI3 kinases (indicated by arrow to PO4?). Otheras-yet-unid<strong>en</strong>tified subunits of these complexes are shown in white. (Botton) comparison of human andyeast TFIID complexes. In addition to sharing a subset of TaFs with the GCN5-containing complexes,these complexes also contain TFIID-specific subunits, including a HAT (gre<strong>en</strong>) and other TAFs (cyan), aswell as a TATA-binding protein (TBP in yellow). Interestingly, whereas the human TAF250 contain HATactivity, two bromodomains (dark blue ovals), and a C-terminal protein kinase activity (arrow to PO4), inyeast these functional domains appear to be pres<strong>en</strong>t on separate polypeptides: the yeastTAF130/145protein harbors HAT activity and the yeast BDF1/2 proteins contain the two bromodomainsand protein kinase activity.
A model of some of the differ<strong>en</strong>t activities displayed by distinct types of transcriptional coactivator complexes in regulating g<strong>en</strong>eactivity. ATP-dep<strong>en</strong>d<strong>en</strong>t nucleosome remodeling complexes light blue), which may or may not be directly recruited by sequ<strong>en</strong>cespecificactivators, help activators and the transcriptional apparatus to gain access to their cognate <strong>en</strong>hancer/promoter sequ<strong>en</strong>ce bymobilizing nucleosomes. Histone acetyltransferase (HAT) containing coactivator complexes (light purplue) have be<strong>en</strong> shown to berecruited by activators such as nuclear receptors (NRs, orange), to specific target g<strong>en</strong>es. HATs may acetylate nucleosomes tocounter repressive effects of local chromatin structure or g<strong>en</strong>erate targets for bromodomain interactions. HAT complexes could alsoacetylate other target polypeptides, such as the activators themselves, with important functional consequ<strong>en</strong>ces. Mediator-typecoactivator complexes (lav<strong>en</strong>der) may be directed to select g<strong>en</strong>es by interaction with activators, such as SREBPs [sterol-regulatedtranscription factor (blue-gre<strong>en</strong>)], and to mediate recruitm<strong>en</strong>t of RNA polymerase II (gre<strong>en</strong>) and possibly, chromatin-directedactivities. Other activators, like SP1 (dark blue) may bind to TAF compon<strong>en</strong>ts of TFIID (light red) and serve to recruit thiscoactivator complexes to nucleate the formation of a pre-initiation complex of g<strong>en</strong>eral transcription factors (GTFs, blue) and Pol II,which can th<strong>en</strong> proceed to initiate g<strong>en</strong>e trancription.Activadores y represores de la <strong>transcripción</strong> eucarionteLos amplificadores suel<strong>en</strong> cont<strong>en</strong>er multiples sitos de fijación acumulados para factores de <strong>transcripción</strong>. <strong>La</strong>unión cooperativa de multiples activadores a sitios cercanos forman un complejo multiproteico d<strong>en</strong>ominadoamplificosoma. El <strong>en</strong>samblaje de estas estructuras a m<strong>en</strong>udo requiere proteínas pequeñas, que se un<strong>en</strong> alsurco m<strong>en</strong>or del DNA y curvan mucho la doble hélice para que las proteínas a ambos lados de lacurvatura interactú<strong>en</strong> con más facilidad.Los activadores suel<strong>en</strong> ser proteínas modulares que conti<strong>en</strong><strong>en</strong> un solo dominio de unión al DNA y uno o másdominios de activación; los difer<strong>en</strong>tes dominios con frecu<strong>en</strong>cia están vinculados a través de regionespolipeptídicas flexibles. Esto permitiría la interacción de dominios de activación de difer<strong>en</strong>tes activadores,incluso cuando sus dominios de fijación al DNA estuvies<strong>en</strong> separados por dec<strong>en</strong>as de pares de bases.Los represores eucariontes también son, <strong>en</strong> su mayoría, proteínas modulares. Al igual que los activadores,suel<strong>en</strong> cont<strong>en</strong>er un solo dominio de fijación al DNA y uno o más dominios de represión, y pued<strong>en</strong> controlarla <strong>transcripción</strong> cuando se un<strong>en</strong> a sitios ubicados de ci<strong>en</strong>tos a miles de bp de un sitio de inicio.Los dominios de fijación al DNA de los factores de <strong>transcripción</strong> eucariontes pres<strong>en</strong>tan una gran variedad deestructuras. Entre los motivos estructurales más comunes están: el homeodominio, la cremallera básica(cremallera de leucina), la hélice-bucle-hélice y varios tipos de dedos de cinc. En g<strong>en</strong>eral, una alfa hélice (omás de ellas) <strong>en</strong> un dominio de fijación al DNA interactúa con el surco mayor <strong>en</strong> su sitio cognado.<strong>La</strong> capacidad de algunos factores de <strong>transcripción</strong> de formar heterodímeros aum<strong>en</strong>ta la cantidad de sitios <strong>en</strong> elDNA desde los cuales esos factores pued<strong>en</strong> controlar la <strong>transcripción</strong> y las maneras <strong>en</strong> que pued<strong>en</strong> sercontrolados.
Aunque algunos dominios de activación y de represión son ricos <strong>en</strong> aminoácidos particulares, <strong>en</strong> losdifer<strong>en</strong>tes factores de <strong>transcripción</strong> estos dominios funcionales exhib<strong>en</strong> una gran variedad desecu<strong>en</strong>cias de aminoácidos y estructuras proteicas. EjemploModelo de amplificosoma (amplificador del interferón β). El heterodímero cJun/ATF-2, IRF-3, IRF-7 y NF-κB un heterodímero (p50 y p65) se un<strong>en</strong> a los cuatro elem<strong>en</strong>tos de control <strong>en</strong> elamplificador. <strong>La</strong> unión cooperativa de estos factores de <strong>transcripción</strong> es facilitada por HMGI, quese une al surco m<strong>en</strong>or del DNA. <strong>La</strong>s proteínas cJjun, ATF-2, p50 y p65 parec<strong>en</strong> interactuar demanera directa con un HMGI unido adyac<strong>en</strong>te a ellas. <strong>La</strong> curvatura de la secu<strong>en</strong>cia amplificadoradebída a la unión HMGI es decisiva para la formación de un amplificosoma. Proteínas curvadorasdel DNA difer<strong>en</strong>tes actúan de manera similar <strong>en</strong> otros amplificadores.Estructura g<strong>en</strong>eral de los factores de <strong>transcripción</strong>Los factores de <strong>transcripción</strong> eucariontes conti<strong>en</strong><strong>en</strong> diversos motivos estructurales que interactúancon secu<strong>en</strong>cias de DNA específicas.Estructura modular de los activadores de la <strong>transcripción</strong> <strong>en</strong> eucariontesEstos factores de <strong>transcripción</strong> pued<strong>en</strong> cont<strong>en</strong>er más de un dominio de activación, pero rara vezpose<strong>en</strong> más de un dominio de fijación al DNA. Gal4 y Gnc4 son activadores de la <strong>transcripción</strong> <strong>en</strong>levaduras. El receptor de glucocorticoides (GR), que también conti<strong>en</strong>e un dominio de fijación a lahormona (no ilustrado), activa la <strong>transcripción</strong> de los g<strong>en</strong>es objetivo <strong>en</strong> pres<strong>en</strong>cia de su ligando. SP1se une a elem<strong>en</strong>tos promotores ricos <strong>en</strong> GC <strong>en</strong> una gran cantidad de g<strong>en</strong>es de mamiferos. Losdominios proteicos muy flexibles y relativam<strong>en</strong>te poco estructurados de los activadores pres<strong>en</strong>tangran s<strong>en</strong>sibilidad a la digestión de proteasas.
Hélice-giro-hélice ( Cro de λ, el represor cI de λ y CRP)Proteína Cro, dímero formado por subunidadesidénticas de 66 residuos de aa, cada una poseetres hélices α y tres hojas β antiparalelas. Eldímero se manti<strong>en</strong>e unido por la asociación dedos hebras β antiparalelas, <strong>en</strong>tre las que sesitua el eje de simetría binario<strong>La</strong> hélice α-3 (hélice de reconocimi<strong>en</strong>to) deuna subunidad está alejada 3.4 nm de suhomóloga situada <strong>en</strong> la otra subunidad, lamisma distancia que separa dos surcosmayores consecutivos de una doble hélice dewatson y Crick. Una hélice α ti<strong>en</strong>e un diámetroaproximado de 1.2 nm, el tamaño exacto para<strong>en</strong>cajar <strong>en</strong> el surco mayor del DNA, que mide1.2 nm de ancho y 0.7 nm de profundidad.<strong>La</strong> unión al DNA es un motivo hélice-giro-hélice (HTH).Los residuos del 1 al 7 forman la hélice N-terminal, losresiduos del 8 al 11 forman el giro y los residuos del 12 al20 forman la hélice C-terminal de este módulo repetitivoLos contactos nopolares <strong>en</strong>tre estashélices estabilizan elconjuntoLos residuos de estelado forman pu<strong>en</strong>tesde hidróg<strong>en</strong>o con lasbases del surco mayor
Proteínas de homeodominio<strong>La</strong> secu<strong>en</strong>cia homeo es un motivo que aparece <strong>en</strong> los g<strong>en</strong>es que controlan el desarrollo <strong>en</strong>insectos y <strong>en</strong> vertebrados. <strong>La</strong> secu<strong>en</strong>cia homeo consta de 180 bp y está bastante conservada,codifica el homeodominio de 60 aa con un alto cont<strong>en</strong>ido <strong>en</strong> aa básicos y se un<strong>en</strong> asecu<strong>en</strong>cias específicas <strong>en</strong> el DNA(A) g<strong>en</strong> MO-10 del ratón; (B)g<strong>en</strong> MM3 de rana (C)g<strong>en</strong> Antp de Drosophila (D)g<strong>en</strong> MA α2de levadura.180 nt60 aaEl dominio pres<strong>en</strong>ta un brazo amino-terminal ext<strong>en</strong>dido y tres alfa hélices. <strong>La</strong>s hélices 1 y 2son antiparalelas <strong>en</strong>tre sí, y casi perp<strong>en</strong>diculares a la hélice 3. <strong>La</strong> cara hidrofóbica de lahélice 3 se empaqueta fr<strong>en</strong>te a las hélices 1 y 2 para formar el interior de la proteína . Loshomeodominios se fijan a lugares específicos del DNA <strong>en</strong> forma de monómeros. El brazoamino-terminal <strong>en</strong>caja <strong>en</strong> el surco m<strong>en</strong>or, mi<strong>en</strong>tras que la hélice 3 se introduce <strong>en</strong> el surcomayor. <strong>La</strong> disposición de las hélices 2 y 3 del homeodominio es parecida a la del motivohélice-vuelta-hélice (HTH) que aparece <strong>en</strong> reguladores génicos de procariotas.(A) Repres<strong>en</strong>tación lineal del motivo del homeodominio. (B) Muestra la unión de la proteínaa un duplex de DNA de 21 pb. <strong>La</strong> hélice 3 <strong>en</strong> purpura del homeodominio ocupa el surcomayor del DNA, mi<strong>en</strong>tras que el brazo N-terminal (<strong>en</strong> amarillo) se une al surco m<strong>en</strong>or.
Dedos de zinc (C 2 H 2 )El TF IIIA conti<strong>en</strong>e nueve dominios similares, cada uno de ellos de unos 30 residuos,cada una de estas unidades repetitivas conti<strong>en</strong>e dos cisteínas y dos histidinas <strong>en</strong>localizaciones idénticas. Estos residuos invariantes están coordinados tetraédricam<strong>en</strong>tecon un ión zinc. Además se conservan tres residuos hidrofóbicosSecu<strong>en</strong>cia conc<strong>en</strong>so : -X 3 –Cys-X 2-4 -Cys-X 12 -His-X 3-4 -His-X 4 -Residuos hidrofóbicosUna horquilla β antiparalela (residuos 1-10) va seguida por una vuelta y después poruna hélica α. El átomo de zinc, que se <strong>en</strong>cu<strong>en</strong>tra <strong>en</strong>cerrado <strong>en</strong> su interior, estabiliza elmódulo debido a que está unido a dos cisteínas de la horquilla β y a dos histidinas de lahélice α.
Dedos de Zinc C 4Los dedos C 4 se descubrieron <strong>en</strong> los receptores nucleares.El dominio de fijación al DNA deestas proteínas posee la secu<strong>en</strong>cia cons<strong>en</strong>so:-Cys-X 2 -Cys-X 13 -Cys-X 2 -Cys-X 14-15 -Cys-X 5 -Cys-X 9 -Cys-X 2 -Cys-Cada uno de los dos grupos de cuatro cisteínas fija un ión zinc. A difer<strong>en</strong>cia de las C 2 H 2 queconti<strong>en</strong><strong>en</strong> tres o más dedos y se fijan al DNA como monómeros, éste grupo suel<strong>en</strong> cont<strong>en</strong>ersólo dos dedos y se fijan como homodímeros o heterodímeros. Los homodímeros suel<strong>en</strong>t<strong>en</strong>er simetría rotacional doble.a) <strong>La</strong> proteína GL1 con cinco dedos C 2 H 2, esta proteína monomérica es codificada por ung<strong>en</strong> que está amplificado <strong>en</strong> varios tumores humanos. El dedo 1 no interactúa con el DNA,mi<strong>en</strong>tras que los otros cuatro dedos si lo hac<strong>en</strong>. Los pequeños circulos negros repres<strong>en</strong>tanátomos de Zn 2+ . b) el receptor de glucocorticoides, una proteína C 4 hodimérica. Dos hélicesα (más oscuras), una <strong>en</strong> cada monómero, interactúan con el DNA. Como todos loshomodímeros con dedos de Zn 2+ C 4 , este factor de <strong>transcripción</strong> posee una simetríarotacional doble; el c<strong>en</strong>tro de simetría está señalado por la elipse amarilla. <strong>La</strong>s esferas grisesindican iones de Zn 2+ .
Dedo de zinc C 6<strong>La</strong> proteína Gal 4 de levadura es un tercer tipo de motivo <strong>en</strong> dedo de cinc. <strong>La</strong>sproteínas de esta clase pose<strong>en</strong> la secu<strong>en</strong>cia cons<strong>en</strong>so:-Cys-X 2 -Cys-X 6 -Cys-X 5-6 -Cys-X 2 -Cys-X 6 -Cys-<strong>La</strong>s seis cisteínas fijan 2 iónes Zn 2+ , con lo que la región se pliega <strong>en</strong> un dominioglobular compacto. <strong>La</strong> proteína Gal 4 se fija al DNA <strong>en</strong> forma de un homodímero, <strong>en</strong> elcual los monómeros se asocian a través de interacciones hidrofóbicas a lo largo de unacara de sus regiones alfa helicoidales, para formar una estructura superhelicoidal .Modelo tridim<strong>en</strong>sional de la interacción <strong>en</strong>tre la Gal 4 y el DNA.Esta proteína se fija al DNA como un homodímero <strong>en</strong> donde los monómeros interactúanpara formar una hélice <strong>en</strong>rollada que se ubica perp<strong>en</strong>dicular a la doble hélice del DNA.<strong>La</strong> unión de residuos de cisterna a dos iónes Zn 2+ (<strong>en</strong> amarillo) <strong>en</strong> cada monómeroforma dos dominios globulares que interactúan con el DNA.
<strong>La</strong>s proteínas con cremallera de leucina- Pres<strong>en</strong>cia de segm<strong>en</strong>tos con una longitud de aproximadam<strong>en</strong>te 35 residuos <strong>en</strong> los quela leucina aparece cada 7 residuos. Esta regularidad sugiere que forman un alfahelicoide<strong>en</strong>rollado (super<strong>en</strong>rollami<strong>en</strong>to). Además, hay una región básica de unos 30residuos hacia el extremo amino terminal. Esta región actúa como un módulo de uniónal DNA.- <strong>La</strong> función de la región de cremallera de leucina es la de acercar una pareja demódulos de unión al DNA para que se unan a dos secu<strong>en</strong>cias de DNA adyac<strong>en</strong>tes.- <strong>La</strong>s cremalleras de leucina pued<strong>en</strong> formar homodímeros o heterodímeros.K leucinaR argininaL leucinaModelo propuesto para la unión de una proteínacon cremallera de leucina a una secu<strong>en</strong>cia dianapalindrómica del DNA. <strong>La</strong> cremallera estáestabilizada por interacciones hidrofóbicas y devan der Waals <strong>en</strong>tre leucinas.
Hélice-lazo-héliceEl dominio de fijación al DNA de otra clase de factores de <strong>transcripción</strong> diméricosconti<strong>en</strong>e un motivo estructural muy similar al de cremallera básica , exepto que unbucle no helicoidal de la cad<strong>en</strong>a polipeptídica separa dos regiones α-helicoidales <strong>en</strong>cada monómero, llamado hélice-lazo-hélice (HLH). Estas proteínas conti<strong>en</strong><strong>en</strong> unahélice α N-terminal con residuos básicos que interactúan con el DNA, una regiónintermedia <strong>en</strong> bucle y una región C-terminal con aminoácidos hidrófobos espaciados aintervalos característicos de una α-hélice antipática. Debido a los aminoácidos básicoscaracterísticos de este motivo, los factores de <strong>transcripción</strong> que lo conti<strong>en</strong><strong>en</strong> a veces sed<strong>en</strong>ominan proteínas con hélice-bucle-hélice básicas (bHLH). Como ocurre con lasproteínas de cremallera básica, las difer<strong>en</strong>tes proteínas con hélice-lazo-hélice pued<strong>en</strong>formar heterodímeros.
Homodimers vs. HeterodimersDimerization and G<strong>en</strong>eration of DNA Binding MotifsActivation domains for pol II factors• "Acid Blob" or Acidic domainso Acidic activators that have preponderance of negatively charged residueso This g<strong>en</strong>eral structure may allow a wide variety of sequ<strong>en</strong>ces to have activator functiono Rec<strong>en</strong>t data suggest that although many differ<strong>en</strong>t sequ<strong>en</strong>ces do work that not all sequ<strong>en</strong>ces of equival<strong>en</strong>tcharge will activate and thus there is some restriction on range of pot<strong>en</strong>tial structureso Ex. Gal4 and VP16• Glutamine Richo Ex. Sp1 binds Sp1 box (GGGCGG)-- two glutamine-rich domains ess<strong>en</strong>tial for activation• Proliine Richo CTF/NF1 binds CCAAT box -- 25% of residues are prolineso Ex. AP2 and jun
Mecanismos de acción de los represores-Indirecta, modificando el estado de la cromatina (desacetilación de histonas)-Directa:a) competitivad con el sitio de fijación del activadorb) competitividad por el sitio de fijación de los factores g<strong>en</strong>erales de <strong>transcripción</strong> delos activadores (<strong>en</strong> el esquema C)c) interactúan directam<strong>en</strong>te con el dominio de activación de los activadoresbloqueandolos.Algunos represores eucariontes pued<strong>en</strong>inhibir la <strong>transcripción</strong> por mecanismosdifer<strong>en</strong>tes a la desacetilación de histonas.En los tres mecanismos, el represor inhibe laactivación o interfiere directam<strong>en</strong>te laformación del complejo de iniciación. Ademásalgunos represores interactúan con proteínas“correpresoras”, que a su vez interactúan confactores de <strong>transcripción</strong> g<strong>en</strong>erales.Ejemplo:Región de control del g<strong>en</strong> codificador de EGR-1, un activador de la <strong>transcripción</strong>. Lossitios de unión para la WT1, una proteína represora eucarionte, no se superpon<strong>en</strong> con lossitios de union para SRF y AP1, dos activadores ubicuos, ni con el sitio de inicio. Por tanto, larepresión por la WT1 no interfiere <strong>en</strong> la unión de otras proteínas.
Receptores nuclearesHormonas liposolubles que seun<strong>en</strong> a los miembros de lasuperfamilia de receptoresnucleares de los factores de<strong>transcripción</strong>.Modelo g<strong>en</strong>eral de losfactores de <strong>transcripción</strong><strong>en</strong> la superfamilia de losreceptores nucleares.Secu<strong>en</strong>cias cons<strong>en</strong>so de los sitios del DNA,llamados “elem<strong>en</strong>tos de respuesta”, quefijan el receptor de glucocorticoides (GRE),el receptor de estróg<strong>en</strong>os (ERE), el receptorde la vitamina D 3 (VDRE), el receptor dehormona tiroidea (TRE) y el receptor de ac.retinoico (RARE).
Los activadores estimulan el <strong>en</strong>samblaje altam<strong>en</strong>te cooperativo de los complejos deiniciación.A)HNF1 : con caja homeótica, específica del hepatocitoB)HNF3 : con hélice alada, específica del hepatocitoC)HNF4 : receptor nuclear se <strong>en</strong>cu<strong>en</strong>tra además, <strong>en</strong> epitelio intestinal y células de los túbulos r<strong>en</strong>alesD)C/EBP: heterodímero con cremallera básica, además está <strong>en</strong> intestino, adipocitos y neuronasE)AP1: familia de proteínas pequeñas con cremallera básica, heterodiméricas de expresión g<strong>en</strong>eralActivadores que controlan la <strong>transcripción</strong> del g<strong>en</strong> de la transtirretina (TTR)
Los precursores de los mRNA adquier<strong>en</strong> la estructura cap 5’ durante la <strong>transcripción</strong><strong>La</strong>s funciones de la caperuza son:a) <strong>La</strong> protección de la molécula fr<strong>en</strong>te a exonucleasasb) Marcar al hnRNA como sustrato de otras reacciones de procesami<strong>en</strong>to <strong>en</strong> el núcleoc) Marcar el final de la iniciación para com<strong>en</strong>zar la elongación de la <strong>transcripción</strong>d) Señalar el mRNA como traduciblee) Ayudar a eliminar el primer intrón.(a) <strong>La</strong> 7- metilguanosina se une al extremo 5’ de casi todos los mRNA eucarióticos con un <strong>en</strong>lace pocousual 5’-5’-trifosfato. Hay tres tipos de caperuzas:Tipo 0: se produce por metilación <strong>en</strong> el N-7 de la guanosina terminal. Se <strong>en</strong>cu<strong>en</strong>tra <strong>en</strong> todos losmRNA eucariotas.Tipo 1: metilación de una caperuza tipo 0 <strong>en</strong> el 2’-OH del primer nucleótido del hnRNA. No están <strong>en</strong>levaduras por carecer de esta <strong>en</strong>zima.Tipo 2: se metila una caperuza tipo 1 <strong>en</strong> el 2’OH de la ribosa sigui<strong>en</strong>te. Es habitual <strong>en</strong>contrarla <strong>en</strong> lossnRNA, y sólo se suele <strong>en</strong>contrar <strong>en</strong> vertebrados. (b) <strong>La</strong> formación de la caperuza <strong>en</strong> 5’ precisa decuatro a cinco pasos difer<strong>en</strong>tes.
Poliad<strong>en</strong>ilaciónAunque la poliad<strong>en</strong>ilación del mRNA se descubrió <strong>en</strong> 1970, su función todavía no está clara:a) Parece interv<strong>en</strong>ir <strong>en</strong> el transporte del mRNA al citoplasma;b) Parece determinar la duración de la vida media del mRNA;c) Intervi<strong>en</strong>e <strong>en</strong> la correcta o efici<strong>en</strong>te traducción del mRNA;d) Parece ser la señal que indica qué hnRNA van a madurar y cuáles no;e) Parece ser es<strong>en</strong>cial para la eliminación del último intrón.Modificación 3´: Terminación de histonasEl mRNA de las histonas no se poliad<strong>en</strong>ila sino quetermina <strong>en</strong> una posición determinada definida por elsnRNA U7 que forma parte de la snRNP U7. El cortedel mRNA lo establece y produce la propia snRNP U7gracias a que se aparean 9 nt <strong>en</strong>tre el mRNA y elsnRNA U7 unos 14-17 nt después de la horquilla. Aunos 5 nt de la horquilla se produce el corte queliberará el mRNA maduro.Algunos de los pasos principales del proceso de g<strong>en</strong>eración del extremo 3´ de un mRNAeucariota. Este proceso es mucho más complejo que su equival<strong>en</strong>te <strong>en</strong> bacterias, <strong>en</strong> el que la RNApolimerasa se deti<strong>en</strong>e al llegar a una señal de terminación y libera tanto el extremo 3´ de su transcritocomo el molde de DNA.
<strong>La</strong> mayoría de los pre-mRNA son escindidos <strong>en</strong> sitios 3’ específicos y poliad<strong>en</strong>iladosCPSF : Cleavage and polyad<strong>en</strong>ylation specifity factorCStF : Cleavage stimulatory factorCFI : Cleavage factor ICFII : Cleavage factor IIPAP : Poli (A) polimerasaPABII: Proteína de fijación a poli (A)10-35N150N31 CPSF, Heterotetrámero señal de poli(A)2 CStF, Heterotrímero G/U3 CFI, Heterotrímero CPSF-RNA-CStF3 CFII, Monómero CPSF-RNA-CStF4 PAP, Poli(A) polimerasa7 PABII Proteína fijadora de poli(A), la faserápida requiere la fijación de múltiples copiasde PABII.24567
Eliminación de intronesLos puntos de empalme de los precursores de mRNA se especifican mediante secu<strong>en</strong>cias situadas<strong>en</strong> los extremos de los intrones y la fusión de los exones se realiza mediante dos reacciones detransesterificación.Secu<strong>en</strong>cias cons<strong>en</strong>so alrededor de los sitios de empalme 5’ y 3’ <strong>en</strong> los pre-mRNA de vertebrados.<strong>La</strong>s únicas bases casi invariables son las GU (5’) y AG 3’) del intrón. En la mayoría de los casosse <strong>en</strong>cu<strong>en</strong>tra una región rica <strong>en</strong> pirimidinas cerca del extremo 3’ del intrón. <strong>La</strong> ad<strong>en</strong>osina del puntode ramificación, también invariable, suele estar a 20-50 bases del sitio de empalme 3’. <strong>La</strong> regiónc<strong>en</strong>tral del intrón cuya longitud oscila <strong>en</strong>tre 40 bases y 50 kilobases, <strong>en</strong> g<strong>en</strong>eral no es necesariapara que el empalme t<strong>en</strong>ga lugar.
Procesami<strong>en</strong>to de los snRNA de tipo UEstos RNAs los transcribe la RNA-polimerasa II, excepto el U6 que lo transcribe la III. Se expresan <strong>en</strong>todas las células eucarióticas, y sus g<strong>en</strong>es suel<strong>en</strong> estar repetidos <strong>en</strong> tándem. No están poliad<strong>en</strong>ilados, perosí ti<strong>en</strong><strong>en</strong> caperuza. Necesitan salir al citoplasma para que se elimin<strong>en</strong> de 2 a 12 nucleótidos <strong>en</strong> el extremo3’ para madurar, y luego han de volver a <strong>en</strong>trar <strong>en</strong> el núcleo para cumplir su función.TiposU1, U2, U4, U5 y U6 son los más abundantes (más de 20.000 copias por núcleo) e intervi<strong>en</strong><strong>en</strong> <strong>en</strong> el ayusteU3 intervi<strong>en</strong>e <strong>en</strong> la terminación de los rRNAU7 intervi<strong>en</strong>e <strong>en</strong> la terminación de las histonasU11 (snoRNA) intervi<strong>en</strong>e <strong>en</strong> la poliadelinación y a veces <strong>en</strong> el ayuste, sustituy<strong>en</strong>do a U1U12 (snoRNA) también intervi<strong>en</strong><strong>en</strong> <strong>en</strong> el ayuste sustituy<strong>en</strong>do a U2.Esquema de los mecanismos utilizados <strong>en</strong> los tres tipos de maduración del RNA. (A) Tres tipos deespliceosomas . El espliceosoma principal (izquierda), el espliceosoma AT-AC (c<strong>en</strong>tro) y eltransespliceosoma (derecha) se repres<strong>en</strong>tan <strong>en</strong> dos estados difer<strong>en</strong>tes de <strong>en</strong>samblaje. <strong>La</strong> SnRNP U5 es elúnico compon<strong>en</strong>te común de los tres espliceosomas. Los intrones eliminados por el espliceosoma AT-ACti<strong>en</strong><strong>en</strong> una secu<strong>en</strong>cia cons<strong>en</strong>so de maduración difer<strong>en</strong>tes a las de los intrones eliminados por elespliceosoma principal. En los seres humanos, se estima que el 0.1% de los intrones es eliminado por elespliceosoma AT-AC. En la transmaduración, una parte del SnRNA SL se convierte <strong>en</strong> el primer exón delmRNA maduro, por lo que snRNP SL acaba si<strong>en</strong>do consumida durante la reacción. (B) Tanto la snRNPU6 principal como la snRNP U6 AT-AC reconoc<strong>en</strong> el sitio 5´ de maduración, pero lo hac<strong>en</strong> medianteapareami<strong>en</strong>tos de bases difer<strong>en</strong>tes. <strong>La</strong>s secu<strong>en</strong>cias repres<strong>en</strong>tadas correspond<strong>en</strong> al humano.
Los RNAs nucleares pequeños (SnRNAs) de los espliceosomas catalizan elempalme de los precursores del mRNA.Pequeñas particulas de ribonucleoproteínas nucleares (snRNPs)implicadas <strong>en</strong> el procesami<strong>en</strong>to de los precursores de mRNAsnRNP Tamaño de snRNAFunciónU1U2U5U4U6165185116145106(nucleótidos)Se une al c<strong>en</strong>tro de empalme 5’y después al c<strong>en</strong>tro de empalme 3’Se une al c<strong>en</strong>tro de ramificación y forma parte del c<strong>en</strong>tro catalíticoSe une al c<strong>en</strong>tro de empalme 5’Enmascara la actividad catalítica de U6Cataliza el empalmeU6 ↔Interacciones <strong>en</strong>tre pre-mRNA, snRNA U1 y snRNA U2 al comi<strong>en</strong>zo del proceso de empalme. <strong>La</strong> región 5’ del snRNAU1 inicialm<strong>en</strong>te aparea sus bases con nucleótidos <strong>en</strong> el extremo 5’ del intrón y el extremo 3’ del exón 5’ del premRNA;el snRNA U2 aparea con una secu<strong>en</strong>cia que incluye la A del punto de ramificación, aunque este residuo nosufre apareami<strong>en</strong>to (levadura). Los rectángulos purpuras (Sm) repres<strong>en</strong>tan secu<strong>en</strong>cias que fijan proteínas de snRNPreconocidas por anticuerpos anti-Sm y el verde el sitio de fijación de U6.El c<strong>en</strong>tro catalítico del espliceosoma está formadopor el U2-snRNA (rojo) y el U6-snRNA (verde),cuyas bases estan apareadas. U2 también se apareacon el c<strong>en</strong>tro de ramificación del precursor delmRNA. Además U6 también aparea con el extremo5´del intrón, mi<strong>en</strong>tras U5 aparea primero con elextremo 3´del exón 1 y a continuación con elextremo 5´del exón 2ATP
Ciclo de empalme del empalmosoma