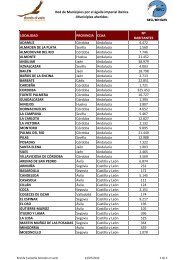
Efectos de las jaulas de engorde de dorada y lubina sobre las aves ...
Efectos de las jaulas de engorde de dorada y lubina sobre las aves ...
Efectos de las jaulas de engorde de dorada y lubina sobre las aves ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Efectos</strong> <strong>de</strong> <strong>las</strong> jau<strong>las</strong> <strong>de</strong> engor<strong>de</strong> <strong>de</strong> <strong>dorada</strong> y<strong>lubina</strong> <strong>sobre</strong> <strong>las</strong> <strong>aves</strong> marinas: presencia <strong>de</strong>especies migratorias, nidificantes einvernantes <strong>de</strong> la provincia <strong>de</strong> Alicante, suaprovechamiento alimentario y la influencia<strong>sobre</strong> sus poblacionesAutora: Eva Álamo CarrascoTutor <strong>de</strong>l proyecto: Germán López IborraI
ÍNDICESFigura 22. Variación mensual <strong>de</strong> <strong>las</strong> <strong>aves</strong> en los censos <strong>de</strong>s<strong>de</strong> tierra <strong>de</strong>ntro <strong>de</strong> la piscifactoría <strong>de</strong>Altea…………………………………………………………………………………………….37Figuras 23, 24 y 25. Variación mensual por géneros <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> piscifactorías <strong>de</strong> Altea,Guardamar y El Campello en los censos <strong>de</strong> tar<strong>de</strong>………………………………………………38Figuras 26, 27, 28 y 29. Variación horaria <strong>de</strong> la Garceta en <strong>las</strong> cuatro estaciones <strong>de</strong>l año.…….47Figuras 30, 31, 32 y 33. Variación horaria <strong>de</strong> la Gaviota patiamarilla en <strong>las</strong> cuatro estaciones <strong>de</strong>laño………………………………………………………………………………………………48Figuras 34 y 35. Variación horaria <strong>de</strong> la Gaviota reidora en otoño e invierno…………………48Figuras 40 y 41. Variación horaria <strong>de</strong>l Charrán común en primavera y verano………………..49Figura 42. Variación horaria <strong>de</strong>l Charrán común en la estación <strong>de</strong> otoño.……………………..50Figura 43. Porcentaje <strong>de</strong> <strong>las</strong> diferentes categorías <strong>de</strong> comportamiento en cada piscifactoría…..51Figura 44. Vuelvepiedras picoteando en <strong>las</strong> algas adheridas a <strong>las</strong> jau<strong>las</strong> en Guardamar……….53Figura 45. Porcentaje <strong>de</strong>l uso <strong>de</strong> los diferentes tipos <strong>de</strong> alimentación (FEAA: fauna epifita <strong>de</strong> <strong>las</strong>algas marinas adheridas en <strong>las</strong> jau<strong>las</strong>)…………………………………………………………..54Figura 46. Peces muertos <strong>de</strong>ntro <strong>de</strong> una jaula <strong>de</strong> Guardamar en el mes <strong>de</strong> abril……………….54Figura 47. Algas adheridas en los bor<strong>de</strong>s <strong>de</strong> <strong>las</strong> jau<strong>las</strong>…………………………………………55Figura 48. Gaviotas reidoras alimentándose <strong>de</strong>l pienso <strong>de</strong>s<strong>de</strong> el aire en Altea, mes <strong>de</strong>noviembre……………………………………………………………………………………….56Figura 49. Gaviotas reidoras capturando pienso <strong>de</strong>s<strong>de</strong> el aire y <strong>de</strong>s<strong>de</strong> el agua en la piscifactoría<strong>de</strong> Guardamar en el mes <strong>de</strong> noviembre…………………………………………………………56Figura 50. Estado <strong>de</strong> <strong>las</strong> <strong>aves</strong> atrapadas. (AT: atrapadas; AT-M atrapadas muertas; AT-R:atrapadas rescatadas vivas; AT-R-M: atrapadas, rescatadas y posterior muerte………………..59Figura 51. Garceta atrapada <strong>de</strong>ntro <strong>de</strong> una jau<strong>las</strong> <strong>de</strong> Guardamar en mayo……………………..59Figura 52. Gaviota reidora <strong>de</strong> primer invierno atrapada en una red antipájaros en la piscifactoría<strong>de</strong> Altea en diciembre…………………………………………………………………………...60Figura 53. Charrán patinegro atrapado <strong>de</strong>ntro <strong>de</strong> una jaula <strong>de</strong> El Campello en Octubre……….60V
ÍNDICESFigura 54. Juveniles <strong>de</strong> Gaviota patiamarilla atrapadas en una jaula <strong>de</strong> Guardamar en febrero..61Figura 55. Gaviota reidora rescatada <strong>de</strong> una jaula <strong>de</strong> Altea en noviembre……………………..61Figuras 56 y 57. Cormoranes atrapados en la red en la piscifactoría <strong>de</strong> Guardamar en febrero ydiciembre………………………………………………………………………………………..61VI
1. INTRODUCCIÓN1. INTRODUCCIÓN1.1. La acuicultura marina en EspañaSeguido <strong>de</strong> Egipto, España es el segundo país <strong>de</strong>l Mediterráneo en términos <strong>de</strong> niveles<strong>de</strong> producción acuícola. Durante el periodo <strong>de</strong> 1995 y 2004 incrementó casi 10 veces suvolumen <strong>de</strong> producción. Las especies más utilizadas para la acuicultura son la <strong>dorada</strong> yla <strong>lubina</strong> cultivadas tradicionalmente en lagunas, pero actualmente <strong>de</strong> forma intensiva(Cardia, F. and Lovatelli, 2007) aunque en Italia y Grecia aun siguen utilizando lossistemas extensivos para éstas y otras especies (Beveridge, 2000). La cantidad <strong>de</strong> <strong>dorada</strong>y <strong>lubina</strong> producidas en granjas el mismo año representó el 70% <strong>de</strong> la producciónnacional (Cardia, F. and Lovatelli, 2007). En el 2004 la producción global en Españafue <strong>de</strong> 363.181 Tn, <strong>de</strong> <strong>las</strong> cuales el 93% era <strong>de</strong> proce<strong>de</strong>ncia marina (Tabla 1).Fuente: FAO 2007Tabla 1. Producción <strong>de</strong> jau<strong>las</strong> en España <strong>de</strong>s<strong>de</strong> 1995 al 2004 por especies y producción totalActualmente en la Comunidad Valenciana existen 13 granjas marinas <strong>de</strong> <strong>dorada</strong> y<strong>lubina</strong> <strong>de</strong> <strong>las</strong> cuales 10 se encuentran en la provincia <strong>de</strong> Alicante distribuidas a lo largo<strong>de</strong> <strong>las</strong> costas <strong>de</strong> los municipios <strong>de</strong> Altea, Calpe, Villajoyosa, El Campello y Guardamar(www.mapa.es).1.2. Interacción <strong>de</strong> <strong>las</strong> <strong>aves</strong> y <strong>las</strong> piscifactoríasExiste un rango bastante amplio <strong>de</strong> especies <strong>de</strong>predadoras, pero <strong>las</strong> <strong>aves</strong> son el principalproblema para <strong>las</strong> granjas <strong>de</strong>l Mediterráneo. Éstas se alimentan <strong>de</strong> los peces o los1
1. INTRODUCCIÓNlesionan, dañan el equipo creando pérdidas a los peces, los estresan disminuyéndoles elapetito por lo que crecen menos y los hacen más vulnerables a <strong>las</strong> enfermeda<strong>de</strong>screando una producción y rentabilidad baja (Beveridge, 2000). Es bien conocido que <strong>las</strong><strong>aves</strong> pue<strong>de</strong>n transmitir enfermeda<strong>de</strong>s a los peces. En Europa <strong>las</strong> <strong>aves</strong> fueronresponsables <strong>de</strong> transmitir tres virus diferentes a los peces: Viremia primaveral <strong>de</strong> lacarpa (SVC), Septicemia viral hemorrágica (VHS), y Necrosis pancreática infecciosa(IPN) (EIFAC 1988), (Price, I.M. and Nickum, J.G., 1995). Sin embargo también se<strong>de</strong>be tener en cuenta que la estructura física y <strong>las</strong> luces <strong>de</strong> <strong>las</strong> instalaciones provocancambios en el comportamiento <strong>de</strong> <strong>las</strong> <strong>aves</strong>, los peces pue<strong>de</strong>n transferirles susenfermeda<strong>de</strong>s (Inka Milewski, 2001) y muchas <strong>aves</strong> mueren por ahogamiento comoconsecuencia <strong>de</strong> quedar enganchadas en <strong>las</strong> re<strong>de</strong>s (Inka Milewski, 2001, Diaz Lopez, B,2008)Así algunas especies nativas, podrían estar compitiendo y siendo <strong>de</strong>splazadas por otrasque no lo son (Beveridge, 2000). En Escocia una población <strong>de</strong> Charranes fue <strong>de</strong>splazadapor una población <strong>de</strong> gaviotas que se estaban aprovechando <strong>de</strong> la presencia <strong>de</strong> estasinstalaciones don<strong>de</strong> se alimentaban (Furness, 1996).En Norte América, <strong>las</strong> garzas modificaron su comportamiento aprendiendo a bucearcomo los pelícanos en <strong>las</strong> piscifactorías <strong>de</strong> bagres (Davis, 1993). Y en Brasil, especiesque antes <strong>de</strong>scansaban en <strong>las</strong> playas o áreas costeras ahora lo hacen en <strong>las</strong> instalacionesacuíco<strong>las</strong> <strong>de</strong> mejillones por estar más alejadas <strong>de</strong> los predadores y <strong>de</strong> los disturbioshumanos (Olinto Branco, J., 1999).A lo largo <strong>de</strong>l tiempo se han ido proponiendo y experimentando diferentes métodos paraahuyentar a <strong>las</strong> <strong>aves</strong>, como la presencia <strong>de</strong> perros y cuervos, <strong>de</strong>stellos <strong>de</strong> luz, emisión <strong>de</strong>sonidos simulando un motor, disparos, etc.… Pero lo único que se conseguía era<strong>de</strong>splazar<strong>las</strong> a otras instalaciones cercanas que no tuvieran estos métodos o bien <strong>las</strong> <strong>aves</strong>se acostumbraban a estos sonidos o luces. Respecto a los disparos varios estudios hanconfirmado que es inefectivo (Beveridge, 1988). En Israel, se intentó acabar con lapresencia <strong>de</strong>l cormorán usando sirenas y disparando (Sly & Frankenberg, 1995), sinembargo aunque hubo una disminución en su número, afectó a la especie protegidaCormorán pigmeo. El cañón <strong>de</strong> acetileno y disparos al aire fueron utilizados en un2
1. INTRODUCCIÓNestudio realizado en una piscifactoría <strong>de</strong> Navarra sin éxito (Lekuona, J.M., 1998). Lasre<strong>de</strong>s antipredadores son <strong>las</strong> que mejor funcionan si se colocan correctamente y serealiza un buen mantenimiento (Beveridge, 2000).La gran concentración <strong>de</strong> peces que se produce alre<strong>de</strong>dor <strong>de</strong> <strong>las</strong> jau<strong>las</strong> (Dempster et al.2004, Dempster et al., 2002, Beveridge M.C.M. 2000, Carss, D.N., 1990) hace quealgunos oportunistas y predadores sean atraídos por su presencia, como es el caso <strong>de</strong> <strong>las</strong><strong>aves</strong> marinas (Beveridge M.C.M., 2000). Estos predadores también se ven atraídos porla gran <strong>de</strong>nsidad <strong>de</strong> peces <strong>de</strong> <strong>las</strong> jau<strong>las</strong>, que al ser presas fácilmente disponibles parael<strong>las</strong>, hacen que estas obtengan el alimento que necesitan con menor gasto <strong>de</strong> energía alemplear menos tiempo en la búsqueda <strong>de</strong> alimento (Diaz Lopez, B., 2006b, Diaz Lopez,B et al., 2008).El <strong>de</strong>sarrollo <strong>de</strong> la acuicultura marina en el Mediterráneo indudablemente ha creadonuevos hábitats y nuevas oportunida<strong>de</strong>s para algunos predadores y <strong>aves</strong> oportunistascomo <strong>las</strong> gaviotas, garzas y cormoranes (Beveridge, 2000).1.3. Las <strong>aves</strong> marinas <strong>de</strong> Alicante y sus poblacionesLas <strong>aves</strong> marinas, componentes integrados en el ecosistema marino, son excelentesindicadores <strong>de</strong> los cambios en el medio marino (Furness, R. W. and Monaghan, P. 1987;Furness and Camphuysen, 1997).Cualquier cambio en sus poblaciones, en su salud, o en su éxito reproductor, nos podríaindicar una posible contaminación en el medio o un problema <strong>de</strong> disponibilidad <strong>de</strong>alimento (Furness and Kess, 1997). También pue<strong>de</strong>n indicar fluctuaciones en el stock<strong>de</strong> algunas especies <strong>de</strong> peces (Monaghanj, P. et al., 1989) y <strong>de</strong> <strong>las</strong> condicionesoceanográficas (Montevecchi, 1993; Fre<strong>de</strong>riksen et al., 2004), (ver tabla 2).3
1. INTRODUCCIÓNFuente: Diamond, A.W. and Devlin, C.M., 2003Tabla 2. Respuesta <strong>de</strong> <strong>las</strong> <strong>aves</strong> marinas a los cambios ambientalesLas diferentes <strong>aves</strong> marinas, se alimentan en un rango muy amplio <strong>de</strong> niveles tróficos yen diferentes zonas, <strong>de</strong>s<strong>de</strong> el litoral hasta la zona pelágica. Así por ejemplo, el petrel <strong>de</strong>Bulwer se alimenta en la zona mesopelágica, mientras que la Par<strong>de</strong>la cenicienta lo haceen la epipelágica y la Gaviota patiamarilla en la costa tanto cerca como lejos <strong>de</strong> la orilla.A<strong>de</strong>más aunque estas <strong>aves</strong> se alimenten <strong>de</strong> especies y en zonas muy diferentes pue<strong>de</strong>ncompartir la misma colonia. (Furness and Kess, 1997).Las <strong>aves</strong> marinas tanto nidificantes como invernantes <strong>de</strong> la provincia <strong>de</strong> Alicante <strong>las</strong>po<strong>de</strong>mos ver en la tabla 3. En total hay 14 especies <strong>de</strong> <strong>aves</strong> marinas que pasan elinvierno en estas costas, pertenecientes a 7 familias diferentes, mientras que <strong>las</strong> especiesque nidifican en esta provincia son 12 proce<strong>de</strong>ntes <strong>de</strong> tan solo 5 familias diferentes. Laspoblaciones <strong>de</strong> Gaviota reidora y Gaviota patiamarilla son <strong>las</strong> más abundantes duranteel invierno con 3921 y 1242 individuos respectivamente. Las especies nidificantes másabundantes son la Gaviota reidora, la Gaviota <strong>de</strong> Audouin, el Charrán común y Fumarelcariblanco con 768, 500, 499 y 788 parejas respectivamente. También hay poblacionesimportante <strong>de</strong> Charrancito y Gaviota picofina con 278 y 214 parejas respectivamente.4
1. INTRODUCCIÓNESPECIES EST. FEN COLONIASCormorán gran<strong>de</strong>I Salinas <strong>de</strong> Calpe, Salinas <strong>de</strong> Sta Pola, PN(Phalacrocorax carbo)Hondo, Salinas Mata-Torrevieja, Hondo <strong>de</strong>Cormorán moñudo(Phalacrocorax aristotelis)Amorós, Embalse la PedreraV N/I Serra Gelada, Islote <strong>de</strong> Benidorm/Garceta (Egretta garzetta) I / N Salinas <strong>de</strong> Calpe, Salinas <strong>de</strong> Sta Pola, PNHondo, Salinas Mata-Torrevieja / SalinasSanta Pola, Islote BenidormGarza Real (Ar<strong>de</strong>a cinerea) I / N Salinas <strong>de</strong> Calpe, Salinas <strong>de</strong> Sta Pola, PNHondo, Salinas Mata-Torrevieja, Hondo <strong>de</strong>Amorós, Embalse la Pedrera / SalinasSanta PolaGarceta gran<strong>de</strong> (Egretta alba) I Salinas Santa PolaGarza Imperial (Ar<strong>de</strong>apurpurea)Gaviota patiamarilla (Larusmichahelis)Gaviota reidora(Chroicocephalus ridibundus)Gaviota <strong>de</strong> Audouin (Larusaudouinii)IPN Hondo, Salinas Sta PolaI / N Salinas <strong>de</strong> Calpe, Clot <strong>de</strong> Galvany, SalinasSta Pola, PN Hondo, Salinas Mata-Torrevieja, Embalse Pedrera / Santa Pola,Mata-Torrevieja, Tabarca, Peñón <strong>de</strong> Ifach,Islote Descubridor, Isla Mitjana, IsloteBenidormI / N Salinas <strong>de</strong> Calpe, Salinas <strong>de</strong> Sta Pola, PNHondo, Salinas Mata-Torrevieja, Embalsela Pedrera / PN Hondo, Santa Pola, Mata-TorreviejaPE I / N Salinas <strong>de</strong> Calpe, Salinas Mata-Torrevieja /Salinas Mata-Torrevieja, Isla <strong>de</strong> BenidormGaviota sombria (LarusI Salinas Sta Pola, Salinas Mata-Torrevieja,fuscus)Embalse La PedreraGaviota picofina (Larus V I / N Salinas Sta Pola, Salinas Mata-Torrevieja /genei)Salinas Mata-TorreviejaGaviota cabecinegra (L.N PN Hondo, Salinas Mata-Torreviejamelanocephalus)Charran común (Sterna V N Salinas Sta Pola, Salinas Mata-Torreviejahirundo)Charran patinegro (SternaI / N Calpe, Mata-Torrevieja / Salinas Matasandvicensis)TorreviejaCharrancito (Sterna albifrons) V N Hondo <strong>de</strong> Amorós, Salinas Sta Pola,Salinas Mata-Torrevieja, Embalse PedreraPaiño europeo (Hydrobates V N Islote <strong>de</strong> Benidorm, Isla Mitjana, Tabarcapelagicus)Par<strong>de</strong>la Balear (PuffinusI Islote <strong>de</strong> Benidorm, Cabo Cerveramauretanicus)Alcatraz Atlantico (MorusIbassanus)Alca (Alca torda)I5
1. INTRODUCCIÓNFuente: Gómez, J.A., 2007 y 2008; Santamaría, J., & Gomis, E., 2006; Aleixos, L., et al., 2008Tabla 3. Listado <strong>de</strong> especies <strong>de</strong> <strong>aves</strong> marinas mas abundantes <strong>de</strong> la provincia <strong>de</strong> Alicante, suestatus, fenología y respectivas colonias y dormi<strong>de</strong>ros. (Est: Estatus: V (vulnerable), PE (Peligro <strong>de</strong>extincion). Fen:Fenologia)1.4. Importancia <strong>de</strong>l estudioDes<strong>de</strong> el <strong>de</strong>sarrollo <strong>de</strong> la acuicultura marina a comienzo <strong>de</strong> los 80, el número <strong>de</strong>instalaciones flotantes se ha incrementado rápidamente en aguas costeras <strong>de</strong>lMediterráneo. Y en los últimos diez años lo han hecho <strong>de</strong> forma dramática laproducción <strong>de</strong> <strong>dorada</strong> y <strong>lubina</strong>. Aproximadamente 169 instalaciones están presentes a lolargo <strong>de</strong> la costa española, <strong>de</strong> <strong>las</strong> cuales 10 se encuentran en aguas Alicantinas.La presencia <strong>de</strong> estas instalaciones en el mar indudablemente ha creado nuevos hábitatsy nuevas oportunida<strong>de</strong>s para los <strong>de</strong>predadores y oportunistas como algunas <strong>aves</strong>. Sinembargo, no existe ningún estudio en España <strong>de</strong>dicado a la influencia <strong>de</strong> estos nuevos“hábitats” en <strong>las</strong> poblaciones <strong>de</strong> <strong>aves</strong> marinas.1.5. Objetivo <strong>de</strong>l proyectoEl objetivo principal <strong>de</strong> este proyecto es estudiar <strong>las</strong> interacciones entre <strong>las</strong> <strong>aves</strong> marinasy la presencia <strong>de</strong> granjas marinas en la provincia <strong>de</strong> Alicante.Los objetivos específicos <strong>de</strong> este estudio son:Realizar un inventario <strong>de</strong> <strong>las</strong> especies <strong>de</strong> <strong>aves</strong> marinas presentes en <strong>las</strong> instalaciones.Estudiar su variación temporal y espacial a lo largo <strong>de</strong>l estudio.Definir su comportamiento y el grado <strong>de</strong> aprovechamiento <strong>de</strong> estas para alimentarse.Determinar <strong>las</strong> eda<strong>de</strong>s <strong>de</strong> <strong>las</strong> diferentes especies que visitaron <strong>las</strong> piscifactorías.Determinar <strong>las</strong> inci<strong>de</strong>ncias y mortalidad <strong>de</strong> <strong>las</strong> <strong>aves</strong> <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> instalaciones.6
2. AREA DE ESTUDIO2. AREA DE ESTUDIOEl área <strong>de</strong> estudio esta situada al sur <strong>de</strong> La Comunidad Valenciana, en la zona costera<strong>de</strong> la provincia <strong>de</strong> Alicante. Las observaciones se llevaron a cabo en tres piscifactorías(ver tabla 2) separadas aproximadamente 50 Km. y localizadas en los municipios <strong>de</strong>Altea, El Campello y Guardamar (Figura 1).Figura 1. Mapa <strong>de</strong> situación <strong>de</strong> los tres municipios costeros don<strong>de</strong> se encuentran <strong>las</strong> áreas <strong>de</strong>estudioLa piscifactoría <strong>de</strong> Altea está compuesta por 18 jau<strong>las</strong>, 8 <strong>de</strong> <strong>dorada</strong>, 6 <strong>de</strong> <strong>lubina</strong> y 4llamadas jau<strong>las</strong> comerciales (vacías, utilizadas solo para la pesca). La alimentación serealiza en dos turnos durante el verano, <strong>de</strong> mañana y <strong>de</strong> tar<strong>de</strong> y solo <strong>de</strong> mañana eninvierno. La pesca solo se realiza durante la noche mientras que en Guardamar y ElCampello se realiza durante el día. De <strong>las</strong> 18 jau<strong>las</strong> que hay en Campello, 4 son <strong>de</strong><strong>lubina</strong>, 8 <strong>de</strong> <strong>dorada</strong> y 6 más pequeñas, <strong>de</strong> <strong>las</strong> cuales 4 están vacías y en 2 hay <strong>dorada</strong>s <strong>de</strong>pequeño tamaño. A lo largo <strong>de</strong>l estudio la piscifactoría fue disminuyendo suproducción.7
2. AREA DE ESTUDIOLa instalación <strong>de</strong> Guardamar comenzó a funcionar en el año 2000 con 24 jau<strong>las</strong> y en elaño 2003 la aumentaron hasta 42. Es la más gran<strong>de</strong> <strong>las</strong> tres, con 42 jau<strong>las</strong>, <strong>de</strong> <strong>las</strong> cualesdos están vacías, 4 son <strong>de</strong> corvina (ver Tabla 4).Solo la piscifactoría <strong>de</strong> Guardamar y la <strong>de</strong> Altea tenían torres centrales en todas <strong>las</strong>jau<strong>las</strong> para evitar que la red “antipájaros” entrara en contacto con el agua, <strong>de</strong>bido a supropio peso, y así dificultar el robo por parte <strong>de</strong> <strong>las</strong> <strong>aves</strong>. La alimentación era intensivacompuesta exclusivamente por pienso.Altea El Campello GuardamarAño <strong>de</strong> inicio 2001 1997 2000-2003Nº Jau<strong>las</strong> 18 20 42EspeciesDorada y Lubina Dorada y Lubina Dorada, <strong>lubina</strong> y corvinaDist. A la costa (Km.) 1.7 3.72 4.22Alimentación Mañana y tar<strong>de</strong> Mañana Mañana y tar<strong>de</strong>Pesca Noche Día DíaTorre central Si No SiRe<strong>de</strong>s “antipájaros” Si Si SiTabla 4. Características <strong>de</strong> <strong>las</strong> piscifactorías8
2. AREA DE ESTUDIOFigura 2. Piscifactoría <strong>de</strong> Guardamar en el mes <strong>de</strong> Septiembre.9
3. MÉTODOS3. METODOS3.1. Jornadas <strong>de</strong> observaciónEl muestreo se llevó a cabo <strong>de</strong>s<strong>de</strong> el mes <strong>de</strong> Abril <strong>de</strong>l 2008 hasta el mes <strong>de</strong> Marzo <strong>de</strong>l2009. Durante este periodo se realizaron 74 jornadas <strong>de</strong> observación, distribuidasuniformemente en cada estación y piscifactorías según <strong>las</strong> limitaciones meteorológicas yoceanográficas. En cada jornada <strong>de</strong> observación se realizaron censos <strong>de</strong>s<strong>de</strong> barco y<strong>de</strong>s<strong>de</strong> tierra y la duración <strong>de</strong> cada observación varió entre 10 y 20 min. El métodoutilizado fue la observación directa con la ayuda <strong>de</strong> prismáticos 10x50 para el censo<strong>de</strong>s<strong>de</strong> barco, telescopio Swarovsky 20-60x para el censo <strong>de</strong>s<strong>de</strong> tierra y cámarascolocadas en la instalación <strong>de</strong> Altea para <strong>de</strong>terminar la presencia <strong>de</strong> <strong>aves</strong> durante <strong>las</strong>horas fuera <strong>de</strong>l muestreo. Las especies se i<strong>de</strong>ntificaron con la ayuda <strong>de</strong> <strong>las</strong> guías <strong>de</strong>campo <strong>de</strong> Mullarney, K., et al. (2003) y Blomdahl, A., et al. (2007) y <strong>las</strong> fotografíasrealizadas en <strong>las</strong> instalaciones.3.2. Censos <strong>de</strong>s<strong>de</strong> barcoLos censos se realizaron <strong>de</strong>s<strong>de</strong> <strong>las</strong> 9 hasta <strong>las</strong> 13.00 horas con intervalos <strong>de</strong> una hora ycuya duración variaba <strong>de</strong> 10 a 15 minutos. Las embarcaciones utilizadas para <strong>las</strong> salidasal mar fueron <strong>las</strong> empleadas por <strong>las</strong> respectivas empresas <strong>de</strong> cada piscifactoría marina.Generalmente eran barcos <strong>de</strong> 8-10 metros <strong>de</strong> eslora con grúa que realizaban trabajos <strong>de</strong>mantenimiento y estaban fijos en una <strong>de</strong> <strong>las</strong> jau<strong>las</strong> <strong>de</strong> la instalación y/o otro tipo <strong>de</strong>embarcaciones semirígidas o <strong>de</strong> fibra <strong>de</strong> 3-4 metros <strong>de</strong>stinadas a llevar material y buzosque estaban en continuo movimiento por la instalación. En varias jornadas <strong>de</strong>observación, algunos censos no pudieron ser realizados ya que había que ceñirse alhorario <strong>de</strong> trabajo <strong>de</strong> la piscifactoría y a sus a veces inesperados problemas y/o atrasosen la salida o llegada a <strong>las</strong> instalaciones y en algunos casos los censos <strong>de</strong> la mañanafueron realizados <strong>de</strong>s<strong>de</strong> tierra. Durante <strong>las</strong> observaciones se anotaron todas <strong>las</strong> variables<strong>de</strong> meteorología, número <strong>de</strong> individuos <strong>de</strong> cada especie <strong>de</strong>ntro y fuera <strong>de</strong> <strong>las</strong>instalaciones, la edad aproximada, su comportamiento y el lugar exacto (jaula, boya,agua, etc.), el tipo <strong>de</strong> alimentación y el éxito <strong>de</strong> pesca, la mortalidad, así como la10
3. MÉTODOSpresencia <strong>de</strong> barcos <strong>de</strong> la piscifactoría y <strong>de</strong> recreo, el personal y los trabajos realizadosen ese momento.Figura 3: Realización <strong>de</strong>l censo <strong>de</strong> mañana <strong>de</strong>s<strong>de</strong> barco en la piscifactoría <strong>de</strong> El Campello3.3. Censos <strong>de</strong>s<strong>de</strong> tierraEl censo <strong>de</strong>s<strong>de</strong> tierra se realizó <strong>de</strong>s<strong>de</strong> el punto más cercano a la piscifactoría, que en loscasos <strong>de</strong> Guardamar y Altea coincidieron con el Faro <strong>de</strong>l puerto mientras que en ElCampello se realizó <strong>de</strong>s<strong>de</strong> el museo <strong>de</strong> restos arqueológicos que hay en frente <strong>de</strong>lpuerto. El primer censo comenzaba a <strong>las</strong> 14:00 horas y con intervalos <strong>de</strong> una hora serealizaron censos hasta <strong>las</strong> 16:00 horas, y en los casos en que <strong>las</strong> condicionesmeteorológicas lo permitían y la visibilidad seguía siendo buena se realizaban hasta <strong>las</strong>18:00 horas. En algunos casos, el primer censo se realizó <strong>de</strong>s<strong>de</strong> barco <strong>de</strong>bido al retrasoen llegar a tierra. En la mayoría <strong>de</strong> censos los individuos se <strong>de</strong>terminaron a nivel <strong>de</strong>género ya que en el caso <strong>de</strong> El Campello y Guardamar los puntos <strong>de</strong> observaciónestaban a más <strong>de</strong> 2 Km. y a nivel <strong>de</strong>l mar lo que dificultaba la observación. En Altea, elpunto <strong>de</strong> observación estaba situado a 1.7 Km. y a unos 25 metros <strong>de</strong> altura lo quefacilitó la i<strong>de</strong>ntificación a nivel <strong>de</strong> especie.11
3. MÉTODOSFigura 4. Realización <strong>de</strong>l censo <strong>de</strong> tar<strong>de</strong> <strong>de</strong>s<strong>de</strong> el Faro L´Albir (piscifactoría <strong>de</strong> Altea)3.4. Descriptores, variables y análisis <strong>de</strong> datosInventario <strong>de</strong> <strong>las</strong> especies y su variación temporal y espacial.La información <strong>de</strong> <strong>las</strong> especies encontradas en <strong>las</strong> piscifactorías se obtuvo <strong>de</strong> <strong>las</strong> guías<strong>de</strong> campo nombradas anteriormente y <strong>de</strong> <strong>las</strong> páginas Web <strong>de</strong> la SEO (SociedadEspañola <strong>de</strong> Ornitología) www.seo.org y <strong>de</strong> www.naturalicante.es. La variaciónespacial fue la encontrada en <strong>las</strong> tres piscifactorías <strong>de</strong>scritas anteriormente y la temporalpor estación, por meses y por horas.Los censos utilizados para referirnos a la presencia <strong>de</strong> especies en Alicante fueron los<strong>de</strong>l año 2006 y 2008 para <strong>las</strong> invernantes y <strong>de</strong>l año 2007 para <strong>las</strong> nidificantes.El Índice <strong>de</strong> afinidad <strong>de</strong> Czechanovski, nos indicará que piscifactorías son másparecidas en cuanto a la presencia <strong>de</strong> diferentes especies <strong>de</strong> <strong>aves</strong> se refiere.IC = 2C/A+BA=nº especies sitio A12
3. MÉTODOSAnálisis <strong>de</strong> datosLos datos obtenidos <strong>de</strong> los censos fueron procesados con el programa <strong>de</strong> base <strong>de</strong> datosAccess 2003 y el programa <strong>de</strong> cálculo Excel 2003. El análisis estadístico fue realizadocon el programa SPSS 15.Para estudiar <strong>las</strong> diferencias entre <strong>las</strong> piscifactorías y la estación, meses y horas <strong>de</strong>censo, para <strong>las</strong> especies mas abundantes se realizó un análisis <strong>de</strong> comparación <strong>de</strong>medias, un ANOVA <strong>de</strong> dos vías. El numero <strong>de</strong> individuos <strong>de</strong> cada especie fue lavariable <strong>de</strong>pendiente cuantitativa y <strong>las</strong> variables in<strong>de</strong>pendientes cualitativas fueronPiscifactoría (Altea, Campello y Guardamar), estación (primavera, verano, otoño einvierno), meses (onces meses, <strong>de</strong>s<strong>de</strong> Abril <strong>de</strong>l 2008 hasta Febrero <strong>de</strong>l 2009 ambosinclusivos) y horas (<strong>de</strong> 9.00 a 16.00 horas).A pesar <strong>de</strong> que la variable <strong>de</strong>pendiente no sigue una distribución normal, al ser elANOVA una técnica robusta, don<strong>de</strong> sus resultados se alteran muy poco si se producentransgresiones <strong>de</strong> los supuestos en los que se basa (Martínez-González, M.A. et al.,2006) y a<strong>de</strong>más el tamaño <strong>de</strong> muestra <strong>de</strong>l estudio fue muy gran<strong>de</strong> (>200) se llevó a caboesta técnica.14
4. RESULTADOS4. RESULTADOS4.1. Presencia <strong>de</strong> <strong>aves</strong> en <strong>las</strong> piscifactorías marinasEl número <strong>de</strong> especies censadas en <strong>las</strong> tres piscifactorías a lo largo <strong>de</strong> todo el estudiofueron 20, pertenecientes a 10 familias diferentes. La familia que más especies registrófue Laridae y Sternidae con 6 y 5 especies diferentes respectivamente.100%90%80%70%60%50%40%30%20%10%0%Guardamar Altea CampelloArenaria interpres [R]Phalacrocorax carbo [E]Morus bassanus[O]Chlidonias niger [O]Sterna sandvicensis [E]Sterna hirundo [E]Larus genei [O]Larus audouinii [O]Larus ridibundus [E]Larus michahelis [R]Ar<strong>de</strong>a cinerea [O]Egretta garzetta [R]Figura 5. Lista <strong>de</strong> especies y su presencia en porcentaje a lo largo <strong>de</strong>l estudio <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> tresinstalaciones <strong>de</strong> acuicultura marina, (O = ocasional; R=regular; E=estacional).Las especies más abundantes en la piscifactoría <strong>de</strong> Guardamar fueron el Charráncomún junto con la Gaviota reidora con más <strong>de</strong> un 30% y un 20% respectivamente. Enla granja marina <strong>de</strong> El Campello la Gaviota patiamarilla representó casi un 40% <strong>de</strong>l totalen esa piscifactoria siendo la más abundante respecto a <strong>las</strong> <strong>de</strong>más especies y con más <strong>de</strong>un 20% el Cormorán gran<strong>de</strong>. Sin embargo en Altea, la Gaviota reidora fue sin duda lamás abundante con un 70% con respecto a <strong>las</strong> <strong>de</strong>más especies. La segunda especie masabundante fue la Gaviota patiamarilla con un 15% (ver Figura 5).15
4. RESULTADOSÍndice <strong>de</strong> afinidad <strong>de</strong> CzechanovskiEl número <strong>de</strong> especies encontradas en la granja marina <strong>de</strong> altea fueron 9 mientras queen Guardamar fueron 16 y El Campello 15.IC Altea-Guardamar =56%IC Altea-El Campello = 58%IC Guardamar-El Campello = 83,8%Este Índice nos indica que la afinidad en lo que a diversidad <strong>de</strong> especies se refiere, esmayor entre <strong>las</strong> piscifactorías <strong>de</strong> Guardamar y El Campello con un 83,8% <strong>de</strong> afinidad.Sin embargo la afinidad entre <strong>las</strong> piscifactorías <strong>de</strong> Altea y El Campello y Altea yGuardamar apenas pasan <strong>de</strong> un 50%.Si tuviéramos en cuenta solo <strong>las</strong> especies censadas <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong>maricultura el Índice daría muy parecido. Con dos especies menos en común pero lamisma cantidad <strong>de</strong> especies presentes, el Índice <strong>de</strong> afinidad fue <strong>de</strong> un 78,57% entre <strong>las</strong>piscifactorías <strong>de</strong> Guardamar y El Campello.4.2. Variación estacional <strong>de</strong> <strong>las</strong> <strong>aves</strong> en los censos realizados <strong>de</strong>s<strong>de</strong> barcoLa presencia <strong>de</strong> <strong>aves</strong> marinas en cada estación <strong>de</strong>l año fue muy diferente. Durante laprimavera y el verano la especie mas abundante en la piscifactoría <strong>de</strong> Altea fue laGaviota patiamarilla, tanto <strong>de</strong>ntro como fuera <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong> maricultura. Y en<strong>las</strong> estaciones <strong>de</strong> otoño e invierno lo fue la Gaviota reidora (ver tabla11).La Gaviota patiamarilla también fue la mas abundante en El Campello durante laprimavera, pero también lo fue en esta granja marina durante el otoño junto con laGaviota reidora y el Charrán común y en invierno junto al Cormorán gran<strong>de</strong>. Durante elverano el Charrán común y el patinegro fueron <strong>las</strong> especies más abundantes. Fuera <strong>de</strong>estas y durante todo el estudio el genero Larus spp, fue el mas abundante en estapiscifactoría (ver tabla 13).16
4. RESULTADOSDe nuevo la Gaviota patiamarilla, junto con el Charrán común y la Garceta, fue la masabundante durante la primavera en la piscifactoría <strong>de</strong> Guardamar pero no en el resto <strong>de</strong>estaciones como ocurre en El Campello. Durante toda la estación <strong>de</strong>l verano el Charráncomún fue la especie más abundante <strong>de</strong>ntro y fuera <strong>de</strong> <strong>las</strong> instalaciones (ver tabla 12). Yen otoño e invierno lo fue la Gaviota reidora junto con el Cormorán gran<strong>de</strong> en estaúltima ya que durante el otoño tan solo fue visto en los alre<strong>de</strong>dores <strong>de</strong> <strong>las</strong> instalaciones.Guardamar fue la instalación con mayor número <strong>de</strong> individuos censados.Se encontraron diferencias significativas entre <strong>las</strong> cuatro estaciones para la Garceta, laGaviota reidora y el Cormorán gran<strong>de</strong> (ANOVA p
4. RESULTADOSPara la Gaviota patiamarilla, el Charrán común y el patinegro <strong>las</strong> diferencias no fueronsignificativas por lo que <strong>las</strong> diferentes piscifactorías y <strong>las</strong> estaciones <strong>de</strong>l año no tienenefecto <strong>sobre</strong> la presencia <strong>de</strong> estas especies (ver tab<strong>las</strong> 6, 8 y 9).Pruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio G. patiamarillaFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIOND ELAÑOPISCIFACTORIA *ESTACIOND ELAÑOErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación2430,206 a 11 220,928 2,859 ,0052971,888 1 2971,888 38,456 ,00021,142 2 10,571 ,137 ,872188,056 3 62,685 ,811 ,4931917,189 6 319,531 4,135 ,0024482,256 58 77,28011309,385 706912,463 69a. R cuadrado = ,352 (R cuadrado corregida = ,229)Variable <strong>de</strong>pendiente: Promedio G. reidoraFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIONDELAÑOPISCIFACTORIA *ESTACIONDELAÑOErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación37116,365 a 11 3374,215 11,052 ,00012045,024 1 12045,024 39,452 ,0005966,168 2 2983,084 9,771 ,00015529,856 3 5176,619 16,955 ,0008025,147 6 1337,524 4,381 ,00117707,963 58 305,31074358,876 7054824,328 69a. R cuadrado = ,677 (R cuadrado corregida = ,616)Tab<strong>las</strong> 6 y 7. ANOVA para <strong>las</strong> especies Gaviota patiamarilla y la Gaviota reidora en <strong>las</strong> trespiscifactorías y durante <strong>las</strong> cuatro estaciones <strong>de</strong>l año.18
4. RESULTADOSPruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio Charrán comúnFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIONDELAÑOPISCIFACTORIA *ESTACIONDELAÑOErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación21821,178 a 11 1983,743 2,256 ,0232600,563 1 2600,563 2,958 ,0914065,274 2 2032,637 2,312 ,1085652,433 3 1884,144 2,143 ,10510199,891 6 1699,982 1,934 ,09150993,499 58 879,19877574,810 7072814,677 69a. R cuadrado = ,300 (R cuadrado corregida = ,167)Pruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio Charrán patinegroFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIONDELAÑOPISCIFACTORIA *ESTACIONDELAÑOErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación1252,025 a 11 113,820 3,052 ,003330,726 1 330,726 8,868 ,004139,802 2 69,901 1,874 ,163442,915 3 147,638 3,959 ,012443,457 6 73,910 1,982 ,0832163,126 58 37,2953978,945 703415,150 69a. R cuadrado = ,367 (R cuadrado corregida = ,246)Tab<strong>las</strong> 8 y 9. ANOVA para <strong>las</strong> especies <strong>de</strong> Charrán común y Charrán patinegro en <strong>las</strong> trespiscifactorías y durante <strong>las</strong> cuatro estaciones <strong>de</strong>l año.19
4. RESULTADOSPruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio Cormoran gran<strong>de</strong>FuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIONDELAÑOPISCIFACTORIA *ESTACIONDELAÑOErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación4301,348 a 5 860,270 3,789 ,0053203,470 1 3203,470 14,110 ,0001564,342 2 782,171 3,445 ,0382275,374 1 2275,374 10,022 ,0021208,813 2 604,406 2,662 ,07813622,125 60 227,03519830,254 6617923,472 65a. R cuadrado = ,240 (R cuadrado corregida = ,177)Tabla 10. ANOVA para el Cormorán gran<strong>de</strong> en <strong>las</strong> tres piscifactorías y durante <strong>las</strong> cuatroestaciones <strong>de</strong>l año.Figura 6. Gaviota <strong>de</strong> Audouin y Charranes comunes <strong>de</strong>scansando en el bor<strong>de</strong> <strong>de</strong> la jaula en lapiscifactoría <strong>de</strong> Guardamar en agosto.20
4. RESULTADOSFAMILIA / ESPPRIM d PRIM f VER d VER f OTO d OTO f INV d INV fm SD m SD m SD m SD m SD m SD m SD m SDAr<strong>de</strong>idae:E. garzetta 4,58 3,48 0,11 0,33 1,25 1,21 2,53 1,85 1,53 1,53A. cinerea 0,23 0,30Laridae:C. ridibundus 0,14 0,30 0,06 0,17 0,13 0,33 46,14 18,46 0,71 1,54 22,20 15,34L. audouinii 0,98 0,87 1,88 1,18 0,13 0,33 0,34 0,81L. genei 0,03 0,08 0,27 0,56L. michahelis 9,53 5,87 1,23 1,57 4,60 2,38 0,10 0,23 14,73 9,89 0,57 1,32 4,13 3,23Larus sin i<strong>de</strong>nt. 0,27 0,65 0,26 0,64 0,18 0,49 0,38 1,06 2,80 4,85Sternidae:S. hirundo 12,32 15,56 0,09 0,27 64,26 96,68 5,57 9,04S. sandvicensis 1,12 1,49 15,26 16,62 1,67 4,08 0,94 2,00 1,93 1,50Sterna sin i<strong>de</strong>nt 6,57 16,10 1,29 3,33Phalacrocoracidae:P. carbo 0,82 1,73 0,16 0,44 11,53 18,44Phalac. sin i<strong>de</strong>nt 0,18 0,49 0,08 0,21Sulidae:M. bassanus 0,06 0,11Scolopacidae:A. interpres 2,14 1,95 0,37 0,72 1,00 0,71 0,53 0,23Tabla 12. Promedio <strong>de</strong>l numero <strong>de</strong> <strong>aves</strong> (m) y su <strong>de</strong>sviación estándar (SD) a lo largo <strong>de</strong>l estudio <strong>de</strong>ntro (d) y fuera (f) <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong> la piscifactoría <strong>de</strong> Guardamaren los censos realizados <strong>de</strong>s<strong>de</strong> barco (primavera n=9; verano n=6; otoño n=8; invierno n=3)22
4. RESULTADOSFAMILIA / ESPPRIM d PRIM f VER d VER f OTO d OTO f INV d INV fm SD m SD m SD m SD m SD m SD m SD m SDAr<strong>de</strong>idae:E. garzetta 0,10 0,19 0,18 0,31 1,19 0,99 0,07 0,15Laridae:C. ridibundus 0,84 0,76 0,09 0,23 5,75 8,26 1,18 2,69 0,32 0,41L. audouinii 0,05 0,13 0,04 0,09 0,03 0,08 0,04 0,09L. genei 0,30 0,40 0,20 0,53L. michahelis 3,07 1,98 7,78 11,85 1,03 0,47 0,89 2,36 6,11 7,81 0,79 1,47 23,32 26,11 6,00 13,42Larus sin i<strong>de</strong>nt. 1,73 4,56 0,11 0,24Sternidae:S. hirundo 6,04 13,44 4,81 13,31S. sandvicensis 0,35 0,33 6,74 9,66 2,54 4,41Sterna sin i<strong>de</strong>nt 0,18 0,47 0,71 1,89 0,44 1,24Phalacrocoracidae:P. carbo 0,04 0,09 0,08 0,21 2,00 4,11Sulidae:M. bassanus 0,03 0,09 0,05 0,11Scolopacidae:A. interpres 0,03 0,09Tabla 13. Promedio <strong>de</strong>l numero <strong>de</strong> <strong>aves</strong> (m) y su <strong>de</strong>sviación estándar (SD) a lo largo <strong>de</strong>l estudio <strong>de</strong>ntro (d) y fuera (f) <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong> la piscifactoría <strong>de</strong> El Campelloen los censos realizados <strong>de</strong>s<strong>de</strong> barco (primavera n=7; verano n=7; otoño n=8; invierno n=5).23
4. RESULTADOS4.3. Variación mensual <strong>de</strong> <strong>las</strong> <strong>aves</strong> en los censos realizados <strong>de</strong>s<strong>de</strong> barcoLa Garceta y la Garza real fueron <strong>las</strong> dos únicas especies <strong>de</strong> la familia Ar<strong>de</strong>idae queestuvieron presentes en <strong>las</strong> granjas marinas. La Garza real apenas lo hizo en lapiscifactoría <strong>de</strong> Guardamar durante cuatro días entre los meses <strong>de</strong> Abril a Junio siempre<strong>de</strong>ntro <strong>de</strong> <strong>las</strong> instalaciones y en grupos <strong>de</strong> 1 a 4 individuos. Sin embargo la Garceta(figuras 7 y 8) estuvo presente en <strong>las</strong> tres granjas a lo largo <strong>de</strong> todo el estudio, cuyomáximo se dio en el mes <strong>de</strong> septiembre para Altea, en el mes <strong>de</strong> Mayo para Guardamary en diciembre en El Campello. El número máximo <strong>de</strong> individuos vistos en un mismocenso fueron 28 en Altea, mientras que en Guardamar y El Campello fue <strong>de</strong> 13 y 4individuos respectivamente. El patrón <strong>de</strong> variación <strong>de</strong> esta especie a lo largo <strong>de</strong>l estudiovarió mucho entre piscifactorías (figura 9) y estas diferencias fueron significativas aligual que la interacción piscifactoría-mes que fue positiva aumentando más el efecto<strong>sobre</strong> la Garceta (ver tabla 14).La Familia Laridae fue la que mas especies presentó en <strong>las</strong> instalaciones <strong>de</strong> maricultura,con 6 especies, siendo la Gaviota Reidora (Chroicocephalus ridibundus), la Audouin(Larus audouinii) y la Gaviota patiamarilla (Larus michahelis) <strong>las</strong> comunes en <strong>las</strong> tresáreas <strong>de</strong> estudio. El patrón <strong>de</strong> variación <strong>de</strong> la Gaviota reidora es muy parecido entre <strong>las</strong>piscifactorías. Durante la primavera y el verano apenas se <strong>de</strong>jan ver algunos individuosen <strong>las</strong> tres granjas, pero al inicio <strong>de</strong>l otoño comienza a aumentar su número hastaalcanzar un máximo en Noviembre en el caso <strong>de</strong> Guardamar y en Diciembre en Altea yEl Campello. Después <strong>de</strong> ese máximo disminuyó hasta <strong>de</strong>saparecer en El Campellomientras que en <strong>las</strong> otras dos aun se siguieron viendo durante todo el invierno (verFigura 10). Altea fue la instalación que más individuos presentó fuera <strong>de</strong> la instalaciónen el mes <strong>de</strong> Enero. Estas diferencias mensuales fueron significativas, ANOVA p
4. RESULTADOSpresente <strong>de</strong>s<strong>de</strong> el mes <strong>de</strong> abril don<strong>de</strong> se mantuvo más o menos constante, hasta finales<strong>de</strong> agosto llegando a su máximo en el mes <strong>de</strong> Septiembre para comenzar a disminuirdrásticamente en octubre hasta <strong>de</strong>jar <strong>de</strong> verse a partir <strong>de</strong>l mes <strong>de</strong> Noviembre (ver Figura6).El Patrón <strong>de</strong> variación <strong>de</strong> la Gaviota patiamarilla (Larus michahelis) difiere muchísimoentre piscifactorías. Esta especie que estuvo presente en <strong>las</strong> tres granjas marinas a lolargo <strong>de</strong> todo el estudio, obtuvo su máximo en el mes <strong>de</strong> Diciembre y Enero enGuardamar y El Campello respectivamente mientras que en Altea su máximo lo obtuvoen el mes <strong>de</strong> Septiembre. En el Campello se mantuvo constante <strong>de</strong>s<strong>de</strong> el mes <strong>de</strong> abrilhasta noviembre y fue en el mes <strong>de</strong> diciembre cuando comenzó a aumentar al igual queen Guardamar excepto por ese otro pico <strong>de</strong> la curva en el mes <strong>de</strong> Mayo (ver Figura 8) yporque a<strong>de</strong>más comenzó a aumentar tres meses antes. Sin embargo estas diferencias nofueron significativas, para ninguno <strong>de</strong> los dos factores, sin embargo la interacción si quefue significativa por lo que hay un efecto <strong>sobre</strong> esta especie cuando se dan los dosfactores al mismo tiempo (ver tabla 15). La media <strong>de</strong> los individuos <strong>de</strong> esta especiecensada en los alre<strong>de</strong>dores <strong>de</strong> la instalación fue mayor en la granja <strong>de</strong> El Campellodurante el mes <strong>de</strong> abril.La Gaviota picofina (Larus genei) fue vista tan solo 3 días en <strong>las</strong> piscifactorías <strong>de</strong> ElCampello y Guardamar, en los meses <strong>de</strong> Mayo y Septiembre, y <strong>de</strong> Julio a Septiembrerespectivamente entre uno a cuatro individuos. Tan solo fue visto fuera <strong>de</strong> <strong>las</strong>instalaciones en una ocasión, en El Campello en el mes <strong>de</strong> julio.La Gaviota cabecinegra (Larus melanocephalus) tan solo se vio en Guardamar durantedos días en el mes <strong>de</strong> Noviembre y siempre en solitario y <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> instalaciones, y<strong>de</strong> la Gaviota sombría (Larus fuscus) apenas hubo una cita en el mes <strong>de</strong> Diciembre en lapiscifactoría <strong>de</strong> El Campello.De la familia Sternidae, apenas dos especies fueron <strong>las</strong> más abundantes, el Charráncomún y el patinegro. El Charrán patinegro estuvo presente a lo largo <strong>de</strong> todo el estudioen la piscifactoría <strong>de</strong> Guardamar mientras que en El Campello se <strong>de</strong>jo <strong>de</strong> ver a partir <strong>de</strong>lmes <strong>de</strong> noviembre y en Altea tan solo se vio en los meses <strong>de</strong> noviembre y diciembre.Guardamar y El Campello presentan un patrón <strong>de</strong> variación más parecido con un25
4. RESULTADOSmáximo en el mes <strong>de</strong> Septiembre, mientras que en Altea con su máximo en Diciembresu media siempre se mantuvo por <strong>de</strong>bajo <strong>de</strong> los 5 individuos (ver Figura9). Esta especiesiempre se encontraba en gran<strong>de</strong>s grupos <strong>de</strong> hasta 98 individuos en Guardamar y <strong>de</strong>hasta 16 en El Campello. Fuera <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong> Guardamar apenas se vierondurante un día en todo el estudio un grupo <strong>de</strong> 50 individuos. Las diferencias entrepiscifactorías y entre los diferentes meses para esta especie fueron significativas, aligual que la interacción <strong>de</strong> los dos factores (ver tabla 18).Figuras 7 y 8. Garceta <strong>de</strong>scansando en el bor<strong>de</strong> <strong>de</strong> una jaula <strong>de</strong> la piscifactoría <strong>de</strong> El Campello yun grupo <strong>de</strong> Garcetas <strong>de</strong>scansando en la red “antipájaros” <strong>de</strong> la piscifactoría <strong>de</strong> Altea.26
4. RESULTADOS12108642GarcetaGuardamar El Campello Altea0Abr May Jun Jul Ago Sep Oct Nov Dic Ene Feb100Gaviota reidora806040200Abr May Jun Jul Ago Sep Oct Nov Dic Ene Feb3,0Gaviota <strong>de</strong> Audouin2,52,01,51,00,50,0Abr May Jun Jul Ago Sep Oct Nov Dic Ene FebFiguras 9, 10 y 11. Patrón <strong>de</strong> variaciones <strong>de</strong> la Garceta, la Gaviota reidora y Gaviota <strong>de</strong>Audouin, censadas <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> piscifactorías a lo largo <strong>de</strong>l estudio en los censos realizados<strong>de</strong>s<strong>de</strong> barco.27
4. RESULTADOSGaviota patiamarillaGuardamar Campello Altea4035302520151050Abr May Jun Jul Ago Sep Oct Nov Dic Ene Feb454035302520151050Charrán patinegroAbr May Jun Jul Ago Sep Oct Nov Dic Ene Feb250Charrán común200150100500Abr May Jun Jul Ago Sep Oct Nov Dic Ene FebFiguras 12, 13 y 14. Patrón <strong>de</strong> variaciones <strong>de</strong> la Gaviota patiamarilla, el Charrán patinegro y elCharrán común a lo largo <strong>de</strong>l estudio, censadas <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong> Guardamar y ElCampello en los censos realizados <strong>de</strong>s<strong>de</strong> barco.28
4. RESULTADOS181614121086420Cormorán gran<strong>de</strong>Guardamar Campello AlteaAbr May Jun Jul Ago Sep Oct Nov Dic Ene FebFigura 15. Patrón <strong>de</strong> variación <strong>de</strong>l Cormorán gran<strong>de</strong> <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> tres instalaciones a lo largo<strong>de</strong>l estudio en los censos realizados <strong>de</strong>s<strong>de</strong> barcoEl Charrán común (Sterna hirundo), fue visto solo en Guardamar y El Campello. Supatrón <strong>de</strong> variación a lo largo <strong>de</strong>l estudio difiere mucho entre el<strong>las</strong>. Sin embargo <strong>las</strong>diferencias no fueron significativas (ver tabla 17). En El Campello apenas fue vistodurante los meses <strong>de</strong> Septiembre y Octubre mientras que en Guardamar lo hizo <strong>de</strong>s<strong>de</strong> elinicio <strong>de</strong>l estudio hasta el mes <strong>de</strong> Octubre don<strong>de</strong> no se le volvió a ver, teniendo sumáximo en el mes <strong>de</strong> Agosto con 219 individuos (ver Figura10). Esta especie al igualque la anterior siempre fueron vistas en gran<strong>de</strong>s grupos <strong>de</strong> hasta 506 individuos enGuardamar y <strong>de</strong> 59 en El Campello en un mismo censo.Del Charrancito (Sterna albifrons) apenas fue visto un ejemplar en Guardamar en elmes <strong>de</strong> mayo. Respecto al Fumarel común (Chlidonias niger), fue visto <strong>de</strong>ntro <strong>de</strong> <strong>las</strong>instalaciones <strong>de</strong> El Campello y Guardamar durante 2 y 1 días respectivamente en losmeses <strong>de</strong> verano en grupos <strong>de</strong> 2 a 4 individuos. Apenas hay una cita <strong>de</strong>l fumarelcariblanco (Chlidonias hybridus) <strong>de</strong> El Campello en el mes <strong>de</strong> agosto.El Cormorán gran<strong>de</strong> (Phalacrocorax carbo) <strong>de</strong> la familia <strong>de</strong> Phalacrocoracidae, estuvopresente en la tres instalaciones. A finales <strong>de</strong>l verano, en el mes <strong>de</strong> Septiembre se dieron<strong>las</strong> primeras citas <strong>de</strong>ntro <strong>de</strong> la piscifactoría <strong>de</strong> Altea, mientras que en <strong>las</strong> otras dos no sevieron hasta finales <strong>de</strong> Octubre. El Invierno sin duda fue la estación en la que alcanzó sumáximo, concretamente en el mes <strong>de</strong> Febrero para el caso <strong>de</strong> Guardamar con 16,40individuos en ese mes (ver Figura11). Para El Campello sin embargo su máximo apenas29
4. RESULTADOSalcanzaron los seis individuos. Esta especie también se caracterizaba por <strong>de</strong>splazarse engran<strong>de</strong>s grupos. Así en El Campello hubo un grupo <strong>de</strong> 130 individuos en enero y enfebrero otro <strong>de</strong> 75, y en Guardamar <strong>de</strong> 150 y otro <strong>de</strong> 75 individuos. Estas diferencias nofueron significativas (ver tabla 19).El Paíño europeo (Hydrobates pelagicus) <strong>de</strong> la familia Hydrobatidae apenas fue visto 4días distribuidos en los meses <strong>de</strong> Abril, Junio y Agosto en <strong>las</strong> piscifactorías <strong>de</strong>Guardamar y El Campello y nunca en el interior <strong>de</strong> <strong>las</strong> instalaciones.El Alcatraz Atlántico (Morus bassanus) ave marina <strong>de</strong> gran dimensión <strong>de</strong> la familiaSulidae hizo su presencia en <strong>las</strong> tres instalaciones durante tres o cuatro días en cada unay siempre en solitario. En Altea hubo cuatro citas en los meses <strong>de</strong> Octubre y Noviembre<strong>de</strong>ntro y fuera <strong>de</strong> <strong>las</strong> instalaciones. En El Campello hubo tan solo una cita en el mes <strong>de</strong>Noviembre, y tres en el mes <strong>de</strong> Enero fuera <strong>de</strong> la instalación, y en Febrero <strong>de</strong>ntro <strong>de</strong>ella. En Guardamar sin embargo se vio un día en primavera y tres días en otoño entrelos meses <strong>de</strong> Noviembre y Diciembre. Fura <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong> Altea y Guardamarse vieron en dos ocasiones.La especie limícola Vuelvepiedras (Arenaria interpres) <strong>de</strong> la familia Scolopacidae,visitó la piscifactoría <strong>de</strong> Guardamar a lo largo <strong>de</strong>l todo el estudio aunque en un numeromuy pequeño, apenas <strong>de</strong> 1 a 3 individuos en cada censo con excepciones puntuales enlos que se vieron hasta 10 individuos a la misma hora.La Lavan<strong>de</strong>ra boyera (Motacilla flava) un paseriforme insectívoro <strong>de</strong> la familia <strong>de</strong>Motacillidae, hizo su aparición en la piscifactoría <strong>de</strong> El Campello y Guardamar<strong>de</strong>scansando en el bor<strong>de</strong> <strong>de</strong> una <strong>de</strong> <strong>las</strong> jau<strong>las</strong> y/o revoloteando entre <strong>las</strong> jau<strong>las</strong>. Apenashay una cita <strong>de</strong> esta especie en Septiembre y otra en Noviembre en El Campello y dosen Guardamar en el mes <strong>de</strong> Noviembre. Posible parada en su migración otoñal haciaÁfrica.30
4. RESULTADOSFigura 16. Lavan<strong>de</strong>ra <strong>de</strong>scansando en una jaula <strong>de</strong> El Campello en Septiembre.Variable <strong>de</strong>pendiente: Promedio GarcetaFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación508,946 a 29 17,550 4,026 ,000156,850 1 156,850 35,978 ,00059,666 2 29,833 6,843 ,003154,068 10 15,407 3,534 ,002272,410 17 16,024 3,676 ,000174,383 40 4,360908,999 70683,329 69a. R cuadrado = ,745 (R cuadrado corregida = ,560)Variable <strong>de</strong>pendiente: Promedio G. patiamarillaFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación3795,228 a 29 130,870 1,679 ,0643378,076 1 3378,076 43,347 ,00050,411 2 25,205 ,323 ,726979,297 10 97,930 1,257 ,2872489,153 17 146,421 1,879 ,0513117,234 40 77,93111309,385 706912,463 69a. R cuadrado = ,549 (R cuadrado corregida = ,222)Tab<strong>las</strong> 14 y 15. ANOVA para la Garceta y la Gaviota patiamarilla en <strong>las</strong> tres piscifactorías y alo largo <strong>de</strong> los once meses <strong>de</strong> estudio en los censos <strong>de</strong>s<strong>de</strong> barco.31
4. RESULTADOSVariable <strong>de</strong>pendiente: Promedio G. reidoraFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación27393,659 a 14 1956,690 4,209 ,00237985,503 1 37985,503 81,711 ,00018462,586 2 9231,293 19,857 ,0005851,012 4 1462,753 3,147 ,0364366,441 8 545,805 1,174 ,3599762,437 21 464,87874330,078 3637156,096 35a. R cuadrado = ,737 (R cuadrado corregida = ,562)Variable <strong>de</strong>pendiente: Promedio C. comúnFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación49014,564 a 12 4084,547 3,785 ,00715616,320 1 15616,320 14,473 ,00219120,281 2 9560,141 8,860 ,00322934,696 4 5733,674 5,314 ,00625604,936 6 4267,489 3,955 ,01317264,278 16 1079,01776139,185 2966278,843 28a. R cuadrado = ,740 (R cuadrado corregida = ,544)Tab<strong>las</strong> 16 y 17. ANOVA para la Gaviota reidora y el Charrán común en <strong>las</strong> tres piscifactorías yen los meses <strong>de</strong> octubre a febrero y <strong>de</strong> mayo a septiembre respectivamente en los censos <strong>de</strong>s<strong>de</strong>barco.32
4. RESULTADOSVariable <strong>de</strong>pendiente: Promedio C. patinegroFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación2873,904 a 19 151,258 11,723 ,0001285,949 1 1285,949 99,661 ,000308,743 2 154,372 11,964 ,0001631,887 6 271,981 21,079 ,0001293,145 11 117,559 9,111 ,000322,580 25 12,9033927,363 453196,484 44a. R cuadrado = ,899 (R cuadrado corregida = ,822)Pruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio Cormoran gran<strong>de</strong>FuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación3358,345 a 8 419,793 ,872 ,5513286,355 1 3286,355 6,830 ,0141614,644 2 807,322 1,678 ,206785,125 2 392,562 ,816 ,453728,482 4 182,120 ,379 ,82212991,252 27 481,15719829,614 3616349,597 35a. R cuadrado = ,205 (R cuadrado corregida = -,030)Tab<strong>las</strong> 18 y 19. ANOVA para el Charrán patinegro y el Cormorán gran<strong>de</strong> en <strong>las</strong> trespiscifactorías y los meses <strong>de</strong> agosto a febrero y <strong>de</strong> diciembre a febrero respectivamente en loscensos <strong>de</strong>s<strong>de</strong> barco33
4. RESULTADOSFiguras 17, 18 y 19. Gaviotas reidoras <strong>de</strong>scansando en el agua entre jau<strong>las</strong> <strong>de</strong> la piscifactoría <strong>de</strong>Altea en enero, <strong>de</strong>scansando en el bor<strong>de</strong> <strong>de</strong> una jaula <strong>de</strong> la piscifactoría <strong>de</strong> Guardamar en el mes<strong>de</strong> Noviembre y Gaviotas patiamarilla en la torre <strong>de</strong> una jaula <strong>de</strong> Altea en diciembre.34
4. RESULTADOSFigura 20. Juvenil <strong>de</strong> Cormorán gran<strong>de</strong> en la piscifactoría <strong>de</strong> El Campello en diciembre.Figura 21. Gaviotas reidoras <strong>sobre</strong>volando una jaula y una Gaviota patiamarilla picoteando enuna boya.4.4. Variación mensual y estacional <strong>de</strong> <strong>las</strong> <strong>aves</strong> en los censos realizados <strong>de</strong>s<strong>de</strong>tierraLas especies mas abundantes en los censos <strong>de</strong> tar<strong>de</strong> en Altea fueron <strong>las</strong> <strong>de</strong>l generoLarus, con su media máxima en otoño <strong>de</strong> 28,43 individuos, siendo el genero masabundante en <strong>las</strong> cuatro estaciones <strong>de</strong>l año. En Guardamar este genero fue también elmas abundante excepto en el invierno que fue el Cormorán con una media máxima <strong>de</strong>26,3 individuos. El genero Phalacrocorax también fue la mas abundante en el invierno<strong>de</strong> El Campello con 44,29 individuos <strong>de</strong> media. Sin embargo en verano fue el genero35
4. RESULTADOSSterna el mas abundante, siendo el genero Larus <strong>de</strong> nuevo en primavera y otoño. Seencontraron diferencias significativas para el genero Phalacrocorax en <strong>las</strong> trespiscifactorías y también en <strong>las</strong> cuatro estaciones <strong>de</strong>l año durante el censo <strong>de</strong> tar<strong>de</strong>,a<strong>de</strong>más <strong>de</strong> haber una interacción positiva entre los dos factores (ver tabla 20). Para elgenero Sterna <strong>las</strong> diferencias encontradas entre <strong>las</strong> piscifactorías y entre <strong>las</strong> estaciones<strong>de</strong>l año no fueron significativas. Se encontraron diferencias significativas entre <strong>las</strong>estaciones <strong>de</strong>l año para el genero Larus pero <strong>las</strong> diferencias entre piscifactorías para estaespecie en los censos <strong>de</strong> tar<strong>de</strong> no fueron significativas (ver tabla 22). Para la Garcetahubo una interacción significativa <strong>de</strong> los dos factores (estación y piscifactoría) mientrasque por separado los factores no tuvieron ningún efecto significativo <strong>sobre</strong> la presencia<strong>de</strong> esta especie (ver tabla 26).Presencia <strong>de</strong> <strong>aves</strong> a nivel <strong>de</strong> especie en la piscifactoría <strong>de</strong> AlteaComo se comentó anteriormente, en el caso <strong>de</strong> Altea el punto <strong>de</strong> observación <strong>de</strong>s<strong>de</strong>tierra estaba más cercano a la instalación pudiendo i<strong>de</strong>ntificar a nivel <strong>de</strong> especie en lamayoría <strong>de</strong> censos. Como vemos en la Figura 22 la Gaviota reidora fue también la másabundante con respecto a <strong>las</strong> <strong>de</strong>más especies en otoño e invierno como ocurrió en loscensos realizados <strong>de</strong>s<strong>de</strong> barco. Con la Garceta también ocurrió lo mismo que en loscensos <strong>de</strong> la mañana realizados <strong>de</strong>s<strong>de</strong> barco, fue más abundante en el mes <strong>de</strong> Octubre.La Gaviota patiamarilla estuvo presente a lo largo <strong>de</strong> todo el estudio durante loscensos <strong>de</strong> tar<strong>de</strong>, al igual que en <strong>las</strong> mañanas. Fue mas abundante en el mes <strong>de</strong> abril, sinembargo no sabemos lo que pasó durante la mañana en este mes puesto que los censos<strong>de</strong>s<strong>de</strong> barco en esta piscifactoría no se iniciaron hasta el mes <strong>de</strong> Junio. En la figurapo<strong>de</strong>mos ver un ligero aumento durante los meses <strong>de</strong> Octubre a Febrero, sin embargopor la mañana a partir <strong>de</strong> Diciembre su número empezó a disminuir. Respecto alCharrán patinegro su presencia disminuyo muchísimo en los censos <strong>de</strong> la tar<strong>de</strong>,quedando algunos individuos en el mes <strong>de</strong> mayo, junio, octubre y diciembre, cuyosgrupos no superaban los diez individuos. De la Gaviota <strong>de</strong> Audouin encontramos algúnejemplar en el mes <strong>de</strong> junio y apenas dos grupos <strong>de</strong> 4 y 3 individuos <strong>de</strong> Cormorángran<strong>de</strong> en el mes <strong>de</strong> enero.36
4. RESULTADOS4035302520151050L. ridibundus L. audouinii E. garzettaL. michahelis P. carbo S. sandvicensisAbr May Jun Jul Ago Sep Oct Nov Dic Ene FebFigura 22. Variación mensual <strong>de</strong> <strong>las</strong> <strong>aves</strong> en los censos <strong>de</strong>s<strong>de</strong> tierra <strong>de</strong>ntro <strong>de</strong> la piscifactoría <strong>de</strong>AlteaFuera <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong> Altea, se observaron 2 especies que tan solo han sidovistas en los alre<strong>de</strong>dores <strong>de</strong> esta piscifactoría durante el estudio. La Par<strong>de</strong>lamediterránea (Puffinus yelkouan) y la Par<strong>de</strong>la cenicienta (Calonectris diome<strong>de</strong>a) <strong>de</strong>la familia <strong>de</strong> Procellaridae, en grupos <strong>de</strong> 1-22 y <strong>de</strong> 1-3 individuos respectivamentefueron vistas durante dos días en el mes <strong>de</strong> mayo. A<strong>de</strong>más <strong>de</strong> estas especies tambiénhay una cita en el mes <strong>de</strong> Octubre <strong>de</strong>l Alcatraz atlántico (Morus bassanus).Presencia <strong>de</strong> <strong>aves</strong> a nivel <strong>de</strong> genero en <strong>las</strong> tres instalaciones <strong>de</strong> mariculturaEl genero Phalacrocorax fue mas abundante en <strong>las</strong> granjas <strong>de</strong> Guardamar y ElCampello. En esta ultima mientras en los censos <strong>de</strong> la mañana en los meses <strong>de</strong> enero yfebrero no se vieron apenas individuos en los censos <strong>de</strong> tar<strong>de</strong> se vieron grupos <strong>de</strong> hasta130 individuos. Lo mismo ocurrió en Guardamar que en los censos <strong>de</strong> la mañana <strong>de</strong>estos meses apenas se obtuvo una media <strong>de</strong> 16 individuos y en los <strong>de</strong> la tar<strong>de</strong> la mediasubió hasta más <strong>de</strong> 30 con grupos <strong>de</strong> hasta 70 individuos. En Altea apenas hubo algunascitas <strong>de</strong> 3 y 4 individuos. Sin embargo <strong>las</strong> diferencias encontradas no fueronsignificativas (tab<strong>las</strong> 23, 24 y 25).El patrón <strong>de</strong> variación <strong>de</strong>l genero Larus fue bastante parecido en <strong>las</strong> tres granjas, con uncrecimiento en su número a finales <strong>de</strong>l verano hasta llegar a su máximo en el mes <strong>de</strong>Noviembre en Altea y en diciembre en Guardamar y El Campello para volver a37
4. RESULTADOSdisminuir en enero. Las diferencias entre piscifactorías no fueron significativas sinembargo si que lo fueron <strong>las</strong> que hubo entre los meses (ver tabla 23).5040302010AlteaLarus spp Sterna spp Phalacrocorax spp Egretta spp060Abr May Jun Jul Ago Sep Oct Nov Dic Ene FebGuardamar5040302010060Abr May Jun Jul Ago Sep Oct Nov Dic Ene FebEl Campello50403020100Abr May Jun Jul Ago Sep Oct Nov Dic Ene FebFiguras 23, 24 y 25. Variación mensual por géneros <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> piscifactorías <strong>de</strong> Altea,Guardamar y El Campello en los censos <strong>de</strong> tar<strong>de</strong>.38
4. RESULTADOSRespecto al género Sterna, en Guardamar y El Campello fue mas abundante en el mes<strong>de</strong> septiembre, al igual que ocurrió para la especie <strong>de</strong> este género, el Charrán patinegro,en los censos <strong>de</strong> la mañana. En Agosto que fue el mes <strong>de</strong> máxima presencia <strong>de</strong>l Charráncomún en Guardamar durante la mañana, por la tar<strong>de</strong> no se vio ninguna especie <strong>de</strong>lmismo género. Se encontraron diferencias significativas entre los meses <strong>de</strong>l estudio sinembargo no entre <strong>las</strong> piscifactorías (ver tabla 25).El genero Egretta <strong>de</strong> la que solo hubo una especie, fue más abundante durante laprimavera en la granja <strong>de</strong> Guardamar como ocurrió también durante la mañana. EnAltea apenas se vio en el mes <strong>de</strong> octubre coincidiendo ese mes con la máxima presenciadurante la mañana. En El Campello apenas se vieron algunos individuos en los meses <strong>de</strong>mayo y noviembre. Las diferencias encontradas para esta especie no fueronsignificativas (ver tabla 27).39
4. RESULTADOSPruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio Phalacrocorax sppFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIONDELAÑOPISCIFACTORIA *ESTACIONDELAÑOErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación7011,116 a 5 1402,223 4,083 ,0085243,386 1 5243,386 15,269 ,0012748,737 2 1374,369 4,002 ,0322939,492 1 2939,492 8,560 ,0072342,359 2 1171,180 3,411 ,0508241,559 24 343,39818741,083 3015252,675 29a. R cuadrado = ,460 (R cuadrado corregida = ,347)Pruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio Phalacrocorax sppFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación7777,481 a 14 555,534 1,115 ,4173755,503 1 3755,503 7,536 ,0151832,578 2 916,289 1,839 ,1933400,765 4 850,191 1,706 ,2012713,672 8 339,209 ,681 ,7027475,194 15 498,34618741,083 3015252,675 29a. R cuadrado = ,510 (R cuadrado corregida = ,052)Tab<strong>las</strong> 20 y 21. ANOVA <strong>de</strong>l genero Phalacrocorax spp en <strong>las</strong> tres piscifactorías durante <strong>las</strong>estaciones <strong>de</strong> otoño e invierno y en los once meses <strong>de</strong>l estudio respectivamente en los censos <strong>de</strong>tar<strong>de</strong>.40
4. RESULTADOSVariable <strong>de</strong>pendiente: Promedio Larus sppFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIONDELAÑOPISCIFACTORIA *ESTACIONDELAÑOErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación5574,483 a 11 506,771 3,129 ,0038731,485 1 8731,485 53,904 ,00047,895 2 23,947 ,148 ,8633812,039 3 1270,680 7,845 ,0001484,408 6 247,401 1,527 ,1897937,075 49 161,98125361,394 6113511,558 60a. R cuadrado = ,413 (R cuadrado corregida = ,281)Variable <strong>de</strong>pendiente: Promedio Larus sppFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación9168,413 a 30 305,614 2,111 ,0229133,782 1 9133,782 63,091 ,00044,827 2 22,414 ,155 ,8575965,822 10 596,582 4,121 ,0012183,076 18 121,282 ,838 ,6474343,145 30 144,77225361,394 6113511,558 60a. R cuadrado = ,679 (R cuadrado corregida = ,357)Tab<strong>las</strong> 22 y 23. ANOVA <strong>de</strong>l género Larus en <strong>las</strong> cuatro estaciones y los once meses <strong>de</strong>l estudoen los censos realizados <strong>de</strong>s<strong>de</strong> tierra.41
4. RESULTADOSVariable <strong>de</strong>pendiente: Promedio Sterna sppFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIONDELAÑOPISCIFACTORIA *ESTACIONDELAÑOErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación1213,679 a 11 110,334 1,189 ,319607,846 1 607,846 6,553 ,014216,737 2 108,368 1,168 ,319459,029 3 153,010 1,649 ,190338,177 6 56,363 ,608 ,7234545,413 49 92,7646469,476 615759,093 60a. R cuadrado = ,211 (R cuadrado corregida = ,034)Variable <strong>de</strong>pendiente: Promedio Sterna sppFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaPruebas <strong>de</strong> los efectos inter-sujetosSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación3392,563 a 30 113,085 1,434 ,1651076,511 1 1076,511 13,647 ,001134,164 2 67,082 ,850 ,4371875,622 10 187,562 2,378 ,033868,333 18 48,241 ,612 ,8622366,530 30 78,8846469,476 615759,093 60a. R cuadrado = ,589 (R cuadrado corregida = ,178)Tab<strong>las</strong> 24 y 25. ANOVA para el género Sterna en <strong>las</strong> cuatro estaciones y durante los once meses<strong>de</strong>l estudio en los censos realizados <strong>de</strong>s<strong>de</strong> tierra.42
4. RESULTADOSPruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio Egretta garzettaFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAESTACIONDELAÑOPISCIFACTORIA *ESTACIONDELAÑOErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación555,401 a 11 50,491 2,960 ,00495,768 1 95,768 5,615 ,02239,291 2 19,645 1,152 ,32483,499 3 27,833 1,632 ,194313,428 6 52,238 3,063 ,013835,758 49 17,0561616,913 611391,159 60a. R cuadrado = ,399 (R cuadrado corregida = ,264)Pruebas <strong>de</strong> los efectos inter-sujetosVariable <strong>de</strong>pendiente: Promedio Egretta garzettaFuenteMo<strong>de</strong>lo corregidoIntersecciónPISCIFACTORIAMESPISCIFACTORIA * MESErrorTotalTotal corregidaSuma <strong>de</strong>cuadradosMediatipo III gl cuadrática F Significación917,526 a 30 30,584 1,937 ,03889,518 1 89,518 5,670 ,02449,187 2 24,593 1,558 ,227176,619 10 17,662 1,119 ,381525,460 18 29,192 1,849 ,066473,633 30 15,7881616,913 611391,159 60a. R cuadrado = ,660 (R cuadrado corregida = ,319)Tab<strong>las</strong> 26 y 27. ANOVA para la Garceta durante <strong>las</strong> cuatro estaciones y durante los once meses<strong>de</strong>l estudio en los censos realizados <strong>de</strong>s<strong>de</strong> tierra.4.5. Variación horaria <strong>de</strong> <strong>las</strong> especies más abundantesA lo largo <strong>de</strong>l día el número <strong>de</strong> individuos en la piscifactoría <strong>de</strong> Altea fue aumentandohasta el censo <strong>de</strong> <strong>las</strong> 12 horas a partir <strong>de</strong>l cual fue disminuyendo paulatinamente hastallegar al último censo (ver tabla 28). Sin embargo en Guardamar, fueron disminuyendo<strong>de</strong>s<strong>de</strong> el censo <strong>de</strong> <strong>las</strong> 9 <strong>de</strong> la mañana don<strong>de</strong> se concentraron mayor numero <strong>de</strong>individuos (ver tabla 30). En El Campello, al igual que en Altea fue aumentando, sin43
4. RESULTADOSembargo solo lo hizo hasta el censo <strong>de</strong> <strong>las</strong> 12 horas a partir <strong>de</strong>l cual disminuyo y volvióa aumentar en el <strong>de</strong> <strong>las</strong> 15horas llegando a su máximo (ver tabla 29).La variación <strong>de</strong> la presencia <strong>de</strong> <strong>las</strong> especies a lo largo <strong>de</strong>l día siguieron patronesdiferentes, según la piscifactoría y la especie. Incluso individuos <strong>de</strong> la misma especiesiguieron patrones en <strong>las</strong> diferentes instalaciones. Sin embargo estadísticamenteninguna <strong>de</strong> estas diferencias fueron significativas para ninguna especie.Excepto para la piscifactoría <strong>de</strong> El Campello que apenas presento variaciones en <strong>las</strong>diferentes estaciones <strong>de</strong>l año para la Garceta, en Guardamar y Altea el patrón <strong>de</strong>variación en cada estación fue muy diferente presentando varias oscilaciones a lo largo<strong>de</strong>l DIA. (Figura 26-29).Fam./Especies 9:00 10:00 11:00 12:00 13:00 14:00 15:00 16:00 17:00 18:00Ar<strong>de</strong>idae:E. garzetta 62 52 49 20 26 26 42 37 37 1Laridae:L. michahelis 127 92 66 125 71 119 64 41 17 17C. ridibundus 422 524 577 905 361 208 139 151 27 0L. audouinii 0 0 0 0 0 0 0 0 1 0Larus sin i<strong>de</strong>nt 0 0 1 0 8 6 19 33 6 0Sterninae:S. sandvicensis 7 16 10 23 4 14 4 8 2 2Sterna sin i<strong>de</strong>nt 0 0 0 3 0 1 11 4 1 0Phalacrocoracidae:P. carbo 0 1 0 2 0 3 8 0 0 0P. sin i<strong>de</strong>nt 2 0 0 0 0 0 0 0 0 0Sulidae:M. bassanus 1 0 0 0 0 0 0 1 0 0TOTAL 621 685 703 1078 470 377 287 275 91 20Tabla 28. Individuos <strong>de</strong> cada especie observados en cada uno <strong>de</strong> los censos diarios en la granjamarina <strong>de</strong> Altea44
4. RESULTADOSFam./Especies 9:00 10:00 11:00 12:00 13:00 14:00 15:00 16:00 17:00Ar<strong>de</strong>idae:E. garzetta 9 10 10 9 10 0 4 4 0Laridae:L. michahelis 165 161 145 186 41 101 41 8 0C. ridibundus 12 14 24 105 45 16 1 0 0L. audouinii 0 0 1 0 1 0 0 0 0L. genei 0 2 1 3 4 0 0 0 0L. fuscus 0 1 0 0 0 0 0 0 0Larus din i<strong>de</strong>nt 1 0 0 15 3 84 169 147 12Sterninae:S. sandvicensis 28 86 65 74 36 0 0 0 0S. hirundo 46 91 98 57 36 0 0 0 0C. niger 7 4 0 0 0 0 0 0 0C. hybridus 0 0 1 0 0 0 0 0 0Sterna sin i<strong>de</strong>nt 14 0 0 0 0 144 135 84 65Phalacrocoracidae:P. carbo 2 25 0 6 1 225 211 6 0P. sin i<strong>de</strong>nt 0 0 0 0 0 5 2 4 0Sulidae:M. bassanus 0 1 0 0 1 0 0 0 0Scolopacidae:A. interpres 0 0 0 1 0 0 0 0 0MotacillidaeM. flava 0 0 1 0 1 0 0 0 0TOTAL 284 395 346 456 179 575 563 253 77Tabla 29. Individuos <strong>de</strong> cada especie observados en cada uno <strong>de</strong> los censos diarios en la granjamarina <strong>de</strong> El Campello45
4. RESULTADOSFam./Especies 8:00 9:00 10:00 11:00 12:00 13:00 14:00 15:00 16:00 17:00 18:00Ar<strong>de</strong>idae:E. garzetta 13 109 50 47 62 35 43 38 44 34 37A. cinerea 2 1 0 0 1 4 2 0 0 1 1Laridae:L. michahelis 15 304 196 197 245 83 45 56 51 38 27C. ridibundus 0 743 345 265 361 192 7 13 32 22 0L. audouinii 0 15 21 23 27 21 0 0 0 0 0L. genei 0 1 2 4 1 1 0 0 0 1 0L. melanocephalus 0 1 1 0 1 0 0 0 0 0 0Larus din i<strong>de</strong>nt 0 42 0 4 72 0 124 128 76 15 75Sterninae:S. sandvicensis 2 135 171 100 74 90 12 5 10 0 0S. hirundo 25 978 576 571 336 260 0 0 0 0 0S. albifrons 0 1 0 0 0 0 0 0 0 0 0C. niger 0 2 3 0 2 2 0 0 0 0 0Sterna sin i<strong>de</strong>nt 0 25 17 4 15 0 12 119 237 30 33Phalacrocoracidae:P. carbo 0 27 1 0 170 2 113 112 24 0 0P. sin i<strong>de</strong>nt 0 0 1 0 5 6 0 25 4 2 0Sulidae:M. bassanus 0 0 0 0 0 0 0 2 1 2 0Scolopacidae:A. interpres 0 37 27 30 29 12 4 0 0 0 0MotacillidaeM. spp 0 0 0 0 0 2 0 0 0 0 0TOTAL 57 2421 1411 1245 1401 710 362 498 479 145 173Tabla 30. Individuos <strong>de</strong> cada especie observados en cada uno <strong>de</strong> los censos diarios en la granjamarina <strong>de</strong> GuardamarLa Gaviota patiamarilla, también presento muchas oscilaciones a lo largo <strong>de</strong>l día <strong>sobre</strong>todo en la primavera. En el resto <strong>de</strong> estaciones hay un cierto <strong>de</strong>scenso en su numero<strong>de</strong>s<strong>de</strong> el primer censo hasta el ultimo excepto para Guardamar en el otoño don<strong>de</strong> tuvootro máximo en el ultimo censo <strong>de</strong> la tar<strong>de</strong> (Figura 30-33). También la Gaviota reidoramuestra un <strong>de</strong>scenso a lo largo <strong>de</strong>l día en el otoño e invierno aunque muestra unmáximo a mediodía en el invierno (Figuras 34 y 35).46
4. RESULTADOS1412Altea El Campello GuardamarPrimavera1,61,41,2Verano10864208:009:0010:0011:0012:0013:0014:0015:0016:0017:0018:0010,80,60,40,209:0010:0011:0012:0013:0014:0015:0016:0017:001412Otoño43,5Invierno1086432,521,5120,5009:0010:0011:0012:0013:0014:0015:0016:0017:009:0010:0011:0012:0013:0014:0015:0016:00Figuras 26, 27, 28 y 29. Variación horaria <strong>de</strong> la Garceta en <strong>las</strong> cuatro estaciones <strong>de</strong>l año.47
4. RESULTADOS181614121086420Altea El Campello GuardamarPrimavera1614121086420Verano8:009:0010:0011:0012:0013:0014:0015:0016:0017:0018:009:0010:0011:0012:0013:0014:0015:0016:0017:003530Otoño7060Invierno2550204015301020510009:0010:0011:0012:0013:0014:0015:0016:0017:009:0010:0011:0012:0013:0014:0015:0016:00Figuras 30, 31, 32 y 33. Variación horaria <strong>de</strong> la Gaviota patiamarilla en <strong>las</strong> cuatro estaciones <strong>de</strong>laño.9080706050403020100Altea El Campello GuardamarOtoño9080706050403020100Invierno8:009:0010:0011:0012:0013:0014:0015:0016:009:0010:0011:0012:0013:0014:0015:0016:00Figuras 34 y 35. Variación horaria <strong>de</strong> la Gaviota reidora en otoño e invierno.48
4. RESULTADOSAltea El Campello Guardamar 4,5304Verano3,525Otoño3202,5152101,5150,5008:009:0010:0011:0012:0013:0014:0015:0016:008:009:0010:0011:0012:0013:0014:0015:00Figuras 36 y 37. Variación horaria <strong>de</strong>l Charrán patinegro en verano y otoño.16:002580Otoño 702060155040103020510008:009:0010:0011:0012:0013:0014:0015:0016:008:009:0010:0011:0012:0013:00Figuras 38 y 39. Variación horaria <strong>de</strong>l Cormorán gran<strong>de</strong> en otoño e invierno.Invierno14:0015:00302520Primavera160140120100Verano1580105604020008:009:0010:0011:0012:0013:0014:0015:0016:0017:0018:008:009:0010:0011:0012:0013:0014:0015:0016:00Figuras 40 y 41. Variación horaria <strong>de</strong>l Charrán común en primavera y verano.49
4. RESULTADOS98CampelloOtoño765432109:0010:0011:0012:0013:0014:0015:0016:0017:00Figura 42. Variación horaria <strong>de</strong>l Charrán común en la estación <strong>de</strong> otoño.El patrón que siguió el Charrán patinegro a lo largo <strong>de</strong>l día muestra gran<strong>de</strong>soscilaciones <strong>sobre</strong> todo en otoño y en <strong>las</strong> tres piscifactorías, sin embargo en el veranomuestra un <strong>de</strong>scenso <strong>de</strong>s<strong>de</strong> el primer censo (Figuras 36 y 37). El Charran común aligual que el patinegro en verano muestra un <strong>de</strong>scenso a lo largo <strong>de</strong> todo el día en <strong>las</strong> tresestaciones en <strong>las</strong> que estuvo presente (Figuras 40-42). Sin embargo hay que tener encuenta que durante los censos <strong>de</strong> la tar<strong>de</strong> se observaron bastantes individuos <strong>de</strong> sumismo género sin po<strong>de</strong>r llegar a i<strong>de</strong>ntificar la especie, lo que podría tratarse <strong>de</strong> alguna<strong>de</strong> estas dos especies.La gran mayoría <strong>de</strong> los Cormoranes gran<strong>de</strong>s fueron vistos en los censos <strong>de</strong> la tar<strong>de</strong>,concretamente en el <strong>de</strong> <strong>las</strong> 14 horas en <strong>las</strong> granjas <strong>de</strong> El Campello y Guardamar (verFiguras 38 y 39). Altea apenas la visitaron y cuando lo hicieron también fue <strong>de</strong> tar<strong>de</strong>.Solo se dio un caso <strong>de</strong> un grupo muy numeroso <strong>de</strong> 150 individuos presente en el censo<strong>de</strong> <strong>las</strong> 12 horas. Sin embargo ninguna <strong>de</strong> estas diferencias fue significativa.4.6. Comportamiento <strong>de</strong> <strong>las</strong> <strong>aves</strong> <strong>de</strong>ntro y fuera <strong>de</strong> <strong>las</strong> granjas marinasComo po<strong>de</strong>mos ver en la figura 43, el comportamiento que tuvieron <strong>las</strong> <strong>aves</strong> a lo largo<strong>de</strong>l estudio varía bastante entre <strong>las</strong> piscifactorías. El comportamiento que mas fuerealizado por <strong>las</strong> <strong>aves</strong>, fue el <strong>de</strong> <strong>de</strong>scansar en el agua (Da) en Guardamar y El Campello50
4. RESULTADOSmientras que en Altea fue el <strong>de</strong> Paso (P). Sin embargo hay que tener en cuenta que siunimos <strong>las</strong> categorías <strong>de</strong> Alimentación en jaula, alimentación entre jau<strong>las</strong> yalimentación en los alre<strong>de</strong>dores <strong>de</strong> la instalación, como una misma categoría, elporcentaje que representaría seria mucho mayor que cualquier otra llegando casi a un40% en Guardamar y un 35% en Altea don<strong>de</strong> la Alimentación en jaula fue muchomayor que en <strong>las</strong> otras dos. Las boyas también fueron utilizadas por <strong>las</strong> <strong>aves</strong> en <strong>las</strong> que<strong>de</strong>scansaban y algunas veces se alimentaban <strong>de</strong> la fauna epifita presente en <strong>las</strong> algasacumuladas en el<strong>las</strong>. El <strong>de</strong>scanso en el bor<strong>de</strong> (Db) <strong>de</strong> <strong>las</strong> jau<strong>las</strong> fue más utilizado en lainstalación <strong>de</strong> El Campello. Otras especies <strong>de</strong>scansaban en la red (Dr) antipredadoresllamada también por los trabajadores “red antipájaros” que cubrían <strong>las</strong> jau<strong>las</strong>, menos enEl Campello don<strong>de</strong> apenas se vio este comportamiento.A Aj Ajj Da Db Dbo Df Dr SVGuardamarEl CampelloAltea0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%Figura 43. Porcentaje <strong>de</strong> <strong>las</strong> diferentes categorías <strong>de</strong> comportamiento en cada piscifactoría51
4. RESULTADOSCOMPORT./ESPECIES E. garzetta L. michahelis L. ridibundus S. sandvicensis S. hirundo P. carboP1 7,00 18,00 21,36 1,00AjP2 1,00 1,88 1,00P3 3,33 4,50 15,26 7,00P1 1,00 1,43 25,57Ajj P2 2,67 2,86P3 1,56 11,38 9,71 9,36P1 2,34 1,40 8,29 2,38 2,00Db P2 1,26 4,61 2,00 5,50 8,18 43,50P3 2,04 2,37 8,35 8,12 20,07P1 1,00 1,10 1,76DfP2P3 1,16 1,25P1 10,50 1,00 4,50Dr P2P3 3,14 1,63 2,50 1,00P1 2,79 25,61 1,00 1,00Da P2 16,30 13,36 1,00P3 5,00 15,13 51,00P1 1,50 1,17 3,13 3,19Dbo P2 1,00 2,00P3 1,00 1,41 4,00P1 1,75 2,00 13,75 2,00 2,00SV P2 2,50 1,92 1,79 2,00 1,00 6,83P3 2,17 3,54 8,21 2,56 2,13 5,36Tabla 31. Media <strong>de</strong> cada comportamiento <strong>de</strong> <strong>las</strong> especies mas abundantes en <strong>las</strong> trespiscifactorías (P1=Altea; P2=El Campello; P3=Guardamar).El comportamiento <strong>de</strong> SV (<strong>sobre</strong>volando <strong>las</strong> jau<strong>las</strong>) fue utilizado casi en igualproporción en <strong>las</strong> tres piscifactorías.Ciertas especies tuvieron ten<strong>de</strong>ncia a <strong>de</strong>scansar en <strong>las</strong> re<strong>de</strong>s como la Garceta en Altea(ver tabla 31), que lo hacían en grupo <strong>de</strong>stensando la red antipájaros y así teneraccesible los peces <strong>de</strong>l interior <strong>de</strong> <strong>las</strong> jau<strong>las</strong>, y otras en el bor<strong>de</strong> <strong>de</strong> <strong>las</strong> jau<strong>las</strong> como sonlos Charranes, los cormoranes y <strong>las</strong> gaviotas. Los Charranes y <strong>las</strong> Gaviotas reidoras, sealimentaban entre jau<strong>las</strong> con mayor frecuencia que <strong>las</strong> <strong>de</strong>más especies y los Cormoranesson los que mas se veían <strong>de</strong> paso por <strong>las</strong> instalaciones. El <strong>de</strong>scanso en la torre central <strong>de</strong><strong>las</strong> jau<strong>las</strong> lo realizaban con mayor frecuencia <strong>las</strong> gaviotas y el <strong>de</strong>scanso en el agua tansolo los cormoranes y <strong>las</strong> gaviotas.El comportamiento <strong>de</strong>l Vuelvepiedras (ver figura 44) fue principalmente la búsqueda <strong>de</strong>alimento, bien en los bor<strong>de</strong>s <strong>de</strong> <strong>las</strong> jau<strong>las</strong> en <strong>las</strong> algas adheridas a estas o en <strong>las</strong> torrescentrales buscando restos <strong>de</strong> pienso acumulados.52
4. RESULTADOSFigura 44. Vuelvepiedras picoteando en <strong>las</strong> algas adheridas a <strong>las</strong> jau<strong>las</strong> en GuardamarLos Alcatraces observados en <strong>las</strong> piscifactorías siempre fueron vistos alimentándose <strong>de</strong>los peces agregados a <strong>las</strong> jau<strong>las</strong> y nunca se les vio en ninguna <strong>de</strong> <strong>las</strong> jau<strong>las</strong>.4.7. Tipo <strong>de</strong> alimentaciónLas <strong>aves</strong> encontraron en <strong>las</strong> granjas marinas una fuente <strong>de</strong> alimentación importante(Tabla 32). Algunas especies como los Charranes entre otras, se alimentaron <strong>de</strong> lospeces que se agregaban alre<strong>de</strong>dor <strong>de</strong> <strong>las</strong> jau<strong>las</strong>, <strong>las</strong> gaviotas patiamaril<strong>las</strong> <strong>de</strong> <strong>las</strong> bajasque flotaban en la superficie <strong>de</strong> estas (figura 46), y <strong>las</strong> garcetas, <strong>las</strong> gaviotas o loscormoranes a veces cuando la red antipájaros estaba <strong>de</strong>stensada o rota, llegaban acapturar algún pez <strong>de</strong> <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> jau<strong>las</strong>. A<strong>de</strong>más, hubo varias especies que sealimentaron <strong>de</strong> la fauna epifita presente en <strong>las</strong> algas acumuladas en los bor<strong>de</strong>s <strong>de</strong> cadajaula (figura 47) y en <strong>las</strong> boyas, como la garceta y el vuelvepiedras y también <strong>de</strong>l pienso<strong>de</strong>stinado a la alimentación <strong>de</strong> los peces como la gaviota reidora y la patiamarilla.53
4. RESULTADOS7%15%5%sin <strong>de</strong>terminarbajaspiensoFEAA73%Figura 45. Porcentaje <strong>de</strong>l uso <strong>de</strong> los diferentes tipos <strong>de</strong> alimentación (FEAA: fauna epifita <strong>de</strong> <strong>las</strong>algas marinas adheridas en <strong>las</strong> jau<strong>las</strong>).Figura 46. Peces muertos (bajas) <strong>de</strong>ntro <strong>de</strong> una jaula <strong>de</strong> Guardamar en el mes <strong>de</strong> abril.54
4. RESULTADOSFigura 47. Algas adheridas en los bor<strong>de</strong>s <strong>de</strong> <strong>las</strong> jau<strong>las</strong>La Gaviota reidora aprendió a capturar el pienso a la salida <strong>de</strong>l tubo que lo expulsabaantes <strong>de</strong> que cayera al agua (ver Figura 48), capturando también el que se quedabaflotando en el agua arrastrado por <strong>las</strong> corrientes y que no era aprovechado por los peces<strong>de</strong> <strong>las</strong> jau<strong>las</strong> (ver Figura 49). A<strong>de</strong>más el rango <strong>de</strong>l tamaño <strong>de</strong>l pienso <strong>de</strong>l que sealimentaban era muy amplio, <strong>de</strong>s<strong>de</strong> los 4,5 y los 8 mm. También se vio alimentarse <strong>de</strong>pienso que quedaba atrapado en <strong>las</strong> re<strong>de</strong>s al Vuelvepiedras y a la Gaviota patiamarilla.ESPECIES/ALIMENTACION pienso peces bajas FEAA sin <strong>de</strong>t.E. garzetta 8 3 10 1L. michahelis 20 28 5 3 14L. ridibundus 1681 49 75L. audouinii 9L. melanocephalus 1L. genei 4 4S. sandvicensis 1 95S. hirundo 266S. albifrons 1C. niger 2P. carbo 1A. interpres 1 46M. bassanus 3Tabla 32. Numero <strong>de</strong> individuos <strong>de</strong> cada especie realizando diferentes comportamientos <strong>de</strong>ntro<strong>de</strong> <strong>las</strong> tres instalaciones (FEAA: Fauna epifita Adherida a <strong>las</strong> Algas)55
4. RESULTADOSFigura 48. Gaviotas reidoras alimentándose <strong>de</strong>l pienso <strong>de</strong>s<strong>de</strong> el aire en Altea, mes <strong>de</strong>noviembre.Figura 49. Gaviotas reidoras capturando pienso <strong>de</strong>s<strong>de</strong> el aire y <strong>de</strong>s<strong>de</strong> el agua en la piscifactoría<strong>de</strong> Guardamar en el mes <strong>de</strong> noviembre.4.8. La edad <strong>de</strong> <strong>las</strong> <strong>aves</strong>La edad <strong>de</strong> <strong>las</strong> <strong>aves</strong> se dividió en 4 grupos: juvenil (aquel<strong>las</strong> que nacieron ese mismoverano), <strong>las</strong> <strong>de</strong> primer invierno (también llamadas <strong>de</strong> primer año), <strong>las</strong> <strong>de</strong> segundo y56
4. RESULTADOStercer año englobadas en un mismo grupo <strong>de</strong>bido a su complicada i<strong>de</strong>ntificación(algunas gaviotas no llegan al plumaje adulto hasta el cuarto año, por ellos paradistinguir su edad se c<strong>las</strong>ifican en 4 grupos etarios) y por ultimo los adultos y en el caso<strong>de</strong> algunas gaviotas <strong>de</strong> cuarto año.Las <strong>aves</strong> en edad adulta, fueron <strong>las</strong> que mas frecuentaron <strong>las</strong> instalaciones durante laprimavera, otoño e invierno (Tabla 33), aunque para la familia <strong>de</strong> los Charranes losjuveniles y <strong>de</strong> primer año representaron un gran porcentaje, casi el 40% en verano. En lafamilia <strong>de</strong> <strong>las</strong> gaviotas hubo juveniles, <strong>de</strong> primer, segundo y tercer año aunque en menorproporción que los adultos que representaron alre<strong>de</strong>dor <strong>de</strong> un 35%.Estacion/edad/especies E.g A.c. L.m. L.r. L.a. L.g. S.h. S.s. P.c. A.i.juv. 234 2 4 21 añoPrimavera 2_3 18ad-4año 178 8 238 3 38 1 512 53 83sin i<strong>de</strong>nt.juv. 2 135 10 5 2 232 219 31 año 2130Verano 2_3 14ad-4año 48 247 34 47 16 310 12sin i<strong>de</strong>nt. 6 46 138juv. 252 29 54 22 11 año 270 836 30 22Otoño 2_3 30ad-4año 312 227 2114 9 61 1 36sin i<strong>de</strong>nt. 87 669 100 59 6juv. 1 121 año 417 17Invierno 2_3 32ad-4año 65 200 1459 71 24 9sin i<strong>de</strong>nt. 75 289 173Tabla 33. Numero <strong>de</strong> individuos <strong>de</strong> cada especie y edad censadas <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> tres instalaciones<strong>de</strong>s<strong>de</strong> barco, (E.g.:E. garzetta; A.c.: A. interpres; L.m.: L. michahelis; L.r.: L. ridibundus; L.a.:L. audouinii; L.g.: L. genei; S.h.: S. hirundo; S.s.: S. sandvicensis; P.c.: P. carbo; A.i.: A.interpres)A veces fue difícil i<strong>de</strong>ntificar con exactitud la edad <strong>de</strong> algunos individuos, <strong>sobre</strong> todo enel caso <strong>de</strong> los cormoranes, ya que estos casi siempre eran vistos en el censo <strong>de</strong> tar<strong>de</strong> quese realiza <strong>de</strong>s<strong>de</strong> tierra, cuya distancia dificultaba los <strong>de</strong>talles <strong>de</strong> la i<strong>de</strong>ntificación.57
4. RESULTADOSTambién hubo dificultad con algunos Charranes y gaviotas cuando estaban en un grupogran<strong>de</strong> en una misma jaula y <strong>las</strong> condiciones meteorológicas no permitían laobservación con <strong>de</strong>talle <strong>de</strong> su plumaje.4.9. Inci<strong>de</strong>ncias y mortalidadGuardamar fue la granja marina que más registros tuvo <strong>de</strong> inci<strong>de</strong>ncias y/o mortalidad <strong>de</strong><strong>aves</strong> con 52 registros (Tabla 34). En Altea y El Campello se registraron 12 y 6respectivamente. Las especies que mas se quedaron enganchadas con o sin resultado <strong>de</strong>muerte fueron la Garceta y la Gaviota patiamarilla mientras que la Garza real, laGaviota reidora, el Charrán común y patinegro, el Cormorán gran<strong>de</strong> y el Alcatraz fueronespecies que resultaron atrapadas en <strong>las</strong> re<strong>de</strong>s antipájaros al menos una vez.Especie Guardamar Altea CampelloA. cinerea 1 0 0E. garzetta 21 3 0L. audouinii 1 0 0L. michahelis 18 3 1C. ridibundus 2 5 0P. carbo 8 0 1S. M. basanus 1 0 0sandvicensis 0 1 3S. hirundo 0 0 1TOTAL 52 12 6Tabla 34. Numero <strong>de</strong> inci<strong>de</strong>ncias en <strong>las</strong> tres instalacionesLas <strong>aves</strong> quedaban atrapadas <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> jau<strong>las</strong> al intentar entrar en el<strong>las</strong> para capturarlos peces. Algunas especies mostraron mas facilidad para entrar y salir cuando existíaalgún agujero en <strong>las</strong> re<strong>de</strong>s como la Garceta, pero normalmente una vez <strong>de</strong>ntro les eramuy difícil po<strong>de</strong>r salir lo que hacia que muchas acabaran muriendo <strong>de</strong> agotamiento.Otras al apoyarse en <strong>las</strong> re<strong>de</strong>s antipájaros se quedaban enganchadas <strong>de</strong> <strong>las</strong> patas o a<strong>las</strong>sin po<strong>de</strong>r levantar <strong>de</strong> nuevo el vuelo y terminaban muriendo. El 51% <strong>de</strong> <strong>las</strong> <strong>aves</strong> que sequedaron atrapadas no se supo si consiguieron salir o no y no fueron rescatadas (Figura50). De <strong>las</strong> que quedaron atrapadas y murieron sin ser rescatadas fueron un 25%,mientras que el resto <strong>de</strong> <strong>las</strong> <strong>aves</strong> fueron rescatadas vivas y pudieron empren<strong>de</strong>r <strong>de</strong> nuevoel vuelo, algunas incluso seguían en la instalación alimentándose entre jau<strong>las</strong>. Apenas58
4. RESULTADOSun 1% lo formaban <strong>las</strong> <strong>aves</strong> que fueron rescatadas y no fueron capaces <strong>de</strong> recuperarsemuriendo tiempo <strong>de</strong>spués. Algunas <strong>de</strong> estas <strong>aves</strong> fueron llevadas al Centro <strong>de</strong>Recuperación <strong>de</strong> Santa Faz.23%1%ATAT-M51%AT-R25%AT-R-MFigura 50. Estado <strong>de</strong> <strong>las</strong> <strong>aves</strong> atrapadas. (AT: atrapadas; AT-M atrapadas muertas; AT-R:atrapadas rescatadas vivas; AT-R-M: atrapadas, rescatadas y posterior muerte.Figura 51. Garceta atrapada <strong>de</strong>ntro <strong>de</strong> una jaula <strong>de</strong> Guardamar en mayo.59
4. RESULTADOSFigura 52. Gaviota reidora <strong>de</strong> primer invierno atrapada en una red antipájaros en la piscifactoría<strong>de</strong> Altea en diciembre.Figura 53. Charrán patinegro atrapado <strong>de</strong>ntro <strong>de</strong> una jaula <strong>de</strong> El Campello en Octubre.60
4. RESULTADOSFigura 54. Juveniles <strong>de</strong> Gaviota patiamarilla atrapadas en una jaula <strong>de</strong> Guardamar en febrero.Figura 55. Gaviota reidora rescatada <strong>de</strong> una jaula <strong>de</strong> Altea en noviembre.Figuras 56 y 57. Cormoranes muertos en la red en la piscifactoría <strong>de</strong> Guardamar en febrero ydiciembre.61
5. DISCUSIÓN5. DISCUSIÓNPresencia <strong>de</strong> especies en <strong>las</strong> instalaciones <strong>de</strong> mariculturaLos resultados obtenidos <strong>sobre</strong> el número <strong>de</strong> especies <strong>de</strong> <strong>aves</strong> presentes en <strong>las</strong> áreas <strong>de</strong>maricultura fueron mucho mayores que <strong>las</strong> encontradas en estudios similares aunquecoincidieron en que la familia mas abundante fue Laridae, con mayor numero <strong>de</strong>especies (Roycroft, D. et al., 2004; Olinto Branco, J. et al., 2001; Díaz Lopez, B., et al.,2008). Los estudios realizados en España (Lekuona, J.M., 1998; Lekuona, J.M., 2002;Pérez-Hurtado A. & Hortas, F., 1993; Olmos, V. et al. 2000) fueron centrados enespecies concretas como el Cormorán gran<strong>de</strong>, la Gaviota reidora y la Garza real, y <strong>las</strong>dos primeras fueron muy abundantes en <strong>las</strong> instalaciones <strong>de</strong> este estudio.La granja marina <strong>de</strong> Guardamar fue visitada por un mayor número <strong>de</strong> especies lo quepodría ser explicado por la cercanía <strong>de</strong> mayor numero <strong>de</strong> colonias <strong>de</strong> <strong>aves</strong> y dormi<strong>de</strong>rosen comparación con los alre<strong>de</strong>dores <strong>de</strong> El Campello y Altea. Estudios <strong>de</strong> seguimientovía satélite o GPS loggers serian necesarios para confirmarlo.Variación estacional <strong>de</strong> <strong>las</strong> <strong>aves</strong> marinasNo todas <strong>las</strong> especies mostraron diferencias significativas estacionales, como en otrosestudios (Roycroft, D., et al., 2004). Las diferencias significativas encontradas para elCormorán en <strong>las</strong> diferentes estaciones <strong>de</strong>l año son esperadas ya que es una especiemigratoria que pasa el invierno en estas costas, estando casi ausente en el resto <strong>de</strong>estaciones. Sin embargo <strong>las</strong> diferencias en la Gaviota reidora que la po<strong>de</strong>mos verdurante todo el año en Alicante, nos dicen que el uso que hace esta especie <strong>de</strong> <strong>las</strong>granjas marinas es muy diferente según la estación <strong>de</strong>l año coincidiendo con el otoño einvierno cuya <strong>de</strong>manda energética <strong>de</strong> <strong>las</strong> <strong>aves</strong> es muy alta (Zwarts et al., 1990ª). Lasdiferencias entre piscifactorías pue<strong>de</strong>n ser <strong>de</strong>bidas a algunas características <strong>de</strong> cadainstalación que <strong>las</strong> atraiga más o a la cercanía <strong>de</strong> dormi<strong>de</strong>ros a <strong>las</strong> granjas marinas.A pesar <strong>de</strong> no encontrar diferencias significativas entre <strong>las</strong> estaciones <strong>de</strong>l año y <strong>las</strong>piscifactorías para la Gaviota patiamarilla, esta especie fue mas abundante en diferentesestaciones según la piscifactoría en la que nos encontráramos. Teniendo en cuenta quehay mayor numero <strong>de</strong> individuos <strong>de</strong> esta especie en invierno que en verano en la62
5. DISCUSIÓNprovincia <strong>de</strong> Alicante, cabria esperar mayor presencia <strong>de</strong> estas en <strong>las</strong> instalaciones <strong>de</strong>maricultura durante el invierno. Pero fue solo en la granja marina <strong>de</strong>l El Campellodon<strong>de</strong> esta especie obtuvo un mayor número <strong>de</strong> individuos ya que en Altea yGuardamar fue en verano y otoño respectivamente.El Charrán común, especie para la que tampoco se dieron diferencias significativasentre piscifactorías y <strong>las</strong> estaciones, tuvo oscilaciones estacionales. En Altea no se dioninguna cita <strong>de</strong> esta especie durante todo el estudio, y pue<strong>de</strong> <strong>de</strong>berse a que no existeninguna colonia cercana a esta piscifactoría sin embargo en Guardamar y El Campellofue más abundante en primavera y verano coincidiendo con la época <strong>de</strong> cría <strong>de</strong> estaespecie. A<strong>de</strong>más entre estas dos piscifactorías fue en Guardamar don<strong>de</strong> hubo mayornúmero pudiéndose explicar <strong>de</strong> nuevo por la presencia <strong>de</strong> colonias cercanas a estapiscifactoría como <strong>las</strong> Salinas <strong>de</strong> Mata-Torrevieja y Santa Pola.El Charrán patinegro fue una <strong>de</strong> <strong>las</strong> especies más abundantes cuyas diferencias entrepiscifactorías y entre <strong>las</strong> estaciones <strong>de</strong>l año tampoco fueron significativas. La coloniamás numerosa está en <strong>las</strong> Laguna <strong>de</strong> la Mata-Torrevieja cerca <strong>de</strong> la piscifactoría <strong>de</strong>Guardamar don<strong>de</strong> coincidió ser más numeroso en comparación con <strong>las</strong> <strong>de</strong>máspiscifactorías. A<strong>de</strong>más el verano fue la estación más numerosa para esta especie enGuardamar y El Campello sin embargo esta especie es más abundante en Alicantedurante el invierno según el censo <strong>de</strong>l 2007.La variación estacional <strong>de</strong> <strong>las</strong> <strong>aves</strong> marinas entre piscifactorías, es posible que se <strong>de</strong>ba ala variación estacional <strong>de</strong> peces agregados a <strong>las</strong> jau<strong>las</strong> existente también entre estas trespiscifactorías. Según Fernán<strong>de</strong>z-Jover, D., 2008, algunas especies como el jurelmediterráneo, anjova, palometa y la oblada varían estacionalmente y a<strong>de</strong>más algunastienen afinidad por una piscifactoría concreta, pero estudios mas <strong>de</strong>tallados <strong>sobre</strong> laalimentación <strong>de</strong> <strong>las</strong> <strong>aves</strong> marinas en áreas <strong>de</strong> maricultura son necesarios para po<strong>de</strong>rexplicar estas variaciones y su relación directa con los peces presentes alre<strong>de</strong>dor <strong>de</strong> <strong>las</strong>jau<strong>las</strong>.63
5. DISCUSIÓNVariación mensualAlgunas especies como la Garceta mostraron diferencias significativas a lo largo <strong>de</strong> losonce meses <strong>de</strong>l estudio. Cabria esperar ver mas individuos <strong>de</strong> esta especie enGuardamar don<strong>de</strong> hay una colonia <strong>de</strong> 91 parejas nidificando y en invierno unos 91individuos en <strong>las</strong> Salinas <strong>de</strong> Santa Pola. Y fue en Guardamar don<strong>de</strong> hubo másabundancia aunque el máximo se dio en la piscifactoría <strong>de</strong> Altea en el mes <strong>de</strong>septiembre, don<strong>de</strong> el único dormi<strong>de</strong>ro cercano son <strong>las</strong> Salinas <strong>de</strong> Calpe con 10individuos en el 2008. A<strong>de</strong>más en el Islote <strong>de</strong> Benidorm han empezado a nidificaralgunas parejas <strong>de</strong> Garceta por primera vez (visto por personal <strong>de</strong>l Parque Natural <strong>de</strong>Serra Gelada) sin embargo durante la época <strong>de</strong> nidificacion apenas se vieron individuosen Altea que es la piscifactoría <strong>de</strong>l estudio mas cercana al islote.De la Gaviota reidora existen unas 768 parejas nidificando en <strong>las</strong> costas Alicantinas y735 individuos invernando, por lo que es una especie que se pue<strong>de</strong> ver a lo largo <strong>de</strong>ltodo el año. Sin embargo, en <strong>las</strong> piscifactorías no fue vista hasta el mes <strong>de</strong> octubre. Deacuerdo con Hutchinson 1989, para la mayoría <strong>de</strong> <strong>aves</strong> marinas el periodo <strong>de</strong> incubacióncomienza en el mes <strong>de</strong> abril y mayo, momento en que los padres buscan alimento enzonas cercanas a la colonia por lo que explicaría que durante la primavera y verano nose diera ninguna cita. A<strong>de</strong>más fue más abundante en Altea, que es la piscifactoría masalejada <strong>de</strong> <strong>las</strong> colonias y dormi<strong>de</strong>ros <strong>de</strong> esta especie. Principalmente el comportamiento<strong>de</strong> esta especie fue alimentarse <strong>de</strong>l pienso durante los meses <strong>de</strong> octubre a Febrero.Concretamente en esta piscifactoría se llevaba un or<strong>de</strong>n <strong>de</strong> alimentación muy estricto ytan solo un barco <strong>de</strong>dicado a ello y el pienso era siempre lanzado con una maquina adiferencia <strong>de</strong> <strong>las</strong> otras dos piscifactorías, don<strong>de</strong> se daba el pienso a mano y a veces conmaquina aunque mucho mas pequeña y no siempre se llevaba el mismo or<strong>de</strong>n. Esposible que encontraran en la piscifactoría <strong>de</strong> Altea más facilidad para capturar elpienso.La Gaviota <strong>de</strong> Audouin fue mas abundante en Guardamar posiblemente por la cercanía<strong>de</strong> la única colonia don<strong>de</strong> nidifica (Laguna La Mata-Torrevieja con 451 parejas en2007) y a<strong>de</strong>más lo fue durante la primavera y verano, coincidiendo con la época64
5. DISCUSIÓNprenupcial y <strong>de</strong> cría, aunque el máximo se dio en el mes <strong>de</strong> Septiembre, mes en el quemuchas empiezan a emigrar.La Gaviota patiamarilla esta presente durante todo el año en la costa alicantina, ycomo era <strong>de</strong> esperar estuvo presente en <strong>las</strong> tres piscifactorías a lo largo <strong>de</strong> todo elestudio, quizá por ello <strong>las</strong> diferencias mensuales no fueron significativas.Que <strong>las</strong> Gaviotas picofina, cabecinegra y sombría apenas se vieran en <strong>las</strong>instalaciones se explica por su menor número en la costa <strong>de</strong> Alicante. Tan solo laGaviota picofina tiene una colonia don<strong>de</strong> nidifica, cercana a granja marina <strong>de</strong>Guardamar, que es don<strong>de</strong> se dieron <strong>las</strong> citas durante la época reproductora. Las otrasdos no pasan el verano en esta costa.Las diferencias encontradas en el Charran patinegro y el Charrán común, coinci<strong>de</strong>también con la cercanía <strong>de</strong> <strong>las</strong> colonias don<strong>de</strong> nidifica (Laguna La Mata-Torrevieja ySanta Pola) cercana a la granja marina Guardamar don<strong>de</strong> se vieron mas individuos <strong>de</strong>estas dos especies en comparación con <strong>las</strong> otras granjas coincidiendo durante la épocareproductora. Es posible que los individuos <strong>de</strong> patinegro vistos durante los meses <strong>de</strong>invierno <strong>de</strong> noviembre y diciembre en Altea, se trate <strong>de</strong> individuos que pasan elinvierno en Alicante aunque en el año 2008 tan solo se dieron tres citas <strong>de</strong> esta especieen el Hondo y a<strong>de</strong>más, no se conoce ningún dormi<strong>de</strong>ro <strong>de</strong> esta especie cercana a estainstalación. También es probable que se trate <strong>de</strong> individuos que iniciaron su viaje haciael sur mas tar<strong>de</strong>. Del resto <strong>de</strong> especies <strong>de</strong> la familia Sternidae, apenas se vieronejemplares, <strong>de</strong>bido a que su presencia en estas costas es escasa. Sin embargo supresencia en <strong>las</strong> piscifactorías coinci<strong>de</strong> con la existencia <strong>de</strong> colonias cercanas a estas. Enel caso <strong>de</strong>l fumarel común sus citas esporádicas en <strong>las</strong> granjas <strong>de</strong> Guardamar y ElCampello pue<strong>de</strong> <strong>de</strong>berse a su paso migratorio, ya que no existe ninguna colonia nidormi<strong>de</strong>ro en la costa alicantina.Al igual que en otros estudios (Lekuona, J.M., 2002; Genard et al., 1993), el Cormorángran<strong>de</strong> fue muy abundante durante los meses <strong>de</strong> invierno, ya que es una especiemigratoria que pasa los veranos en el norte <strong>de</strong> Europa. Sus dormi<strong>de</strong>ros están situadosmas cercanos a la piscifactoría <strong>de</strong> Guardamar, don<strong>de</strong> claramente fue más abundante.A<strong>de</strong>más esta especie ha creado <strong>de</strong>s<strong>de</strong> hace unos años un conflicto ya que es una ave65
5. DISCUSIÓNictiófaga que se alimenta <strong>de</strong> 78 especies diferentes <strong>de</strong> peces distribuidos en 24 familias(Carss et al. 2003; Russell et al. 1996) y su crecimiento ha tenido repercusiones <strong>sobre</strong>algunas poblaciones <strong>de</strong> peces como truchas Salmo trutta (Carss et al., 1997), carpas,Cyprinus carpio (Schmidt, 1998), salmones Salmo salar (Warke & Day, 1995) ymugílidos Chelon labrosus y Liza ramada (Genard et al., 1993).La única especie pelágica que se vio <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> instalaciones fue el AlcatrazAtlántico. Esta especie pasa los inviernos en el Atlántico y el Mediterráneo, por lo quese esperaba verla aunque no <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> instalaciones por la cercanía <strong>de</strong> estas a lacosta. Otra especie pelágica, el Paíño, que fue visto en los alre<strong>de</strong>dores <strong>de</strong> lapiscifactoría <strong>de</strong> Guardamar y no en Altea, piscifactoría más cercana a su colonia <strong>de</strong>nidificacion, el Islote <strong>de</strong> Benidorm.Variación horariaA pesar <strong>de</strong> que <strong>las</strong> diferencias horarias <strong>de</strong> <strong>las</strong> <strong>aves</strong> en <strong>las</strong> tres zonas <strong>de</strong> estudio no fueronsignificativas, se pue<strong>de</strong> ver que siguen patrones muy diferentes, incluso en individuos<strong>de</strong> la misma especie en <strong>las</strong> diferentes instalaciones y en <strong>las</strong> diferentes estaciones <strong>de</strong>laño.Las especies que mostraron mas oscilaciones a lo largo <strong>de</strong> día fueron el Charránpatinegro en otoño y la Gaviota patiamarilla en primavera. Las <strong>de</strong>más especies exceptola Garceta y el Cormorán gran<strong>de</strong> siguieron un patrón parecido con un máximo en losprimeros censos y a continuación un <strong>de</strong>scenso a lo largo <strong>de</strong>l día que muchas vecesllegaba a cero en los últimos censos. La Garceta fue la especie que más variaciones tuvoa lo largo <strong>de</strong>l día en <strong>las</strong> diferentes piscifactorías y estaciones. Mientras se manteníaconstante en Altea y El Campello en Guardamar variaba mucho a lo largo <strong>de</strong>l díasiguiendo patrones muy diferentes en primavera y en verano.Para el Cormorán gran<strong>de</strong> se vio el mismo comportamiento en <strong>las</strong> tres piscifactorías,don<strong>de</strong> acudían cada día durante el otoño e invierno por la tar<strong>de</strong> cuando ya los barcos <strong>de</strong>trabajo se habían ido a tierra. Muchas veces se les veía llegar antes <strong>de</strong> que lostrabajadores se fueran y esperar en los alre<strong>de</strong>dores <strong>de</strong> <strong>las</strong> jau<strong>las</strong>, para posarse <strong>sobre</strong> el<strong>las</strong>66
5. DISCUSIÓNuna vez los barcos hubieran <strong>de</strong>jado <strong>las</strong> instalaciones. Lo hacían en gran<strong>de</strong>s gruposexcepto en Altea que fue la única instalación don<strong>de</strong> apenas se vieron individuos.En un estudio similar (Olinto Branco, 2001), la mayoría <strong>de</strong> <strong>las</strong> <strong>aves</strong> seguían el mismopatrón horario, que al contrario que en este estudio, fueron aumentando a lo largo <strong>de</strong>ldía teniendo su máximo por la tar<strong>de</strong>, cuando había un menor numero <strong>de</strong> barcos <strong>de</strong> pescaoperando en el área en los que suele haber agregaciones <strong>de</strong> <strong>aves</strong> por los <strong>de</strong>scartes. Peroen este caso es posible que la mayoría <strong>de</strong> especies vayan disminuyendo a lo largo <strong>de</strong>ldía <strong>de</strong>bido a la presencia <strong>de</strong> barcos <strong>de</strong> trabajo que operan continuamente y varían <strong>de</strong>jaula constantemente a lo largo <strong>de</strong>l día al igual que los pequeños barcos <strong>de</strong> pesca queutilizan los alre<strong>de</strong>dores <strong>de</strong> <strong>las</strong> instalaciones <strong>de</strong> maricultura para pescar e incluso enalgunas ocasiones entrar <strong>de</strong>ntro <strong>de</strong> el<strong>las</strong> y pescar muy cerca <strong>de</strong> <strong>las</strong> jau<strong>las</strong>. Así a primerahora <strong>de</strong> la mañana era el momento en el que menos barcos o menos movimientopodíamos encontrar en <strong>las</strong> instalaciones.Comportamiento <strong>de</strong> <strong>las</strong> <strong>aves</strong>La mayor parte <strong>de</strong> <strong>las</strong> <strong>aves</strong> censadas en este estudio fueron vistas alimentándose enalgún momento en <strong>las</strong> instalaciones. Cuando se alimentaban <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> jau<strong>las</strong>normalmente estaba relacionado con el estado <strong>de</strong> la red antipájaros, a veces rota o<strong>de</strong>sgastada, oportunidad que aprovechan <strong>las</strong> <strong>aves</strong> para po<strong>de</strong>r capturar fácilmentealgunos peces y obtener así alimento <strong>de</strong> manera más fácil. Según Díaz López, B., et al.,2008, el tiempo <strong>de</strong>stinado por <strong>las</strong> <strong>aves</strong> marinas en la búsqueda <strong>de</strong> alimento se hareducido <strong>de</strong> forma drástica (75%) por la presencia <strong>de</strong> este tipo <strong>de</strong> instalaciones. Lapiscifactoría <strong>de</strong> Altea fue la que mas porcentaje tuvo <strong>de</strong> individuos alimentándose<strong>de</strong>ntro <strong>de</strong> la jaula, pero sin embargo no para alimentarse <strong>de</strong> los peces, sino <strong>de</strong>l piensorepartido a los peces en cada jaula y fueron solo <strong>las</strong> Gaviotas reidoras <strong>las</strong> que tuvieroneste comportamiento <strong>de</strong> captura <strong>de</strong>l pienso <strong>de</strong>s<strong>de</strong> el aire y <strong>de</strong>s<strong>de</strong> el agua y algunapresencia esporádica <strong>de</strong> Gaviota patiamarilla.El comportamiento <strong>de</strong> <strong>de</strong>scanso en el bor<strong>de</strong> <strong>de</strong> la jaula fue el segundo mas importanteya que <strong>las</strong> <strong>aves</strong> aprovechaban para limpiarse <strong>las</strong> plumas, secar<strong>las</strong> o simplemente67
5. DISCUSIÓN<strong>de</strong>scansar <strong>de</strong>spués <strong>de</strong> alimentarse. Muchas especies presentan este comportamiento yespecies que antes <strong>de</strong>scansaban en playas o rocas, ahora lo hacen en <strong>las</strong> piscifactorías,mas alejadas <strong>de</strong> los predadores y <strong>de</strong> la perturbación humana (Olinto Branco, J., 2001).La Garceta principalmente se quedaba <strong>de</strong>scansando en <strong>las</strong> re<strong>de</strong>s “antipájaros”, lo hacíanen gran<strong>de</strong>s grupos y con su peso conseguían <strong>de</strong>stensar la red antipájaros y así po<strong>de</strong>rllegar a los peces <strong>de</strong> la jaula. Sin embargo otro estudio (Ashkenazi, S. & Yom-Tov, Y.,1996) revela que la aparición <strong>de</strong> esta especie en <strong>las</strong> jau<strong>las</strong> esta relacionada con laaparición <strong>de</strong> bajas en los dos o tres días siguientes, cuando se llenaba <strong>de</strong> gaviotas. Porello son un indicador <strong>de</strong> que algo va a ocurrir en una jaula, o una alerta <strong>de</strong> que los pecesno están <strong>de</strong>l todo sanos. Así los peces mas débiles nadan muy cerca <strong>de</strong> la superficie ymas <strong>de</strong>spacio, siendo una presa fácil para <strong>las</strong> <strong>aves</strong>. Sin embargo en este estudio no seprodujo este comportamiento.AlimentaciónEl pienso fue la mayor fuente <strong>de</strong> alimento para <strong>las</strong> <strong>aves</strong> <strong>de</strong>bido a la gran cantidad <strong>de</strong>Gaviotas reidoras que se alimentaron <strong>de</strong>l pienso. Pero esta fue la única especie que lohizo directamente <strong>de</strong>s<strong>de</strong> el aire y <strong>de</strong>s<strong>de</strong> el agua. Algunas otras especies lo hacían <strong>de</strong>forma indirecta alimentándose <strong>de</strong> los restos <strong>de</strong> pienso que quedaban enganchados en <strong>las</strong>re<strong>de</strong>s. En otros estudios realizados en Europa cisnes, fochas, patos reales compitieronpor el pienso distribuido a los peces. En Polonia también algunos patos y fochas sealimentaron <strong>de</strong>l 2-7% <strong>de</strong>l pienso <strong>de</strong>stinado para los peces (EIFAC, 1988).Según Harpaz, S. & Clark, L., (2006), el uso <strong>de</strong> un repelente en el pienso <strong>de</strong>stinado a lospeces evita que <strong>las</strong> <strong>aves</strong> se alimenten <strong>de</strong>l pienso incluso cuando este esta flotando en elagua mas fácilmente accesible.También fueron una gran fuente <strong>de</strong> alimento para la mayoría <strong>de</strong> <strong>las</strong> especies <strong>de</strong> esteestudio, los peces agregados a <strong>las</strong> jau<strong>las</strong>. Según Fernán<strong>de</strong>z-Jover, D., et al., 2008, en unestudio realizado en <strong>las</strong> mismas granjas marinas, se encontraron alre<strong>de</strong>dor <strong>de</strong> 33especies <strong>de</strong> peces pertenecientes a cuatro familias diferentes.68
5. DISCUSIÓNEdad <strong>de</strong> <strong>las</strong> <strong>aves</strong> y la mortalidadLa mortalidad y/o inci<strong>de</strong>ncias <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> granjas marinas estuvieron muyrelacionadas con la edad <strong>de</strong> <strong>las</strong> <strong>aves</strong>, ya que los adultos fueron los mas abundantes enestas áreas <strong>de</strong> maricultura pero la mayoría <strong>de</strong> inci<strong>de</strong>ncias y mortalidad se dieron en <strong>aves</strong>jóvenes o todavía no adultas como en el caso <strong>de</strong> la Gaviota reidora en la piscifactoría <strong>de</strong>Altea, don<strong>de</strong> la mayoría <strong>de</strong> inci<strong>de</strong>ncias fueron en individuos <strong>de</strong> primer invierno. Sinembargo para otras especies como la Gaviota patiamarilla hubieron inci<strong>de</strong>ncias porigual en adultos y en juveniles.Principalmente la causa <strong>de</strong> la muerte en todas <strong>las</strong> especies fue por causa <strong>de</strong> la re<strong>de</strong>santipájaros. Se han realizado muchos estudios a nivel mundial para <strong>de</strong>terminar el mejormétodo para evitar que <strong>las</strong> <strong>aves</strong> puedan acce<strong>de</strong>r a los peces <strong>de</strong> <strong>las</strong> jau<strong>las</strong> (Blackwell, B.F. et al., 2000; Mott, D. F. & Boyd, F. L., 2008; Belant, J. L. et al., 2000; Quick, N. J. etal., 2004; Harpaz, S & Clark, L., 2006), pero el método <strong>de</strong> <strong>las</strong> re<strong>de</strong>s hasta ahora siguesiendo el mas utilizado ya que es el mas económico y a<strong>de</strong>más el mas útil.69
6. CONCLUSIONES6. CONCLUSIONES1) La actividad <strong>de</strong> maricultura en la costa <strong>de</strong> Alicante agrega a una gran variedad <strong>de</strong><strong>aves</strong> marinas tanto <strong>de</strong>ntro como en los alre<strong>de</strong>dores <strong>de</strong> <strong>las</strong> instalaciones, <strong>de</strong> <strong>las</strong> cualessolo una está en peligro <strong>de</strong> extinción, la Gaviota <strong>de</strong> Audouin, y tres especies: laGaviota picofina, el Charrán común y el Paíño están consi<strong>de</strong>radas vulnerables.2) La familia <strong>de</strong> <strong>aves</strong> más abundante y con mayor número <strong>de</strong> especies presentes en <strong>las</strong>tres instalaciones <strong>de</strong> maricultura fueron Laridae y Sternidae.3) El Paiño, la Par<strong>de</strong>la Mediterránea y Cenicienta, <strong>aves</strong> marinas pelágicas, fueron <strong>las</strong>únicas que nunca fueron censadas <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> instalaciones, sin embargo si queestuvieron presentes en los alre<strong>de</strong>dores.4) Existe una estrecha relación entre la presencia <strong>de</strong> colonias y dormi<strong>de</strong>ros <strong>de</strong> <strong>aves</strong>marinas y su presencia en <strong>las</strong> granjas marinas.5) La presencia <strong>de</strong> <strong>aves</strong>, esta relacionada con la presencia tanto <strong>de</strong> los barcos <strong>de</strong> trabajo<strong>de</strong> <strong>las</strong> piscifactorías, como los barcos <strong>de</strong> recreo agregados alre<strong>de</strong>dor <strong>de</strong> <strong>las</strong>instalaciones, ya que el momento <strong>de</strong> mayor agregación <strong>de</strong> <strong>aves</strong> marinas en <strong>las</strong> jau<strong>las</strong>es en los primeros y últimos censos cuando estos llegaban o se marchaban.6) El pienso juega un papel muy importante en la alimentación <strong>de</strong> la Gaviota reidoradurante el otoño e invierno. Y fue la única especie, junto con alguna Gaviotapatiamarilla esporádica, que aprendió a capturarlo <strong>de</strong>s<strong>de</strong> aire.7) El uso <strong>de</strong> <strong>las</strong> granjas marinas como <strong>de</strong>scanso fue muy importante para casi todas <strong>las</strong>especies presentes en el estudio, que aprovechaban para limpiarse <strong>las</strong> plumas o para<strong>de</strong>scansar entre <strong>las</strong> capturas durante la búsqueda <strong>de</strong> alimento o para mantenersealejadas <strong>de</strong> posibles <strong>de</strong>predadores y/o en su paso migratorio.8) Un buen mantenimiento <strong>de</strong> <strong>las</strong> re<strong>de</strong>s “antipájaros” es fundamental para evitar queestas que<strong>de</strong>n atrapadas al intentar entrar muriendo días o semanas <strong>de</strong>spués, a la vez70
6. CONCLUSIONESque se evita la captura <strong>de</strong> los peces <strong>de</strong> <strong>de</strong>ntro <strong>de</strong> <strong>las</strong> jau<strong>las</strong> por parte <strong>de</strong> <strong>las</strong> <strong>aves</strong>, loque perjudica económicamente a <strong>las</strong> empresas.9) Algunas especies presentaron comportamiento nunca observados anteriormente,como la Garceta que aprendió rápidamente a entrar y salir por los agujeros <strong>de</strong> <strong>las</strong>re<strong>de</strong>s antipájaros lo que le permitía capturar peces <strong>de</strong> <strong>las</strong> jau<strong>las</strong>. A<strong>de</strong>más esta mismaespecie también aprendió a capturar los peces en grupo <strong>de</strong>stensando la red“antipájaros”10) Los juveniles o <strong>de</strong> primer año fueron <strong>las</strong> que mas inci<strong>de</strong>ncias o mortalidadpresentaron a pesar <strong>de</strong> que la edad mas abundante fue la edad adulta o <strong>de</strong> cuarto año(para algunas gaviotas).11)71
7. REFERENCIAS7. REFERENCIASAleixos, L., Santamaría, J., & Gomis, E., 2008. Registros en el censo <strong>de</strong> <strong>aves</strong> marinasinvernantes en el litoral <strong>de</strong> la comunidad Valenciana. Año 2008.Ashkenazi, S. & Yom-Tov, Y., 1996. Herons and Fish Farming in the Huleh Valley,Israel: Conflict or Mutual Benefit?. Colonial Waterbirds 19 (Special Publication 1):143-151.Belant, J. L., Tyson, L. A. & Mastrangelo, P. A., 2000. Effects of letal control ataquaculture facilities on populations of piscivorous birds. Wildlife Society Bulletin,Volume 28, number 2.Beveridge, M.C.M., 2000. Aquaculture and wildlife interactions in Proceedings of theseminar of the CIHEAM network on technology of aquaculture in the Mediterranean(TECAM), jointly organized by CIHEAM and FAO, Zaragoza (Spain), 17-21 January2000, pp: 57-66.Blackwell, B. F., Dolbeer, R. A., & Tyson, L. A., 2000. Lethal Control of PiscivorousBirds at Aquaculture Facilities in the Northeast United States: Effects on Populations.North American Journal of Aquaculture 62:300–307.Blomdahl, A., Breife, B and Holmström, N., 2007. Flight I<strong>de</strong>ntification of EuropeanSeabirds. Christopher Helm, London.Cardia, F. and Lovatelli, A. A review of cage aquaculture: Mediterranean Sea. In M.Halwart, D. Soto and J.R. Arthur (eds). Cage aquaculture – Regional reviews and globaloverview, pp. 156–187. FAO Fisheries Technical Paper. No. 498. Rome, FAO. 2007.241 pp.Carss D. N., 1990. Concentrations of wild and escaped fishes immediately adjacent tofish farm cages. Aquaculture, 90; 29-40.72
7. REFERENCIASCarss DN, Bregnballe T, Keller TM, van Eer<strong>de</strong>n M (2003) Reducing the conflictbetween Cormorants Phalacrocorax carbo and fisheries on a pan-European scale:REDCAFE opens for business. Vogelwelt 124:299–307Carss, D. N., Marquiss, M. & Lau<strong>de</strong>r, A. W. 1997. Cormorant Phalacrocorax carbocarbo predation at a major trout fishery in Scotland. Supplemento alle Richerche diBiologia <strong>de</strong>lla Selvaggina, XXVI: 281-294.Davis,J. T. 1993. Solutions and recommendations (pan- el discussion). In: Price, I.M.and Nickum, J.G. 1995. Aquaculture and Birds: The Context for Controversy. ColonialWaterbirds, Vol. 18, Special Publication 1: The Double-Crested Cormorant: Biology,Conservation and Management (1995), pp. 33-45 Waterbird Society.Dempster T, Sanchez-Jerez P, Bayle-Sempere JT, Giménez-Casalduero F, Valle C(2002) Attraction of wild fish to seacage fish farms in the south-western MediterraneanSea: spatial and short-term variability. Mar Ecol Prog Ser 242: 237–252.Dempster T, Sanchez-Jerez P, Bayle-Sempere JT, Kingsford MJ (2004) Extensiveaggregations of wild fish at coastal seacage fish farms. Hydrobiologia 525(1-3):245–248Diamond, A.W. and Devlin, C.M. 2003. Seabirds as a indicators of changes in marineecosystems: Ecological monitoring on Machias Seal Island. Environmental Monitoringand Assessment 88: 153–175.Díaz Lopez, B., 2006b. Bottlenose dolphin (Tursiops truncatus) predation on a marinefinfish farm: some un<strong>de</strong>rwater observations. Aquat. Mammals 32, 305–310.Díaz Lopez, B., Bunke, M. and Bernal Shirai, J.A., 2008. Marine aquaculture offSardinia Island (Italy): Ecosystem effects evaluated through a trophic mass-balancemo<strong>de</strong>l. Ecological mo<strong>de</strong>lling 212 (2008) 292–303European Inland Fisheries Advisory Commission (EIFAC). 1988. Report of the EIFACWorking Party on prevention and control of bird predation in aquaculture and fisheriesoperations. Food and Agriculture Organization EIFAC Technical Paper 51:1- 79.73
7. REFERENCIASFerlin P, La Croix D (2000) Current state and future <strong>de</strong>velopment of aquaculture in theMediterranean region. World Aquac 31:20–23. In: Dempster, T., et al. 2002. Attractionof wild fish to sea-cage fish farms in the south-western Mediterranean Sea: spatial andshort-term temporal variability. Mar Ecol Prog Ser Vol. 242: 237–252.Fernán<strong>de</strong>z-Jover, D., Sánchez-Jerez, P., Bayle-Sempere, J. T., Valle, C. & Dempster, T.,2008. Seasonal patterns and diets of wild fish assemblages associated withMediterranean coastal fish farms. ICES Journal of Marine Science, 65.Fre<strong>de</strong>riksen, M.,Wanless, S., Harris, M. P., Rothery, P., andWilson, N. J., 2004. Therole of industrial fisheries and environmental change in the <strong>de</strong>cline of North Sea blackleggedkittiwakes. Journal of Applied Ecology, 41: 1129–1139.Furness, R. W. and Monaghan, P. 1987. Seabird ecology. Blackie, G<strong>las</strong>gow. 164 pp.Furness, R. W. & Camphuysen, C. J. 1997. Seabirds as monitors of the marineenvironment. ICES Journal of Marine Science, 54: 726–737.Furness, R.W. (1996). Interactions between seabirds and aquaculture in sea lochs, In:Aquaculture and wildlife interactions, Beveridge M.C.M.Genard, M., Masse, J. & Rigaud, C. 1993. Approche expérimentale <strong>de</strong> l’impact <strong>de</strong>soiseaux piscivores sur une pisciculture extensive littorale. Bulletin Français <strong>de</strong> la Pêcheet <strong>de</strong> la Pisciculture, n.o 29: 231-243.Gómez, J.A. Censos <strong>de</strong> <strong>aves</strong> acuáticas nidificantes (2007) e invernantes (2008) en loshumedales <strong>de</strong> la Comunidad Valenciana. Servicio <strong>de</strong> Biodiversidad.Harpaz, S. & Clark, L., 2006. Effects of addition of a bird repellent to fish diets on theirgrowth and bioaccumulation. Aquaculture Research, 37, 132-138.Hutchinson, C.D., 1989. Birds in Ireland. P & A D Poyser, Calton, 215 pp.74
7. REFERENCIASLekuona, J.M., 1998. Impacto <strong>de</strong>l cormorán gran<strong>de</strong> Phalacrocorax carbo sinensis, lagaviota reidora Larus ridibundus y la garza real Ar<strong>de</strong>a cinerea en una piscifactoría <strong>de</strong>Navarra en la época invernal. Ar<strong>de</strong>ola 45 (2): 171-182Lekuona, J.M., 2002. Food intake, feeding behaviour and stock losses of cormorants,Phalacrocorax carbo, and grey herons, Ar<strong>de</strong>a cinerea, at a fish farm in Arcachon Bay(Southwest France) during breeding and non-breeding season. Folia Zool. – 51(1): 23–34 (2002)Martínez-González, M.A., Sánchez-Villegas, A. & Faulin Fajardo, J., 2006.Bioestadística Amigable. Ed. Díaz <strong>de</strong> Santos.Milewski, I., 2001. Impacts of Salmon Aquaculture on the Coastal Environment: AReview. In: Tlusty, M.F., D.A. Bengston, H.O. Halvorson, S.D. Oktay, J.B. Pearce, andR.B. Rheault, Jr. (eds.) 2001. Marine Aquaculture and the Environment; A meeting forStakehol<strong>de</strong>rs in the Northeast. 166 - 197 pp. Cape Cod Press, Falmouth, Massachusetts.324 p.Mott, D. F. & Boyd, F. L., 2008. A Review of Techniques for Preventing CormorantDepredations at Aquaculture Facilities in the Southeastern United States. ColonialWaterbirds, Vol. 18, Special Publication 1: The Double-Crested Cormorant: Biology,Conservation and Management (1995), pp. 176-180 Published by: Waterbird SocietyMontevecchi,W. A., 1993. Birds as indicators of change in marine prey stocks. Instudies of seabirds: a review and recommendations. Barrett, R. T., Camphuysen, C. J.,Anker-Nilssen, T., Chardine, J. W., Furness, R. W., Garthe, S., Hu¨ppop, O., Leopold,M. F., Montevecchi, W. A., and Veit, R. R. 2007. ICES Journal of Marine Science, 64:1675–1691.Monaghanj, P., Uttleya, D. and Okill, J.D., 1989. Terns and san<strong>de</strong>els: seabirds asindicators of changes in marine fish populations. J. Fish Biol. (1989) 35 (SupplementA), 339-340Mullarney, K., Svensson, L., Zetterström, D. and Grant, P.J., 2003. Assirio and Alvim.75
7. REFERENCIASOlmos, V., Aragoneses, J., Echevarrias, J.L. & Oltra, R., 2000. Composición <strong>de</strong> <strong>las</strong>dieta e impacto <strong>de</strong>l Cormorán gran<strong>de</strong> (Phalacrocorax carbo sinensis) durante lainvernada en <strong>las</strong> Salinas <strong>de</strong> Santa Pola, Alicante, Este <strong>de</strong> España. Ar<strong>de</strong>ola 47 (2): 227-236.Olinto Branco, J., Reuter Braun, J.R. & Verani, J.R., 2001. Seasonal variation in theabundante of seabirds in areas of mariculture. Vol 44. N4: pp. 395-399Pérez-Hurtado, A. & Hortas, F., 1993. Actividad trófica <strong>de</strong> limíco<strong>las</strong> invernantes ensalinas y cultivos piscíco<strong>las</strong> <strong>de</strong> la Bahía <strong>de</strong> Cádiz. Doñana Acta Vertebrata 20: 103-123.Price, I.M. and Nickum, J.G. 1995. Aquaculture and Birds: The Context forControversy. Colonial Waterbirds, Vol. 18, Special Publication 1: The Double-CrestedCormorant: Biology, Conservation and Management (1995), pp. 33-45 WaterbirdSociety.Quick, N. J., Middlemas, S. J. & Armstrong, J. D., 2004. A survey of antipredatorcontrols at marine salmon farms in Scotland. Aquaculture 230: 169– 180Roycroft, D., Kelly, T.C. & Lewis, L.J., 2007. Behavioural interactions of seabirds withsuspen<strong>de</strong>d mussel longlines. Aquacult. Int. 15: 25-36.Roycroft, D., Kelly, T.C. & Lewis, L.J. 2004. Birds, seals and the suspension culture ofmussels in Bantry Bay, a non-seaduck area in Southwest Ireland. Estuar Coast Shelf Sci61:703–712Russell IC, Dare PJ, Eaton DR, Armstrong JA (1996) Assessment of the problem offish-eating birds in inland fisheries in England and Wales. Report to the Ministry ofAgriculture, Fisheries and Food (MAFF Project VC0104)Santamaría, J. & Gomis, E., 2006. Evolución <strong>de</strong>l censo <strong>de</strong> <strong>aves</strong> marinas invernantes enla costa <strong>de</strong> Alicante (2002-2006).Sly, E. and Frankenberg, E. (1995). The conflict between cormorants and fishery inIsrael. Corm. Res. Group Bull., 1: 45-46.76
7. REFERENCIASSchmidt, J. P. 1998. Deterring cormorants Phalacrocorax carbo sinensis with wi<strong>de</strong>spaced overhead wire grids at common carp Cyprinus carpio wintering ponds in theBavarian Oberpfalz, 1995-1996. Cormorant Research Group Bulletin, 3:16-21.Warke, G. M. A. & Day, K. R. 1995. Chances in abundance of cyprinid and percid preyaffect rate of predation by cormorants Phalacrocorax carbo carbo on salmon Salmosalar smolt in Northern Ireland. Ar<strong>de</strong>a, 83: 157-166.Zwarts, L., Blomert, A. & Hup, S. R. (1990a). Increase of feeding time in wa<strong>de</strong>rspreparing for spring migration from the Banc d´Arguin, Mauritania. Ar<strong>de</strong>a, 78:237-256.www.mapa.eswww.gva.eswww.seo.orgwww.naturalicante.es77