Fosforolación oxidativa I n°8
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Roberto Rustom y Matías San Martín Bioquímica General N°08 13/05/02<br />
Odontología II año U. de Chile<br />
‣ Contenidos:<br />
♦ La anatomía mitocondrial<br />
♦ Secuencia de transporte electrónico<br />
‣ Introducción:<br />
En una primera parte de la clase vamos a ver los componentes que participan en la fosforilación <strong>oxidativa</strong> y cómo<br />
actúan para la entrega de electrones al O 2 y la formación de ATP. Los elecctrones van a ser entregados por<br />
compuestos reducidos como NADH y FADH 2 .<br />
♦ Fosforilación Oxidativa:<br />
La fosforilación <strong>oxidativa</strong> es la culminación del metabolismo productor de energía en los organismos aeróbicos.<br />
Todos los pasos enzimáticos de la degradación <strong>oxidativa</strong> de glúcidos, grasas y aminoácidos en las células aeróbicas<br />
convergen en esta etapa final de la respiración celular, en la que los electrones fluyen desde intermedios<br />
catabólicos al 0 2 produciendo energía para la generación de ATP a partir del ADP y el P i . Así, las moléculas<br />
formadas en éstos procesos se van a reoxidar, generando energía para la síntesis de ATP.<br />
Éste es el proceso de transfusión de energía más importante, junto con la fotofosforilación, ya que son los<br />
procesos que sintetizan la mayor cantidad de ATP en los organismos aeróbicos.<br />
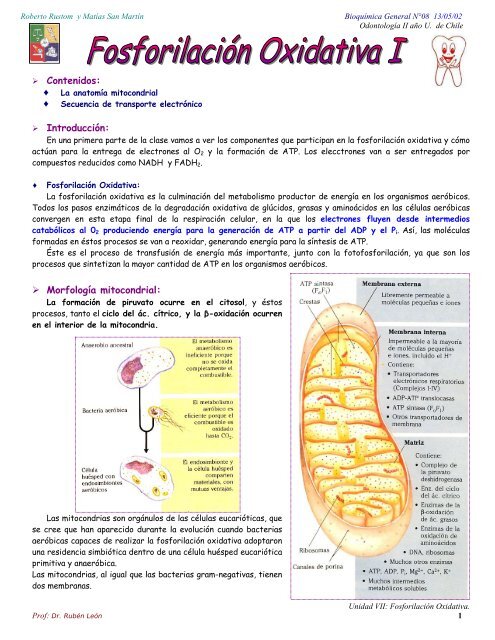
‣ Morfología mitocondrial:<br />
La formación de piruvato ocurre en el citosol, y éstos<br />
procesos, tanto el ciclo del ác. cítrico, y la β-oxidación ocurren<br />
en el interior de la mitocondria.<br />
Las mitocondrias son orgánulos de las células eucarióticas, que<br />
se cree que han aparecido durante la evolución cuando bacterias<br />
aeróbicas capaces de realizar la fosforilación <strong>oxidativa</strong> adoptaron<br />
una residencia simbiótica dentro de una célula huésped eucariótica<br />
primitiva y anaeróbica.<br />
Las mitocondrias, al igual que las bacterias gram-negativas, tienen<br />
dos membranas.<br />
Unidad VII: Fosforilación Oxidativa.<br />
Prof: Dr. Rubén León 1
Roberto Rustom y Matías San Martín Bioquímica General N°08 13/05/02<br />
Odontología II año U. de Chile<br />
La membrana mitocondrial externa es fácilmente permeable a pequeñas moléculas e iones; canales<br />
transmembrana compuestos por la proteína porina permiten que pasen fácilmente la mayoría de moléculas con una<br />
masa molecular de menos de 5 Kd. Existen algunas enzimas asociadas a la membrana externa que participan en<br />
procesos como la desaturación de ác. grasos, síntesis de fosfolípidos, y posee tb. algunas monoaminooxidasas que<br />
participan en el metabolismo de los diacilgliceroles.<br />
La membrana interna tiene muchas proteínas, que representan el 80% de la M. Interna, por lo que es<br />
probablemente la membrana biológica más rica en proteínas. ahora un 60% son transportadores de e - ordenados en<br />
cinco complejos multiproteicos, llamados complejo I, II, III, IV y V.<br />
Por esta característica es bastante permeable, sin embargo, posee una permeabilidad selectiva a la mayoría de<br />
moléculas pequeñas e iones, incluido el protón (H + ); las únicas especies que cruzan la membrana interna son<br />
aquéllas para las que existen proteínas transportadoras específicas. Esta membrana aloja los componentes de la<br />
cadena respiratoria y el complejo enzimático responsable de la síntesis de ATP.<br />
Debido a que la membrana interna tiene una permeabilidad selectiva, separa los intermedios y enzimas de las<br />
rutas metabólica citosólicas de los de los procesos metabólicos que se producen en la matriz. El piruvato, ácidos<br />
grasos y aminoácidos o sus derivados a cetoácidos son llevados por transportadores específicos a la matriz para<br />
poder acceder a la maquinaria del ciclo del ácido cítrico. De modo semejante, ADP y P, son transportados<br />
específicamente a la matriz al mismo tiempo que el ATP recién sintetizado es transportado al exterior.<br />
Recuérdese que la matriz mitocondrial, espacio acotado por la membrana interna, contiene:<br />
el complejo de la piruvato deshidrogenasa<br />
Las enzimas del ciclo del ácido cítrico-<br />
Las enzimas de la ruta de la β-oxidación de los ácidos grasos.<br />
Las enzimas de las rutas de oxidación de los aminoácidos<br />
Es decir, todas las rutas de oxidación de combustibles excepto la glucólisis que tiene lugar en el citosol.<br />
‣ Transportadores electrónicos de la cadena respiratoria:<br />
La cadena respiratoria mitocondrial consta de una serie de transportadores electrónicos, la mayoría proteínas<br />
integrales de membrana, con grupos prostéticos capaces de aceptar y donar uno o dos electrones. Cada componente<br />
de la cadena puede aceptar electrones del transportador precedente y transferirlos al siguiente en una secuencia<br />
específica.<br />
♦<br />
Existen cuatro tipos de transferencias electrónicas en los sistemas biológicos:<br />
1-. transferencia directa de electrones, tal como sucede en la reducción de Fe 3+ a Fe +2<br />
2-. Transferencia de un átomo de hidrógeno (H + + e - ).<br />
3-. Transferencia de un ion hidruro (: H - ) portador de dos electrones.<br />
4-. Combinación directa de un reductor orgánico con el oxígeno<br />
Los tres primeros tipos tienen lugar en la cadena respiratoria. Algunas de las reacciones de esta secuencia son<br />
transferencias de un electrón mientras que otras son transferencias de pares de electrones.<br />
Cualquiera que sea la forma, se utiliza el término equivalente de reducción para designar el equivalente de un<br />
electrón sencillo que se transfiere en una reacción de oxidación-reducción.<br />
Además del NAD y de las flavoproteínas antes descritas, hay otros tres tipos de grupos transportadores de<br />
electrones que funcionan en la cadena respiratoria.<br />
Unidad VII: Fosforilación Oxidativa.<br />
Prof: Dr. Rubén León 2
Roberto Rustom y Matías San Martín Bioquímica General N°08 13/05/02<br />
Odontología II año U. de Chile<br />
♦ Complejo I ó NADH deshidrogenasa<br />
Está formado por aprox. 25 unidades proteicas. Su masa es de<br />
aprox. 850 kd (kilodaltons).<br />
Posee como grupos prostéticos:<br />
Flavina mononucleótido (FMN)<br />
Fierro-azufre. Las proteínas<br />
que poseen como grupo<br />
prostético fierro-azufre se<br />
denominan<br />
proteínas<br />
ferrosulfuradas.<br />
Posee específicamente, al menos siete proteínas que poseen<br />
centros fierrosulfurados.<br />
Éste complejo se encuentra completamente embebido en la mb.<br />
interna de la mitocondria, y está orientado de tal manera que el<br />
sitio de fijación de NADH está mirando hacia la matriz<br />
mitocondrial para así poder interaccionar con cualquier NADH<br />
producido por cualquiera de las deshidrogenasa producidas en la<br />
matriz.<br />
Este complejo cuando oxida al NADH transfiere su par de equivalentes de reducción al FMN, luego a las proteínas<br />
ferrosulfuradas que se los transferirá finalmente a la ubiquinona 1 . Es importante acotar que este flujo de<br />
electrones desde el Complejo I al III va acompañado también de un movimiento de protones desde la matriz<br />
mitocondrial hacia el espacio intermembrana.<br />
♦ Complejo II ó succinato deshidrogenasa,<br />
Su masa es de aprox. 140 kilodaltons. Es mucho más pequeño que el complejo I.<br />
Posee a lo menos cuatro proteínas diferentes y 2 grupos prostéticos:<br />
Flavina adenina dinucleótido (FAD + )<br />
Fierro-azufre (Fe-S).<br />
Se piensa que el FAD + es quien va a recibir los electrones directamente del succinato, donde luego son transferidos<br />
a los centros Fe-S, quien se los traspasa, finalmente, a la ubiquinona.<br />
♦ Complejo III ó citocromo C ó coenzima Q reductasa:<br />
Su masa es de aprox. 250 Kd. Está compuesto por:<br />
Los citocromos b 562 y b 566.<br />
Citocromo c 1 y c.<br />
Una proteína ferro-sulfurada.<br />
Al menos otras seis subunidades proteicas.<br />
Posee como grupos prostéticos:<br />
Fierro-azufre<br />
El grupo Hem.<br />
Las proteínas están dispuestas de manera asimétrica: Cit. b entre la<br />
membrana mientras que la proteína Fe-S y el cit. c están por la cara<br />
externa. El flujo electrónico desde la UQ a los citocromos se denomina<br />
ciclo Q. Por último queda que gracias a la disposición asimétrica del<br />
complejo cuando la UQ se oxida y por ende reduce a 2 citocromos, (son<br />
2 porque cada uno puede aceptar sólo 1 e - ) se produce un flujo de<br />
protones hacia el espacio intermembrana.<br />
1 Existen fármacos como el amital, el antibiótico peiricidina A que inhiben el flujo electrónico desde estos centros Fe-S a la ubiquinona.<br />
Unidad VII: Fosforilación Oxidativa.<br />
Prof: Dr. Rubén León 3
Roberto Rustom y Matías San Martín Bioquímica General N°08 13/05/02<br />
Odontología II año U. de Chile<br />
♦ Complejo IV ó citocromo oxidasa<br />
Su masa es de aprox. 160 Kd. Contiene los citocromos a 1 y a 3 .<br />
Éstos están formados por dos grupos Hem unidos a diferentes<br />
regiones de la misma proteína (tiene entre 6 y 13 subunidades<br />
proteicas), y son, por lo tanto, espectral y funcionalmente distintos.<br />
Este complejo también contiene dos iones cobre, Cu A y Cu B, de<br />
gran importancia para la transferencia de electrones al O 2 , sin<br />
general radicales libres, es decir, intermedios incompletamente<br />
reducidos.<br />
Sus grupos prostéticos son:<br />
el ión Cu (en forma A y B)<br />
El grupo Hem. ⇒ Cit a 1 y a 3 .<br />
Además nuevamente encontramos que debido al flujo de elctrones<br />
se produce ttambién una salida de protones hacia el espacio<br />
intermembrana es, como los complejos I y III, una bomba de<br />
protones que contribuyen a la fuerza “protón-motriz”.<br />
♦ Complejo V ó complejo F 0- F 1 ó ATP sintetasa<br />
Es el responsable directo de la síntesis de ATP a partir de ATP + P i .<br />
Las subunidades proteicas que lo componen varían de acuerdo a la<br />
especie, pero el rango en mamíferos va desde 12 a 18 subunidades.<br />
La subunidad F 0 está completamente embebida dentro de la<br />
membrana interna mitocondrial, a modo de una proteína integral de<br />
membrana, además ella fija a F 1 , pues ésta es perisférica. La<br />
subunidad F 0 funciona como un canal protónico.<br />
La subunidad F 1 se encuentra orientada hacia la matriz<br />
mitocondrial. El F 1 aislado no puede sintetizar ATP a partir de ADP<br />
y P i y debido a que puede catalizar la reacción inversa, hidrólisis del<br />
ATP, a la enzima se le denominó originariamente F 1 ATPasa.<br />
La unidad F 1 para ser funcional necesita como mínimo:<br />
tres unidades de α y β,<br />
dos subunidades γ, δ y ε.<br />
En un comienzo fueron llamados “partículas elementales”, que se<br />
podían ver fácilmente en el microscopio electrónico al observar un<br />
corte de la mb. interna de la mitocondria.<br />
Como aclaración agregamos que este complejo también se le<br />
denomina ATP asa , pues también tiene la capacidad de hidrolizar ATP, pero su función biológica es, sin duda, la<br />
condensación de ATP<br />
♦ Ubiquinona ó coenzima Q, ó sencillamente UQ:<br />
Otro componente presente en la cadena de electrones y que participa activamente en ella es la ubiquinona o<br />
coenzima Q. No pertenece a ningún complejo en particular.<br />
Es una benzoquinona liposoluble, que contiene una larga cadena lateral isoprenoide y se mueve con bastante libertad<br />
en la mb. interna mitocondrial.<br />
Es capaz de captar los electrones de los complejos I y II, y los cede al complejo III.<br />
La ubiquinona puede aceptar:<br />
Un electrón transformándose en el radical semiquinona (UQH + ).<br />
O dos electrones formando ubiquinol (UQH 2 ).<br />
Unidad VII: Fosforilación Oxidativa.<br />
Prof: Dr. Rubén León 4
Roberto Rustom y Matías San Martín Bioquímica General N°08 13/05/02<br />
Odontología II año U. de Chile<br />
Al igual que las flavoproteínas transportadoras es, por tanto, capaz de actuar como unión entre un dador de dos<br />
electrones y un aceptor de un electrón. Debido a que la ubiquinona es al mismo tiempo pequeña e hidrofóbica puede<br />
difundir libremente a través de la membrana mitocondrial interna y puede hacer de lanzadera de equivalentes<br />
de reducción entre otros transportadores electrónicos de la membrana menos móviles.<br />
‣ Representación gráfica de los compuestos de acuerdo a su potencial de reducción:<br />
En la reacción global catalizada por la cadena respiratoria mitocondrial se transportan electrones desde el<br />
NADH, el succinato u otro dador electrónico primario a través de las flavoproteínas, ubiquinona, proteínas<br />
ferrosulfuradas y citocromos (casi todos los cuales están incrustados en la membrana interna) y finalmente al 0 2 . La<br />
secuencia en la que actúan los transportadores se ha deducido de diversas formas.<br />
Una forma sería con la utilización de diversos inhibidores que bloquean en diferentes puntos la cadena<br />
transportadora de electrones.<br />
Teóricamente podríamos orientar los potenciales de reducción de cada una de éstos complejos, y veríamos<br />
de qué forma se encuentran secuencialmente orientados en la mb. interna mitocondrial para movilizar los electrones<br />
hacia el oxígeno.<br />
Un transportador de electrones va a ceder sus electrones desde un menor potencial de reducción hacia<br />
uno mayor<br />
Uno puede esperar que los transportadores funcionen en orden de potenciales de reducción crecientes, porque los<br />
electrones tienden a fluir espontáneamente desde los transportadores de E’ 0 más bajo hacia los transportadores<br />
con E’ 0 más elevado.<br />
Cuando se estudió la composición de la mitocondria y de los complejos que participarían en la cadena<br />
transportadora de electrones, se determinaron los potenciales de reducción mostrados en la tabla.<br />
♦ Según la tabla la secuencia sería:<br />
El complejo I, completamente embebido en la mb. interna mitocondrial, va a ceder los electrones del NADH con<br />
un potencial de reducción de –0.4, luego el complejo II, con un potencial de reducción cercano a –0.2, quien recibe<br />
los electrones del succinato , ambos complejos a su vez se los ceden a la coenzima Q, con un potencial cercano a 0, y<br />
así para llegar al complejo III, el cual a través del citocromo c se los cede al complejo IV, el que va a reducir al<br />
oxígeno para transformarlo en agua, donde éste tiene un potencial mucho mayor.<br />
Los complejos I, III y IV van a liberar protones hacia el espacio intermembrana.<br />
Unidad VII: Fosforilación Oxidativa.<br />
Prof: Dr. Rubén León 5
Roberto Rustom y Matías San Martín Bioquímica General N°08 13/05/02<br />
Odontología II año U. de Chile<br />
‣ Características de los componentes de los complejos:<br />
♦ Características de las proteínas ferrosulfuradas:<br />
En las proteínas ferro-sulfuradas, el hierro está presente no en forma de hemo (como en los citocromos) sino en<br />
asociación con átomos de azufre inorgánico o con átomos de azufre de residuos de Cys de la proteína, o con<br />
los dos al mismo tiempo.<br />
Estos centros ferro-sulfurados (Fe-S) van desde estructuras sencillas con un solo átomo de Fe coordinado a cuatro<br />
residuos de Cys mediante el azufre de sus cadenas laterales a centros Fe-S más complejos con dos o cuatro átomos<br />
de Fe.<br />
Todas estas proteínas participan en transferencias de un sólo electrón en las que se oxida o reduce uno de<br />
los átomos de Fe. Con alguna excepción, las proteínas ferro-sulfuradas tienen potenciales de reducción estándar<br />
bajos, es decir, son buenos dadores de electrones.<br />
La dificultad de detectar e identificar proteínas ferro-sulfuradas a temperatura ambiente ha complicado mucho<br />
los estudios sobre su función en la transferencia de electrones, si bien está claro que diversas proteínas ferrosulfuradas<br />
juegan papeles cruciales.<br />
♦ Citocromos ⇒ Grupo Hem<br />
También poseen fierro en su composición, pero formando un grupo Hem razón de sus fuertes colores<br />
característicos de los citocromos.<br />
Existen tres clases de citocromos que se distinguen por diferencias en su espectro de absorción de la luz 2 y que<br />
se designan a, b y c. Se puede medir el espectro de luz que posee la proteína y así determinar si es una proteína con<br />
un grupo Hem de tipo a, b o c.<br />
Los grupos prostéticos Hem de los citocromos tienen 4 anillos pentaatómicos nitrogenados en una<br />
estructura cíclica llamada “PORFIRINA” 3 , que están coordinados al ión fierro en estado 3 + ó 2 + (reducido),<br />
nótese que éstas 2 posibilidades que puede presentar el hierro en éstos anillos, explican el porqué los<br />
citocromos sólo pueden transportar sólo 1 e - .<br />
2 El sistema de dobles enlaces conjugados (en rojo) del anillo de la porfirina explica la absorción de la luz visible por estos hemos.<br />
3 Recodar que éste anillo deriva del precursor Succinil-CoA, intermediario de una de las reacciones del ciclo de Krebs<br />
Unidad VII: Fosforilación Oxidativa.<br />
Prof: Dr. Rubén León 6
Roberto Rustom y Matías San Martín Bioquímica General N°08 13/05/02<br />
Odontología II año U. de Chile<br />
Hem a:<br />
Se encuentra en los citocromos a (del<br />
complejo IV ó citocromo oxidasa) y presentan<br />
además una larga cadena hidrocarbonada (cola<br />
isoprenoide) unida al hem a<br />
Hem b:<br />
Se encuentra presente en los citocromos b (del Complejo III).<br />
Este grupo Hem b se llama también Ferro-protoporfina IX, y también se<br />
encuentra en la hemoglbina (para poder transportar el oxígeno) y la<br />
mioglobina .<br />
Los grupos hemo de los citocromos a y b están unidos muy fuertemente,<br />
aunque no de manera covalente, a sus proteínas respectivas.<br />
Hem c<br />
Los grupos hemo de los citocromos del tipo c están unidos de<br />
forma covalente (a través de residuos de Cys) a la proteína del citocromo<br />
c.<br />
Éstos citocromos también van a aceptar y ceder un electrón a la vez.<br />
‣ En resumen:<br />
en la mb. interna mitocondrial, van a fluir, por una parte, los electrones desde succinato o o NDAH<br />
deshidrogenasa, por la ubiquinona hasta el O 2 para producir H 2 O; y por otra parte fluirán protones hacia el<br />
espacio intermembrana.<br />
En el citosol tenemos la producción de NADH y en la matriz mitocondrial la producción de NADH y<br />
FADH 2 en el ciclo de Krebs. El NADH y FADH 2 , van a ceder sus electrones a la cadena transportadora.<br />
El NADH va a ceder sus e. a la FMN que está en el complejo I, la que cederá sus e - uno a uno a los<br />
centros ferro-azufre. Secuencialmente, los centros ferro-azufre van a transferir 2 e - a la ubiquinona (UQ),<br />
formando ubiquinol, (UQH 2 ) quedando totalmente reducida.<br />
El FADH 2 “se libera” de sus protones en el complejo II, que está formado por la succinato<br />
deshidrogenasa (flavoproteína), única enzima del ciclo de Krebs que está unida a la mb. interna mitocodrial, y es<br />
aquí donde éstos electrones también van a pasar a los centros ferro-azufre del Com. II, los cuales cederán<br />
uno a uno los e. a la ubiquinona ( hay varias moléculas de ubiquinona en la mb.).<br />
Unidad VII: Fosforilación Oxidativa.<br />
Prof: Dr. Rubén León 7