You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
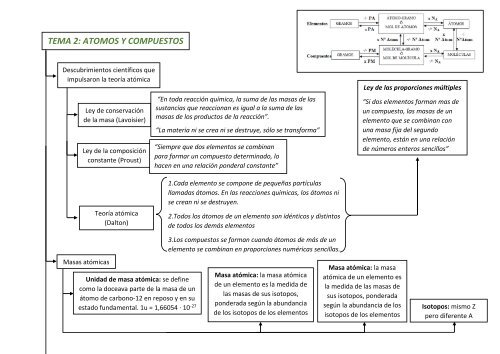
TEMA 2: ATOMOS Y COMPUESTOS<br />
Descubrimientos científicos que<br />
impulsaron la teoría atómica<br />
Ley de conservación<br />
de la masa (Lavoisier)<br />
Ley de la composición<br />
constante (Proust)<br />
“En toda reacción química, la suma de las masas de las<br />
sustancias que reaccionan es igual a la suma de las<br />
masas de los productos de la reacción”.<br />
“La materia ni se crea ni se destruye, sólo se transforma”<br />
“Siempre que dos elementos se combinan<br />
para formar un compuesto determinado, lo<br />
hacen en una relación ponderal constante”<br />
Ley de las proporciones múltiples<br />
“Si dos elementos forman mas de<br />
un compuesto, las masas de un<br />
elemento que se combinan con<br />
una masa fija del segundo<br />
elemento, están en una relación<br />
de números enteros sencillos”<br />
Teoría atómica<br />
(Dalton)<br />
1.Cada elemento se compone de pequeñas partículas<br />
llamadas átomos. En las reacciones químicas, los átomos ni<br />
se crean ni se destruyen.<br />
<strong>2.</strong>Todos los átomos de un elemento son idénticos y distintos<br />
de todos los demás elementos<br />
Masas atómicas<br />
Unidad de masa atómica: se define<br />
como la doceava parte de la masa de un<br />
átomo de carbono-12 en reposo y en su<br />
estado fundamental. 1u = 1,66054 · 10 -27<br />
Kg<br />
3.Los <strong>compuestos</strong> se forman cuando átomos de más de un<br />
elemento se combinan en proporciones numéricas sencillas.<br />
Masa atómica: la masa atómica<br />
de un elemento es la medida de<br />
las masas de sus isotopos,<br />
ponderada según la abundancia<br />
de los isotopos de los elementos<br />
Masa atómica: la masa<br />
atómica de un elemento es<br />
la medida de las masas de<br />
sus isotopos, ponderada<br />
según la abundancia de los<br />
isotopos de los elementos<br />
Isotopos: mismo Z<br />
pero diferente A
La tabla periódica<br />
Mol y nº de Avogadro<br />
Leyes volumétricas<br />
Gay-Lussac: los volúmenes de los<br />
gases que reaccionan entre sí,<br />
medidos en las mismas condiciones<br />
de presión y temperatura, guardan<br />
una relación constante que puede<br />
expresarse por números enteros<br />
sencillos; y el volumen del gas<br />
resultante es a lo sumo igual a la<br />
suma de los volúmenes de los<br />
gases que reaccionan<br />
Mol: cantidad de sustancia<br />
que contiene tantas<br />
entidades elementales<br />
como átomos hay en 0,012<br />
Kg de carbono-12<br />
Ley de Avogadro:<br />
Volúmenes iguales de<br />
gases diferentes en las<br />
mismas condiciones de<br />
presión y temperatura<br />
contiene el mismo<br />
número de moléculas<br />
v α n (nº de moleculas)<br />
Numero de Avogadro:<br />
6,022 · 10 23 mol -1<br />
Masa molar: masa de un mol<br />
de entidades elementales<br />
Tipos de <strong>compuestos</strong><br />
químicos y sus formulas<br />
Formula empírica: formula<br />
sencilla que contiene los<br />
diferentes átomos que se<br />
encuentran en la molécula.<br />
Sus números relativos se<br />
encuentran en los subíndices<br />
Formula molecular: basada en la<br />
formulación real del compuesto<br />
Formula estructural: nos da<br />
información de la forma y enlace<br />
en la que se unen los átomos<br />
Unidad formula:<br />
basada en el numero de<br />
cationes y aniones de<br />
un compuesto neutro lo<br />
más reducido posible
Problemas de formula empírica y molecular<br />
Fáciles: a partir de la composición porcentual del<br />
compuesto<br />
1. Se toma una muestra de 100g<br />
<strong>2.</strong> Se convierten las cantidades a moles<br />
3. Se dividen los resultados por el más pequeño<br />
de los mismos<br />
4. Se multiplican los subíndices resultantes por<br />
nº enteros para obtener resultados enteros<br />
Difíciles: a partir de los datos del análisis de<br />
los productos de la combustión<br />
CXHYOZ + O2 → CO2 + H2O<br />
1. De la cantidad de los productos obtengo<br />
los gramo de las sustancias no comunes<br />
<strong>2.</strong> De esos gramos, por diferencia, obtengo<br />
los gramos de la sustancia común en<br />
base a la cantidad de muestra<br />
3. Una vez obtenidos todos los gramos, se<br />
procede como en el ejemplo facil