Cours chimie INTRODUCTION A LA CHIMIE ORGANIQUE 11-mai ...
Cours chimie INTRODUCTION A LA CHIMIE ORGANIQUE 11-mai ...
Cours chimie INTRODUCTION A LA CHIMIE ORGANIQUE 11-mai ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Cours</strong> <strong>chimie</strong><br />
1 STL<br />
I / Qu’est ce que la <strong>chimie</strong> organique ?<br />
II/ Le carbone : Elément de base de la <strong>chimie</strong> organique.<br />
<strong>INTRODUCTION</strong> A <strong>LA</strong> <strong>CHIMIE</strong> <strong>ORGANIQUE</strong> <strong>11</strong>-<strong>mai</strong>-10<br />
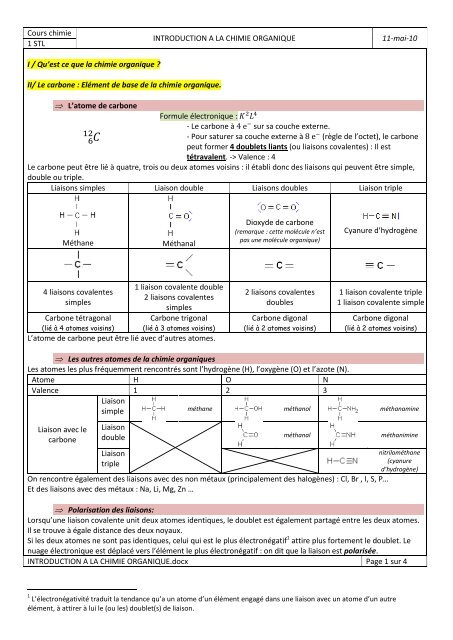
L’atome de carbone<br />
Formule électronique :<br />
- Le carbone à sur sa couche externe.<br />
- Pour saturer sa couche externe à (règle de l’octet), le carbone<br />
peut former 4 doublets liants (ou liaisons covalentes) : Il est<br />
tétravalent. -> Valence : 4<br />
Le carbone peut être lié à quatre, trois ou deux atomes voisins : il établi donc des liaisons qui peuvent être simple,<br />
double ou triple.<br />
Liaisons simples Liaison double Liaisons doubles Liaison triple<br />
Méthane<br />
4 liaisons covalentes<br />
simples<br />
Carbone tétragonal<br />
(lié à 4 atomes voisins)<br />
Méthanal<br />
1 liaison covalente double<br />
2 liaisons covalentes<br />
simples<br />
Carbone trigonal<br />
(lié à 3 atomes voisins)<br />
L’atome de carbone peut être lié avec d’autres atomes.<br />
Dioxyde de carbone<br />
(remarque : cette molécule n’est<br />
pas une molécule organique)<br />
2 liaisons covalentes<br />
doubles<br />
Carbone digonal<br />
(lié à 2 atomes voisins)<br />
Les autres atomes de la <strong>chimie</strong> organiques<br />
Les atomes les plus fréquemment rencontrés sont l’hydrogène (H), l’oxygène (O) et l’azote (N).<br />
Atome H O N<br />
Valence 1 2 3<br />
Liaison avec le<br />
carbone<br />
Liaison<br />
simple<br />
Liaison<br />
double<br />
Liaison<br />
triple<br />
méthane<br />
méthanol<br />
méthanal<br />
Cyanure d’hydrogène<br />
1 liaison covalente triple<br />
1 liaison covalente simple<br />
Carbone digonal<br />
(lié à 2 atomes voisins)<br />
On rencontre également des liaisons avec des non métaux (principalement des halogènes) : Cl, Br , I, S, P…<br />
Et des liaisons avec des métaux : Na, Li, Mg, Zn …<br />
méthanamine<br />
méthanimine<br />
nitrilométhane<br />
(cyanure<br />
d’hydrogène)<br />
Polarisation des liaisons:<br />
Lorsqu’une liaison covalente unit deux atomes identiques, le doublet est également partagé entre les deux atomes.<br />
Il se trouve à égale distance des deux noyaux.<br />
Si les deux atomes ne sont pas identiques, celui qui est le plus électronégatif 1 attire plus fortement le doublet. Le<br />
nuage électronique est déplacé vers l’élément le plus électronégatif : on dit que la liaison est polarisée.<br />
<strong>INTRODUCTION</strong> A <strong>LA</strong> <strong>CHIMIE</strong> <strong>ORGANIQUE</strong>.docx Page 1 sur 4<br />
1 L’électronégativité traduit la tendance qu’a un atome d’un élément engagé dans une liaison avec un atome d’un autre<br />
élément, à attirer à lui le (ou les) doublet(s) de liaison.
Exemples :<br />
L’atome de chlore est plus électronégatif. Il<br />
attire le doublet. Il présente donc un excès de<br />
charge négative noté – .<br />
L’atome d’hydrogène présente un déficit de<br />
charge négative que l’on note<br />
Si la différence d’électronégativité est trop importante, l’élément le plus électronégatif « accapare » le doublet, ce<br />
qui conduit à la formation d’un ion.<br />
Remarques :<br />
L’électronégativité de l’hydrogène est très proche de celle du carbone de sorte que la liaison C-H est très peu<br />
polarisée.<br />
La polarisation d’une liaison joue un rôle très important dans la réactivité des molécules. ( ce qui explique la faible<br />
réactivité des alcanes composées uniquement de liaisons non polarisées).<br />
III/ Représentation des molécules<br />
Formule brute<br />
Exemples :<br />
(urée) propanol<br />
La formule brute représente peu d’intérêt. On a besoin de connaitre la façon dont les atomes sont liés les uns aux<br />
autres<br />
Formule développée plane<br />
Elle montre l’ordre dans lequel les différents atomes sont liés ensembles.<br />
urée Propan-1-ol<br />
H<br />
O<br />
N C N<br />
H<br />
H<br />
H<br />
H H H<br />
C C C<br />
Remarque : la formule développée plane ne représente pas la géométrie réelle des molécules : c’est une<br />
représentation plane.<br />
Ces formules sont vites très lourdes à utiliser quand le nombre d’atomes devient conséquent.<br />
Formules semi-développées<br />
Les liaisons avec les atomes d’hydrogène n’apparaissent pas.<br />
urée Propan-1-ol<br />
Formules topologique<br />
Les liaisons C-C sont représentées par des segments.<br />
Les atomes de carbone ne sont pas indiqués.<br />
Seuls les atomes des groupes caractéristiques sont représentés<br />
urée Propan-1-ol<br />
<strong>INTRODUCTION</strong> A <strong>LA</strong> <strong>CHIMIE</strong> <strong>ORGANIQUE</strong>.docx Page 2 sur 4<br />
H<br />
H H<br />
H<br />
O<br />
H
IV / Diversités des chaines carbonées<br />
Lorsque les liaisons entre les atomes de carbone sont simples, la chaine est dite saturée.<br />
Lorsqu’il existe des liaisons carbone-carbone doubles ou triple la chaine est dite insaturée.<br />
Si la chaine se referme sur elle-même, la chaine est cyclique.<br />
Lorsqu’un atome de carbone est lié à 3 ou 4 atomes de carbone, la chaine est ramifiée.<br />
Exemples :<br />
Butane But-1-ène Cyclohexane méthylpropane<br />
Chaine saturée Chaine insaturée Chaine cyclique Chaine ramifiée<br />
On peut trouver associé dans une même molécule tous les éléments structuraux définis ici : linéaire, ramifié,<br />
cyclique, saturé, insaturé…<br />
Exemples :<br />
méthylpropène<br />
Chaine insaturée ramifiée Chaine insaturée ramifiée + cycle<br />
V / Groupements fonctionnels<br />
Hydrocarbures (Hc) (ce ne sont pas des groupes fonctionnels :<br />
Hc saturés Alcanes, cyclohexane<br />
Vitamine A (rétinol)<br />
C C<br />
Hc insaturés Alcènes, cycloalcènes C C<br />
Dérivés benzenique Arènes<br />
Fonctions monovalentes :<br />
Halogénures<br />
Organométalliques<br />
Alcools<br />
Thiols<br />
Phénols<br />
Ethers oxydes<br />
Amines<br />
Alcynes, cycloalcynes C C<br />
C X<br />
C M<br />
C OH<br />
C SH<br />
C O C<br />
C N<br />
<strong>INTRODUCTION</strong> A <strong>LA</strong> <strong>CHIMIE</strong> <strong>ORGANIQUE</strong>.docx Page 3 sur 4<br />
OH
Fonctions bivalentes<br />
Aldéhydes C H<br />
Cétones<br />
Fonctions trivalentes<br />
Acides carboxyliques<br />
Chlorures d’acide<br />
O<br />
C C<br />
O<br />
C O<br />
OH<br />
C O<br />
Cl<br />
Anhydride d’acide C O C<br />
O O<br />
Amides C N<br />
Nitriles C N<br />
Cette notion de fonction permet de classer les quelques 7 millions de composés connus à l’heure actuelle : ils se<br />
répartissent entre un nombre restreint de fonctions importantes.<br />
Il y a un grand contraste entre la réactivité du groupe fonctionnel et la relative inertie chimique de la chaine<br />
carbonée saturée.<br />
<strong>INTRODUCTION</strong> A <strong>LA</strong> <strong>CHIMIE</strong> <strong>ORGANIQUE</strong>.docx Page 4 sur 4<br />
O