Annexe: Tests de reconnaissance des ions
Annexe: Tests de reconnaissance des ions
Annexe: Tests de reconnaissance des ions
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Annexe</strong> :<br />
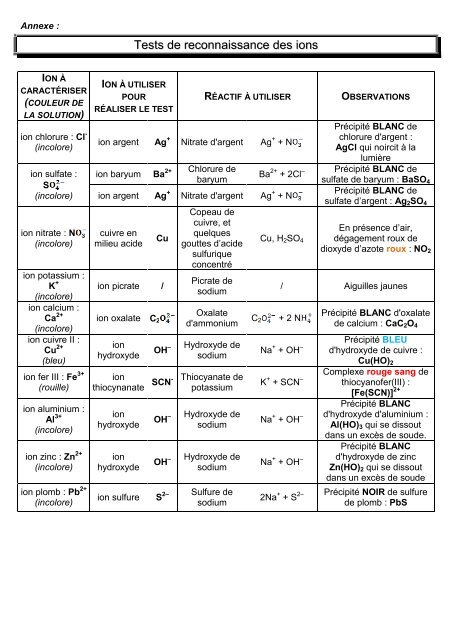
ION À<br />
CARACTÉRISER<br />
(COULEUR DE<br />
LA SOLUTION)<br />
ion chlorure : Cl -<br />
(incolore)<br />
ion sulfate :<br />
S<br />
(incolore)<br />
ion nitrate : N<br />
(incolore)<br />
ion potassium :<br />
K +<br />
(incolore)<br />
ion calcium :<br />
Ca 2+<br />
(incolore)<br />
ion cuivre II :<br />
Cu 2+<br />
(bleu)<br />
ion fer III : Fe 3+<br />
(rouille)<br />
ion aluminium :<br />
Al 3+<br />
(incolore)<br />
ion zinc : Zn 2+<br />
(incolore)<br />
ion plomb : Pb 2+<br />
(incolore)<br />
ION À UTILISER<br />
POUR<br />
RÉALISER LE TEST<br />
<strong>Tests</strong> <strong>de</strong> <strong>reconnaissance</strong> <strong>de</strong>s <strong>ions</strong><br />
ion argent Ag + Nitrate d'argent Ag + + N<br />
ion baryum Ba 2+<br />
RÉACTIF À UTILISER OBSERVATIONS<br />
Chlorure <strong>de</strong><br />
baryum<br />
Ba 2+ + 2Cl –<br />
ion argent Ag + Nitrate d'argent Ag + + N<br />
cuivre en<br />
milieu aci<strong>de</strong><br />
Cu<br />
ion picrate /<br />
ion oxalate C2<br />
ion<br />
hydroxy<strong>de</strong><br />
ion<br />
thiocynanate<br />
ion<br />
hydroxy<strong>de</strong><br />
ion<br />
hydroxy<strong>de</strong><br />
ion sulfure S 2–<br />
Copeau <strong>de</strong><br />
cuivre, et<br />
quelques<br />
gouttes d’aci<strong>de</strong><br />
sulfurique<br />
concentré<br />
Picrate <strong>de</strong><br />
sodium<br />
Cu, H2SO4<br />
Oxalate<br />
d'ammonium C2 + 2 N<br />
OH– Hydroxy<strong>de</strong> <strong>de</strong><br />
sodium<br />
SCN- Thiocyanate <strong>de</strong><br />
potassium<br />
OH– Hydroxy<strong>de</strong> <strong>de</strong><br />
sodium<br />
OH– Hydroxy<strong>de</strong> <strong>de</strong><br />
sodium<br />
Sulfure <strong>de</strong><br />
sodium<br />
Précipité BLANC <strong>de</strong><br />
chlorure d'argent :<br />
AgCl qui noircit à la<br />
lumière<br />
Précipité BLANC <strong>de</strong><br />
sulfate <strong>de</strong> baryum : BaSO4<br />
Précipité BLANC <strong>de</strong><br />
sulfate d’argent : Ag2SO4<br />
En présence d’air,<br />
dégagement roux <strong>de</strong><br />
dioxy<strong>de</strong> d’azote roux : NO2<br />
/ Aiguilles jaunes<br />
Na + + OH –<br />
K + + SCN –<br />
Na + + OH –<br />
Na + + OH –<br />
2Na + + S 2–<br />
Précipité BLANC d'oxalate<br />
<strong>de</strong> calcium : CaC2O4<br />
Précipité BLEU<br />
d'hydroxy<strong>de</strong> <strong>de</strong> cuivre :<br />
Cu(HO)2<br />
Complexe rouge sang <strong>de</strong><br />
thiocyanofer(III) :<br />
[Fe(SCN)] 2+<br />
Précipité BLANC<br />
d'hydroxy<strong>de</strong> d'aluminium :<br />
Al(HO)3 qui se dissout<br />
dans un excès <strong>de</strong> sou<strong>de</strong>.<br />
Précipité BLANC<br />
d'hydroxy<strong>de</strong> <strong>de</strong> zinc<br />
Zn(HO)2 qui se dissout<br />
dans un excès <strong>de</strong> sou<strong>de</strong><br />
Précipité NOIR <strong>de</strong> sulfure<br />
<strong>de</strong> plomb : PbS
<strong>Annexe</strong> :<br />
ION À<br />
CARACTÉRISER<br />
(COULEUR DE<br />
LA SOLUTION)<br />
ion chlorure : Cl -<br />
(incolore)<br />
ion sulfate :<br />
S<br />
(incolore)<br />
ion nitrate : N<br />
(incolore)<br />
ion potassium :<br />
K +<br />
(incolore)<br />
ion calcium :<br />
Ca 2+<br />
(incolore)<br />
ion cuivre II :<br />
Cu 2+<br />
(bleu)<br />
ion fer III : Fe 3+<br />
(rouille)<br />
ion aluminium :<br />
Al 3+<br />
(incolore)<br />
ion zinc : Zn 2+<br />
(incolore)<br />
ion plomb : Pb 2+<br />
(incolore)<br />
ION À UTILISER<br />
POUR<br />
RÉALISER LE TEST<br />
<strong>Tests</strong> <strong>de</strong> <strong>reconnaissance</strong> <strong>de</strong>s <strong>ions</strong><br />
ion argent Ag + Nitrate d'argent Ag + + N<br />
ion baryum Ba 2+<br />
RÉACTIF À UTILISER OBSERVATIONS<br />
Chlorure <strong>de</strong><br />
baryum<br />
Ba 2+ + 2Cl –<br />
ion argent Ag + Nitrate d'argent Ag + + N<br />
cuivre en<br />
milieu aci<strong>de</strong><br />
Cu<br />
ion picrate /<br />
ion oxalate C2<br />
ion<br />
hydroxy<strong>de</strong><br />
ion<br />
thiocynanate<br />
ion<br />
hydroxy<strong>de</strong><br />
ion<br />
hydroxy<strong>de</strong><br />
ion sulfure S 2–<br />
Copeau <strong>de</strong><br />
cuivre, et<br />
quelques<br />
gouttes d’aci<strong>de</strong><br />
sulfurique<br />
concentré<br />
Picrate <strong>de</strong><br />
sodium<br />
Cu, H2SO4<br />
Oxalate<br />
d'ammonium C2 + 2 N<br />
OH– Hydroxy<strong>de</strong> <strong>de</strong><br />
sodium<br />
SCN- Thiocyanate <strong>de</strong><br />
potassium<br />
OH– Hydroxy<strong>de</strong> <strong>de</strong><br />
sodium<br />
OH– Hydroxy<strong>de</strong> <strong>de</strong><br />
sodium<br />
Sulfure <strong>de</strong><br />
sodium<br />
Précipité BLANC <strong>de</strong><br />
chlorure d'argent :<br />
AgCl qui noircit à la<br />
lumière<br />
Précipité BLANC <strong>de</strong><br />
sulfate <strong>de</strong> baryum : BaSO4<br />
Précipité BLANC <strong>de</strong><br />
sulfate d’argent : Ag2SO4<br />
En présence d’air,<br />
dégagement roux <strong>de</strong><br />
dioxy<strong>de</strong> d’azote roux : NO2<br />
/ Aiguilles jaunes<br />
Na + + OH –<br />
K + + SCN –<br />
Na + + OH –<br />
Na + + OH –<br />
2Na + + S 2–<br />
Précipité BLANC d'oxalate<br />
<strong>de</strong> calcium : CaC2O4<br />
Précipité BLEU<br />
d'hydroxy<strong>de</strong> <strong>de</strong> cuivre :<br />
Cu(HO)2<br />
Complexe rouge sang <strong>de</strong><br />
thiocyanofer(III) :<br />
[Fe(SCN)] 2+<br />
Précipité BLANC<br />
d'hydroxy<strong>de</strong> d'aluminium :<br />
Al(HO)3 qui se dissout<br />
dans un excès <strong>de</strong> sou<strong>de</strong>.<br />
Précipité BLANC<br />
d'hydroxy<strong>de</strong> <strong>de</strong> zinc<br />
Zn(HO)2 qui se dissout<br />
dans un excès <strong>de</strong> sou<strong>de</strong><br />
Précipité NOIR <strong>de</strong> sulfure<br />
<strong>de</strong> plomb : PbS