Prépa agreg Interne 2004 Electrochimie
Prépa agreg Interne 2004 Electrochimie
Prépa agreg Interne 2004 Electrochimie
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Prépa</strong> <strong>agreg</strong> <strong>Interne</strong> <strong>2004</strong><br />
<strong>Electrochimie</strong><br />
<strong>Prépa</strong>ration industrielle du zinc.<br />
Données:<br />
Potentiels standard d'oxydoréduction E° à 25°C:<br />
Na + /Na : -2,71 V; Zn 2+ /Zn : -0,76 V; H + /H2, : 0 V;<br />
Fe 3+ /Fe 2+ : 0,68 V en milieu sulfurique; O2/H2O : 1,23 V;<br />
Cl2/CI - : 1,36 V; MnO - 4 /Mn 2+ :1,51 V.<br />
Charge de l'électron: -1,6 . 10 -19 C<br />
Constante d'Avogadro: 6,022 10 23 mol -1 .<br />
On trouvera ci après les courbes j - f (E) pour les systèmes considérés dans cette étude.<br />
La plupart du temps, l'étude des réactions d'oxydoréduction aux électrodes met en jeu non seulement<br />
des phénomènes thermodynamiques. mais aussi des phénomènes cinétiques. Afin d'appréhender ces<br />
derniers, on est amené à étudier la variation de la densité du courant j aux électrodes (respectivement ja<br />
et jc à l'anode et à la cathode) en fonction du potentiel de l'électrode, ceci pour un système donné<br />
(couple redox et électrode).<br />
Ainsi, si on étudie les deux couples redox Fe 3+ /Fe 2+ et MnO - 4 /Mn 2+ , en milieu sulfurique et sur<br />
électrode de platine, on obtient les courbes j - f (E) données ci après.<br />
1) Définir la surtension.<br />
2) L'un de ces deux systèmes est dit rapide, l'autre lent. Que veulent dire ces termes ? Quel est le<br />
système rapide ? Le système lent ?<br />
Actuellement, 80 % de la production de zinc se fait par électrolyse, procédé permettant d'obtenir une<br />
très grande pureté.<br />
L'électrolyse est effectuée dans une cellule comportant des anodes en plomb/dioxyde de plomb et des<br />
cathodes en aluminium de dimensions comparables. L'électrolyte est constitué par une solution purifiée<br />
et acidifiée de sulfate de zinc, solution préparée par traitements successifs du minerai. Il y a dégagement<br />
d'oxygène à l'anode et dépôt de zinc à la cathode.<br />
3) D'après les données thermodynamiques, que pouvait-on s'attendre à observer à la cathode ?<br />
4) Pourquoi observe-t-on un dépôt de zinc ?<br />
Industriellement, on a dans la cellule une densité de courant de l'ordre de 4 A dm -2 .<br />
5) Quelles sont alors les valeurs de la surtension anodique et de la surtension cathodique ?<br />
6) La chute ohmique de tension due aux électrodes et à l'électrolyte étant d'environ 200 mV, quelle<br />
tension faut-il appliquer aux bornes de la cellule ?
Électrolyse d'une solution d'acide sulfurique<br />
Ce fut historiquement la première électrolyse réalisée en 1800 par Nicholson et Carlisle un mois<br />
et demi après la découverte de la pile Volta.<br />
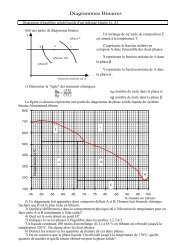
On donne les courbes intensité potentiel suivantes les deux électrodes sont en platine:<br />
4mA<br />
3?<br />
Volt<br />
1?<br />
2?<br />
L'acide sulfurique a une concentration de 0,005 mol/L est peut être considéré comme un diacide<br />
fort la résistance de la solution est de 0,50 ohms.<br />
Lorsque l'intensité qui circule dans l'électrolyseur est de 400 mA, la tension U à ces bornes est<br />
de 2 Volts.<br />
1) Indiquez dans cette différence de potentiel :la part ohmique, cinétique et thermodynamique.<br />
2) Complétez la figure 1 en identifiant les N°?<br />
Les gaz seront supposés parfaits, sous 1 bar et la température est de 20°C<br />
Un jeune professeur veut illustrer la loi d'avogadro-Ampère en réalisant l'électrolyse de l'eau<br />
.Pour cela il réalise l'électrolyse à U = 2 V de la solution précédente entre deux électrodes de fer (les<br />
dimensions des électrodes restent identiques). On considère que l'allure des courbes I = f(E) demeure<br />
quasiment inchangée.<br />
3) Pourquoi n'utilise t il pas de l'eau pure ?Quel terme composant U serait affecté par ce choix?<br />
4) Le changement de nature des électrodes peut affecter le résultat de l'électrolyse ;Quel terme<br />
composant U est concerné par ce changement?<br />
5) Par manque de temps il ne peut laisser se dérouler l'expérience que 5 min. Quel volume de H2<br />
peut il recueillir ?<br />
6) Il ne peut s'empêcher de constater que le rapport des volumes de H2 et O2 n'est pas 2, comme<br />
le prévoit la loi d'Avogadro-Ampère, mais à peu près 4 . Trouvez une explication à cette '"erreur".<br />
Données:<br />
o<br />
E O2 / H 2 O<br />
= 1,23V, R= 8,31 J.K -1 mol -1
Oxydation acide du Zinc.<br />
On donne les potentiels standards à 25°C des couples :<br />
Zn 2+ /Zn = -0,76V ; H + aq / H 2 = 0,00V ; Cl 2 /Cl- = 1,36V ; O 2<br />
/H 2<br />
O= 1,23V.<br />
1 faraday = 96500 C.mol -1 , la constante des gaz parfaits= 8,31 J.mol -1 .K -1<br />
On place du Zinc Ultra pur dans une solution d’acide chlorhydrique de pH=3. La pression des gaz sera<br />
toujours considérée égale à 1 bar.<br />
1) Quelles sont les espèces présentes dans le milieu susceptibles d’être oxydées ou réduites.<br />
2) Ecrire la réaction redox spontanée attendue.<br />
3) Exprimer le potentiel d’équilibre du couple H + aq / H 2<br />
4) Faites un schéma i= f(E) en disposant uniquement la branche cathodique et anodique effectivement<br />
mise en cause dans la réaction spontanée.<br />
5) Définissez la notion de surtension.<br />
On observe pas de réaction notable<br />
6) Expliquez et donnez un ordre de grandeur à la surtension cathodique.<br />
En touchant le zinc ultra pur avec un fil de platine, on observe un dégagement gazeux de H 2<br />
important<br />
sur le fil de platine.<br />
7) Expliquez brièvement ce phénomène<br />
Polarographie sur EDT de Pt<br />
On désire mesurer la concentration d’une espèce R en solution en utilisant une électrode à disque<br />
tournant de Pt. Pour cela on trace, en régime stationnaire, les courbes i = f(E) du système redox O/R<br />
pour différentes concentrations connues de l’espèce R avec la concentration en O = 0. La surface de<br />
l’électrode est de S =1 cm 2 . La vitesse de rotation de l’électrode est de 1000 tr mn –1 . Le système redox<br />
met en jeu le transfert d’un seul électron.<br />
Fig. 1: Courbes i = f(E) tracées pour différentes valeurs de la concentration en espèce R.<br />
1/ Expliquer la forme des courbes. Comment varie le palier limite avec la concentration en R au sein de<br />
la solution ?<br />
Augmente-t-il ou diminue-t-il avec cette concentration ?
2/ Les valeurs du courant mesurées sur les paliers limites d’oxydation sont: I dif<br />
en mA = 0.40, 0.80,<br />
1.20, 1.60 et 2.00.<br />
La Fig. 2 présente l’évolution de ce courant limite avec la concentration en R. Proposer une méthode<br />
graphique de mesure, sans calcul, de la concentration en R d’une solution.<br />
Métal passivable<br />
Fig. 2: Évolution du courant limite avec la concentration en espèce R.<br />
Fig: 1 Graphes i = f(E) pour une électrode de métal M et deux couples redox O 1<br />
/R 1<br />
et O 2<br />
/R 2<br />
.<br />
1/ Sur la Fig.1 sont tracées les courbes i = f(E) relatives au comportement électrochimique d’un métal et<br />
de deux couples redox de potentiels thermodynamiques. Le métal M est mis dans une solution contenant<br />
le couple O 1<br />
/R 1<br />
puis dans une seconde solution contenant le couple O 2<br />
/R 2<br />
. Dans quelle solution le métal<br />
M se corrodera-t-il le plus vite ? Justifier votre réponse.
2/ Certains métaux appelés métaux passivables présentent une courbe i = f(E). E en forme de cloche<br />
Fig. 2: Graphes i= f(E) pour une électrode de métal M passivable et deux couples redox O 1<br />
/R 1<br />
et O 2<br />
/R 2<br />
.<br />
Les courbes en pointillés sont les graphes des courbes i = f(E)E des deux couples redox. Elles peuvent<br />
être utilisées pour déterminer facilement la tension de corrosion du métal M.<br />
Sur la Fig. 2 sont tracées les courbes i = f(E) relatives au comportement électrochimique d’un métal<br />
passivable et de deux couples redox de potentiels thermodynamiques. Le métal M est mis dans une<br />
solution contenant le couple O 1<br />
/R 1<br />
puis dans une seconde solution contenant le couple O 2<br />
/R 2<br />
. Dans<br />
quelle solution le métal M se corrodera-t-il le plus vite ? Justifier votre réponse.<br />
3/ Que signifie "passivable?
L'électrode de Clark Agrégation <strong>Interne</strong> <strong>2004</strong><br />
Cette sonde est très utilisée en biologie pour la mesure des teneurs en dioxygène. Sa miniaturisation<br />
permet même son emploi in vivo<br />
électrolyte interne membrane de PTFE<br />
La concentration en dioxygène dissous est déterminée par électrolyse de la solution contenue dans la<br />
cellule.A la cathode de platine se produit la réduction du dioxygène et à l 'anode d 'argent I 'oxydation de<br />
l'argent. Une membrane de polytetrafluoroéthylène (PTFE), imperméable au solvant et aux ions mais<br />
perméable au dioxygène, sépare l'intérieur de la cellule de la solution extérieure étudiée et permet I<br />
'apport de dioxygène a la cathode. On applique une tension de 700 m V entre Ies deux électrodes pour<br />
réaliser l'électrolyse.<br />
Les courbes intensité-potentiel relatives aux deux systèmes étudiés sont données ci-dessous:<br />
1. Ecrire les équations des reactions anodique et cathodique. Comment évolue le pH à l'intérieur de la<br />
cellule ?<br />
2. Définir Ie terme "surtension". Que peut on dire, du point de vue cinétique, de chacun des systèmes<br />
intervenant dans cette électrolyse ?<br />
Tension d'électrolyse.<br />
3. Justifier la valeur choisie pour la tension d'électrolyse à l'aide des courbes intensite-potentiel fournies.<br />
4. Pourquoi la tension d`electrolyse doit elle rester notablement inférieure a 1 Volt ?<br />
5. On considère une réaction électrochimique écrite: Red -> Ox + n e - .<br />
Définir la vitesse de réaction pour une réaction d'avancement ξ se déroulant sur une électrode de<br />
surface S.<br />
Donner la relation entre l'intensité i et la vitesse de réaction<br />
6. Le courant de réduction tend vers une limite. Quelle est l'origine de ce phénomène? Pourquoi ne<br />
l'observe-t-on pas pour les autres branches des deux courbes ?
L'intensité du courant limite de réduction a pour expression:<br />
i lim = −<br />
4.S.D m .K O m[ O 2]<br />
2<br />
(S est la surface de la cathode D m<br />
et K m<br />
sont respectivement le coefficient de diffusion de O 2<br />
a travers la<br />
membrane et la constante de solubilité de O 2<br />
dans la membrane, δ m l'épaisseur de la membrane et O 2<br />
la concentration de la solution extérieure en dioxygène.)<br />
7. En déduire la nature de l'étape limitant ici l'intensité du courant. Que peut-on dire alors de la<br />
concentration en dioxygène dans la cellule, en régime stationnaire ?<br />
8. En utilisant la première loi de Fick, r<br />
J = −D mO<br />
2 .grad O 2 [ ], proposer une démonstration de l'expression<br />
de l'intensité du courant limite.<br />
δ m<br />
[ ]