L'allèle de résistance CCR5Î32 - Evolution of life
L'allèle de résistance CCR5Î32 - Evolution of life
L'allèle de résistance CCR5Î32 - Evolution of life
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
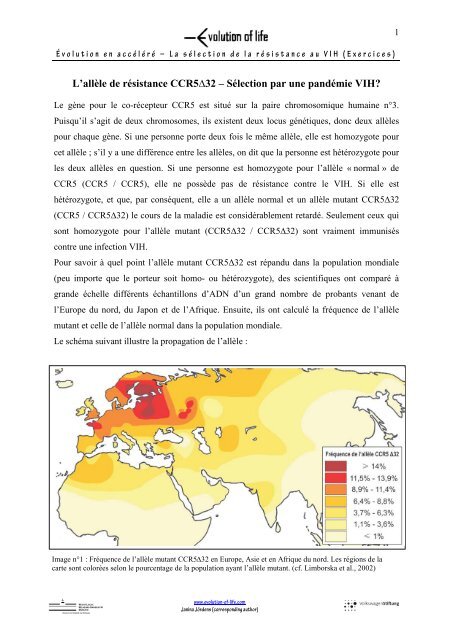
Évolution en accéléré – La sélection <strong>de</strong> la résistance au VIH (Exercices)1L’allèle <strong>de</strong> résistance CCR5∆32 – Sélection par une pandémie VIH?Le gène pour le co-récepteur CCR5 est situé sur la paire chromosomique humaine n°3.Puisqu’il s’agit <strong>de</strong> <strong>de</strong>ux chromosomes, ils existent <strong>de</strong>ux locus génétiques, donc <strong>de</strong>ux allèlespour chaque gène. Si une personne porte <strong>de</strong>ux fois le même allèle, elle est homozygote pourcet allèle ; s’il y a une différence entre les allèles, on dit que la personne est hétérozygote pourles <strong>de</strong>ux allèles en question. Si une personne est homozygote pour l’allèle « normal » <strong>de</strong>CCR5 (CCR5 / CCR5), elle ne possè<strong>de</strong> pas <strong>de</strong> résistance contre le VIH. Si elle esthétérozygote, et que, par conséquent, elle a un allèle normal et un allèle mutant CCR5∆32(CCR5 / CCR5∆32) le cours <strong>de</strong> la maladie est considérablement retardé. Seulement ceux quisont homozygote pour l’allèle mutant (CCR5∆32 / CCR5∆32) sont vraiment immuniséscontre une infection VIH.Pour savoir à quel point l’allèle mutant CCR5Δ32 est répandu dans la population mondiale(peu importe que le porteur soit homo- ou hétérozygote), <strong>de</strong>s scientifiques ont comparé àgran<strong>de</strong> échelle différents échantillons d’ADN d’un grand nombre <strong>de</strong> probants venant <strong>de</strong>l’Europe du nord, du Japon et <strong>de</strong> l’Afrique. Ensuite, ils ont calculé la fréquence <strong>de</strong> l’allèlemutant et celle <strong>de</strong> l’allèle normal dans la population mondiale.Le schéma suivant illustre la propagation <strong>de</strong> l’allèle :Image n°1 : Fréquence <strong>de</strong> l’allèle mutant CCR5∆32 en Europe, Asie et en Afrique du nord. Les régions <strong>de</strong> lacarte sont colorées selon le pourcentage <strong>de</strong> la population ayant l’allèle mutant. (cf. Limborska et al., 2002)www.evolution-<strong>of</strong>-<strong>life</strong>.comJanina Jör<strong>de</strong>ns (corresponding author)
Évolution en accéléré – La sélection <strong>de</strong> la résistance au VIH (Exercices)2Exercices1. Décrivez le schéma <strong>de</strong> propagation <strong>de</strong> l’allèle mutant CCR5∆32 sur la carte.2. Après constat <strong>de</strong> la répartition <strong>de</strong> l’image n°1, <strong>de</strong> quelle manière la propagation <strong>de</strong>l’infection VIH semble évoluer et comment se répercutera-t-elle sur la carte?3. Comparez le schéma <strong>de</strong> propagation <strong>de</strong> l’allèle résistant au VIH (image n°1) avec lapropagation <strong>de</strong>s infections VIH dans le mon<strong>de</strong> (image n°2) –surtout en Europe et enAfrique. Que remarquez-vous ? L’observation correspond-elle à vos attentes ?Image n°2 : Propagation géographique <strong>de</strong>s infections VIH dans le mon<strong>de</strong>. La coloration correspond aupourcentage <strong>de</strong>s personnes infectées par le VIH (env. 39,5 mio en 2006) relative à la population totale <strong>de</strong> chaquepays (OMS) © WHO 2009, all rights reserved.4. Les scientifiques ne supposent pas qu’il s’agit d’une adaptation à la pandémie VIHprédominante. Pourquoi une telle hypothèse serait-elle improbable ?www.evolution-<strong>of</strong>-<strong>life</strong>.comJanina Jör<strong>de</strong>ns (corresponding author)
Évolution en accéléré – La sélection <strong>de</strong> la résistance au VIH (Exercices)3Quoi alors, si ce n’est pas le VIH?Certains scientifiques attribuent la forte propagation <strong>de</strong> l‘allèle mutant à un autre événementdévastateur. Une épidémie par exemple qui utilise une porte d’entrée qui ressemble à celledont le VIH se sert pour pénétrer la cellule humaine : La protéine CCR5 intacte. Desmutations sur ce gène, et ainsi une protéine défectueuse, auraient éventuellement protégé unepetite quantité <strong>de</strong> personnes <strong>de</strong> l’infection. Cela leur aurait procuré un avantage <strong>de</strong> survieconsidérable et <strong>de</strong> plus ce phénomène <strong>de</strong> sélection aurait permis une propagationrégionalement limitée mais très rapi<strong>de</strong>. Certaines hypothèses décrivent non seulement la peste(Yersinia pestis) mais aussi la variole (Variola major) comme pathogène responsable <strong>de</strong> cettesélection. Duncan et al. (2005) refusent cependant cette hypothèse et ont conçu une autre.Dans leurs simulations, ils supposent pour l’année 13.000 une fréquence allélique <strong>de</strong> départ <strong>de</strong>5x10 -5 pour l’allèle mutant CCR5Δ32. Dans l’Europe d’aujourd’hui la fréquence <strong>de</strong> cet allèleest d’environ 10%.• La mort noire dont on croyait l’époque qu’il s’agissait <strong>de</strong> la peste bubonique, tuaitdans les années 1347 à 1350 environ 40% <strong>de</strong> la population européenne. Cettepandémie unique n’aurait cependant augmenté la fréquence <strong>de</strong> l’allèle mutant qu’à10 -4 (si la moitié <strong>de</strong> la population meurt, il y a duplication <strong>de</strong>s individus résistants etprotégés). Quelques scientifiques avancent l’hypothèse que <strong>de</strong>s épidémies <strong>de</strong> la pestebubonique réapparaissaient à peu près tous les 10 ans pendant une durée <strong>de</strong> 400 ans,tuant régulièrement une bonne partie <strong>de</strong> la population. Cette théorie a pourtant étéréfutée par <strong>de</strong>s modèles mathématiques. De plus, on sait aujourd’hui que la bactérieYersinia pestis, pathogène <strong>de</strong> la peste bubonique, ne se sert pas du récepteur CCR5pour entrer dans les cellules et par conséquent ne peut être facteur sélectif pour cetallèle.• Une autre hypothèse (entre autre <strong>de</strong> Galvani et Slatkin, 2003) d’après laquelle <strong>de</strong>sépidémies <strong>de</strong> la variole pourraient être responsable <strong>de</strong> la forte augmentation <strong>de</strong> lafréquence allélique ayant entre 1347 et 1970 à peu près tous les cinq ans un pointculminant <strong>de</strong> mortalité. Pour Duncan et ses collègues (2005) cette hypothèse n’estcependant pas valable parce que ce n’était qu’en 1628 qu’une forme nocive <strong>de</strong> lavariole apparut en Angleterre. Avant ce temps-là, la variole n’était pas une maladienocive qu’on <strong>de</strong>vait vraiment prendre au sérieux. La mortalité annuelle à Londres <strong>de</strong>l’année 1710 ne dépassait pas les 1000 personnes. À partir <strong>de</strong> 1750 on se protégeaitdéjà contre la variole à l’ai<strong>de</strong> <strong>de</strong> la « variolation » et à partir <strong>de</strong> 1800 on commençait àwww.evolution-<strong>of</strong>-<strong>life</strong>.comJanina Jör<strong>de</strong>ns (corresponding author)
4Évolution en accéléré – La sélection <strong>de</strong> la résistance au VIH (Exercices)vacciner la population contre la variole. Déjà vers 1900, la variole avait disparu <strong>de</strong>l’Europe. Contrairement au résultat <strong>de</strong> la simulation décrite plus haut, et même si levirus se sert du récepteur CCR5 en tant que porte d’entrée pour pénétrer dans la cellulehôte, la variole ne peut pas avoir eu une influence suffisamment importante sur lafréquence allélique du gène mutant.Duncan et al. (2005) supposent que le pathogène qui a causé la mort noire et les épidémiesrégulières, n’était pas la bactérie Yersinia pestis et en conséquence pas la peste bubonique,mais plutôt un virus inconnu qui déclenche la fièvre hémorragique et qui est transmisdirectement <strong>de</strong> homme en homme. Une maladie virale alors dont la forme la plus connue estla fièvre Ébola, atteignant une mortalité <strong>de</strong> 100%. Un virus qui se sert comme par exemple lavariole ou le VIH du CCR5 comme porte d’entrée dans les cellules du système immunitairehumain, pourrait – selon Duncan et ses collègues – avoir déclenché les épidémies <strong>de</strong> l’Europedu Moyen Âge. De plus, ce virus peut être la cause pour l’augmentation considérable <strong>de</strong> lafréquence <strong>de</strong> l’allèle mutant dans certaines régions (voir simulation image n°3). Duncanappelle cette maladie la « peste hémorragique ».5. Décrivez le développement simulé <strong>de</strong> la fréquence allélique sur l’image n°3.Fréquence <strong>de</strong> l'allèle CCR5D32 en Europe (p)0,120,100,080,060,040,020,001000 1200 1400 1600 1800 2000annéeImage n°3: Simulation mathématique du développement <strong>de</strong> la fréquence <strong>de</strong> l’allèle mutantCCR5Δ32 en Europe (cf. Duncan et al., 2005).6. Pendant plus <strong>de</strong> 320 ans (1347 – 1670), la peste hémorragique exerçait une pression <strong>de</strong>sélection constante sur l’allèle mutant CCR5Δ32. En Scandinavie, en Pologne et enRussie, les épidémies continuaient à éclater jusqu’en 1800.www.evolution-<strong>of</strong>-<strong>life</strong>.comJanina Jör<strong>de</strong>ns (corresponding author)
5Évolution en accéléré – La sélection <strong>de</strong> la résistance au VIH (Exercices)a. Concernant la propagation <strong>de</strong> l’allèle mutant, quel phénomène <strong>de</strong> l’évolutionexpecterait-on si la pression <strong>de</strong> sélection par la peste hémorragique étaitsupprimée ?b. Pourquoi la fréquence <strong>de</strong> l‘allèle mutant se stabilise-t-elle à partir <strong>de</strong> 1670 (voirimage n°3) ?c. Dans quelles régions du mon<strong>de</strong> (image n°3) la fréquence est-elle extrêmementélevée ?Comment s’explique cette fréquence par rapport au reste <strong>de</strong> l’Europe ?Bibliographie & liens:Duncan, S. R., S. Scott, et al. (2005). "Reappraisal <strong>of</strong> the historical selective pressures for the CCR5-Δ32 mutation." Journal <strong>of</strong> Medical Genetics 42(3): 205-208.Limborska, S. A., O. P. Balanovsky, et al. (2002). "Analysis <strong>of</strong> CCR5Δ32 Geographic Distributionand Its Correlation with Some Climatic and Geographic Factors." Human Heredity 53: 49-54.World Health Organization (2009):http://gamapserver.who.int/mapLibrary/Files/Maps/Global_HIVprevalence_2007.pngwww.evolution-<strong>of</strong>-<strong>life</strong>.comJanina Jör<strong>de</strong>ns (corresponding author)
Évolution en accéléré – La sélection <strong>de</strong> la résistance au VIH (Exercices)Solutions:Exercice 1:Fossé entre le nord et le sud ainsi qu’une baisse <strong>de</strong> l’ouest à l’est. Centre <strong>de</strong> la propagationdans l’Europe du nord (jusqu’à 14%), tandis que l’allèle n’apparaît quasiment pas dans lespays africains et dans les régions <strong>de</strong> l’Asie <strong>de</strong> l’est.Exercice 2:Etant le pays d’origine du VIH, le virus existe <strong>de</strong>puis plus long temps en Afrique qu’ailleursdans le mon<strong>de</strong>. A cause <strong>de</strong> la pression <strong>de</strong> sélection intensive causée par une infection VIH, ons’attendrait à y trouver également un point capital <strong>de</strong> la fréquence <strong>de</strong> l’allèle mutant(adaptation à la pression <strong>de</strong> sélection).Exercice 3:L’allèle „résistant“ apparaît le plus souvent dans <strong>de</strong>s régions où le taux d’infection par leVIH est plus bas qu’ailleurs. Puisque l’allèle mutant n’apparaît pas dans la populationafricaine, on suppose que la mutation et sa propagation ont eu lieu seulement après quel’homme ait quitté l’Afrique pour colonisé le continent européen et d’autres parties <strong>de</strong> laterre. Cette migration a eu lieu il y a environ 200.000 à 130.000 ans.Exercice 4:Lapse <strong>de</strong> temps trop court pour une adaptation à une pandémie VIH. Le virus n’existe que<strong>de</strong>puis le début du 20é siècle. Puisque le taux d’évolution chez l’homme est petit et le temps<strong>de</strong> génération assez long, l’homme a besoin <strong>de</strong> beaucoup plus <strong>de</strong> temps pour développer uneadaptation à une nouvelle pression <strong>de</strong> sélection.Exercice 6a:Dérive génétique.On s’attendrait à ce que la fréquence <strong>de</strong> l’allèle mutant rediminuerait petit à petit parce qu’iln’y a plus <strong>de</strong> pression <strong>de</strong> sélection influençant cette qualité. La possession <strong>de</strong> cette qualité nereprésente plus un avantage sélectif. C’est pourquoi la dérive génétique <strong>de</strong>vrait mener à unebaisse <strong>de</strong> fréquence pour cet allèle.Exercice 6b:Ce n’était qu‘à partir du 17é et 18é siècle que la variole <strong>de</strong>venait une maladie nocive. C’estdonc elle qui continuait à exercer une légère pression <strong>de</strong> sélection sur l’allèle mutant après ladisparition <strong>de</strong> la peste hémorragique en Europe. C’est pourquoi la fréquence allélique restaità peu près constante.Exercice 6c:En Scandinavie, en Russie et en Pologne, la pression <strong>de</strong> sélection faisait plus long temps effetsur l’allèle mutant (jusqu’au 19é siècle) puisque la peste hémorragique existait plus longtemps dans ces régions. C’est pourquoi l’allèle mutant y était plus long temps favorisé.6www.evolution-<strong>of</strong>-<strong>life</strong>.comJanina Jör<strong>de</strong>ns (corresponding author)