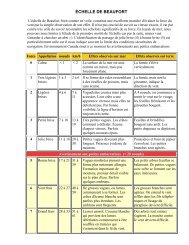
L'eau de Javel - Pistes
L'eau de Javel - Pistes
L'eau de Javel - Pistes
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Chimie dans la buan<strong>de</strong>rieQue peut-on dire du nombre <strong>de</strong> moles <strong>de</strong> I 2 présentes dans 25 mL <strong>de</strong> solution titrée, connaissantle nombre <strong>de</strong> moles <strong>de</strong> S 2 O 3 2- ajoutées au point d’équivalence ?Quel rapport y a-t-il entre le nombre <strong>de</strong> moles <strong>de</strong> ClO - et celui <strong>de</strong> I 2 présentes dans 25 mL d’eau<strong>de</strong> <strong>Javel</strong> avant l’ajout <strong>de</strong> l’excès <strong>de</strong> KI ?Connaissant le nombre <strong>de</strong> moles <strong>de</strong> ClO - présentes dans 25 mL, déduire le nombre <strong>de</strong> moles <strong>de</strong>ClO - présentes dans 1000 mL d’eau <strong>de</strong> <strong>Javel</strong>.Qu’entend-on par molarité d’une solution ?Note : la solution d’eau <strong>de</strong> <strong>Javel</strong> titrée était diluée 10 fois.© UCL (Université catholique <strong>de</strong> Louvain) / PISTES (Projets d’Intégration <strong>de</strong>s Sciences et <strong>de</strong>s Technologies enEnseignement au Secondaire) / (Droits <strong>de</strong> reproduction autorisés avec la mention <strong>de</strong> la source)