PROGETTO DI EDUCAZIONE AMBIENTALE ... - ISISS Morciano
PROGETTO DI EDUCAZIONE AMBIENTALE ... - ISISS Morciano
PROGETTO DI EDUCAZIONE AMBIENTALE ... - ISISS Morciano
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>PROGETTO</strong> <strong>DI</strong> <strong>EDUCAZIONE</strong> <strong>AMBIENTALE</strong><br />
ANNO SCOLASTICO 2011 - 2012<br />
COOR<strong>DI</strong>NATRICE DEL <strong>PROGETTO</strong>:<br />
Prof. ssa Amalia <strong>DI</strong> PUMPO<br />
CONOSCIAMO IL FIUME CONCA<br />
ANALISI DELLE ACQUE SUPERFICIALI<br />
IN UN TRATTO DELL’ALVEO<br />
NEI PRESSI DELL’ISTITUTO SCOLASTICO.<br />
A CURA DEGLI INSEGNANTI <strong>DI</strong>PARTIMENTO <strong>DI</strong> SCIENZE:<br />
• Demetrio Bastianelli<br />
• Marco Malavolta<br />
• Mirko Maffei<br />
• Teresa Cavaliere<br />
• Stefania Cancellieri<br />
CONSULENZA SCIENTIFICA ED ORGANIZZAZIONE:<br />
Prof. Demetrio BASTIANELLI - Prof. Marco MALAVOLTA - Prof. Mirco MAFFEI<br />
CONSULENTI TECNICI <strong>DI</strong> LABORATORIO:<br />
Prof. Mirco MAFFEI - Prof.ssa Stefania CANCELLIERI
1 – ILLUSTRAZIONE DEL <strong>PROGETTO</strong><br />
2 – CONOSCIAMO IL FIUME CONCA<br />
2.1 – Aspetti fisici e geologici<br />
2.2 – Aspetti naturalistici<br />
3 – INQUADRAMENTO DELL’AREA D’INDAGINE<br />
IN<strong>DI</strong>CE<br />
4 – I PARAMETRI CHIMICO-FISICI E LE TECNICHE <strong>DI</strong> MISURA<br />
5 – L’USCITA <strong>DI</strong>DATTICA - BREVE REPORTAGE A CURA DELLE CLASSI<br />
6 – I RISULTATI<br />
7 - CONCLUSIONI<br />
1
1 ILLUSTRAZIONE DEL <strong>PROGETTO</strong><br />
Il progetto nasce per cercare di far conoscere meglio gli aspetti naturalistici dell’ambiente che ci circonda, con<br />
particolare riferimento all’ambiente fluviale del Fiume Conca, posto in vicinanza del nostro plesso scolastico.<br />
Gli insegnanti del dipartimento disciplinare di Scienze Intergrate (Scienze della Terra/Biologia e Chimica) ed i<br />
Coordinatori del progetto ambiente, hanno pensato dunque di porre attenzione sulla qualità ambientale del fiume,<br />
utilizzando osservazioni, laboratori e strumenti dell’Istituto.<br />
Il lavoro parte anche dall’esigenza di trovare forme alternative di didattica scientifica, nel ricercare con maggior<br />
efficacia forme di sapere alternative e nel tentare di decodificare ciò che si intende normalmente per “metodo di<br />
studio”, spesso chiamato in causa a dare nome alle forme più svariate di difficoltà scolastica.<br />
Per questo motivo si è scelto di scomporre il processo di apprendimento in successioni di tappe, “controllabili” e<br />
“verificabili”, capaci di aprire nuove forme di autoconsapevolezza per lo studente.<br />
Nel corso dell’elaborazione dell’esperienza, abbiamo cercato di mettere a fuoco anche le coordinate teoriche nel<br />
cui ambito si muovono gli interventi più interessanti della didattica. Il lavoro ha cercato di ribaltare la prospettiva più<br />
classica della metodologia didattica: anziché occuparsi di quello che noi dobbiamo fare per insegnare, ci si pone<br />
qui il problema di quello che devono fare i nostri alunni per imparare.<br />
Pertanto lo scopo principale del lavoro è stato soprattutto quello di “insegnare ad imparare”. Imparare ad imparare<br />
è un patrimonio di abilità relativo al “saper essere” ed investe il processo di sviluppo di ogni persona.<br />
2
2.1 – Aspetti fisici e geologici<br />
2 CONOSCIAMO IL FIUME CONCA<br />
Il Fiume Conca nasce sul versante del Monte Carpegna, a 1415 m. di altitudine in località Bocca della Conca. Ha<br />
una lunghezza di 44.50 chilometri ed il suo bacino si estende per 164 kmq.. Il fiume discende inizialmente come<br />
piccolo ruscello fino a raggiungere la piana di Mercatino Conca, dove il suo letto si allarga e il suo corso rallenta.<br />
Dopo aver attraversato alcuni comuni nel Pesarese entra in provincia di Rimini per sfociare poi nel mare Adriatico<br />
tra Misano Adriatico e Cattolica. Possiede un carattere torrentizio con portate variabili, con minime estive o talora<br />
con apporto nullo estivo. Oggi la portata del fiume è<br />
notevolmente ridotta, a causa soprattutto della captazione<br />
dell’acqua per uso umano. In epoche remote si ritiene però che<br />
la sua portata fosse maggiore; la tradizione vuole infatti che in<br />
epoca romana il fiume Conca fosse utilizzato per il trasporto del<br />
legname, tagliato sul Monte Carpegna, e trasportato fino al<br />
cantiere navale romano, localizzato nei pressi di Cattolica. Il<br />
suo reticolo idrografico è poco esteso; unico affluente di una<br />
certa importanza è il Rio Ventena di Gemmano, che confluisce<br />
in sponda destra, a monte di <strong>Morciano</strong> in località Casarola. Nel<br />
tratto più montano il corso d’acqua incide rocce calcaree<br />
dell’Eocene (55-35 milioni di anni), dando origine ai ciottoli<br />
ghiaiosi che trasporta come materiale di fondo prevalente.<br />
3
A valle del M. Carpegna, i terreni sono sostanzialmente argillosi e quindi facilmente erodibili dalle acque di<br />
scorrimento superficiale, che danno origine alle tipiche forme di erosione calanchive.<br />
Calanchi<br />
In questo “mare” di argille di età da 11 a 7 milioni di anni circa (Miocene),<br />
galleggiano “zatteroni” calcarei più antichi, smembrati dall’orogenesi, su cui<br />
sorgono abitati come Montecerignone e Montegrimano.<br />
Montecerignone Montegrimano<br />
Nel tratto intermedio del bacino idrografico affiorano rocce sedimentarie gessose ed arenacee di circa 7 milioni di<br />
anni (Messiniano), che caratterizzano i territori di Montescudo, Montecolombo, Gemmano e Montefiore Conca.<br />
4
Nelle rocce gessose l’acqua ha scavato le note Grotte di Onferno.<br />
Il Fiume Conca termina il suo percorso con<br />
foce ad estuario in località Portoverde tra<br />
Cattolica e Misano Adriatico.<br />
La medio-bassa valle del corso d’acqua è caratterizzata dall’affioramento di<br />
rocce sedimentarie argilloso – marnose del Pliocene (2 milioni di anni), che<br />
rappresentano l’antico fondo di un mare e che oggi formano le colline di San<br />
Clemente, Misano Monte e le porzioni collinari di <strong>Morciano</strong> e San Giovanni in<br />
Marignano.<br />
All’incirca dalla località di Pianventena, la valle del Conca si apre a ventaglio<br />
formando la conoide alluvionale costituita dai detriti trasportati ed accumulati<br />
dal fiume durante il Quaternario (da 2 milioni di anni ai tempi più recenti).<br />
5
L’intervento dell’uomo sul paesaggio fluviale è stato intenso, soprattutto in conseguenza del boom turistico degli<br />
anni ’60 che richiedeva un massiccio sfruttamento dei materiali (ghiaia) per le costruzioni.<br />
2.2 – Aspetti naturalistici<br />
Cava di ghiaia abbandonata in località Pianventena<br />
Sono tanti gli aspetti biologici-naturalistici, osservabili lungo il tragitto del fiume. Lungo il suo percorso si può<br />
osservare il bosco di Pianacquadio, che rappresenta l’ultimo lembo di una immensa faggeta che un tempo ricopriva<br />
la sommità del M. Carpegna.<br />
6
Si tratta di un bosco unico nel centro Italia, costituito da faggi secolari ma anche da aceri montani, acero riccio,<br />
acero napoletano, acero campestre, dal tiglio e dal sorbo montano.<br />
Tratto naturalistico del fiume Conca<br />
Faggio ( Fagus sylvatica )<br />
7
Acero montano Acero riccio Acero napoletano<br />
(Acer pseudoplatanus) (Acer platanoides) (Acer ophalus)<br />
Acero campestre<br />
(Acer campestre) Tiglio (Tilia) Sorbo montano<br />
(Sorbus aria)<br />
Inoltre lungo il tragitto del fiume , non e’ raro vedere alcuni interessanti<br />
arbusti come il nocciolo, il biancospino (Crataegus monogyna), e il<br />
ciliegio alpino.<br />
8
Interessanti sono le specie ittiche, maggiormente presenti nel fiume Conca. Da segnalare la carpa, il cavedano il<br />
barbo padano, e la comune alborella.<br />
Alborella<br />
(Alburmus alburmus)<br />
Carpa<br />
(Cyprinius carpio)<br />
Cavedano<br />
(Leuciscus cephalus )<br />
Barbo padano<br />
(Barbus plebejus)<br />
9
3 INQUADRAMENTO DELL’AREA D’INDAGINE<br />
Lungo il percorso del fiume non sono abbondanti, grandi centri abitati ed industrie, quindi la qualità delle acque<br />
dovrebbe essere sostanzialmente discreta in quanto preservata da aggressioni chimiche, se non di modesta entità.<br />
Tuttavia sostanze inquinanti potrebbero giungere dall’agricoltura e dagli allevamenti. Il bacino idrografico del fiume<br />
Conca, è infatti prevalentemente agricolo.<br />
10
Per l’analisi della qualità delle acque superficiali, è stato individuato un punto di prelievo, facilmente raggiungibile a<br />
piedi dal plesso scolastico; tale scelta si è resa necessaria per raggruppare le 4 classi destinate al progetto, così<br />
da poter utilizzare la strumentazione disponendo di un'unica stazione di misura.<br />
Stralcio della Carta Tecnica Regionale a scala 1:5.000<br />
con individuazione dell’Istituto e del sito di prelievo<br />
Ogni classe ha poi autonomamente<br />
prelevato campioni di acqua del fiume ed<br />
analizzato in sito i principali parametri<br />
chimici e fisici previsti dal progetto.<br />
producendo un report contenente i dati<br />
grezzi.<br />
Tale fase è stata condotta con la<br />
supervisione dei Docenti. L’insieme dei<br />
report ha costituito la base dati per<br />
l’elaborazione finale dei risultati conclusivi<br />
del progetto, che ha prodotto una tabella di<br />
valutazione della qualità delle acque del<br />
fiume Conca relativamente alla stazione<br />
campionata ed alla data di campionamento.<br />
I dati sono stati anche pubblicati sul sito<br />
internet dell’<strong>ISISS</strong> alla pagina “Ambiente”.<br />
11
4 I PARAMETRI CHIMICO - FISICI E LE TECNICHE <strong>DI</strong> MISURA<br />
L’OSSIGENO <strong>DI</strong>SCIOLTO<br />
Nelle acque del mare, dei fiumi, dei laghi, come in quelle sotterranee, di ossigeno (O2) disciolto non c’è ne in<br />
grande quantità, di norma non più di 10 mg/litro o 10 ppm, ma questa modesta quantità è indispensabile per la vita<br />
dei pesci e di tutte le altre forme di vita.<br />
L’O2 viene in parte dall’ atmosfera (con cui le acque sono in costante equilibrio di scambio come anche per l’azoto<br />
N2 e l’anidride carbonica CO2) ed in parte dalle alghe monocellulari e pluricellulari che lo rilasciano con la<br />
fotosintesi clorofilliana.<br />
Come per tutti gli altri gas, la presenza dell’ O2 nell’ acqua non è certo costante ma varia molto in funzione della<br />
temperatura (diminuisce quando aumenta la temperatura ed aumenta quando le acque si raffreddano) e della<br />
pressione che, se aumenta, fa crescere la solubilità di questo gas. Così a 25°c e 1 atm di pressione, l’O2 disciolto è<br />
8.3 mg/litro e a 4°c, aumenta a 13,1 mg/litro, sempre ad 1 atm. Come si vede, non sono variazioni di poco conto.<br />
Inoltre, quando le acque si muovono in modo rapido e turbolento si mescolano ad un gran numero di bolle d’aria ed<br />
assorbono O2 fino a saturarsi, come accade nei freschi torrenti zampillanti in montagna e in mare durante le<br />
tempeste ad opera delle onde.<br />
Così, sono proprio le acque stagnanti quelle in cui l’O2 arriva più facilmente a scarseggiare, fino a causare la morte<br />
dei pesci per asfissia. L’O2 che contengono infatti, viene consumato facilmente dai processi di decomposizione<br />
delle alghe e degli altri organismi quando muoiono, senza essere rimpiazzato dall’O2 che diffonde dall’aria troppo<br />
lentamente attraverso la superficie calma dell’acqua; fenomeno analogo avviene anche nelle acque inquinate in cui<br />
proprio gli inquinanti consumano rapidamente l’O2 disciolto.<br />
12
La quantità di O2 disciolto si può esprimere in ppm o in mg/litro, ma è importante il valore relativo della % di<br />
saturazione rispetto alla massima concentrazione possibile in ogni condizione di temperatura e pressione. Questi<br />
valori limite sono tabulati e un’acqua è sana quando l’O2 disciolto è sopra il 90% della saturazione, ma diventa<br />
sospetta di inquinamento o di “anossia” quando si scende al di sotto del 60% della saturazione. Sotto questo<br />
valore, i pesci cominciano a morire.<br />
Occorre misurare l’O2 disciolto in acqua il più presto possibile dopo il prelievo dei campioni, poichè l’O2 disciolto è<br />
un valore che cambia molto facilmente. Per questo motivo è stato deciso di misurare l’ossigeno disciolto con una<br />
sonda portatile direttamente nel corpo idrico. La sonda utilizzata è composta da un elettrodo amperometrico di<br />
Clark. Questo elettrodo è detto “amperometrico” perchè la sua reazione con l’O2 genera una corrente elettrica che<br />
viene elaborata dallo strumento per dare il valore dell’ O2 disciolto sul display.<br />
L’ elettrodo cilindrico contiene un catodo di platino e un anodo di Ag/AgCl immersi un soluzione di cloruro di<br />
potassio. La punta del sensore è formata da una membrana microporosa o semipermeabile per assorbire solo l’O2<br />
dell’acqua. Questo si riduce al catodo (O2 + 2e- + H2O —> 4 OH - ) mentre l’argento dell’ anodo si ossida (2 Ag + 2<br />
Cl - —> 2 AgCl + 2e - ).<br />
La corrente elettrodica così prodotta è proporzionale alla concentrazione di O2 nell’acqua in cui si immerge<br />
l’elettrodo.<br />
L’elettrodo ha bisogno di essere tarato con soluzioni apposite a concentrazione nota di O2. Questo metodo è il più<br />
usato per le analisi ambientali quando il laboratorio è lontano e per gli impianti di depurazione. L’elettrodo è<br />
collegato ad uno strumento elettronico con un software che calcola le concentrazioni di O2 e la visualizza sia come<br />
mg/l che come %.<br />
13
Il pH<br />
Il pH è un indicatore di acidità ed è definito come il logaritmo negativo della concentrazione dello ione H + . Il pH si<br />
misura mediante una scala i cui valori a 25 °C, sono compresi tra 1 e 14. Il pH è un parametro chimico-fisico<br />
importante in quanto è un fattore limitante per la crescita degli organismi; l’acqua di un fiume, per essere di buona<br />
qualità e favorire la vita, dovrebbe avere un pH che si aggiri sul valore neutro 7, con un massimo di 8. Se questo è<br />
maggiore o minore, le caratteristiche dell’ecosistema fluviale subiranno sensibili cambiamenti sia nella componente<br />
abiotica che nella componente biotica.<br />
Per una determinazione quantitativa si utilizza il pH-metro che misura il pH per via elettrica, sfruttando la misura<br />
della differenza di potenziale ai capi di una catena galvanica (pila elettrochimica) costituita da un elettrodo sensibile<br />
all’attività degli ioni idrogeno (elettrodo a vetro) e da un elettrodo di riferimento.<br />
Il pH è una grandezza variabile con la temperatura il cui effetto può essere controllato utilizzando il sistema di<br />
termocompensazione in dotazione col pH-metro. La modifica degli equilibri ionici in soluzione non può essere<br />
invece valutata a priori. E’ pertanto sempre necessario riferire il pH alla temperatura alla quale è stato misurato.<br />
Prima della misura è necessario tarare il sistema di misura facendo uso di una soluzione tampone di riferimento<br />
avente pH prossimo a 7 e controllare la linearità della risposta dello strumento, facendo uso di almeno un'altra<br />
soluzione di riferimento a pH diverso (4). A tal fine, prima delle misure, l’elettrodo del pH-metro viene immerso in<br />
25-50 ml di soluzione tampone contenuta in un bicchiere pulito ed asciutto e viene misurato il pH. Se il valore letto<br />
non corrisponde a quello della soluzione tampone di riferimento scelta, ci si riferisce al manuale dello strumento<br />
per riportare la lettura al valore nominale della soluzione tampone.<br />
14
Dopo aver tarato l’apparecchio, la bottiglia da campionamento (250 ml) è stata immersa nel corso d’acqua per 30<br />
secondi, svuotata ed immersa nuovamente per 3 minuti. Successivamente si è immerso il pH-metro nella bottiglia<br />
ed effettuata la lettura. Le condizioni ideali per il campionamento sono: a mezza luce e in acqua corrente. Questo<br />
procedimento è stato ripetuto più volte, per poi calcolare il valore medio.<br />
LA TEMPERATURA<br />
Ossimetro + pH-metro con relative sonde<br />
La temperatura dei corsi d’acqua influisce direttamente sugli organismi presenti (ogni tipo di organismo ha un<br />
optimum di temperatura per svilupparsi ed un range, generalmente abbastanza ristretto, a cui sopravvive) ed<br />
interagisce con i principali fattori chimico-fisici (es.: densità, salinità, gas disciolti, ecc…). La temperatura assoluta<br />
dell’acqua viene perciò misurata, come ricordato sopra (ossigeno disciolto, pH ecc…), per dare misure corrette di<br />
altri parametri ma, quello che interessa maggiormente la determinazione del W.Q.I., è la differenza di temperatura<br />
(∆T) fra quella del sito di campionamento ed una stazione situata 1500 m a monte.<br />
15
Un valore di ∆T elevato può segnalare la presenza di uno scarico nel tratto considerato e può fornire utili<br />
indicazioni anche per le diverse comunità fluviali che si possono ritrovare in quelle condizioni.<br />
Le condizioni ideali per il campionamento sono: a mezza luce e in acqua corrente. Questo procedimento si può<br />
ripetere più volte, sia a valle che a monte, per poi calcolare il valore medio. Si deve poi sottrarre il valore della<br />
temperatura a monte da quella a valle. Calcolata la differenza (∆T), si trova il valore normalizzato e si moltiplica per<br />
il peso del parametro che, in questo specifico caso, equivale a 0,10.<br />
BOD5<br />
Con la sigla B.O.D.5 (domanda biochimica di ossigeno), si intende la quantità di ossigeno consumato dai batteri<br />
(respirazione cellulare) durante un tempo determinato (5 giorni per il B.O.D.5), ad una data temperatura, per<br />
decomporre le sostanze organiche presenti nell’acqua. Il B.O.D.5 rappresenta il 68% del B.O.D. tot, necessario per<br />
ossidare tutto il substrato organico nell’arco di 20 giorni a 20 °C. Un’elevata domanda biochimica d’ossigeno è<br />
l’indice di un’intensa attività batterica di demolizione organica e potrebbe quindi evidenziare la presenza di un<br />
inquinamento di questo tipo. Questo materiale può provenire sia da fonti naturali (zone paludose), sia da fonti<br />
antropiche (industrie o impianti di trattamento di acque inquinate). In acque ricche di azoto e fosforo, dove è in atto<br />
un processo di eutrofizzazione, le stesse alghe possono divenire la principale fonte di materiale organico da<br />
degradare e contribuire, quindi, al processo di deossigenazione. Anche la struttura del corpo idrico può influire;<br />
tratti di fiume chiusi o lenti facilitano, infatti, l’accumulo di sostanze organiche.<br />
Come per l’ossigeno disciolto, il campione deve essere prelevato in una bottiglietta di vetro apposita, facendo<br />
attenzione che non rimangano bolle d’aria; per questo bisogna chiuderla sott’acqua.<br />
16
La presenza di bolle d’aria, e quindi di ossigeno atmosferico, falserebbe infatti i risultati. Il campione così prelevato<br />
dovrà poi essere ricoperto con carta stagnola o colorato di nero in modo che non entri luce, la quale consentirebbe<br />
la fotosintesi causando un’ulteriore produzione di ossigeno. Dopo 5 giorni (nel caso del B.O.D.5) si esegue la<br />
misura dell’ossigeno disciolto, come nel paragrafo relativo alla misura dell’ossigeno disciolto, ricavando così i mg/l<br />
di ossigeno rimasto. Questo è l’ossigeno disciolto dopo 5 giorni, per cui tale valore viene poi sottratto al valore di<br />
ossigeno disciolto iniziale: a questo punto abbiamo trovato il valore del B.O.D.5. Questo valore contribuirà alla<br />
determinazione della qualità dell’acqua.<br />
NITRATI<br />
Affinché la vita sia possibile ogni organismo necessita di diversi elementi tra i quali è indispensabile l’azoto, fattore<br />
fondamentale nella costruzione delle proteine. In natura, pochi organismi sono in grado di utilizzarlo direttamente<br />
(prelevandolo dall’aria dove l’azoto molecolare – N2 – rappresenta la frazione più abbondante). Esistono particolari<br />
microrganismi – azotofissatori – in grado di convertire biologicamente questo elemento in ammoniaca e altri –<br />
nitroso e nitrobatteri – in grado di ossidare l’ammoniaca a ioni nitrito e questi ultimi a ioni nitrato. L’azoto, quindi, è<br />
presente nelle acque in diversi stadi di ossidazione. La sua presenza nelle acque non è un fattore di inquinamento<br />
lo è, invece, la presenza di alcuni dei suoi composti intermedi quali l’ammoniaca. È infatti questo composto che,<br />
oltre a denunciare un inquinamento di tipo fecale, determina la tossicità dell’acqua anche se vi è comunque un<br />
certo grado di tolleranza che dipende direttamente dalla concentrazione dell’ossigeno disciolto e dal pH. Il<br />
processo di nitrificazione, ossia il processo di ossidazione dell’ammoniaca a ione nitrato, è responsabile di una<br />
diminuzione dell’ossigeno disciolto che può essere invertito solo da particolari batteri che riducono nitrati a nitriti ed<br />
infine ad azoto molecolare (batteri denitrificanti).<br />
17
Non sempre i nitrati sono da considerarsi fattore negativo poichè essi possono impedire, nei fiumi molto inquinati<br />
(quando il tenore di ossigeno libero è pari a zero), lo sviluppo di cattivi odori e stimolare la crescita di alghe e<br />
macrofite che favoriscono a loro volta, la riossigenazione dell’acqua. Gli ioni nitrito possono essere abbondanti<br />
nelle acque reflue da impianti di trattamento se il loro funzionamento non è corretto. Nelle acque superficiali<br />
inquinate i composti azotati possono essere prodotti durante il ciclo di riduzione ed ossidazione dell’azoto organico<br />
ed inorganico che spesso proviene da liquami domestici, da lavorazioni agro-alimentari, da fertilizzanti o da reflui<br />
industriali. Dannoso è invece un apporto di azoto nei laghi, che viene a costituire un problema molto grave poiché<br />
può accelerare il processo di eutrofizzazione. La determinazione dei nitrati viene eseguita utilizzando un fotometro<br />
multiparametrico ed un kit basato sulla riduzione dei nitrati in nitriti ad opera di particelle di cadmio,<br />
contestualmente i nitriti assumono, a causa di un colorante presente nel kit, la colorazione rossa.<br />
L’intensità di tale colorazione risulta proporzionale alla quantità di nitrati presenti inizialmente e viene letta come<br />
assorbanza a 525 nm dal fotometro, che, sulla base di curve di taratura interne, la traduce in concentrazione mg/l<br />
di nitrato NO3.<br />
Fotometro da Banco<br />
18
FOSFATI<br />
Il fosforo è generalmente presente nelle acque come fosfato (PO4<br />
3- ). I fosfati organici sono componenti degli<br />
organismi viventi mentre quelli inorganici sono rappresentati da ioni legati alle particelle del suolo e da polifosfati<br />
presenti, ad esempio, nei detersivi. Il fosforo è, come l’azoto, un elemento essenziale per la vita. Nella maggior<br />
parte delle acque il fosforo agisce come fattore che limita la crescita dei vegetali perché, in genere, esso è<br />
presente in concentrazioni molto basse. Poiché le alghe richiedono solo piccole quantità di fosforo per vivere, un<br />
eccesso di fosforo può provocare una forte crescita algale, detta “fioritura”. L’eccesso di fosfati (e/o di nitrati) nelle<br />
acque viene chiamato “eutrofizzazione”. La maggior parte dell’eutrofizzazione attuale è di origine umana (impianti<br />
di depurazione, scarichi industriali, fertilizzanti per usi agricoli che arricchiscono le acque di fosforo (e azoto) al cui<br />
confronto quella naturale è trascurabile (incendi di foreste, eruzioni vulcaniche). Il primo sintomo è una fioritura<br />
algale; con l’aumentare dell’eutrofizzazione le fioriture diventano sempre più frequenti. Ad uno stadio avanzato,<br />
può provocare l’anaerobiosi: l’ossigeno presente nell’acqua è utilizzato nella ossidazione biologica delle sostanze<br />
organiche. Queste condizioni, in genere, si verificano sul fondo di un lago o di uno specchio d’acqua poco profondo<br />
e producono gas, come acido solfidrico dall’inconfondibile odore di uova marce. L’anossia rende difficile, a volte<br />
impossibile, la vita ai pesci e seleziona le specie presenti nella comunità eliminando quelle più esigenti rispetto<br />
all’ossigeno. L’eutrofizzazione quindi, come altre forme di inquinamento, provoca cambiamenti nella comunità<br />
acquatica in cui la biodiversità si riduce drasticamente con l’eliminazione delle specie più sensibili.<br />
Utilizzando l’apposito kit si perviene alla determinazione del fosforo totale (inizialmente, infatti, si converte il fosforo<br />
organico in ortofosfato inorganico) espresso in mg/l di fosfati PO4 3- .<br />
19
TRASPARENZA<br />
L’intorbidamento dell’acqua è causato dalla presenza di solidi sospesi quali: sabbia, argilla, materiali organici e di<br />
rifiuto. Un aumento di torbidità può avere conseguenze piuttosto rilevanti: le particelle presenti in superficie<br />
possono assorbire calore causando un aumento di temperatura del corso d’acqua; tale riscaldamento riduce il<br />
livello di ossigeno disciolto. Inoltre, la diminuita trasparenza delle acque ostacola il passaggio della luce limitando<br />
così l’attività fotosintetica degli organismi vegetali con ulteriore riduzione dell’ossigeno disciolto.<br />
Infine i solidi inorganici hanno un effetto abrasivo sulle branchie e sulla cute dei pesci riducendone il tasso di<br />
sviluppo e la resistenza alle malattie. La torbidità è un utile indicatore della presenza, nella colonna d’acqua, di<br />
particellato sospeso che può essere sia di origine organica che inorganica. Il monitoraggio continuo della<br />
distribuzione dei valori di torbidità permetterà anche di valutare la capacità che una parte del sistema ha di<br />
trattenere e accumulare materiale in sospensione. Infine, è noto che gli inquinanti sono preferenzialmente associati<br />
a sospensioni sia organiche che inorganiche, le quali ne determineranno il destino all’interno dell’ecosistema.<br />
La misura della torbidità è perciò di grande importanza nello studio e nel controllo dei processi di inquinamento nel<br />
sistema monitorato. La misura della torbidità viene effettuata con uno spettrotometro ed espressa in NTU.<br />
SOLI<strong>DI</strong> TOTALI<br />
I solidi totali comprendono oltre ai solidi sospesi filtrabili e non, i solidi disciolti nell’acqua. I materiali disciolti o<br />
inorganici includono: calcio, bicarbonati, ioni di composti di azoto, di fosforo, di ferro, di zolfo e altri ioni.<br />
20
Un livello costante di queste sostanze è essenziale per il mantenimento della vita acquatica; la concentrazione di<br />
solidi disciolti determina infatti lo scambio di acqua con le cellule di un organismo (equilibrio osmotico), inoltre<br />
azoto, fosforo e zolfo, sono coinvolti nella costruzione di molecole indispensabili alla vita. Il contenuto naturale di<br />
solidi sospesi in un corso d’acqua può venire alterato da diversi fattori quali: dilavamento di aree urbane;<br />
depuratori; erosione del suolo ecc…<br />
Basse concentrazioni di solidi totali possono limitare la vita acquatica; alte concentrazioni possono abbassare la<br />
qualità dell’acqua causando gli effetti già discussi per la torbidità.<br />
La determinazione dei solidi totali si può eseguire solo in laboratorio. Si pongono 100 ml di campione d'acqua in un<br />
beaker (asciutto e pesato), l’acqua viene fatta evaporare completamente in stufa termostatata a 110 °C. Dopo<br />
raffreddamento, si ripesa il beaker e per differenza si ottiene il valore dei solidi totali su 100 ml di campione. Si<br />
esprime il risultato in mg/l.<br />
COLIFORMI FECALI<br />
I coliformi totali sono una parte naturale della flora intestinale degli organismi a sangue caldo, uomo incluso; si<br />
possono però trovare anche nel terreno e in altri animali, come gli insetti. Il gruppo dei coliformi totali è<br />
relativamente facile da coltivare in laboratorio e, non essendo organismi patogeni, tale tecnica è anche abbastanza<br />
sicura. Il test dei coliformi fecali (che sono quindi una frazione dei totali), è di primaria importanza per stabilire la<br />
“potabilità” dell’acqua, per stabilire cioè se è adatta al consumo umano. Il test misura la concentrazione di quei<br />
coliformi che sono indice di contaminazione fecale a cui, quindi, è associata la possibile presenza di organismi<br />
patogeni per l’uomo. Se nell’acqua viene rilevato un grande numero di coliformi fecali c’è una grande probabilità<br />
che siano presenti anche i patogeni.<br />
21
Questi ultimi possono anche essere ricercati direttamente nelle acque ma, essendo più “deboli” e meno numerosi,<br />
sono più difficili da individuare.<br />
Il prelievo va eseguito con una bottiglia da 500 cc in plastica sterile monouso, riempita solo per 3/4 cercando di<br />
limitare al massimo la contaminazione. Il campione può essere conservato a 4 °C per non più di 24 ore.<br />
Per l’analisi si è ricorsi ad un laboratorio qualificato che ha proceduto come di seguito indicato: preparare un<br />
numero di capsule Petri pari al numero di campioni più una (per controllare la sterilità del terreno) con il terreno (m<br />
FC). Con pinzette sterili sistemare le membrane sui supporti dell'apparato di filtrazione. Inserire gli imbuti e filtrare<br />
10, 50 e 100 ml di campione. Trasferire con le pinzette sterili ogni membrana nella rispettiva piastra con il terreno<br />
di coltura evitando di inglobare aria. Incubare le piastre a 44 °C per 24 ore. La risalita per capillarità dei principi<br />
nutritivi del m FC fa si che, in quelle condizioni, da ogni cellula vitale trattenuta sulla membrana prenda origine una<br />
colonia blu. Al termine del periodo d’incubazione vanno contate le colonie di ogni piastra (considerando solo le<br />
piastre che abbiano un numero di colonie compreso fra 10 e 100) riportando ogni valore a 100 ml di campione e<br />
calcolando il numero medio fra le piastre. Il risultato si esprime in unità formanti colonie (UFC)/100 ml di campione.<br />
Piastra Petri con m FC Agar<br />
22
5 L’USCITA <strong>DI</strong>DATTICA - BREVE REPORTAGE A CURA DELLE CLASSI<br />
Il 31 marzo 2012 in una bellissima e calda giornata di sole, le classi 2°A, 2°C, 2°I e 2°J, si sono recate a piedi al<br />
Fiume Conca in un punto del fiume a monte di Via Ponte di <strong>Morciano</strong> di Romagna, scelto per potere svolgere<br />
l’esperienza di educazione ambientale.<br />
La mattinata è iniziata raccogliendoci al parco comunale dove i professori ci hanno spiegato come avremmo<br />
dovuto misurare i parametri a noi utili e si sono raccomandati sui comportamenti da tenere durante la mattinata.<br />
23
Poi, dopo qualche minuto di camminata lungo il fiume, osservando il paesaggio circostante,<br />
24
siamo giunti al punto in cui avremmo svolto l’esperienza e<br />
posizionato gli strumenti di lavoro.<br />
25
Abbiamo iniziato le misure con il parametro dell’ossigeno disciolto,<br />
indispensabile per la vita dei pesci e di tutti gli altri organismi. L’O2 deriva<br />
dall’atmosfera e dalle alghe che lo rilasciano con la fotosintesi. Il parametro è<br />
stato misurato tramite uno strumento con sonda amperometrica immersa<br />
direttamente nel corpo idrico.<br />
26
Il passo successivo è stata la misurazione del pH, ovvero un indicatore di acidità che incide sulla crescita degli<br />
organismi. Si misura mediante una scala i cui valori a 25° sono compresi tra 1 a 14. Questa misurazione è stata<br />
effettuata con il pHmetro, immerso nell’acqua dopo essere stata tarato.<br />
Successivamente ci siamo occupati della temperatura la quale influisce direttamente sugli organismi presenti ed<br />
interagisce con i principali valori chimico-fisici.<br />
Altro parametro misurato è quello dei fosfati che si dividono in organici e non organici. Gli organici sono<br />
componenti di organismi viventi, mentre i non organici sono rappresentati da ioni legati alle particelle del suolo, e<br />
da polifosfati presenti.<br />
27
La determinazione di questo parametro e dei nitrati è stata eseguita utilizzando un fotometro multi parametrico.<br />
28
Un valore che è stato inoltre misurato in laboratorio, è il BOD5, che è la quantità di ossigeno consumato dagli<br />
organismi presenti nel campione durante un determinato tempo (circa 5 giorni) ad una data temperatura, per<br />
decomporre le sostanze organiche. Per misurarlo occorre prelevare un campione d’acqua in una bottiglia di vetro<br />
facendo attenzione che non rimangano bolle d’aria. Successivamente il campione è stato oscurato e dopo 5 giorni<br />
si è eseguita la misurazione.<br />
Spesso l’intorbidamento dell’acqua è causato dalla<br />
presenza di solidi sospesi quali: sabbia, argilla,<br />
materiali organici e di rifiuto. Il parametro della<br />
trasparenza dell’acqua è utile per verificare la<br />
presenza di particellato sospeso che può essere di<br />
origine organica o inorganica.<br />
29
In conclusione possiamo affermare che l’uscita didattica al fiume Conca è stata una esperienza oltre che utile e<br />
interessante anche piacevole, in quanto ci siamo ritrovati molto coinvolti e uniti per imparare cose nuove ed<br />
approfondire al meglio gli aspetti del territorio che ci circonda, in particolare il Fiume Conca.<br />
30
WQI<br />
6 – I RISULTATI<br />
I parametri raccolti permettono di calcolare il WQI; questo è un indice combinato in un singolo numero che<br />
rappresenta il livello di qualità dell’ acqua, eliminando le valutazioni soggettive e le polarizzazioni di diversi esperti<br />
di qualità dell'acqua.<br />
Intorno ai primi anni ’70 la NSF (National Sanitation Foundation ) riuscì a definire un indice di qualità dell’acqua in<br />
grado di confrontare la qualità dell’acqua di fiumi differenti o punti diversi dello stesso corso d’acqua.<br />
Il protocollo fu sviluppato utilizzando il metodo DELPHI. La NSF selezionò 142 esperti di qualità dell’acqua; ad<br />
ognuno fu chiesto di scegliere 35 parametri per la valutazione della qualità dell’acqua; successivamente i parametri<br />
furono ridotti a nove. Per ogni parametro, poi, fu chiesto di disegnare una curva che potesse rappresentare<br />
graficamente il variare (da 0 a 100) del livello di qualità dell’acqua rispetto ai dati grezzi, così che dal grafico si<br />
potesse risalire alla normalizzazione dei dati espressa come “valore Q”.<br />
UTILIZZO DEL WQI<br />
Dal 1970 si è fatto un grande uso di questo indice, vista la semplicità della sua determinazione e la chiarezza con<br />
la quale esprime la qualità dell’acqua. Ad oggi, sono moltissimi i Paesi che adottano il WQI come strumento per la<br />
gestione di corpi idrici, per esempio Taiwan, Washington, Dalmazia, Canada, Oregon, Iraq, Corea.<br />
I parametri considerati possono variare da Paese a Paese, in quanto ciascuno ha riadattato i parametri dell’indice<br />
secondo la caratteristiche idrogeologiche dei propri corsi d’acqua.<br />
31
PARAMETRI DEL WQI<br />
I nove parametri utilizzati in Italia per il calcolo dell’indice sono:<br />
1. BOD<br />
2. Ossigeno Disciolto<br />
3. E.Coli<br />
4. Nitrati<br />
5. pH<br />
6. Temperatura<br />
7. Solidi Disciolti totali<br />
8. Fosfato totale<br />
9. Torbidità<br />
A ciascun parametro verranno allegate, di seguito, le relative curve di normalizzazione stabilite dalla NSF.<br />
1) BOD<br />
La domanda biochimica di ossigeno indica la quantità di ossigeno richiesta dai batteri per degradare la sostanza<br />
organica. Il BOD è un indicatore della quantità di sostanza biodegradabile presente.<br />
32
2) Ossigeno Disciolto<br />
L’ossigeno disciolto è fondamentale per la respirazione degli organismi acquatici e per l’attività dei batteri che<br />
assicurano la mineralizzazione della sostanza organica . Un basso livello di saturazione indica la parziale o<br />
completa compromissione dei processi di auto depurazione.<br />
33
3) Coliformi fecali<br />
E. coli è un batterio coliforme fecale che risiede nell’intestino di umani e animali. La presenza di questo coliforme<br />
nelle acque, è indice di contaminazione fecale, causata da scarichi urbani o da allevamenti.<br />
4) Nitrati<br />
I nitrati costituiscono il processo più avanzato di ossidazione delle sostanze azotate. Una concentrazione<br />
eccessiva di nitrati provoca fenomeni di “concimazione” che è alla base del fenomeno di eutrofizzazione delle<br />
acque<br />
34
5) pH<br />
Un allontanamento sostanziale del pH da valori di normalità, causato dalla perdita delle capacità di tamponamento<br />
può essere pericoloso per la vita acquatica in quanto i valori di compatibilità sono compresi fra 6,5 e 8,5 unità di<br />
pH.<br />
35
6) Temperatura<br />
La temperatura dell’acqua regola numerose processi fisici, chimici e biologici. Inoltre molte specie vegetali e sono<br />
estremamente sensibili alle variazioni di temperatura.<br />
7) Solidi Disciolti totali<br />
Comprendono frazioni diverse di sali minerali e materia organica .<br />
36
8) Fosforo totale<br />
Insieme all’azoto controlla i processi di eutrofizzazione. Un quantità eccessiva di fosforo è indice di inquinamento<br />
organico. Gli effetti secondari, legati all’attività di decomposizione dei batteri, può determinare deossigenazione o<br />
anossia.<br />
9) Torbidità<br />
La torbidità è influenzate dalla quantità di materiale solido trasportato dall’acqua. Generalmente, alla torbidità viene<br />
associata una funzione spia per il controllo dell’inquinamento.<br />
37
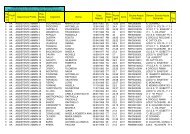
I valori di qualità dell’acqua sono ottenuti quindi dal prodotto del “VALORE NORMALIZZATO” per il “PESO”. I<br />
valori ottenuti per ogni parametro sono poi sommati tra loro.<br />
Parametri Unità di Misura Valori Ottenuti Valori<br />
Normalizzati<br />
Peso Valori assoluti<br />
Ossigeno % sat % 103,6 99 0,17 16,83<br />
Coliformi fecali UFC/100 mL 104 44 0,16 7,04<br />
pH Unità pH 7,2 88 0,11 9,68<br />
BOD5 mg/L 1,94 95 0,11 10,45<br />
Differenza di T °C 0,1 93 0,10 9,3<br />
Nitrati totali mg/L 4,67 70 0,10 7,0<br />
Fosfati totali mg/L 0,032 100 0,10 10<br />
Torbidità NTU 11 74 0,08 5,92<br />
Solidi Totali mg/L 183 75 0,07 5,25<br />
Per il giudizio finale di qualità si utilizzano le seguenti classi:<br />
W.Q.I 81,3<br />
38
In conclusione si può affermare che, l’acqua nel tratto di fiume campionato e relativamente al<br />
periodo di prelievo, appartiene alla categoria BUONO quindi presenta una condizione di<br />
massima idoneità per la vita acquatica e garantisce inoltre qualsiasi forma di attività ricreativa o<br />
di sfruttamento.<br />
39
7 – CONCLUSIONI<br />
L’attività didattica ambientale “Conosciamo il Fiume Conca”, realizzata in una unica mattinata, è stata una<br />
magnifica esperienza conoscitiva, umana, e didattica. E’ stata organizzata con lo scopo di favorire sia l’aspetto<br />
scientifico, sia quello didattico, e anche di promuovere quei processi di socializzazione fra gli allievi partecipanti,<br />
importanti nei loro momenti di crescita.<br />
Le intenzioni progettuali, nella fase operativa, si sono tradotte in :<br />
a) analisi dei parametri chimico-fisici del fiume Conca<br />
b) applicazione di un approccio didattico alternativo alla tradizionale lezione frontale<br />
c) lavoro di equipe e di gruppo<br />
I dati risultanti dalla ricerca non sempre hanno una valenza rigorosamente scientifica, anche se la loro attendibilità<br />
va comunque ritenuta alta. Questo perché i coordinatori del progetto hanno scelto di privilegiare il diverso<br />
approccio didattico e il lavoro sperimentale di gruppo.<br />
<strong>Morciano</strong> di Romagna 06.06.2012<br />
Riferimenti:<br />
www.cattolica.info/tradzioni/gli-speciali-di-cattolica/il-conca-storia-di-un-fiume<br />
it.ewrite.us/come-misurare-l-ossigeno-disciolto-nell-acqua-90611.html<br />
www.geolab-onlus.org/html/pdf/Metodiche04.pdf<br />
Vari Siti internet per le immagini<br />
40
Si ringrazia la Banca Popolare Valconca di <strong>Morciano</strong> di Romagna per il contributo offerto<br />
ai fini della pubblicazione.<br />
41