Diapositiva 1 - Biotecnologie Mediche, Veterinarie e Farmaceutiche
Diapositiva 1 - Biotecnologie Mediche, Veterinarie e Farmaceutiche
Diapositiva 1 - Biotecnologie Mediche, Veterinarie e Farmaceutiche
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
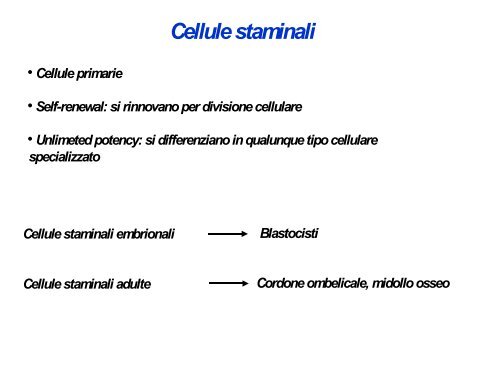
• Cellule primarie<br />
Cellule staminali<br />
• Self-renewal: si rinnovano per divisione cellulare<br />
• Unlimeted potency: si differenziano in qualunque tipo cellulare<br />
specializzato<br />
Cellule staminali embrionali<br />
Cellule staminali adulte<br />
Blastocisti<br />
Cordone ombelicale, midollo osseo
Totipotenti: morula<br />
Possono formare i tessuti<br />
Embrionali e extraembrionali<br />
Multipotenti: blastocisti<br />
Possono formare i tessuti<br />
embrionali<br />
Multipotenti:adulte<br />
Producono cellule di una famiglia<br />
Correlata. Ex: ematopoietiche<br />
Unipotenti: adulte<br />
producono un solo<br />
tipo cellulare<br />
Cellule staminali
Le cellule staminali embrionali (ES) di<br />
topo presentano il vantaggio di poter<br />
essere mantenute in coltura e la<br />
totipotenza preservata grazie alla<br />
presenza, nel mezzo di coltura, del fattore<br />
LIF (Leukemia Inhibitor Factor). In queste<br />
condizioni le cellule ES possono essere<br />
manipolate geneticamente e, grazie alla<br />
ricombinazione omologa, un frammento di<br />
DNA esogeno può essere integrato in un<br />
preciso sito del genoma (Jasin et al.,<br />
1996).
Transgenesi<br />
Organismo<br />
transgenico<br />
intervento sperimentale volontario di inserimento di un<br />
gene esogeno nel genoma di una specie animale o<br />
vegetale. Knock in<br />
Il gene può appartenere alla stessa<br />
specie o può derivare da specie differenti.<br />
quando il gene esterno è:<br />
• integrato nel suo genoma;<br />
• espresso correttamente (in genere si usa un gene<br />
che codifica una data proteina)<br />
e selettivamente in uno o più tessuti dell'animale;<br />
• integrato nella linea germinale e per conseguenza<br />
trasmissibile dall’animale fondatore alla progenie.
Jaenisch 1974: topi mutanti, frammenti di DNA di SV40 iniettati nella cavità<br />
celomatica di blastocisti murina mantenuti nel topo adulto.<br />
Gordon e Ruddle 1980: topi transgenici. Questi ricercatori sono stati i primi a<br />
mettere a punto la tecnica di microiniezione del DNA ricombinante all'interno<br />
dello zigote (ovulo fertilizzato ) e a dimostrare la trasmissione del transgene<br />
alla progenie da parte degli animali ottenuti con questa tecnica.<br />
Palmiter e Brinster nel 1982: ceppo di topi transgenici ottenuti microiniettando<br />
il gene dell’ormone della crescita umano. Questo esperimento ha prodotto un<br />
ceppo di topi molto più grandi dei loro omologhi non transgenici, dimostrando<br />
che era possibile modificare non solo il genotipo ma anche il fenotipo degli animali<br />
mutati.
Metodi per ottenere un animale transgenico<br />
• Microiniezione del DNA nell’ovocita fertilizzato<br />
• Microiniezione di cellule staminali nell’ovocita fertilizzato<br />
• Nuclear Transfer di cellule staminali trasformate in vitro<br />
• Mediata da retrovirus<br />
• Mediata da spermatozoi
Microiniezione del DNA<br />
nell’ovocita fertilizzato<br />
•Prelievo dopo 15-20h dalla fecondazione<br />
degli zigoti dalla femmina e microiniezione<br />
del DNA nel pro-nucleo maschile<br />
• Impianto dopo 24h di coltura in una<br />
pseudo-madre<br />
• Analisi sui nati a 3 settimane su DNA<br />
estratto dalla coda<br />
• Efficienza del 10%<br />
Ricombinazione casuale,<br />
raramente omologa<br />
Pronucleo<br />
femminile<br />
Pipetta di<br />
fissaggio<br />
Femmina che ha<br />
subito l’impianto<br />
Fondatore<br />
transgenico<br />
Pronucleo<br />
maschile<br />
Ovulo<br />
fertilizzato<br />
Transgene<br />
Pipetta di<br />
iniezione
Microiniezione di cellule<br />
staminali nell’ovocita fecondato<br />
Cellule staminali da blastocisiti<br />
transfettate con il transgene associato<br />
a resistenza antibiotica<br />
Dopo selezione trasferite in blastocisti<br />
riceventi<br />
Impianto in madri pseudogravide<br />
Progenie mosaico (chimere)<br />
Selezione del fondatore transgenico<br />
Ricombinazione omologa<br />
Blastocisti<br />
donatrice<br />
coltura<br />
Massa<br />
cellulare<br />
interna<br />
Transfezione<br />
Arricchimento in<br />
cellule transfettate<br />
Microiniezione<br />
nella blastocisti<br />
Impianto<br />
Cellule ES<br />
Transgene<br />
Blastocisti<br />
ricevente<br />
Fondatore<br />
transgenico
Selezione delle cellule staminali transgeniche<br />
Ricombinazione omologa<br />
HB1 Neo r TG HB2 TK<br />
HB1 TG HB2<br />
cromosoma<br />
ricombinazione omologa<br />
transgene<br />
HB1 Neo TG HB2<br />
cromosoma<br />
Le cellule sono selezionate in positivo con il G418 e non avendo il gene per la<br />
TK sono resistenti al Gancyclovir<br />
r<br />
Neo r :Resistenza al G418<br />
TK<br />
:sensibilità al<br />
gancyclovir
Selezione delle cellule staminali transgeniche<br />
HB1 Neo r TG HB2 TK<br />
transgene<br />
HB1 TG HB2 X cromosoma<br />
Neo r<br />
Ricombinazione eterologa<br />
ricombinazione eterologa<br />
HB1 TG HB2<br />
X TK<br />
cromosoma<br />
Le cellule sono selezionate in positivo con il G418, ma negativamente per la<br />
presenza della timidina chinasi<br />
Neo r :Resistenza al G418<br />
TK<br />
:sensibilità al<br />
gancyclovir
X, gene normale<br />
X*, transgene<br />
Topo marrone<br />
Colore marrone A/A<br />
ES ricombinanti<br />
Topo nero<br />
Colore nero a/a<br />
Impianto delle ES<br />
Progenie chimerica:<br />
Possibili gameti:<br />
A/X A/X* a/X<br />
Incrocio di un topo chimerico con un<br />
topo nero, a/a, X/X<br />
Si originano topi neri e topi marroni<br />
Analisi dei topi marroni per individuare<br />
gli eterozigoti<br />
Incrocio tra eterozigoti per ottenere<br />
omozigoti<br />
A/A, X/X* x A/A, X/X*
Clonazione<br />
Nuclear transfer di cellule<br />
trasformate in vitro<br />
Cellule staminale trasfettate e selezionte<br />
Nuclei delle cellule microiniettati in un ovocita<br />
Anucleato<br />
Embrione impiantato nella pseudo-madre<br />
Nati tutti transgenici<br />
Efficienza bassa 1/centinaia<br />
nucleo<br />
Impianto<br />
Trasfezione<br />
Ovulo<br />
enucleazione<br />
ICM<br />
Neo introne esone<br />
Selezione<br />
cellule<br />
Nuclei purificati<br />
Fusione attivazione<br />
Coltura embrione in vitro<br />
Topo transgenico
Transgenesi mediata da retrovirus<br />
• Embrioni prelevati a 4-8 cellule<br />
• Infezione con un retrovirus reso non patogeno<br />
con alcune parti sostituite con il gene di interesse<br />
• Impianto nella pseudo-madre<br />
• Alto numero di nati a mosaico<br />
• Possibili danni associati al retrovirus
Transgenesi mediata<br />
da spermatozoi<br />
Interazione spontanea<br />
DNA/spermatozoo<br />
Fecondazione<br />
Selezione della prole sulla<br />
analisi del DNA prelevato<br />
da coda o orecchio
Knock out<br />
Studiare la funzione di un gene e della sua proteina<br />
Riprodurre in un modello animale uno stato di malattia<br />
Eliminazione di un gene o delezione di 1 o + esoni<br />
Eliminazione di una proteina o di un dominio<br />
funzionale<br />
Gene targenting Topo Knock out<br />
Ricombinazione omologa<br />
Produzione di una proteina mutata<br />
Espressione della proteina abolita
Topo<br />
Vettore contenente il transgene e i marker<br />
Cellule staminali<br />
Ricombinazione omologa:<br />
Targeting genico<br />
Il DNA da inserire contiene parecchie kbasi omologhe al genoma di topo<br />
In lievito la ricombinazione omologa avviene nel corretto locus con<br />
frequenza molto alta<br />
Nei mammiferi la ricombinazione omologa nel corretto locus avviene con<br />
frequenza molto bassa. Southern blot e PCR per lo screening dei cloni.
Knock-out convenzionale<br />
Ricombinazione omologa nelle<br />
cellule staminali embrionali.<br />
(topo marrone)<br />
Selezione con G418 e gancyclovir<br />
Iniezione delle cellule transgeniche<br />
in una blastocisiti e impianto in una<br />
madre pseudogravida. (topo nero)<br />
Progenie chimerica<br />
Incrocio di eterozigoti per ottenere<br />
omozigote
Knock-out e ricerca di base<br />
Knock-out con fenotipo normale: ipotesi che altre proteine compensino<br />
la perdita della proteina abolita<br />
Knock-out con fenotipo inducibile da stress:la funzione genica è associata<br />
alla comparsa di stress ambientali o a eventi patologici. Ex: knock-out per<br />
il recettore dell’interferone I da fenotipo normale, ma mostra aumentata<br />
suscettibilità alle infezioni virali rispetto ai controlli.<br />
Knock-out con fenotipo letale: geni necessari per lo sviluppo embrionale che<br />
non consentono di ottenere topi adulti
Knock-out condizionale<br />
Transgenesi in cui il knockout di un gene può essere controllato<br />
temporalmente e spazialmente<br />
Transgenesi binaria: transgene effettore e transgene target.<br />
Il transgene effettore non influisce sull’espressione dei geni endogeni in quanto<br />
agisce solo sul transgene target<br />
Fase 1 Costruzione di knockin per il transgene target (espresso correttamente<br />
sino all’excisione)<br />
Fase 2 Costruzione di knockin per il transgene effettore<br />
Fase 3 Incrocio tra i due knockin per ottenere il knockout condizionale
2 tipi di transgenesi binaria<br />
1, effettore:fattore di trascrizione<br />
Il costrutto del transgene effettore è costituito da un promotore tessutospecifico<br />
(TSP) che regola la produzione di una proteina chimerica costituita dal repressore<br />
della Tetraciclina di E. coli (tetR) e dal dominio di transattivazione di VP16 (herpes<br />
simplex). Questa proteina tTA ha due domini uno lega la tetraciclina, l’altro una<br />
sequenza di 19bp nell’operone per la tetraciclina nel transgene attivandolo.
Tet-off: Il transattivatore regolato dalla tetraciclina (tTA) non<br />
può legare il DNA quando è presente l’induttore<br />
Tet-on: nel sistema inverso (rtTA) tTA lega il DNA solo<br />
quando è presente l’induttore.<br />
L’induttore utilizzato è la doxiciclina (Dox), analogo della<br />
tetraciclina,<br />
attiva rtTA e inattiva tTA in maniera efficiente a dosi al di sotto<br />
dei livelli citotossici.<br />
Poiché la Dox può attraversare la placenta nel<br />
topo transgenico e<br />
regolare efficientemente l’espressione genica<br />
durante l’embriogenesi, questi sistemi vengono<br />
impiegati per evitare l’espressione di un<br />
transgene letale nell’embrione.<br />
Effettore inducibile<br />
hCMV1E1: TSP, attivo in numerosi tessuti<br />
EFFETTO REVERSIBILE
2, effettore: ricombinasi<br />
Ricombinasi Cre e Flp: enzimi che fanno parte della famiglia delle integrasi ricombinasi sitospecifiche.<br />
La ricombinasi Cre è presente in natura nel batteriofago P1 ed ha un ruolo nel ciclo lisogenico, in<br />
quanto serve per l’integrazione del genoma fagico in quello batterico.<br />
La ricombinasi Flp deriva dal lievito Saccharomyces cerevisiae.<br />
Le due ricombinasi sono in grado di riconoscere specifiche sequenze di DNA chiamate<br />
rispettivamente sito loxP e sito FRT. Filamenti di DNA fiancheggiati da una coppia di tale siti<br />
vengono definiti “floxed” o “fliped”. I siti loxP e FRT sono costituiti da due distinte sequenze<br />
palindromiche di 13 nucleotidi ciascuna interrotte da una sequenza asimmetrica di 8 nucleotidi<br />
detta “spacer” che conferisce direzionalità al sito.
In base alla direzione ed alla posizione dei siti loxP oppure FRT su un filamento di DNA la ricombinasi Cre<br />
oppure Flp è in grado di catalizzare reazioni irreversibili di tre diversi tipi:<br />
Inversione:i siti loxP/FRT si trovano<br />
sullo stesso filamento di DNA ed<br />
hanno direzioni opposte.<br />
Traslocazione: i siti loxP/FRT si<br />
trovano su due filamenti diversi di<br />
DNA.<br />
Excisione: i siti loxP/FRT si trovano<br />
sullo stesso filamento ed hanno la<br />
stessa direzione.<br />
EFFETTO IRREVERSIBILE
Analisi di lineage cellulare<br />
La cre o la FLP sono regolate da un promotore tessuto specifico<br />
Il gene reporter è preceduto da uno STOP fiancheggiato da 2 siti lox o FRT<br />
• se il TSP non è attivato non si<br />
ha espressione del reporter<br />
• se il TSP è espresso si ha<br />
excisione dello STOP e espressione<br />
del reporter<br />
• l’irreversibilità della ricombinasi<br />
fa sì che il transgene si esprima<br />
nelle cellule figlie dove il TSP<br />
non è più attivo
Reporter: GFP, LacZ<br />
TSP: promotore tessuto<br />
Specifico<br />
UP: promotore ubiquitario<br />
Target<br />
Target<br />
Target
Verifiche per la corretta espressione dei transgeni<br />
• Effetti di posizione nella linea che esprime la ricombinasi Cre/FLP<br />
Inserzione di più copie del transgene floxato/flippato nel genoma: possibili instabilità<br />
cromosomiche, aneuploidia.<br />
• Importante: disponibilità di elementi regolatori della trascrizione che siano in<br />
grado di attivare l’espressione della ricombinasi cre in tutta una gamma di tessuti<br />
e a stadi diversi dello sviluppo. Attivazione temporale e spaziale dell’espressione<br />
della ricombinasi Cre<br />
Utilizzo di vettori, cromosomi artificiali:<br />
Derivazione da lievito: YAC si propagano in lievito contengono alcune Mbasi<br />
Derivazione da fago P1: PAC si propagano in E. coli contengono sino a 300Kbasi<br />
Derivazione da batteri: BAC si propagano in E. coli contengono sino a 300kbasi
Molti geni sono essenziali per la vita,<br />
lo sviluppo, la fertilità del topo.<br />
Il knock-out tradizionale di tali geni<br />
non consente la creazione di un topo<br />
knock-out<br />
Knock-out condizionale<br />
Tecnologia Cre/lox
Pharming<br />
Utilizzo di animali per la produzione di farmaci e sostanze utili all’uomo<br />
Nonostamte sia difficile e costoso i benefici possono essere<br />
potenzialmente elevati<br />
Biotech company: soldi e aumento vendite<br />
Persone ordinarie: riduzione del costo dei farmaci<br />
Sostituisce produzione di farmaci in E. coli, lievito, cellule animali:<br />
Monitoraggio e campionamento continuo<br />
Espansione e strumentazione nuova<br />
Modificazione di proteine permesse solo da cellule di mammifero<br />
Animali come bioreattori
Transgenesi utilizzata nella produzione di animali bioreattori<br />
Espressione sperimentale di geni umani in mammiferi:<br />
OVINI<br />
CAPRINI<br />
BOVINI<br />
SUINI<br />
CONIGLI<br />
LATTE (caratteristiche migliori per estrazione)<br />
SANGUE<br />
TESSUTI<br />
Previsto uso di somatotropina bovina per aumentare la produzione nei Paesi estraUE.<br />
In Europa i trattamenti ormonali sugli animali sono proibiti.<br />
Ex: anti-emorragico antitrombinaIII nella capra (latte)<br />
(08-06-2006 1° farmaco transgenico in commercio)<br />
alfa-1 antitripsina per terapia respiratoria nella pecora (latte)<br />
proteina C-reattiva nei suini<br />
Prove cliniche in corso
EX: espressione di un fattore di coagulazione nel latte vaccino<br />
Il gene per il fattore è fuso a un<br />
promotore per una proteina del latte<br />
Assicura che li transgene sia espresso<br />
solo nel latte<br />
Molte copie di DNA sono microiniettate<br />
nel pronucleo maschile di un uovo fecondato<br />
Impianto in una pseudomadre<br />
La microiniezione nel pronucleo ha efficenza<br />
molto bassa<br />
(15 transgenici su 100 nati)<br />
Microiniezione nel pronucleo
Trasfezione di cellule adulte con il<br />
transgene e un gene per selezione<br />
antibiotica<br />
Selezione delle cellule resistenti<br />
Il nucleo di tali cellule è trasferito in<br />
uovo in cui è stato rimosso il proprio<br />
nucleo<br />
Impianto<br />
Poiché tutti gli ovuli contengono il<br />
DNA transgenico, il 100% degli animali<br />
è transgenico<br />
Nuclear transfer<br />
clonazione<br />
Ri-differenziamento delle cellule adulte
Aspetti negativi della clonazione<br />
Integrazione del transgene nel genoma è:<br />
• rara<br />
• casuale:può inserirsi in regioni che possono essere<br />
deleterie per il gene stesso o per il gene in cui si<br />
inserisce<br />
• molti animali nascono con difetti:<br />
sotto- sovra-peso, organi interni sottosviluppati o<br />
deformati<br />
• nessuna garanzia che i nati transgenici siano sani,<br />
esprimano il transgene in grande quantità e nel<br />
tessuto giusto
Percentuali di successi di clonazioni in diversi animali<br />
Specie<br />
s<br />
Utilizzate cellule adulte<br />
Number of<br />
oocytes used<br />
Number of<br />
live offspring<br />
Notes<br />
Mouse 2468 31 (1.3%) -<br />
Bovine 440 6 (1.4%) 2 died<br />
Sheep 417 14 (3.4%) 11 died<br />
within 6<br />
months<br />
Pig 977 5 (0.5%) -<br />
Goat 285 3 (1.1%) -<br />
Yanagimachi, R. 2002. "Cloning: experience from the mouse and other animals." Molecular and Cellular Endocrinology. 21 March,<br />
187.
Mammal Cloning Timeline<br />
1984 – A live lamb was cloned from sheep<br />
embryo cells<br />
1986 – Early embryo cells were used to clone<br />
a cow<br />
1993 – Calves were produced by transfer of<br />
nuclei from cultured embryonic cells<br />
1995 – Two sheep, named Megan & Morag,<br />
were cloned using embryo cells<br />
1996 – Birth of Dolly, the first organism to be<br />
cloned from a fully differentiated adult cell<br />
1997 – Transgenic sheep named Polly was<br />
cloned containing a human gene<br />
Megan and Morag<br />
Dolly<br />
http://www.cnn.com/2001/<br />
WORLD/europe/08/06/clo<br />
From: student presentation Aman Arya, Nancy Chen, Dan Perz, Dave Reichert, Ronnie ne.critics/index.html<br />
Wong
Tetra<br />
1998 – 50 mice were cloned in three<br />
generations from a single mouse<br />
1998 – 8 calves were cloned from a single<br />
adult cow, but only 4 survived to their first<br />
birthday<br />
1999 – A female rhesus monkey named Tetra<br />
was cloned by splitting early embryo cells.<br />
2000 – Pigs and goats reported cloned from<br />
adult cells<br />
2002 – Rabbits and a kitten reported cloned<br />
from adult cells<br />
http://hs.houstonisd.org/h<br />
spva/academic/Science/<br />
Thinkquest/gail/text/bene<br />
fits.html
Dolly with her surrogate mother<br />
Dolly with her first<br />
newborn, Bonnie<br />
Dolly<br />
• Born in July 1996 at the Roslin<br />
Institute in Scotland<br />
• First mammal to be cloned<br />
from an adult mammal using the<br />
nuclear transfer technique<br />
• 277 attempts were made<br />
before the experiment was<br />
successful<br />
•Dolly died in February 14, 2003<br />
of progressive lung disease at<br />
the age of 6; whereas normal<br />
sheep can live up to 12 years of<br />
age.
Mammal Cloning allows propagation of<br />
endangered species<br />
http://www.howstuf<br />
fworks.com/cloning<br />
.htm/printable<br />
January 8, 2001 Noah, a baby bull gaur, became the first<br />
clone of an endangered animal.
Xenotrapianti<br />
Utilizzo di animali transgenici come donatori di organi per trapianti umani<br />
Tentativi con scarso successo con cuore, fegato e reni dei primati<br />
Possibile utilizzo degli organi dei suini:<br />
• dimensioni organi simili a quelli dell’uomo<br />
• creazione di transgeni che aboliscano il rigetto iperacuto e tardivo (knockout dei<br />
geni per molecole di superficie cellulari riconosciute come estranee)<br />
• creazione di transgeni che eliminino il rigetto Tmediato<br />
Rischio:<br />
Nel maiale sono presenti i retrovirus (PERV, porcine endogenous retrovirus) e i<br />
retrotrasposoni.<br />
Elementi genetici mobili, che costituiscono quasi il 50% del genoma dei mammiferi<br />
Possono staccarsi da un distretto e introdursi in altre zone del genoma con azione<br />
mutagena.<br />
Tali elemanti si sono introdotti durante l’evoluzione e sono in equilibrio che evita<br />
Danni genetici. In caso di xenotrapianto si potrebbe perdere questo equilibrio<br />
Dimostrato il passaggio di retrovirus endogeni di maiale in cellule umane coltivate
Terapia genica<br />
La terapia genica è quell'intervento tendente a modificare localmente<br />
la condizione del fenotipo, alterato da una mutazione, attraverso la<br />
sostituzione funzionale del gene alterato col corrispondente gene<br />
sano.<br />
Interessa solo la linea somatica
Terapia genica<br />
SCID: severe combined immunodeficiency, causata da mutazioni nella<br />
proteina γ dei recettori per alcune IL necessarie per lo sviluppo dei<br />
linfociti B e T. Gli affetti da SCID sono privi di un sistema immunitario<br />
funzionante.<br />
Il gene γIL è sul cromosoma X, quindi in maschi con la mutazione sono<br />
affetti, le femmine eterozigoti per la mutazione sono sane ma portatrici<br />
Affetto da SCID<br />
Vissuto in “bolla di plastica” in condizioni sterili.<br />
Nel 1980 gli viene trapiantato il midollo osseo,<br />
donatrice la sorella.<br />
Dopo mesi insorgono complicanze, febbre, vomito e<br />
diarrea. È costretto a uscire dalla bolla.<br />
Nel 1984 muore in seguito a molteplici tumori insorti<br />
a causa della presenza di Epstein Bar virus non<br />
segnalato nel midollo della sorella<br />
Il ragazzo della bolla<br />
di plastica. David Phillip Vetter<br />
September 21, 1971 – February 22, 1984
1990: primo caso di cura di SCID con terpaia genica su di una<br />
bambina di 4 anni.<br />
Le cellule del sangue messe in coltura e transfettate con il gene<br />
corretto e reinfuse nella paziente<br />
Da allora pochi i tentativi con successo dal punto di vista clinico.<br />
Le numerose ricerche sono ancora volte alla messa a punto di sistemi<br />
efficienti e sicuri di terapia
In vivo: Viene attuata in tutti quei casi in cui le cellule non possono essere<br />
messe in cultura o prelevate o reinfuse come quelle del cervello o del cuore<br />
e della maggior parte degli organi interni. In questo caso il gene d’interesse<br />
viene inserito, tramite un opportuno vettore, nell’organismo direttamente per<br />
via locale o sistemica.<br />
Ex vivo:<br />
In generale, il protocollo adottato nella terapia genica consiste nel prelevare le<br />
cellule di interesse dal paziente, a metterle in coltura e a transfettarle o infettarle<br />
con un virus ingegnerizzato con il costrutto contenente il gene normale;<br />
Tale procedura è sicuramente la più lunga e la più costosa delle due ma permette di<br />
selezionare ed amplificare le cellule d’interesse ed inoltre<br />
gode d’una maggior efficienza. E’ attualmente la modalità più utilizzata ma è<br />
riservata solamente a quei casi in cui sia possibile prelevare, mettere le cellule in<br />
cultura e reinserirle nell'organismo
Non virali:<br />
Metodologie del trasferimento del DNA<br />
• Microiniezione in singole cellule del DNA nudo<br />
• Liposomi, vescicole sferiche cationiche legano il DNA che a pH neutro è negativo.<br />
0,1% del DNA introdotto è espresso<br />
• Polimeri cationici, azione simile a quella dei liposomi<br />
• Gene gun, inviano nella cellula particelle microscopiche d’oro o di tungsteno<br />
ricoperte da DNA (al momento non esistono studi sull’uomo, ma solo su animali)<br />
Virali:<br />
Retrovirus, lentivirus, Adenovirus, herpesvirus attenuati
Virali:<br />
Retrovirus: hanno la capacità di integrare il loro DNA all’interno dei cromosomi delle cellule bersaglio<br />
determinando l’inserimento stabile del gene nei cromosomi della cellule infettata e il suo trasferimento a tutte le<br />
cellule figlie; i retrovirus infettano solo cellule che stanno proliferando;<br />
Lentivirus, come l'HIV: che permettono di trasferire materiale genetico anche in cellule che non proliferano,<br />
come le cellule "mature" (es. neuroni, cellule del fegato ) o in cellule particolarmente refrattarie ai retrovirus (es.<br />
cellule staminali prelevate del midollo osseo);<br />
Virus adenoassociati che integrano il loro DNA nei cromosomi della cellula ospite come i retrovirus, ma<br />
hanno rispetto a questi il vantaggio di essere per natura innocui; difficilmente trasportano geni di grandi<br />
dimensioni.<br />
Adenovirus:che non si integrano nei cromosomi della cellula ospite, ma possono trasportare geni di grosse<br />
dimensioni; tuttavia la loro espressione non dura nel tempo.<br />
Virus dell’herpes simplex infettano soltanto alcuni tipi di cellule, in particolare i neuroni e sono quindi<br />
indicati per la terapia di patologie neurologiche.
La sicurezza della procedura<br />
Selettività del bersaglio<br />
I limiti della terapia genica<br />
Questo è un problema particolarmente evidente per i vettori virali. Alcuni<br />
di questi derivano infatti da virus pericolosi, come l’HIV. E’ quindi<br />
necessario che prima dell’utilizzo questi vettori siano privati della virulenza<br />
originaria del virus e mantengano invece inalterata la capacità di infettare<br />
le cellule bersaglio.<br />
Efficienza di trasferimento<br />
Negli studi sulla terapia genica, la maggior parte degli sforzi si concentra<br />
oggi sulla ricerca di vettori in grado di trasferire il DNA in modo efficiente<br />
e di inserirlo stabilmente nelle cellule.<br />
In questi ultimi anni sono stati messi a punto una varietà di vettori, alcuni<br />
dei quali in grado di fare esprimere il gene estraneo in uno specifico tipo<br />
cellulare (come i globuli bianchi, le cellule del muscolo, delle vie respiratorie<br />
ecc…).
Durata dell’espressione del gene trasferito<br />
La terapia genica risulta praticamente inutile se l’espressione del gene "estraneo" non viene mantenuta per un<br />
tempo sufficiente. Le ricerche mirano a sviluppare sistemi che permettono un espressione duratura, in modo da<br />
sottoporre il paziente ad un unico trattamento, o al limite a trattamenti ripetuti a distanza di qualche anno.<br />
La reazione immunitaria<br />
Come ogni altra sostanza estranea, il prodotto del gene nuovo, il gene stesso e soprattutto il vettore possono<br />
scatenare una risposta immunitaria da parte dell’organismo ospite. Questa può portare all’eliminazione delle cellule<br />
modificate geneticamente, o all’inattivazione della proteina prodotta dal nuovo gene, annullando quindi tutti gli<br />
effetti della terapia. Nello sviluppo delle nuove strategie di terapia genica si cerca di evitare per quanto possibile che<br />
il vettore o il gene estraneo producano una reazione immunitaria.
Nel 1989 è stata approvata la prima sperimentazione sull’uomo di un protocollo di terapia genica.<br />
Da allora, di più di mille protocolli sono stati approvati in tutto il mondo; di questi alcuni si sono conclusi, altri sono in<br />
corso.<br />
Più del 90% delle sperimentazioni sono in fasi molto precoci del protocollo (fase I o II) (vedi figura1). Queste fasi iniziali<br />
permettono di valutare l’eventuale tossicità del trattamento, l’efficacia del trasferimento genico e l’espressione a<br />
breve/medio termine del materiale genetico introdotto.<br />
E’ nelle fasi successive (dalla III) che si valuta invece in modo più approfondito la reale efficacia del trattamento in<br />
funzione della cura.<br />
Ad oggi, la FDA americana (Food and Drug Administration), l’ente governativo cui spetta l’approvazione di nuovi<br />
trattamenti terapeutici affinché possano essere introdotti nella pratica medica corrente, non ha autorizzato la<br />
commercializzazione di nessun prodotto di terapia genica.<br />
Dal 1998 al 2005
Dal 1998 al 2005