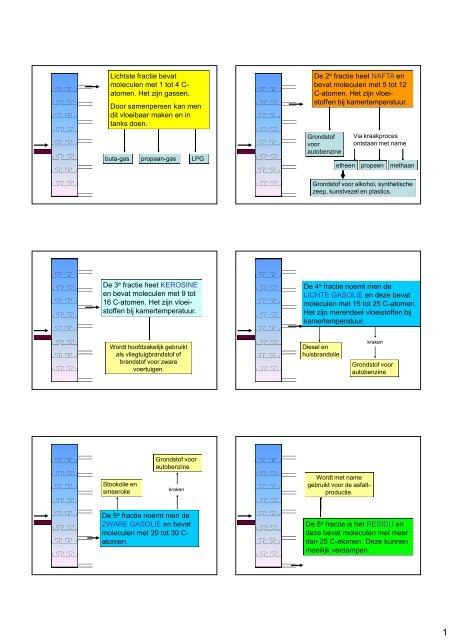
Lichtste fractie bevat moleculen met 1 tot 4 C- atomen. Het ... - eu-re-ka
Lichtste fractie bevat moleculen met 1 tot 4 C- atomen. Het ... - eu-re-ka
Lichtste fractie bevat moleculen met 1 tot 4 C- atomen. Het ... - eu-re-ka
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Lichtste</strong> <strong>fractie</strong> <strong>bevat</strong><br />
<strong>moleculen</strong> <strong>met</strong> 1 <strong>tot</strong> 4 C<strong>atomen</strong>.<br />
<strong>Het</strong> zijn gassen.<br />
Door samenpersen <strong>ka</strong>n men<br />
dit vloeibaar maken en in<br />
tanks doen.<br />
buta-gas propaan-gas LPG<br />
De 3 e <strong>fractie</strong> heet KEROSINE<br />
en <strong>bevat</strong> <strong>moleculen</strong> <strong>met</strong> 9 <strong>tot</strong><br />
16 C-<strong>atomen</strong>. <strong>Het</strong> zijn vloeistoffen<br />
bij <strong>ka</strong>mertemperatuur.<br />
Wordt hoofdzakelijk gebruikt<br />
als vliegtuigbrandstof of<br />
brandstof voor zwa<strong>re</strong><br />
voertuigen.<br />
Stookolie en<br />
smeerolie<br />
Grondstof voor<br />
autobenzine<br />
kraken<br />
De 5 e <strong>fractie</strong> noemt men de<br />
ZWARE GASOLIE en <strong>bevat</strong><br />
<strong>moleculen</strong> <strong>met</strong> 20 <strong>tot</strong> 30 C<strong>atomen</strong>.<br />
De 2 e <strong>fractie</strong> heet NAFTA en<br />
<strong>bevat</strong> <strong>moleculen</strong> <strong>met</strong> 5 <strong>tot</strong> 12<br />
C-<strong>atomen</strong>. <strong>Het</strong> zijn vloeistoffen<br />
bij <strong>ka</strong>mertemperatuur.<br />
Grondstof<br />
voor<br />
autobenzine<br />
Via kraakproces<br />
ontstaan <strong>met</strong> name<br />
etheen propeen <strong>met</strong>haan<br />
Grondstof voor alkohol, synthetische<br />
zeep, kunstvezel en plastics.<br />
De 4 e <strong>fractie</strong> noemt men de<br />
LICHTE GASOLIE en deze <strong>bevat</strong><br />
<strong>moleculen</strong> <strong>met</strong> 15 <strong>tot</strong> 25 C-<strong>atomen</strong>.<br />
<strong>Het</strong> zijn me<strong>re</strong>ndeel vloeistoffen bij<br />
<strong>ka</strong>mertemperatuur.<br />
Diesel en<br />
huisbrandolie<br />
kraken<br />
Grondstof voor<br />
autobenzine<br />
Wordt <strong>met</strong> name<br />
Stookolie gebruikt voor en de asfalt-<br />
smeerolie productie.<br />
De 6 e <strong>fractie</strong> is het RESIDU en<br />
deze <strong>bevat</strong> <strong>moleculen</strong> <strong>met</strong> meer<br />
dan 25 C-<strong>atomen</strong>. Deze kunnen<br />
moeilijk verdampen.<br />
1
Een tetraëder is een<br />
<strong>re</strong>gelmatig viervlak.<br />
De ruimtelijke structuur<br />
Als basis voor de ruimtelijke (3 dimensionale) opbouw<br />
die bij <strong>moleculen</strong> voorkomt dient het tetraëder.<br />
<strong>Het</strong> aantal bindingen<br />
dat een atoom <strong>ka</strong>n<br />
aangaan <strong>met</strong> ande<strong>re</strong><br />
<strong>atomen</strong> verschilt per<br />
atoomsoort.<br />
Bv<br />
Een C-atoom <strong>ka</strong>n 4<br />
bindingen aangaan<br />
en een H-atoom<br />
slechts 1 binding.<br />
Dit viervlak is opgebouwd uit 4<br />
gelijk-zijdige driehoeken.<br />
Naam Symbool<br />
Maar ook<br />
Bv <strong>met</strong>haan<br />
Aantal<br />
bindingen<br />
(covalentie)<br />
Waterstof H 1<br />
Zuurstof en zwavel O en S 2<br />
Stikstof en fosfor N en P 3<br />
Koolstof en silicium C en Si 4<br />
De halogenen F, Cl, Br, I 1<br />
De 4 bindingen wijzen<br />
vanuit het centrale atoom<br />
naar de hoekpunten van de<br />
tetraëder.<br />
de omringende <strong>atomen</strong><br />
bevinden zich op de<br />
hoekpunten<br />
Zo <strong>ka</strong>n bv een<br />
zuurstofatoom<br />
2 bindingen<br />
aangaan <strong>met</strong><br />
ande<strong>re</strong> <strong>atomen</strong>.<br />
<strong>Het</strong> aantal bindingen<br />
dat een atoom <strong>ka</strong>n<br />
aangaan heet de<br />
covalentie van<br />
dat atoom.<br />
Bv in<br />
ethanol<br />
Soms is sprake zijn van een dubbele binding tussen twee<br />
<strong>atomen</strong>. De belangrijkste voorbeelden staan hieronder.<br />
Elk st<strong>re</strong>epje stelt 1 atoombinding voor.<br />
Er zijn zelfs drievoudige bindingen mogelijk.<br />
2
Chemici werken vaak <strong>met</strong><br />
formules. Je krijgt dan voor<br />
ethanol het volgende:<br />
(Dit noemen we structuurformules).<br />
<strong>Het</strong> <strong>ka</strong>n nog simpeler:<br />
Of verder<br />
ve<strong>re</strong>envoudigd:<br />
Daarnaast gebruiken chemici vaak de molecuulformule. In<br />
molecuulformules staat alleen het aantal <strong>atomen</strong><br />
aangegeven. Dat zegt dus niets meer over de structuur.<br />
of<br />
of<br />
C 2H 6O<br />
Methaan is het eenvoudigste al<strong>ka</strong>an. <strong>Het</strong><br />
bezit slechts één C-atoom omringd door 4 H<strong>atomen</strong>.<br />
Methaan is het hoofdbestanddeel<br />
van aardgas. Methaan is r<strong>eu</strong>kloos. Om voor<br />
een gaslek te waarschuwen wordt een<br />
g<strong>eu</strong>rstof toegevoegd.<br />
De stof staat ook wel bekend als “mijngas”.<br />
<strong>Het</strong> heeft <strong>re</strong>eds vele ongelukken veroorzaakt<br />
in de mijnen. Methaan is uiterst brandbaar.<br />
In de algemene formule van al<strong>ka</strong>nen C nH 2n+2<br />
geldt: n=1<br />
Propaan is de 3 e koolwaterstof in de <strong>re</strong>eks<br />
der al<strong>ka</strong>nen. <strong>Het</strong> bezit 3 C-<strong>atomen</strong> en 8 H<strong>atomen</strong>.<br />
Samengeperst <strong>tot</strong> vloeistof in een<br />
tank vindt het toepassing als brandstof<br />
voor verwarming, koken, enz. Ook in LPG<br />
wordt het toegepast.<br />
In de algemene formule van al<strong>ka</strong>nen<br />
C nH 2n+2 geldt voor propaan: n=3<br />
Ruimtelijke tekening<br />
(model)<br />
Structuurtekening<br />
Structuurformule<br />
Ve<strong>re</strong>envoudigde<br />
structuurformules<br />
Samenvatting<br />
Molecuulformule C 2H 6O<br />
Ethaan is de 2 e koolwaterstof in de<br />
<strong>re</strong>eks der al<strong>ka</strong>nen. <strong>Het</strong> bezit 2 C<strong>atomen</strong><br />
en 6 H-<strong>atomen</strong>. Ethaan is<br />
een grondstof voor de fabricage<br />
van etheen en azijnzuur. Ethaan is<br />
r<strong>eu</strong>kloos en zeer brandbaar.<br />
In de algemene formule van<br />
al<strong>ka</strong>nen C nH 2n+2 geldt voor ethaan:<br />
n=2<br />
Butaan is de 4 e koolwaterstof in de<br />
<strong>re</strong>eks der al<strong>ka</strong>nen. <strong>Het</strong> bezit 4 C<strong>atomen</strong><br />
en 10 H-<strong>atomen</strong>. Evenals<br />
propaan vindt het toepassing als<br />
brandstof voor verwarming, koken,<br />
enz. Met name op campings.<br />
In de algemene formule van<br />
al<strong>ka</strong>nen C nH 2n+2 geldt voor butaan:<br />
n=4<br />
3
1<br />
2<br />
3<br />
4<br />
5<br />
6<br />
7<br />
8<br />
9<br />
10<br />
Naamgeving al<strong>ka</strong>nen<br />
Algemene formule<br />
C nH 2n+2<br />
Ma<br />
En<br />
Pa<br />
Bakken<br />
Patat<br />
Heel<br />
Heerlijk<br />
Of<br />
Niet<br />
Dan??<br />
Methaan<br />
1 Methyl<br />
Ethaan<br />
2 Ethyl<br />
Propaan<br />
3 Propyl<br />
Butaan<br />
4 Butyl<br />
Pentaan<br />
5 Pentyl<br />
Hexaan<br />
6 Hexyl<br />
Heptaan<br />
7 Heptyl<br />
Oktaan<br />
8 Oktyl<br />
Nonaan<br />
9 Nonyl<br />
Decaan<br />
10 Decyl<br />
Naamgeving vertakte al<strong>ka</strong>nen<br />
zijtakken<br />
<strong>Het</strong> aantal C-<strong>atomen</strong> in de langste<br />
ononderbroken keten bepaalt de stamnaam<br />
van het molecuul.<br />
De volgorde van de zijgroepen is alfabetisch<br />
(NB: <strong>re</strong>ken de voorvoegsels di, tri, etc niet mee in<br />
de naam)<br />
Naamgeving onvertakte al<strong>ka</strong>nen<br />
<strong>Het</strong> aantal C-<strong>atomen</strong> in de langste<br />
ononderbroken keten bepaalt de naam van<br />
het molecuul.<br />
Aantal C naam<br />
H<br />
|<br />
H— C—H 1 <strong>met</strong>haan<br />
|<br />
H<br />
H H<br />
| |<br />
2 H— C—C—H<br />
ethaan<br />
| |<br />
H H<br />
| | |<br />
3 —C—C—C— propaan<br />
| | |<br />
| | | |<br />
—C—C—C—C—<br />
4 butaan<br />
| | | |<br />
Naamgeving vertakte al<strong>ka</strong>nen<br />
<strong>Het</strong> aantal C-<strong>atomen</strong> in de langste<br />
ononderbroken keten bepaalt de stamnaam<br />
van het molecuul.<br />
<strong>Het</strong> aantal C-<strong>atomen</strong> in de zijketen bepaalt de<br />
naam van de zijgroep. De naam van de<br />
zijgroep eindigt op –yl.<br />
Naamgeving vertakte al<strong>ka</strong>nen<br />
CH 3<br />
| | | | | |<br />
— C—C—C—C—C—C —<br />
| | | | | |<br />
2 e 1 e<br />
CH 3<br />
CH 3<br />
| | | | |<br />
— C—C—C—C—C—<br />
| | | | | |<br />
—C—C—<br />
| |<br />
2 e 4 e<br />
2-<strong>met</strong>hylhexaan 2,4-di<strong>met</strong>hylheptaan<br />
CH3 | | | | |<br />
— C—C—C—C—C—<br />
| | | | | |<br />
CH3 —C—C—<br />
| |<br />
2,2-di<strong>met</strong>hylheptaan<br />
| | | | | |<br />
—C—C—C—C—C—C—<br />
| | | | | |<br />
CH3 C2H5 4-ethyl-2-<strong>met</strong>hyl hexaan<br />
4
vergis je niet in de langste keten de hoofdketen bepaalt de naam<br />
C<br />
C C C C<br />
H 2<br />
C<br />
C<br />
H 2<br />
C<br />
H 3<br />
C<br />
H 3<br />
H 2<br />
C<br />
C<br />
(H-<strong>atomen</strong> in de<br />
langste keten voor het<br />
gemak weggelaten)<br />
H 3<br />
H 2<br />
C<br />
C C C C<br />
C<br />
C<br />
C<br />
C<br />
C<br />
C<br />
de langste keten bestaat<br />
dus uit 8 C-<strong>atomen</strong>.<br />
de C-<strong>atomen</strong> <strong>met</strong> een zijketen krijgen een<br />
rangnummer<br />
C8<br />
C1<br />
H 2<br />
C C C C<br />
C<br />
C<br />
2<br />
3<br />
C<br />
1<br />
C<br />
7<br />
4 5 6<br />
C<br />
C<br />
H 2<br />
H 3<br />
Deze nummering is foutief: de<br />
zijketens zouden aan nr 4 en 6<br />
zitten.<br />
H 2<br />
C C C C<br />
6<br />
7<br />
5<br />
C<br />
C<br />
C<br />
C<br />
H 2<br />
H 3<br />
C<br />
C<br />
Deze nummering is juist: de<br />
zijketens zitten aan nr 3 en 5<br />
zitten.<br />
We kiezen de nummering waarin de<br />
laagste getallen voorkomen.<br />
1 2 3 4<br />
C<br />
C<br />
F<br />
ande<strong>re</strong> groepen als zijketen<br />
C C C C C<br />
CH 3<br />
Br<br />
5<br />
6 7<br />
CH 3<br />
2-fluor-4,6-di<strong>met</strong>hyl-5-broomheptaan ??????<br />
Fout, want de zijketens moeten alfabetisch in de naam<br />
5-broom-4,6-di<strong>met</strong>hyl-2-fluorheptaan ??????<br />
Fout, want de alfabet<strong>re</strong>gel geldt niet voor voorvoegsels<br />
5-broom-2-fluor-4,6-di<strong>met</strong>hylheptaan ??????<br />
Nog steeds niet helemaal goed<br />
4<br />
8<br />
3<br />
2<br />
H 2<br />
H 3<br />
C<br />
C C C C<br />
H 2<br />
C<br />
C<br />
H 2<br />
C<br />
H 3<br />
C<br />
H 3<br />
H 2<br />
C<br />
C<br />
(H-<strong>atomen</strong> in de langste<br />
keten voor het gemak<br />
weggelaten)<br />
H 3<br />
H 2<br />
C<br />
C C C C<br />
De stamnaam is dus<br />
niet pentaan maar. octaan<br />
de C-<strong>atomen</strong> <strong>met</strong> een zijketen<br />
De ethyl-groep zit aan nr 3<br />
De <strong>met</strong>hyl-groep zit aan nr 5<br />
H 2<br />
De zijketens worden in alfabetische<br />
volgorde vermeld in de naam<br />
voorafgegaan door het rangnummer.<br />
Naam: 3-ethyl-5-<strong>met</strong>hyloctaan<br />
Met als naam:<br />
Je had:<br />
C<br />
C<br />
5<br />
C<br />
C<br />
C<br />
C C C C<br />
6<br />
7<br />
C<br />
C<br />
5-broom-2-fluor-4,6-di<strong>met</strong>hylheptaan<br />
Som van de rangnummers moet zo laag<br />
mogelijk zijn<br />
Van <strong>re</strong>chts naar links<br />
7<br />
C<br />
1 2 3 4<br />
C<br />
4<br />
C<br />
8<br />
C<br />
3<br />
1<br />
2<br />
C<br />
C<br />
H 2<br />
H 3<br />
C<br />
C<br />
C C C C C<br />
F CH3 CH3 3-broom-6-fluor-2,4-di<strong>met</strong>hylheptaan ??????<br />
6<br />
C<br />
C<br />
F<br />
Cor<strong>re</strong>ct: immers 15
CH3 │ │ │ │<br />
—C—C—C—C—<br />
│ │ │ │<br />
CH 3<br />
CH3 │ │ │ │<br />
—C—C—C—C—<br />
│ │ │ │<br />
CH2 │<br />
CH3 2,3-di<strong>met</strong>hylbutaan 2-ethyl-3-<strong>met</strong>hylbutaan<br />
De langste keten bestaat niet uit 4, maar uit 5 C-<strong>atomen</strong><br />
De juiste naam is dus 2,3-di<strong>met</strong>hylpentaan<br />
Naamgeving cyclische al<strong>ka</strong>nen<br />
De C-<strong>atomen</strong> kunnen ook in een ring zitten<br />
cyclo-al<strong>ka</strong>nen. Let op: C nH 2n<br />
De naamgeving gaat hetzelfde alleen wordt nu de<br />
toevoeging cyclo voor de stamnaam gezet.<br />
cyclo-butaan<br />
cyclo-pentaan<br />
structuurformules en namen van alle isome<strong>re</strong>n van<br />
C 5H 12<br />
| | | |<br />
—C—C—C—C—<br />
| | | |<br />
—C—<br />
|<br />
Isome<strong>re</strong>n en isomerie<br />
| | | | |<br />
—C—C—C—C—C—<br />
| | | | |<br />
2-<strong>met</strong>hylbutaan<br />
|<br />
—C—<br />
| | |<br />
—C—C—C—<br />
| | |<br />
—C—<br />
|<br />
di<strong>met</strong>hylpropaan<br />
pentaan<br />
Als een rangnummer overbodig is moet je het weglaten.<br />
CH3 │ │ │<br />
—C—C—C—<br />
│ │ │<br />
│<br />
C—<br />
│<br />
Dus niet: 2-<strong>met</strong>hylbutaan<br />
De juiste naam is <strong>met</strong>hylbutaan<br />
CH 3<br />
│ │ │ │ │<br />
—C—C—C— C— C—<br />
│ │ │ │ │<br />
Maar wel: 2-<strong>met</strong>hylpentaan<br />
Want 3-<strong>met</strong>hylpentaan is een ande<strong>re</strong> stof<br />
Van dezelfde molecuulformule kunnen<br />
verschillende structuurformules bestaan.<br />
Dit noemen we isomerie.<br />
Isome<strong>re</strong>n zijn <strong>moleculen</strong> <strong>met</strong> dezelfde molecuulformule<br />
maar een ande<strong>re</strong> structuurformule.<br />
| | | |<br />
—C—C—C—C—<br />
| | | |<br />
butaan = C 4H 10<br />
Isome<strong>re</strong>n en isomerie<br />
| | |<br />
—C—C—C—<br />
| | |<br />
—C—<br />
|<br />
<strong>met</strong>hylpropaan = C 4H 10<br />
structuurformules en namen van alle isome<strong>re</strong>n van<br />
C 6H 14<br />
| | | | | |<br />
—C—C—C—C—C—C—<br />
| | | | | |<br />
| | | | |<br />
—C—C—C—C—C—<br />
| | | | |<br />
—C—<br />
|<br />
| | | | |<br />
—C—C—C—C—C—<br />
| | | | |<br />
—C—<br />
|<br />
Isome<strong>re</strong>n en isomerie<br />
hexaan<br />
2-<strong>met</strong>hylpentaan<br />
3-<strong>met</strong>hylpentaan<br />
|<br />
—C—<br />
| | | |<br />
—C—C—C—C—<br />
| | | |<br />
—C—<br />
|<br />
|<br />
—C—<br />
| | | |<br />
—C—C—C—C—<br />
| | | |<br />
—C—<br />
|<br />
2,2-di<strong>met</strong>hylbutaan<br />
2,3-di<strong>met</strong>hylbutaan<br />
6