Quando adicionamos sal comum (NaCl) à água, s - piratini
Quando adicionamos sal comum (NaCl) à água, s - piratini
Quando adicionamos sal comum (NaCl) à água, s - piratini
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
COLÉGIO ESTADUAL PIRATINI<br />
DISCIPLINA: QUÍMICA – 2° ANO<br />
ASSUNTO: SOLUÇÕES<br />
PROFESSORA: GLÁUCIA COSTA<br />
ALUNO:______________________________________________________ DATA:____/____/____ TURMA:______<br />
Lista de exercícios extras - QUÍMICA<br />
Assunto: Soluções + concentração<br />
01 - <strong>Quando</strong> <strong>adicionamos</strong> <strong>sal</strong> <strong>comum</strong> (<strong>NaCl</strong>) <strong>à</strong> <strong>água</strong>, sob agitação e temperatura constantes,<br />
verificamos que, em dado momento, o <strong>sal</strong> não se dissolve mais. No caso do <strong>NaCl</strong>, isso ocorre<br />
quando há, aproximadamente, 360g de <strong>sal</strong> por 1000 mL de <strong>água</strong>. Se adicionarmos 500g de <strong>NaCl</strong><br />
em 1000 mL de <strong>água</strong>, nas mesmas condições acima, estaremos preparando uma solução que<br />
será classificada como uma:<br />
a) solução saturada sem <strong>sal</strong> precipitado.<br />
b) solução saturada com <strong>sal</strong> precipitado.<br />
c) solução supersaturada.<br />
d) solução insaturada.<br />
e) solução supersaturada instável.<br />
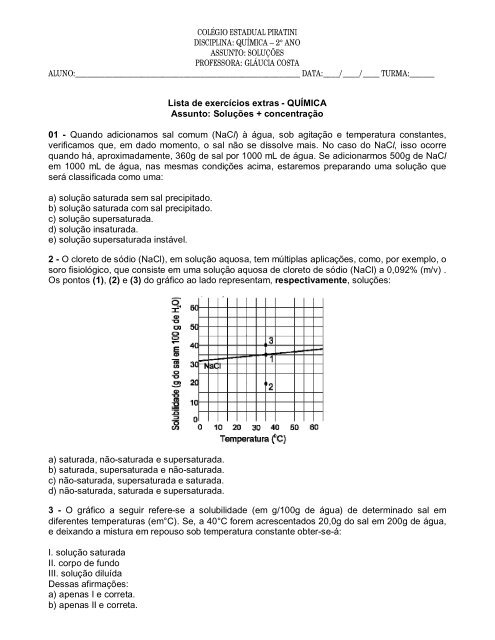
2 - O cloreto de sódio (<strong>NaCl</strong>), em solução aquosa, tem múltiplas aplicações, como, por exemplo, o<br />
soro fisiológico, que consiste em uma solução aquosa de cloreto de sódio (<strong>NaCl</strong>) a 0,092% (m/v) .<br />
Os pontos (1), (2) e (3) do gráfico ao lado representam, respectivamente, soluções:<br />
a) saturada, não-saturada e supersaturada.<br />
b) saturada, supersaturada e não-saturada.<br />
c) não-saturada, supersaturada e saturada.<br />
d) não-saturada, saturada e supersaturada.<br />
3 - O gráfico a seguir refere-se a solubilidade (em g/100g de <strong>água</strong>) de determinado <strong>sal</strong> em<br />
diferentes temperaturas (em°C). Se, a 40°C forem acrescentados 20,0g do <strong>sal</strong> em 200g de <strong>água</strong>,<br />
e deixando a mistura em repouso sob temperatura constante obter-se-á:<br />
I. solução saturada<br />
II. corpo de fundo<br />
III. solução diluída<br />
Dessas afirmações:<br />
a) apenas I e correta.<br />
b) apenas II e correta.
c) apenas III e correta.<br />
d) I, II e III são corretas.<br />
e) I, II e III são INCORRETAS.<br />
4 - A curva de solubilidade de um <strong>sal</strong> hipotético é:<br />
Se a 20°C misturarmos 20g desse <strong>sal</strong> com 100g de <strong>água</strong>, quando for atingido o equilíbrio,<br />
podemos afirmar que:<br />
a) 5 g do <strong>sal</strong> estarão em solução.<br />
b) 15 g do <strong>sal</strong> será corpo de fundo (precipitado).<br />
c) o <strong>sal</strong> não será solubilizado.<br />
d) todo o <strong>sal</strong> estará em solução.<br />
e) 5 g do <strong>sal</strong> será corpo de fundo (precipitado).<br />
5 - O teor de oxigênio dissolvido na <strong>água</strong> é um parâmetro importante na determinação das<br />
propriedades químicas e biológicas da <strong>água</strong>. Para se determinar a concentração de oxigênio,<br />
pode-se utilizar pequenas porções de palha de aço. Colocando uma porção de palha de aço em<br />
contato com 1 litro de <strong>água</strong>, por 5 dias em um recipiente fechado, observou-se que a massa de<br />
ferrugem (óxido de ferro III) formada foi de 32 mg. Escreva a equação química para a reação de<br />
oxidação do ferro metálico e determine a concentração, em g.L–1, de O2 na <strong>água</strong> analisada.<br />
Massas molares, em g.mol –1 : Fe = 56 e O = 16.<br />
6 - As instruções da bula de um medicamento usado para reidratação estão resumidas no quadro,<br />
a seguir. Modo de usar: dissolva o conteúdo do envelope em 500 mL de <strong>água</strong>. Composição: cada<br />
envelope contém<br />
cloreto de potássio 75 mg<br />
citrato de sódio diidratado 145 mg<br />
cloreto de sódio 175 mg<br />
glicose 10 g<br />
Calcule a concentração de potássio, em mg/L, na solução preparada segundo as instruções da<br />
bula.<br />
(R: 78,6 g/L)<br />
7 - O rótulo de um recipiente de leite em pó indica:<br />
Composição média por 100g de pó<br />
Gorduras....................................... 1,0g<br />
Proteínas..................................... 36,0g<br />
Lactose........................................ 52,0g<br />
Sais minerais................................. 8,0g<br />
Água.............................................. 3,0g<br />
Valor energético......................... 180kcal
O fabricante recomenda usar 2 colheres das de sopa para um copo de 200mL.<br />
Considerando que cada colher contém 20g do leite em pó, determine a quantidade de gordura<br />
que se ingere, ao beber todo o conteúdo de um copo.<br />
(R: 0,4 g)<br />
8 - Calcule a concentração em g/L de uma solução aquosa de sulfato de potássio que contém 45g<br />
do <strong>sal</strong> dissolvido em 500cm 3 de solução.<br />
(R: 90 g/L)<br />
9 - Sabendo que uma solução de H2SO4 tem C = 50g/L, determine o volume dessa solução que<br />
contém 2,5g do ácido.<br />
(R: 0,05L)<br />
10 - O soro caseiro consiste em uma solução de cloreto de sódio (<strong>NaCl</strong> – 3,5 g/l ) e de sacarose (<br />
11g/l ). Quais as massa de cloreto e sacarose necessárias p/ o preparo de 4litros de soro?<br />
(R: 14g e 44g)<br />
Gabarito:<br />
Para validar as questões é<br />
necessário mostrar os cálculos. OK!<br />
Bons estudos!!!<br />
1 2 3 4 5 6 7 8 9 10<br />
B A B E 9,6E-3g/L 78,6 g/L 0,4g 90 g/L 0,05L 14g e 44g<br />
5) 4Fe + 3 O2 = 2Fe2O3