Medindo Calor Vimos que calor é o fluxo de energia de um ... - Faccat
Medindo Calor Vimos que calor é o fluxo de energia de um ... - Faccat
Medindo Calor Vimos que calor é o fluxo de energia de um ... - Faccat
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Medindo</strong> <strong>Calor</strong><br />
<strong>Vimos</strong> <strong>que</strong> <strong>calor</strong> <strong>é</strong> o <strong>fluxo</strong> <strong>de</strong> <strong>energia</strong> <strong>de</strong> <strong>um</strong> objeto para outro <strong>de</strong>vido a <strong>um</strong>a diferença <strong>de</strong><br />
temperatura. Uma vez <strong>que</strong> <strong>calor</strong> <strong>é</strong> <strong>um</strong>a forma <strong>de</strong> <strong>energia</strong>, ele <strong>é</strong> medido em joules. Outra unida<strong>de</strong> mais<br />
com<strong>um</strong> <strong>de</strong> <strong>calor</strong> <strong>é</strong> a <strong>calor</strong>ia (a relação entre <strong>calor</strong>ias e joules <strong>é</strong> 1 <strong>calor</strong>ia = 4,184 joules). A <strong>calor</strong>ia <strong>é</strong> <strong>de</strong>finida<br />
como a quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> re<strong>que</strong>rida para alterar a temperatura <strong>de</strong> <strong>um</strong> grama <strong>de</strong> água em 1 grau Celsius.<br />
O conteúdo energ<strong>é</strong>tico dos alimentos e dos combustíveis <strong>é</strong> <strong>de</strong>terminado atrav<strong>é</strong>s da <strong>que</strong>ima dos<br />
mesmos e da medição da <strong>energia</strong> liberada. A unida<strong>de</strong> <strong>de</strong> <strong>calor</strong> usada nos rótulos <strong>de</strong> alimentos<br />
industrializados <strong>é</strong> realmente a quilo<strong>calor</strong>ia (kcal), <strong>que</strong> equivale a 1.000 <strong>calor</strong>ias (o <strong>calor</strong> re<strong>que</strong>rido para<br />
elevar a temperatura <strong>de</strong> 1 kg <strong>de</strong> água em 1°C). Para diferenciar esta unida<strong>de</strong> da <strong>calor</strong>ia <strong>de</strong> menor valor, a<br />
unida<strong>de</strong> <strong>de</strong> <strong>calor</strong> empregada em alimentos <strong>é</strong> chamada <strong>de</strong> <strong>um</strong>a <strong>Calor</strong>ia (escrita com a letra maiúscula C). É<br />
importante lembrar <strong>que</strong> a <strong>calor</strong>ia e a <strong>Calor</strong>ia são unida<strong>de</strong>s <strong>de</strong> <strong>energia</strong>.<br />
Responda: Uma tachinha <strong>de</strong> ferro e <strong>um</strong> gran<strong>de</strong> parafuso tamb<strong>é</strong>m <strong>de</strong> ferro são retirados <strong>de</strong> <strong>um</strong> forno<br />
<strong>que</strong>nte. Eles estão vermelhos <strong>de</strong> tão <strong>que</strong>ntes e se encontram à mesma temperatura. Quando forem<br />
mergulhados em recipientes idênticos, com água nas mesmas temperaturas, qual <strong>de</strong>les elevará mais a<br />
temperatura da água? ____________________________________________________________________<br />
______________________________________________________________________________________<br />
<strong>Calor</strong> Específico<br />
Você provavelmente já notou <strong>que</strong> certos alimentos permanecem <strong>que</strong>ntes por mais tempo do <strong>que</strong><br />
outros. Se você pegar <strong>um</strong>a torrada <strong>de</strong> <strong>de</strong>ntro da torra<strong>de</strong>ira el<strong>é</strong>trica e simultaneamente <strong>de</strong>rramar sopa<br />
<strong>que</strong>nte <strong>de</strong>ntro <strong>de</strong> <strong>um</strong>a tigela, alguns minutos mais tar<strong>de</strong> a sopa ainda estará agradavelmente morna,<br />
enquanto a torrada terá esfriado. Analogamente, se você esperar <strong>um</strong> pouco antes <strong>de</strong> comer <strong>um</strong> pedaço<br />
<strong>que</strong>nte <strong>de</strong> bife e <strong>um</strong>a concha <strong>de</strong> purê da batata, ambos inicialmente à mesma temperatura, você <strong>de</strong>scobrirá<br />
<strong>que</strong> a carne esfria mais rápido do <strong>que</strong> a batata.<br />
Substâncias diferentes possuem diferentes capacida<strong>de</strong>s <strong>de</strong> armazenamento <strong>de</strong> <strong>energia</strong> interna. Se<br />
a<strong>que</strong>cermos <strong>um</strong>a panela com água no fogão, <strong>de</strong>scobriremos <strong>que</strong> leva cerca <strong>de</strong> 15 minutos para <strong>que</strong> sua<br />
temperatura se eleve da temperatura ambiente at<strong>é</strong> a temperatura <strong>de</strong> ebulição. Mas se pusermos <strong>um</strong>a<br />
massa igual <strong>de</strong> ferro (Fe) no mesmo fogo, <strong>de</strong>scobriremos <strong>que</strong> ele sofrerá a mesma elevação <strong>de</strong> temperatura<br />
em cerca <strong>de</strong> 2 minutos. Para a prata (Ag), o tempo seria inferior a <strong>um</strong> minuto. Diferentes materiais re<strong>que</strong>rem<br />
diferentes quantida<strong>de</strong>s <strong>de</strong> <strong>calor</strong> para elevar a temperatura <strong>de</strong> <strong>um</strong>a <strong>de</strong>terminada quantida<strong>de</strong> <strong>de</strong>sse material<br />
em <strong>um</strong> <strong>de</strong>terminado número <strong>de</strong> graus.<br />
Materiais diferentes absorvem <strong>energia</strong> <strong>de</strong> maneiras diferentes.<br />
Um grama <strong>de</strong> água re<strong>que</strong>r 1 <strong>calor</strong>ia <strong>de</strong> <strong>energia</strong> para <strong>que</strong> sua temperatura se eleve em 1 grau<br />
Celsius. Apenas cerca <strong>de</strong> <strong>um</strong> oitavo <strong>de</strong>ssa <strong>energia</strong> <strong>é</strong> gasta para elevar a temperatura <strong>de</strong> <strong>um</strong> grama <strong>de</strong> ferro<br />
na mesma quantida<strong>de</strong> <strong>de</strong> graus.<br />
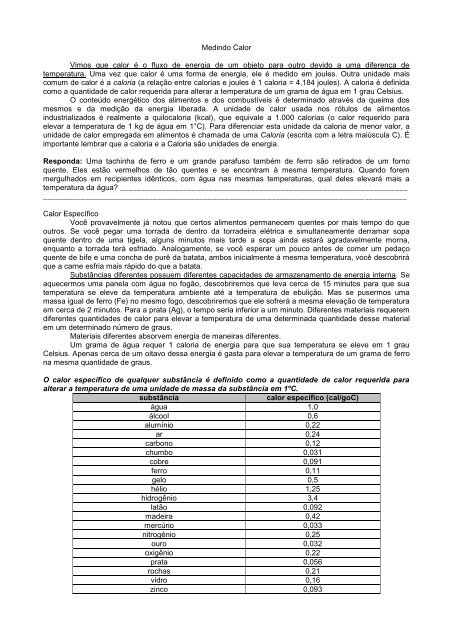
O <strong>calor</strong> específico <strong>de</strong> qual<strong>que</strong>r substância <strong>é</strong> <strong>de</strong>finido como a quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> re<strong>que</strong>rida para<br />
alterar a temperatura <strong>de</strong> <strong>um</strong>a unida<strong>de</strong> <strong>de</strong> massa da substância em 1ºC.<br />
substância <strong>calor</strong> específico (cal/goC)<br />
água 1,0<br />
álcool 0,6<br />
al<strong>um</strong>ínio 0,22<br />
ar 0,24<br />
carbono 0,12<br />
ch<strong>um</strong>bo 0,031<br />
cobre 0,091<br />
ferro 0,11<br />
gelo 0,5<br />
h<strong>é</strong>lio 1,25<br />
hidrogênio 3,4<br />
latão 0,092<br />
ma<strong>de</strong>ira 0,42<br />
mercúrio 0,033<br />
nitrogênio 0,25<br />
ouro 0,032<br />
oxigênio 0,22<br />
prata 0,056<br />
rochas 0,21<br />
vidro 0,16<br />
zinco 0,093
Responda: O <strong>que</strong> possui maior <strong>calor</strong> específico, a água ou a areia? ____________________________<br />
____________________________________________________________________________<br />
A água possui <strong>um</strong>a capacida<strong>de</strong> <strong>de</strong> armazenamento <strong>de</strong> <strong>energia</strong> melhor do <strong>que</strong> a gran<strong>de</strong> maioria dos<br />
materiais, mas alguns materiais incomuns são ainda melhores. Uma quantida<strong>de</strong> relativamente pe<strong>que</strong>na <strong>de</strong><br />
água absorve <strong>um</strong>a gran<strong>de</strong> quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> para haver <strong>um</strong>a elevação correspon<strong>de</strong>ntemente pe<strong>que</strong>na <strong>de</strong><br />
sua temperatura. Por causa disso, a água <strong>é</strong> <strong>um</strong> agente muito útil para refrigerar sistemas encontrados em<br />
automóveis e outras máquinas. Se <strong>um</strong> líquido <strong>de</strong> baixo <strong>calor</strong> específico fosse usado para refrigerar tais<br />
sistemas, sua temperatura se elevaria mais, para <strong>um</strong>a mesma absorção <strong>de</strong> <strong>calor</strong>.<br />
A água tamb<strong>é</strong>m leva muito tempo para esfriar, fato <strong>que</strong> explica por <strong>que</strong>, no passado, cost<strong>um</strong>ava-se<br />
usar bolsas <strong>de</strong> água <strong>que</strong>nte nas noites frias do inverno. Essa tendência da água <strong>de</strong> resistir a mudanças <strong>de</strong><br />
temperaturas melhora o clima em muitos lugares.<br />
Por causa do alto <strong>calor</strong> específico da água, a temperatura da água do oceano não varia muito entre<br />
o verão e o inverno. A água <strong>é</strong> mais fria do <strong>que</strong> o ar durante o verão, e mais <strong>que</strong>nte do <strong>que</strong> ele durante o<br />
inverno. No inverno, a água a<strong>que</strong>ce o ar <strong>que</strong> se move sobre ela e com isso a<strong>que</strong>ce as regiões costeiras da<br />
Am<strong>é</strong>rica do Norte. No verão, a água resfria o ar e com isso as regiões costeiras são resfriadas. Na costa<br />
leste, o ar se movimenta indo da costa para o oceano Atlântico. O solo, com <strong>um</strong> <strong>calor</strong> específico menor, fica<br />
<strong>que</strong>nte no verão, mas se resfria rapidamente no inverno.<br />
Ilhas e penínsulas mais ou menos ro<strong>de</strong>adas por água não têm os mesmos extremos <strong>de</strong> temperatura<br />
observados no interior <strong>de</strong> <strong>um</strong> continente. Quando o ar está <strong>que</strong>nte nos meses <strong>de</strong> verão, a água o resfria.<br />
Quando ele está frio nos meses <strong>de</strong> inverno, a água o a<strong>que</strong>ce. A água, portanto, mo<strong>de</strong>ra os extremos <strong>de</strong><br />
temperatura.<br />
Responda: Por <strong>que</strong> <strong>um</strong> pedaço <strong>de</strong> melancia se mant<strong>é</strong>m frio por períodos <strong>de</strong> tempo mais longos do <strong>que</strong><br />
sanduíches, <strong>de</strong>pois <strong>que</strong> ambos são retirados <strong>de</strong> <strong>um</strong>a geleira <strong>de</strong> pi<strong>que</strong>ni<strong>que</strong>, em <strong>um</strong> dia <strong>que</strong>nte? ________<br />
______________________________________________________________________________________<br />
Como funcionam os rótulos <strong>de</strong> alg<strong>um</strong>as garrafas <strong>de</strong> cerveja <strong>que</strong> mudam <strong>de</strong> cor quando ela está<br />
gelada?<br />
Esses rótulos são impressos com tintas especiais, chamadas <strong>de</strong> termocrômicas. Elas são<br />
formuladas com cristais líquidos <strong>que</strong> mudam <strong>de</strong> cor <strong>de</strong> acordo com a variação da temperatura a <strong>que</strong> estão<br />
submetidos. Em geral, somente <strong>um</strong>a pe<strong>que</strong>na área <strong>de</strong>stes rótulos <strong>é</strong> impressa com esse tipo <strong>de</strong> tinta. Em<br />
temperatura ambiente, ela fica invisível. Mas, quando a cerveja <strong>é</strong> resfriada, a composição dos cristais<br />
líquidos <strong>de</strong> tinta <strong>é</strong> alterada. Essa mudança em sua estrutura interna faz com <strong>que</strong> os pigmentos <strong>de</strong> tinta<br />
sejam ativados e ela se torne mais visível. É o caso <strong>de</strong> <strong>um</strong>a das marcas do mercado em cujo rótulo aparece<br />
a frase “Bem gelada” quando a bebida atinge os 4ºC. Detalhe: quando a cerveja retorna à temperatura<br />
ambiente, a tinta termocrômica fica novamente invisível.<br />
OBS.: os cristais líquidos são <strong>um</strong>a classe <strong>de</strong> mol<strong>é</strong>culas <strong>que</strong> estão em <strong>um</strong> estado da mat<strong>é</strong>ria entre o líquido<br />
e o sólido, conhecido como estado líquido cristalino (ou mesomórfico, do grego Mesos Morphe: entre dois<br />
estados). Alguns cristais líquidos apresentam cores fortes <strong>que</strong> se alteram sob a ação <strong>de</strong> temperatura,<br />
pressão, campo el<strong>é</strong>trico e magn<strong>é</strong>tico.<br />
Quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> e capacida<strong>de</strong> t<strong>é</strong>rmica<br />
Quantida<strong>de</strong> <strong>de</strong> <strong>Calor</strong> <strong>é</strong> <strong>um</strong>a gran<strong>de</strong>za física <strong>que</strong> <strong>de</strong>termina a variação na quantida<strong>de</strong> <strong>de</strong> <strong>energia</strong><br />
t<strong>é</strong>rmica em <strong>um</strong> corpo, ou seja, <strong>de</strong>termina a <strong>energia</strong> t<strong>é</strong>rmica <strong>que</strong> transitou para outro corpo ou <strong>que</strong> mudou <strong>de</strong><br />
natureza. A unida<strong>de</strong> do SI para quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> <strong>é</strong> o J (Joule), mas <strong>é</strong> com<strong>um</strong> usar cal (<strong>calor</strong>ia) ou Cal<br />
(<strong>Calor</strong>ia alimentar).<br />
A quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> po<strong>de</strong> ser chamada <strong>de</strong> Quantida<strong>de</strong> <strong>de</strong> <strong>Calor</strong> Sensível (Qs) por<strong>que</strong> caracterizase<br />
por apresentar mudança <strong>de</strong> temperatura sem alterar o seu estado físico.<br />
Para <strong>de</strong>terminar a Qs utilizamos:<br />
Para enten<strong>de</strong>rmos a capacida<strong>de</strong> t<strong>é</strong>rmica <strong>de</strong> <strong>um</strong> corpo po<strong>de</strong>mos relembrar <strong>um</strong>a pergunta feita em<br />
alg<strong>um</strong>as aulas passadas: “O <strong>que</strong> <strong>de</strong>mora mais para a<strong>que</strong>cer, 1L <strong>de</strong> água ou 2L <strong>de</strong> água na mesma fonte<br />
<strong>calor</strong>ífica? Por quê?”<br />
Situação como esta exemplifica muito bem a capacida<strong>de</strong> t<strong>é</strong>rmica <strong>de</strong> <strong>um</strong> corpo. A Capacida<strong>de</strong><br />
t<strong>é</strong>rmica <strong>é</strong> a gran<strong>de</strong>za física <strong>que</strong> <strong>de</strong>termina a variação t<strong>é</strong>rmica <strong>de</strong> <strong>um</strong> corpo ao receber <strong>de</strong>terminada<br />
quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong>. O valor da capacida<strong>de</strong> t<strong>é</strong>rmica <strong>é</strong> correspon<strong>de</strong>nte à quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> necessária<br />
para elevar a temperatura do corpo em <strong>um</strong>a unida<strong>de</strong> <strong>de</strong> variação <strong>de</strong> temperatura.
A capacida<strong>de</strong> t<strong>é</strong>rmica caracteriza o corpo, e não a substância <strong>que</strong> o constitui. A gran<strong>de</strong>za <strong>que</strong><br />
caracteriza <strong>um</strong>a substância <strong>é</strong> o <strong>calor</strong> específico.<br />
A capacida<strong>de</strong> t<strong>é</strong>rmica <strong>de</strong> <strong>um</strong> corpo po<strong>de</strong> ser calculada a partir da sua quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> e da sua<br />
variação <strong>de</strong> temperatura:<br />
Po<strong>de</strong> tamb<strong>é</strong>m ser calculada a partir da sua massa e do <strong>calor</strong> específico da substância <strong>que</strong> o<br />
constitui:<br />
RESUMINDO:<br />
CALOR SENSÍVEL<br />
A quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> recebida ou cedida por <strong>um</strong> corpo, ao sofrer variação <strong>de</strong> temperatura sem <strong>que</strong> haja<br />
mudança <strong>de</strong> fase, <strong>é</strong> <strong>de</strong>nominada <strong>calor</strong> sensível.<br />
Q = m.c.t<br />
Q = quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> (cal)<br />
m = massa (g)<br />
c = <strong>calor</strong> específico (cal/g. ºC)<br />
t = variação da temperatura (º C)<br />
CALOR LATENTE<br />
Quando <strong>um</strong>a substância está mudando <strong>de</strong> estado, ela absorve ou per<strong>de</strong> <strong>calor</strong> sem <strong>que</strong> sua temperatura<br />
varie. A quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> absorvida ou perdida <strong>é</strong> chamada <strong>calor</strong> latente.<br />
Q = m.L<br />
Q = quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong> (cal)<br />
m = massa (g)<br />
L = <strong>calor</strong> latente da substância (cal/g)<br />
EXERCÍCIOS<br />
1) Em <strong>um</strong>a banheira há 1.10 4 g <strong>de</strong> água <strong>que</strong>nte. É preciso reduzir em 3ºC a temperatura da água para <strong>que</strong><br />
se possa tomar <strong>um</strong> bom banho no verão. Para <strong>que</strong> isso aconteça, calcule quanto <strong>calor</strong> <strong>de</strong>ve ser retirado da<br />
água. R.: -3.10 4 cal
2) Se você <strong>de</strong>seja a<strong>que</strong>cer 100kg <strong>de</strong> água em 20ºC para tomar banho, quanto <strong>calor</strong> será re<strong>que</strong>rido? R.:<br />
2.10 6 cal<br />
3) Quanto <strong>calor</strong> <strong>é</strong> re<strong>que</strong>rido para elevar a temperatura <strong>de</strong> <strong>um</strong> pedaço <strong>de</strong> Cu <strong>de</strong> 10kg <strong>de</strong> 0ºC at<strong>é</strong> 100ºC?<br />
Como isso se compara com o <strong>calor</strong> necessário para elevar a temperatura <strong>de</strong> <strong>um</strong>a massa igual <strong>de</strong> água pela<br />
mesma diferença <strong>de</strong> temperatura? R.: 9,1.10 4 cal<br />
4) A areia do <strong>de</strong>serto <strong>é</strong> muito <strong>que</strong>nte durante o dia e muito fria durante a noite. O <strong>que</strong> isso lhe diz acerca do<br />
<strong>calor</strong> específico da areia?<br />
5) O <strong>que</strong> a<strong>que</strong>ce mais rápido quando lhe <strong>é</strong> fornecida a mesma quantida<strong>de</strong> <strong>de</strong> <strong>calor</strong>: Fe ou Ag? Por quê?<br />
6) Uma substância <strong>que</strong> a<strong>que</strong>ce rapidamente possui <strong>um</strong> “c” alto ou baixo?<br />
7) Uma substância <strong>que</strong> esfria rapidamente possui <strong>um</strong> “c” alto ou baixo?<br />
8) Como o <strong>calor</strong> específico da água se compara com o <strong>calor</strong> específico <strong>de</strong> outros materiais comuns?<br />
9) A capacida<strong>de</strong> t<strong>é</strong>rmica <strong>de</strong> <strong>um</strong>a amostra <strong>de</strong> Ag <strong>é</strong> <strong>de</strong> 17,85cal/ºC.<br />
a) O <strong>que</strong> significa este resultado?<br />
b) Calcule a sua massa. R.: 319g<br />
10) a) Quantas <strong>calor</strong>ias são necessárias para a<strong>que</strong>cer 50g <strong>de</strong> água <strong>de</strong> 293K a 353K? R.: 3.10 3 cal<br />
b) E para a<strong>que</strong>cer, em vez <strong>de</strong> água, a mesma massa <strong>de</strong> Hg? R.: 99cal<br />
11) Calcule a variação da temperatura <strong>de</strong> <strong>um</strong>a massa <strong>de</strong> 1kg <strong>de</strong> Hg à qual foi fornecida <strong>um</strong>a <strong>energia</strong> <strong>de</strong><br />
660cal? R.: 20ºC<br />
12) A capacida<strong>de</strong> t<strong>é</strong>rmica <strong>de</strong> 15kg <strong>de</strong> Cu <strong>é</strong> <strong>de</strong> 1365cal/ºC. Calcule o <strong>calor</strong> específico do Cu. R.:<br />
0,091 cal/gºC<br />
13) Qual a potência <strong>que</strong> <strong>um</strong> banho-maria <strong>de</strong>ve fornecer para a<strong>um</strong>entar, em 30 minutos, a temperatura <strong>de</strong><br />
10kg <strong>de</strong> água <strong>de</strong> 5ºC a 30ºC? R.: 139cal/s<br />
14) Sobre <strong>um</strong> fogareiro <strong>que</strong> a<strong>que</strong>ce 100cal/s são colocados 500g <strong>de</strong> água à temperatura <strong>de</strong> 20ºC. Supondo<br />
<strong>que</strong> todo o <strong>calor</strong> fornecido es<strong>que</strong>nte a água, <strong>que</strong> temperatura ela atinge após 1 minuto? E se, em vez <strong>de</strong><br />
500g <strong>de</strong> água, tiv<strong>é</strong>ssemos 500g <strong>de</strong> Fe? R.: 32ºC; 129ºC<br />
15) Que <strong>energia</strong> absorvem 1.10 6 kg <strong>de</strong> água enquanto sua temperatura varia <strong>de</strong> 8ºC a 18ºC? Após, dê o<br />
resultado em J. R.: 1.10 7 cal; 4,184.10 7 J<br />
16) Em <strong>um</strong>a chaleira há 2.10 3 g <strong>de</strong> água <strong>que</strong>nte. É preciso a<strong>um</strong>entar em 10ºC a temperatura da água para<br />
<strong>que</strong> se possa tomar <strong>um</strong> bom banho no outono. Para <strong>que</strong> isso aconteça, calcule quanto <strong>calor</strong> <strong>de</strong>ve ser<br />
adicionado à água. R.:<br />
17) Enrole <strong>um</strong> pedaço <strong>de</strong> papel, o mais apertado <strong>que</strong> você possa, ao redor <strong>de</strong> <strong>um</strong>a barra metálica grossa e<br />
a exponha a <strong>um</strong>a chama. Observe <strong>que</strong> o papel não pega fogo. Evite o contato direto do fogo com o metal.<br />
Você po<strong>de</strong> explicar esse fato em termos da condutivida<strong>de</strong> metálica?<br />
18) Para a<strong>que</strong>cer 10 g <strong>de</strong> água <strong>de</strong> 10 a 25º C <strong>é</strong> necessário fornecer 150 cal. Para resfriar essa mesma<br />
quantida<strong>de</strong> <strong>de</strong> água <strong>de</strong> 25 a 10º C <strong>de</strong>ve-se retirar:<br />
a) 120 cal b) 180 cal c) 150 cal d) não há resfriamento.<br />
19) Por <strong>que</strong> a água <strong>é</strong> utilizada para a refrigeração dos motores <strong>de</strong> automóveis? __________________<br />
____________________________________________________________________________<br />
20) Um corpo <strong>de</strong> massa 50 gramas recebe 300 <strong>calor</strong>ias e sua temperatura sobe <strong>de</strong> 10 o C at<strong>é</strong> 30 o C.<br />
Determine o <strong>calor</strong> específico da substância <strong>que</strong> o constitui.