revisao_quimica
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
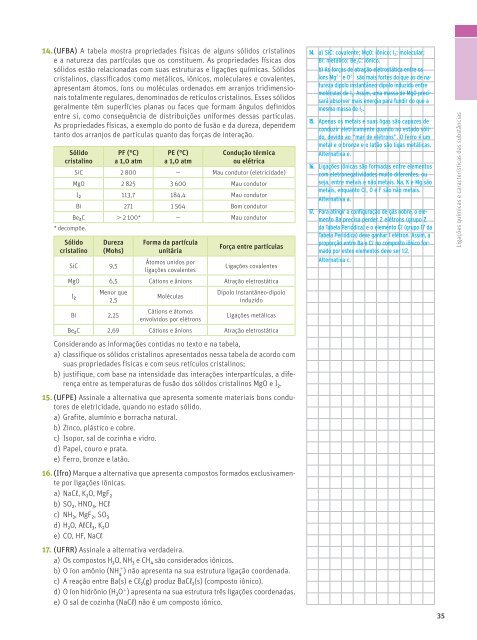
14. (UFBA) A tabela mostra propriedades físicas de alguns sólidos cristalinos<br />
e a natureza das partículas que os constituem. As propriedades físicas dos<br />
sólidos estão relacionadas com suas estruturas e ligações químicas. Sólidos<br />
cristalinos, classificados como metálicos, iônicos, moleculares e covalentes,<br />
apresentam átomos, íons ou moléculas ordenados em arranjos tridimensionais<br />
totalmente regulares, denominados de retículos cristalinos. Esses sólidos<br />
geralmente têm superfícies planas ou faces que formam ângulos definidos<br />
entre si, como consequência de distribuições uniformes dessas partículas.<br />
As propriedades físicas, a exemplo do ponto de fusão e da dureza, dependem<br />
tanto dos arranjos de partículas quanto das forças de interação.<br />
Sólido<br />
cristalino<br />
PF (°C)<br />
a 1,0 atm<br />
PE (°C)<br />
a 1,0 atm<br />
Condução térmica<br />
ou elétrica<br />
SiC 2 800 — Mau condutor (eletricidade)<br />
MgO 2 825 3 600 Mau condutor<br />
I 2 113,7 184,4 Mau condutor<br />
Bi 271 1 564 Bom condutor<br />
Be 2 C . 2 100* — Mau condutor<br />
* decompõe.<br />
Sólido<br />
cristalino<br />
Dureza<br />
(Mohs)<br />
SiC 9,5<br />
Forma da partícula<br />
unitária<br />
Átomos unidos por<br />
ligações covalentes<br />
Força entre partículas<br />
Ligações covalentes<br />
MgO 6,5 Cátions e ânions Atração eletrostática<br />
I 2<br />
Menor que<br />
2,5<br />
Moléculas<br />
Dipolo instantâneo-dipolo<br />
induzido<br />
Bi 2,25<br />
Cátions e átomos<br />
envolvidos por elétrons<br />
Ligações metálicas<br />
Be 2 C 2,69 Cátions e ânions Atração eletrostática<br />
Considerando as informações contidas no texto e na tabela,<br />
a) classifique os sólidos cristalinos apresentados nessa tabela de acordo com<br />
suas propriedades físicas e com seus retículos cristalinos;<br />
b) justifique, com base na intensidade das interações interpartículas, a diferença<br />
entre as temperaturas de fusão dos sólidos cristalinos MgO e I 2 .<br />
15. (UFPE) Assinale a alternativa que apresenta somente materiais bons condutores<br />
de eletricidade, quando no estado sólido.<br />
a) Grafite, alumínio e borracha natural.<br />
b) Zinco, plástico e cobre.<br />
c) Isopor, sal de cozinha e vidro.<br />
d) Papel, couro e prata.<br />
e) Ferro, bronze e latão.<br />
16. (Ifro) Marque a alternativa que apresenta compostos formados exclusivamente<br />
por ligações iônicas.<br />
a) NaCº, K 2 O, MgF 2<br />
b) SO 2 , HNO 3 , HCº<br />
c) NH 3 , MgF 2 , SO 3<br />
d) H 2 O, AºCº 3 , K 2 O<br />
e) CO, HF, NaCº<br />
17. (UFRR) Assinale a alternativa verdadeira.<br />
a) Os compostos H 2 O, NH 3 e CH 4 são considerados iônicos.<br />
b) O íon amônio (NH 1<br />
4<br />
) não apresenta na sua estrutura ligação coordenada.<br />
c) A reação entre Ba(s) e Cº 2 (g) produz BaCº 2 (s) (composto iônico).<br />
d) O íon hidrônio (H 3 O 1 ) apresenta na sua estrutura três ligações coordenadas.<br />
e) O sal de cozinha (NaCº) não é um composto iônico.<br />
14. a) SiC: covalente; MgO: iônico; I 2 : molecular;<br />
Bi: metálico; Be 2 C: iônico.<br />
b) As forças de atração eletrostática entre os<br />
íons Mg 21 e O 22 são mais fortes do que as de natureza<br />
dipolo instantâneo-dipolo induzido entre<br />
moléculas de I 2 . Assim, uma massa de MgO precisará<br />
absorver mais energia para fundir do que a<br />
mesma massa de I 2 .<br />
15. Apenas os metais e suas ligas são capazes de<br />
conduzir eletricamente quando no estado sólido,<br />
devido ao “mar de elétrons”. O ferro é um<br />
metal e o bronze e o latão são ligas metálicas.<br />
Alternativa e.<br />
16. Ligações iônicas são formadas entre elementos<br />
com eletronegatividades muito diferentes, ou<br />
seja, entre metais e não metais. Na, K e Mg são<br />
metais, enquanto Cº, O e F são não metais.<br />
Alternativa a.<br />
17. Para atingir a configuração de gás nobre, o elemento<br />
Ba precisa perder 2 elétrons (grupo 2<br />
da Tabela Periódica) e o elemento Cº (grupo 17 da<br />
Tabela Periódica) deve ganhar 1 elétron. Assim, a<br />
proporção entre Ba e Cº no composto iônico formado<br />
por estes elementos deve ser 1:2.<br />
Alternativa c.<br />
35<br />
Ligações químicas e características das substâncias