You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
GİRİŞ<br />
Hücre, Robert Hooke’un 1665’li yıllarda tanımladığı küçük yapısal ve fonksiyonel ünitesini<br />
yani canlıyı oluşturan temel yapı taşlarıdır. Gözle görülemeyecek kadar küçük olan bu yapı<br />
canlı türüne göre farklılık göstermekle beraber değişik boyutlarda ve şekillerde olmak üzere<br />
birçok çeşidi bulunmaktadır. Hücrelerin gösterdikleri yapı özelliklerine bağlı olarak prokaryot<br />
ve ökaryot olmak üzere iki çeşidi bulunmaktadır. Prokaryotik hücreler sitoplazma organelleri,<br />
nükleusu ve nükleus membranı bulunmayan, kalıtsal materyal olarak tek bir DNA molekülü<br />
barındıran hücrelerdir. Prokaryotik hücre tipine örnek olarak bakteriler ve mavi-yeşil algler<br />
verilebilir. Ökaryotik hücreler ise, hücre membranı ve membranla sarılmış organelleri<br />
bulunan ve gelişmiş yapılar ihtiva eden hücre tipleridir. İnsanlar, hayvanlar ve bitkiler<br />
ökaryotik hücre tiplerine örnek olarak verilebilir. (hücre nedir) Ökaryotik hücrelere<br />
karakteristik olarak baktığımızda sitoiskelet oluşumunu sağlayan filament ve tübüllerden<br />
oluşan bir sitemi bulunmaktadır.<br />
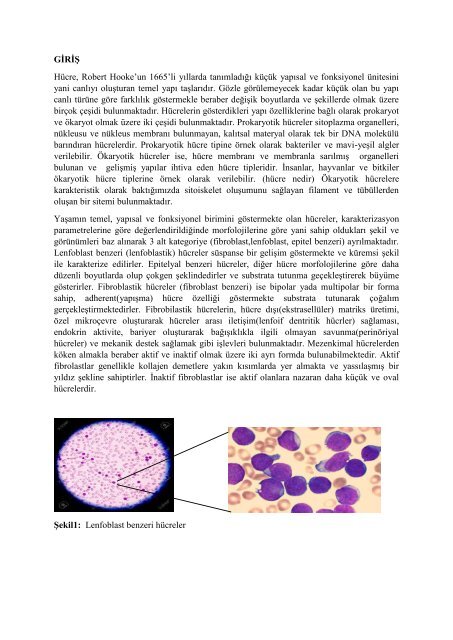
Yaşamın temel, yapısal ve fonksiyonel birimini göstermekte olan hücreler, karakterizasyon<br />
parametrelerine göre değerlendirildiğinde morfolojilerine göre yani sahip oldukları şekil ve<br />
görünümleri baz alınarak 3 alt kategoriye (fibroblast,lenfoblast, epitel benzeri) ayrılmaktadır.<br />
Lenfoblast benzeri (lenfoblastik) hücreler süspanse bir gelişim göstermekte ve küremsi şekil<br />
ile karakterize edilirler. Epitelyal benzeri hücreler, diğer hücre morfolojilerine göre daha<br />
düzenli boyutlarda olup çokgen şeklindedirler ve substrata tutunma geçekleştirerek büyüme<br />
gösterirler. Fibroblastik hücreler (fibroblast benzeri) ise bipolar yada multipolar bir forma<br />
sahip, adherent(yapışma) hücre özelliği göstermekte substrata tutunarak çoğalım<br />
gerçekleştirmektedirler. Fibrobilastik hücrelerin, hücre dışı(ekstrasellüler) matriks üretimi,<br />
özel mikroçevre oluşturarak hücreler arası iletişim(lenfoif dentritik hücrler) sağlaması,<br />
endokrin aktivite, bariyer oluşturarak bağışıklıkla ilgili olmayan savunma(perinöriyal<br />
hücreler) ve mekanik destek sağlamak gibi işlevleri bulunmaktadır. Mezenkimal hücrelerden<br />
köken almakla beraber aktif ve inaktif olmak üzere iki ayrı formda bulunabilmektedir. Aktif<br />
fibrolastlar genellikle kollajen demetlere yakın kısımlarda yer almakta ve yassılaşmış bir<br />
yıldız şekline sahiptirler. İnaktif fibroblastlar ise aktif olanlara nazaran daha küçük ve oval<br />
hücrelerdir.<br />
Şekil1: Lenfoblast benzeri hücreler
Şekil 2: Substrata tutunmuş ve uzamış formda bulunan fibroblast benzeri hücreler.<br />
Şekil 3: Epitelyal benzeri hücreler.<br />
1.<strong>HÜCRE</strong> <strong>KÜLTÜRÜ</strong><br />
Hücre kültürü, tıp alanındaki gelişmeler ile tedavi metodlarını zenginleştirmek, deney<br />
hayvanlarının kullanımını azaltmak ve kanser(!), gen haritalama, toksik maddelerin<br />
incelenmesi gibi birçok alanda kullanılabilirliğinden dolayı büyük bir öneme sahiptir ve<br />
hazırlanması titizlik isteyen çalışma methodudur. Hayvan yada bitkilerden izole edilen<br />
hücrelerin yani canlı hücrelerin ait oldukları organizma dışında, in vitro ortamlarda<br />
büyütülmesi işlemi hücre kültürünü ifade etmektedir. Günümüzde gerçekleştirilen hücre<br />
kültürü çalışmalarına monoklonal antikor, tümör aşıları, hücre içi metabolik aktivitelerin<br />
aydınlatılması, kalıtsal materyallerin replikasyonunun araştırılması ve çeşitli ilaçların hücre<br />
siklusuna etkisinin incelenmesi de örnek olarak verilebilir.<br />
Hücre kültürü in vitro ortamlarda gerçekleştirilmekte olup hücrelerin canlı organizmada<br />
bulunduğu koşullar yani canlı ortamda yaşıyormuş gibi doğal yaşam şartları sağlanmaktadır.<br />
Memeli hücreleri 37 0 C iken böcek hücrelerinin 28 0 C’de yaşaması her canlı tipinin yaşam<br />
ortamının farlılık gösterdiğinin bir belirtecidir. Memeli hücreleri belirli besi ortamına(amino<br />
asitler,glikoz,tuzlar,vitaminler), uygun pH (7.4), büyüme faktörleri (FBS- fetal bovine<br />
serum),) sıcaklık(37 0 C), nem ve CO2 (%5) gibi çoğalması için gerekli olan ihtiyaçlarının<br />
bulunduğu ortamlarda muhafaza edilmektedir.<br />
Hücre kültürüyle gerçekleştirilen kompleks çalışmalara (kanser, metabolik aktiviteler, vb.) ,<br />
protein ve nükleik asit izolasyonları, mikroskobik incelemeler gibi daha basite indirgenmiş<br />
çalışma örnekleri verilebilmekte ve bunlar için biyolojik materyali sağlamaktadır.
İlk olarak hücre kültürü, kurbağa sinir hücrerinin, daha sonra ise tavuk kalp hücrelerinin<br />
incelenmesiyle kullanılmaya başlanmıştır. İnceleme çalışmalarının yaygınlık kazanmasına<br />
bağlı olarak çok sayıda canlı ve hücre çeşiti için hücre kültürleri geliştirilmiştir ve virüs bilimi<br />
olarak bilinen viroloji alanındaki uygulamalar için 1940’lı tarihlerde kullanılmaya<br />
başlanmıştır. 1954 yılında Nobel Tıp ödülünün alındığı çocuk felci üzerine geliştirilmiş olan<br />
aşılar da hücre kültürü çalışmalarına verilebilecek en önemli örnekler arasında yer almaktadır.<br />
Bu ödüllü çalışmadan daha önce 1951’li yılların başlarında ilk kez servikal karsinomalı (<br />
rahim kanalı kanseri-HeLa hücreleri) hastadan alınan insan kanser hücrelerinin kültürü<br />
hazırlanmıştır. Kanser hücreleri, sonsuz, anormal ve kontrol dışı bölünme ile çoğalan agresif<br />
hücrelerdir. HeLa hücre seriside günümüzde kanser çalışmalarında sıklıkla kullanımı devam<br />
etmekte olan ölümsüz hücre hattı olarak isimlendirilmektedir.<br />
Şekil 4: HeLa (rahim kanalı kanser hücreleri)<br />
2.KÜLTÜR VE ÇOĞALMA POTANSİYELİNE BAĞLI <strong>HÜCRE</strong> TİPLERİ<br />
2.1. Kültür Tiplerine Göre Hücreler<br />
2.1.1. Primer Hücre Kültürü: Doku ve organ parçalarının hücre kültürü hazırlamak<br />
amacıyla kullanılmasına eksplant denilmektedir. Ekspalntın doku veya organlardan tripsin ile<br />
ayrıştırılmasının ardından in vitro şartlarda kültür kaplarına gereçekleştirilen ilk ekimlerine<br />
primer kültür denir. İn vitro koşularda çoğalma gerçekleştirirken in vivo ortamda sahip<br />
oldukları genotipik ve fenotipik özelliklerini büyük oranda koruyabilmektedirler.<br />
Şekil 5:Primer hücre kültüe basamakları
2.1.2. Sekonder Hücre Kültürü: Maksimum 50 defa pasajı gerçekleştirilebilen ve normal<br />
diploid kromozom sayısına sahip hücrelerden elde edilerek hazırlanan kültürlere<br />
denilmektedir.<br />
2.1.3. Sürekli Hücre Kültürü: Kromozom sayıları sabit olamamakla beraber genel olarak<br />
kanser hücrelerinin kültüre edilmesiyle hazırlanmakta olup aynı zamanda laboratuvar<br />
ortamında değişim gösterebilmektedirler. Bu kültüre bilim dünyasında ölümsüz hücreler<br />
olarak kabul edilen ve günümüzde kanser çalışmalarında halen kullanılmakta olan insan<br />
serviks karsinoma (HeLa) hücreleri örnek verilebilir.<br />
2.2.Büyüme Tiplerine Göre Hücreler<br />
2.2.1. Adherent Hücreler: En bilinen örnekleri arasında bağ dokusu ve fibroblast hücreleri<br />
verilen, kültür kabına tutunma bağımlılığı ile kültüre edildikleri flask yada diğer kültür<br />
kaplarına yapışarak monolayer (tek tabaka) halinde gelişim gösteren hücrelerin tamamını<br />
kapsamaktadır. Split edilmek istendiğinde enzim(tripsin) yada mekanik kuvvet (kazıma)<br />
yardımıyla kültür kabından (flask, petri, well plate, vb.) kaldırılarak, besiyeri ile santrifüj<br />
sonrasında süspanse form kazandırılmış olup diğer flasklara aktarılmaktadır.<br />
Şekil 6: Monolayer büyüme gösteren hüceler<br />
2.2.2. Süspanse Hücreler : Adherent hücrelerden farklı bir gelişim gösteren bu hücreler,<br />
tutunma bağımlılığı olamayan, kültür kaplarına yapışma eğiliminde bulunmadan çoğalım<br />
göstermektedirler. Başka flasklara aktarılmak istediğinde, herhangi bir enzime veya mekanik<br />
uygulamaya ihtiyaç duymadan aktarım sağlanabilmektedir. Bulunduğu ortamla bağlantı<br />
kurmadan çoğalabilen kan hücreleri örnek olarak verilebilmektedir.<br />
Şekil 7: Yüzeye tutunmadan, besi ortamında askıda büyüyen hücreler
Tablo 1: Adherent- süspanse hücre karşılaştırması<br />
Süspanse Hücreler<br />
Tutunma bağımlısı olmayan tüm hücre<br />
hatlarına uygun,<br />
Kültürün seyreltilmesi büyümeyi teşvik<br />
edecek şekilde etkilemektedir.<br />
Hücrelerin konsantrasyon seviyeleri büyüme<br />
sınırını belirlemektedir.<br />
Adherent Hücreler<br />
Başta primer(birincil) kültür tipi dahil<br />
olmakla beraber çoğu hücre tipi için uygun,<br />
İnverted mikroskopta görsel gözlemlenmesi<br />
kolay,<br />
Yüzey alanı büyüme oranlarını<br />
sınırlamaktadır.<br />
3.<strong>HÜCRE</strong> <strong>KÜLTÜRÜ</strong> LABORATUVARI<br />
Hücre kültürü laboratuvarında yapılan eylemi ciddiye almak ve güvenlik uyarılarına dikkat<br />
kesilmek olmazsa olmazdır. Bu ortamda meydana gelebilecek dikkatsizlikler ve kural ihlalleri<br />
ciddi sağlık problemlerine yol açabileceğinden, kişi sadece kendi güvenliği için değil<br />
laboratuvarda çalışan başka insanları da tehlikeye atmaktan sakınmalıdır. (Hücre kültürü<br />
çeviri)<br />
3.a.Aseptik teknikler<br />
Aseptik teknikler kültür ortamının stabil olmasını sağlamak, mikroorganizmaların ve çeşitli<br />
bulaşkanların kontaminasyonunu önlemek amacıyla gerçekleştirilen teknik uygulamalardır.<br />
Bir hücre kültüründe yapılan çalışmaların en sağlıklı şekilde gerçekleştirilebilmesi için<br />
kontaminasyon riskinin en aza indirgenmesi şarttır. Kültür ortamının kontaminasyona<br />
uğraması steril olmayan solüsyonlar ve pipet uçları, düzenli olarak sterilize edilmeyen<br />
kaynaklanmaktadır. Aseptik tekniğin unsurları steril bir çalışma alanı, kişisel hijyen, steril<br />
reaktifler, medyum ve steril kullanımdır. (Hücre kültürü çeviri).<br />
3.b.Steril Çalışma Alanı<br />
Havadaki toz parçacıklarından ve partiküllerden (öksürme, hapşırma ve sporlar vs.)<br />
korunmanın en iyi ve elverişli yolu biyogüvenlik kabinlerinin kullanılmasıdır. Steril bir<br />
çalışma ortamı için;<br />
• Biyogüvenlik kabinleri kapı ve pencerelerden, laboratuvardaki personel geçiş trafiğinden en<br />
az şekilde etkilenebilecek bir yere kurulmalıdır.<br />
• Çalışma ortamı olabildiğince düzenli olmalı ve depolama alanı olarak kullanılmamalıdır.<br />
• Ortam çalışmadan önce ve sonra düzenli olarak %70 etanol ile dezenfekte edilmelidir.<br />
Özellikle herhangi bir solüsyonun dökülmesi halinde alan temizlenmelidir.<br />
• Hücre kültürü kabini içerisinde ateş ile çalışmak önerilmemektedir.<br />
• Biyogüvenlik kabininin yapılan çalışmada sürekli kapanıp açılması uygun değildir. Uzun<br />
süre çalışılmayacaksa kapatılmalıdır (Cell culture basics).<br />
3.c.Personel Hijyeni<br />
Yapılacak çalışmaya başlanmadan önce ve sonra mutlaka ellerinizi yıkamanız gerekmektedir.<br />
Ayrıca tehlikeli kimyasallardan korunmak için laboratuvar önlüğü giyilmeli ve steril<br />
laboratuvar eldiveni takılmalıdır (Cell culture basics).
3.d.Steril Ajanlar ve Medyumlar<br />
Ticari olarak satın alınan reaktifler ve medyumların sterilizasyonu sağlanmış bir şekilde gelir.<br />
Fakat bu malzemelerin çalışma esnasında kirlenebilmeleri kuvvetle muhtemeldir.<br />
Sterilizasyonundan emin olmadığınız malzemeleri laboratuvarda otoklav veya steril filtre<br />
cihazı kullanılarak sterilize etmek mümkündür (Cell culture basics).<br />
3.d.1.Steril Çalışma Adımları<br />
• Ellerinizi ve çalışma alanını sürekli %70 etanol ile silin.<br />
• Kapları, şişeleri, flaskları vb. malzemeleri çalışma alanına koymadan önce mutlaka %70<br />
etanol ile silin. Ayrıca dökülmelere karşı dikkat edin<br />
• Sıvılarla çalışırken steril cam veya plastik tek kullanımlık pipet uçları kullanın. Herhangi bir<br />
bulaşma riskine karşın her pipet ucunu bir kez kullanmaya özen gösterin ve pipetlerinizi<br />
çalışma alanında dışarı çıkarmamaya özen gösterin.<br />
• Şişerlerle çalışırken kapaklarını açık bırakmamaya ve açtığınız kapakları üst tarafı aşağıya<br />
bakacak şekilde koymaya dikkat edin.<br />
• Çalışma esnasında konuşmamaya, şarkı söylememeye ve ıslık çalmamaya özen gösterin.<br />
• Kontaminasyonun en aza indirgenmesi için çalışmanızı olabildiğince hızlı gerçekleştirin<br />
(Cell culture basics).<br />
3.e.Kontaminasyon Riski<br />
Laboratuvarda çalışırken her an konteminasyon riskine karşı dikkatli olunmalı. Bu, yapılan<br />
çalışmaların sağlıklı sonuç alınması ve verimliliğinin maksimum düzeyde olması için şarttır.<br />
Konteminasyon hemen her laboratuvarda temel sorunlardan biridir. Herhangi bir<br />
konteminasyon oluşması halinde sadece laboratuvar malzemelerinin ziyanı değil aynı<br />
zamanda büyük zaman kayıplarına da sebep olacağından yapılan çalışmanın her adımına<br />
dikkat edilmeli ve steril çalışılmalıdır. Konteminasyonun engellenmesi için hücre kültürünün<br />
her basamağında kullanılacak olan materyaller %70’lik etanol ile temizlenmelidir. (Hücre<br />
kültürü çeviri)<br />
3.1.<strong>HÜCRE</strong> <strong>KÜLTÜRÜ</strong> EKİPMANLARI<br />
3.1.a.Biyogüvenlik Kabini (Laminar flow-Hood)<br />
Biyogüvenlik kabinleri laboratuvarda çalışan personeli, yapılan çalışmayı ve ortamı, havadaki<br />
toz partiküllerinden, sporlardan ve çeşitli enfeksiyöz mikroorganizmaların bulaşmasından<br />
korumak için kullanılan bir cihazdır. Biyogüvenlik kabininin temel çalışma prensibi;<br />
içerisinde oluşturduğu kontrollü hava akımı ile iç ortamı-dış ortamdan ayırmakta ve<br />
kontaminasyona neden olacak moleküllerin girişini engellemeye dayanmaktadır. Kabinin iç<br />
ortamının dış ortamdan ayrılması steril çalışma ortamının sağlanması için gereklidir.<br />
Biyogüvenlik kabinleri steril çalışma alanı düzeylerine göre üç sınıfa ayrılır(Hücre kültürü<br />
çeviri, Cell culture basics).
1<br />
1<br />
2<br />
3<br />
4<br />
5<br />
6 7 8<br />
9 10<br />
11<br />
12<br />
13<br />
14<br />
15<br />
Şekil 8: Steril bir biyogüvenlik kabini içerisinde bulunan ekipmanlar<br />
1-2: Çalışma esnasında ependorf ve falcon tüplerin yerleştirildiği steril Rek (Rack).<br />
3-4: Steril ependorf tüpü kutuları<br />
5: PBS<br />
6: Tripan blue<br />
7: DMSO<br />
8: Steril pipet uçları<br />
9: Pipetler (10-1000 µl)<br />
10: Steril aspiratör uçları<br />
11: Petri kapları<br />
12: Falcon tüpler<br />
13: Pipetör<br />
14: Aspiratör hortumunun yerleştirildiği yalıtkan zemin<br />
15: Kalem<br />
1.Sınıf Biyogüvenlik kabini: 1. Sınıf hücre kültürü biyogüvenlik kabinleri iyi mikrobiyolojik<br />
şartlar oluşturulduğunda laboratuvarda çalışan personele, çevreye ve yapılan çalışmaya iyi bir<br />
koruma sağlar. (Hücre kültürü çeviri, Cell culture basics).
2.Sınıf Biyogüvenlik kabini: 2. Sınıf hücre kültürü biyogüvenlik kabinleri hücre kültürü<br />
çalışmaları için gerekli aseptik ortamı sağlamakla beraber BSL- 1,2 ve 3 materyalleri içeren<br />
bir iş için tasarlanmıştır (Cell culture basics).<br />
3.Sınıf Biyogüvenlik kabini: 3. sınıf Biyogüvenlik kabinleri gaz geçirmesine engel teşkil<br />
etmektedir ve çalışanlar için yüksek güvenlik düzeyine sahiptir(Cell culture basics).<br />
3.1.b.İnverted (Ters) Mikroskoplar<br />
Mikroskop 1590-1610 ylları arasında günümüz kaynaklarına göre keşfeden kişinin tam<br />
bilinmediği, gözle görülemeyecek kadar küçük yapıların gözlemlenmesi amacıyla kullanılan<br />
bir cihazdır. Mikroskopların çalışma alanına göre ışık mikroskobu, elektron mikroskobu ve<br />
ters mikroskop gibi çeşitleri mevcuttur. Ters mikroskoplar kültürdeki hücrelerin gözle<br />
görülmesi, stabil durumları hakkında hakkında fikir edinmek ve buna göre yapılacak<br />
çalışmaya karar vermek için kullanılmaktadır. Ters mikroskoplar ışık mikroskoplarından<br />
farklı olarak zemin alt kısmındaki objektif mercekleri, üst kısmındaki ışık kaynağı ve<br />
yoğunlaştırıcı bulunduran mikroskop türüdür. Bazı hücreler kültür edildikten sonra kabın<br />
tabanına tutunduklarından dolayı objektif kısmı zeminin alt kısmından okülere görüntü<br />
sağlamaktadır. Mikroskopla çalışan personelin sağlıklı görüntü alabilmesi amacıyla<br />
mikroskopta 4X, 10X ve, 20X gibi farklı büyütme ölçekleri yer almakta, görüntünün<br />
netleşmesi açısından bir makrovida ve bir mikrovida, ışık şiddetinin ayarlanması için de bir<br />
kontrol düğmesi bulunmaktadır. (Hücre kültürü çeviri).<br />
1<br />
3<br />
4<br />
2<br />
5<br />
7<br />
6<br />
Şekil 9: Ters Mikroskop<br />
1: Oküler<br />
2: Mikroskop gövdesi<br />
3: Kamera<br />
4: Işık kaynağı<br />
5: Hareketli tabla<br />
6: Makro-Mikro vida
7: Hassas ayarlayıcı<br />
3.1.c.Santrifüj<br />
Santrifüj bir karışım içerisinde farklı boyutlardaki partiküllerin ve farklı yoğunluklara sahip<br />
sıvıların yer çekimi kuvvetine bağlı olarak yüksek hızda döndürmek suretiyle birbirlerinden<br />
ayrılmasını sağlayan cihazdır. Hücre kültüründe santrifüj kullanmanın amacı, yapılacak işlem<br />
için kültür kabından alınan hücrelerin diğer ortam bileşenlerinden (besiyeri, tripsin, DMSO<br />
gibi) ayrılmasını sağlamaktır. Santrifüjün yüksek hızda çalıştırılması hücrelere zarar<br />
vereceğinden işlem sırasında hassas davranılmalıdır. (Hücre kültürü çeviri).<br />
3.1.d.İnkübatör<br />
Hücrelerin kültüre edilmesi için in vivo koşullara yakın ortamın sağlanması şarttır.<br />
İnkübatörler hücrelerin büyüyebilmesi için ihtiyaç duydukları uygun ortam sağlamaktadır.<br />
İnkübatörlerde ayarlanabilir sıcaklık, CO2 ve nem gibi belirli koşullar altında (% 5 CO2 ve<br />
37 o C sıcaklık) hücrelerin yaşam ortamı sağlanması açısından önem arzetmektedir. Hücrelerin<br />
canlılığını devam ettrebilmesi ve çoğalabilmesi açısından bir miktar nemin ortamda<br />
bulunması gerekmektedir. Nem ortamdaki solüsyonların buharlaşmasını engellemektedir.<br />
Hemen her inkübatörde nemin sağlanması için bir miktar saf suyun bulunduğu bir kap<br />
bulunmaktadır. Hücreler in vivo ortamda bulundukları dokuya göre değişkenlik göstermekle<br />
beraber belirli pH düzeylerinde varlıklarını sürdürmektedirler. Ayrıca in vivo ortamda<br />
hücrelerin yapısal ve fonksiyonel çalışmalarını yerine getirebilmesi, enzimlerin çalışması ve<br />
pH düzeyinin sabit kalması açısından hücre içi ve hücreler arası tampon sistemleri<br />
bulunmaktadır. İnkübatörlerin bu şartları sağlamasının yolu ise CO2 ’den geçmektedir. CO2<br />
inkübatördeki hücrelerin pH seviyelelerinin değişmeye karşı direnç göstermesini<br />
sağlamaktadır. CO2 gazının inkübatöre aktarılması için CO2 gazı tüpü bir bağlantıyla cihaza<br />
giriş sağlamaktadır. (Hücre kültürü çeviri-fizyolojik tampon sistemleri)<br />
Vücut içerisinde iç dengeyi sağlamak için hücre içi ve hücreler arası birden fazla tampon<br />
sistemi bulunmakta ve birçok organ bu sistemlerde görev almaktadır. Vücutta ortamın pH,<br />
sıcaklık vb. değişimleri hücrelerin fonksiyonlarını bozacağından çeşitli hastalıklara sebep<br />
olmakla beraber organizmanın yaşam kalitesini düşürmekte hatta ölümcül sonuçlara yol<br />
açabilmektedir. Vücut içerisindeki dengenin sağlanması için karbonik asit-bikarbonat<br />
tamponu, protein tamponu ve fosfat tamponu olmak üzere üç ana tampon sistemi mevcuttur.<br />
Şekil 10: İnsan vücudunda bulunan bikarbonat tampon sisteminde CO 2’nin önemi.
-İnkübatör Tipleri<br />
İnkübatörler tiplerine göre kuru ve nemli inkübatörler olmak üzere ikiye ayrılmaktadır. Kuru<br />
inkübatörler daha ucuzdur ve hücrelerin inkübe edildiği ortam buharlaşmayı önlemek<br />
amacıyla kapalıdır. Kuru inkübatörlerde nemin sağlanması için bir su kabı bulunmaktadır<br />
fakat ortam koşullarının hassas bir şekilde kontrol edilmesine olanak sağlamamak gibi<br />
dezavantajları bulunmaktadır. Nemli inkübatörler kuru inkübatörlere nazaran daha pahalıdır<br />
ancak kültür şartlarının hassasiyeti yüksek düzeylidir. Nemli inkübatörler ortam koşullarının<br />
istenildiği gibi olmasını sağlarken personelin konrolü için ortamın durumu hakkında bilgi<br />
vermekte ve hassas çalışma programına sahip gibi avantajları vardır.<br />
1<br />
3<br />
2<br />
4<br />
5<br />
6<br />
7<br />
Şekil 11: CO 2 İnkübatörü<br />
1: CO2 oranı göstergesi<br />
2: Nem oranı göstergesi<br />
3: Sıcaklık göstergesi<br />
4: Ortam koşulları ayarlayıcı düğmeler<br />
5: Ortamın CO2 ihtiyacını ayarlayan CO2 tüpüne bağlı panel<br />
6: İnkübatör rafları<br />
7: Nemin sağlandığı karışımın bulunduğu su kabı<br />
3.1.e.Su Banyosu<br />
Hücre kültürü laboratuvarında kullanılan solüsyonlar genellikle 4 0 C’de saklanmaktadır.<br />
Hücrelerin inkübatör aşamasından (37 0 C) alınıp 4 0 C’deki bir solüsyon ile muameler<br />
edildiğinde hücreler şoka uğramakta ve strese girmektedirler. Böyle bir sorunun engellenmesi<br />
açısından 37 o C’lik su banyoları mevcuttur. 4 o C’den alınan solüsyonlar su banyosunda yani<br />
37 o C’de bir süre bekletilir, solüsyonlar bir miktar ısınması sağlandıktan sonra hücrelere<br />
muamele edilir. (Hücre kültürü çeviri)
3.1.f.Depolama Alanı ve Buzdolapları<br />
Hücre kültürü laboratuvarında kullanılan besiyerlerleri ve diğer solüsyonlar, ilaçlar, kimyasal<br />
maddelerin oda sıcaklığında bozulmasını önlemek amacıyla bir belirli koşullar altında bir<br />
saklama alanına ihtiyaç vardır. Buzdolapları bu ihtiyacı karşılayabilecek düzeyde bir cihazdır.<br />
4 o C veya -20 o C saklanması gereken medyum ve çeşitli ilaçlar için buz dolapları idealdir.<br />
Bunun dışında daha düşük sıcaklıklarda saklanması gereke materyaller vardır. Bahsedilen<br />
materyaller için ise -80 o C’lik özel kabinler veya -196 o C’lik sıvı azot tankları<br />
bulunmaktadır.(buzdolapları ve kültür kapları).<br />
3.1.g.Hücre Kültür Kapları<br />
Hücrelerin beslenmesi, birbirleriyle iletişim halinde olması ve çoğalabilmesi için farklı<br />
büyüklüklerde hücre kültür kapları bulunmaktadır. Hücrelerin ekimi flask ve petri kapları,<br />
inkübatöre alınması için flasklar kullanılmaktadır. Bahsedilen kültür kapları hücre<br />
çoğalmasının en sağlıklı şekilde olmasını sağlamak açısından dip kısımları düzdür ve<br />
hücrelerin yapışmasını sağlamak için kabın yüzeyi hücre dışı matriksi taklit eden özel sentetik<br />
bileşenlerden üretilmiştir. Bunları dışında yapılacak işleme göre değişkenlik gösteren 6, 12,<br />
24, 48 ve 96 kuyucuğa sahip kaplar da mevcuttur. (Hücre kültürü çeviri ve buzdolapları ve<br />
kültür kapları).<br />
4.<strong>HÜCRE</strong> <strong>KÜLTÜRÜ</strong>NDE KULLANILAN SOLÜSYONLAR<br />
İn vitro ortamda hücrelerin metabolik aktivitelerini sürdürerek yetiştirilebilmeleri için gerekli<br />
normal fizyolojik mikroçevreyi yine laboratuvar ortamında hazırlanmakta olan kültür<br />
besiyerleri(besleyici solüsyonlar) sağlamaktadır. Vitamin, aminoasit, iyon, lipid, protein ve<br />
karbonhidrat içeriği ile hücrelerin gelişimine katkıda bulunmaktadır. Hücre tipine, hücrenin<br />
elde edildiği organizmanın türüne ve ortama adapte olma özelliklerine göre besiyeri ihtiyacı<br />
farklılık gösterebilmektedir. Hücrelerin besiyeri türüne bağlı olarak farklı davranışlar<br />
gösterebilmesi göz önünde bulundurularak çalışılan hücre hattına uygun besiyeri<br />
belirlenmelidir.<br />
4.1.DMEM (Dulbecco’s Modified Eagle Media): Kültürde büyütülen hücrelerin<br />
beslenmeleri için ihtiyaç duyulan glukoz, uygun pH, fenol, demir kırmızısı, canlılıklarının<br />
devamı için gerekli ozmolarite, fonksiyonları için vitamin ve aminoasitleri içeriğinde<br />
barındırmaktadır. Fakat içeriği tek başına hücrelerin gelişimi için yeterli düzeye sahip<br />
değildir. İnsan, hamster, fare vb. birçok hücre tipi için kullanımı mevcuttur.<br />
4.2.FBS (Fetal Bovine Serum): İçeriği tam olarak analiz edilmemiştir fakat hücrelerin kültür<br />
kaplarına yapışmalarını ve buna bağlı olarakda çoğalma gerçekleştirebilmelerini sağlayan<br />
zengin protein çözeltisidir. Hormonlar, hücrelerin büyümesi ve çoğalmasını gerçekleştiren<br />
faktörler ve özellikle adherent hücreler için gerekli olan yüzeye tutunabilmeyi sağlayan<br />
hücrelerarası matriks proteinlerini içeriğinde bulundurur. Hücrelerarası bağlantıda Ca ve Mg<br />
iyonları önem teşkil etmektedir. FBS çözeltisi , sığır hayvanlarının fetüsünden izole edilen<br />
kanın doğal olarak pıhtılaşması sonucunda geriye kalan bölümden hazırlanmaktadır.
4.3.Tripsin: Tripsin, proteaz enzim ailesinde yer alan bir endopeptidazdır. İşlevsel<br />
merkezinde histidin(46.AA) ve serin (183.AA) amino asitleri yer almaktadır. Sindirim sistemi<br />
enzimi olarakda blinen tripsin polipeptid bağlarını arjinin ve lizin amino asitlerinden kesime<br />
uğratmaktadır. Bu enzim 24500 molekül ağırlığında pankreastan inaktif tripsinojen şeklinde<br />
salgılanmakta ve ince barsakta tripsin yada enteropeptidaz etkisiyle aktif tripsin formu<br />
kazandırılmaktadır. Enzimlerin sıcaklıkta yapı ve fonksiyonlarını kaybetmesi söz konusu<br />
olduğu için saklama koşullarına dikkat edilmelidir. Tripsinin aktivitesini kaybetmemesi için<br />
en uygun sıcaklık -20 o C’dir. Fakat tripsin uygulamasının ardından sıcaklık (37 o C) artışı<br />
daha etkili çalışmasını sağlamaktadır. FBS’in içeriğinde tripsin inhibitörleri bulunmaktadır.<br />
İnhibitör, enzimlerin etkinliğini durduran maddelerin geneline verilen isimdir. Bu nedenle<br />
hücre kültürü çalışmalarında tripsisinizasyon basamağından önce ortam PBS (Ca +2 ve Mg +2<br />
içermeyen) ile yıkanmalı ve yüzeydeki serumun uzaklaştırlması gerekmektedir.<br />
Şekil 12: Süspanse edilmiş hücreler<br />
Adherent hücre Tripsinizasyon ESM protein bağlantıları kopmuş<br />
Hücreler<br />
4.4.dPBS (Dulbecco’s Phosphate Buffered Saline): İçeriğinde inorganik tuzlar (Ca +2 ve<br />
Mg +2 ) ve su bulunmaktadır. Bu şekilde hücre metabolizmasını desteklemekte ve hücreler için<br />
en uygun ortamı sağlamak için pH’ı tamponlamaktadır. dPBS’in hücre kültürü çalışmalarında<br />
kullanılamasının temel amacı hücre içindeki ve dışındaki osmotik basıncı dengede tutan bir<br />
tuz solüsyonu olmasıdır.<br />
4.5.Freezen Medium: Hücrelerin saklanmasında, sıklıkla kullanılmakta olan sıvı nitrojende<br />
(-186 o C) veya -80 o C‘de tavsiye edilen donma ortamında DMSO yada gliserol gibi<br />
intraselüller kriyoprotektan bir ajan kullanılmalıdır. Hücre kültürü dondurma ortamı olan<br />
Recovery yada Synthesizer-a-Freeze® gibi özel olarak tasarlanmış tam bir kriyoprotektan<br />
aracılarıda kullanabilmektedir.<br />
Recovery, hücrelerin yaşamlarını devam ettirebilmeleri ve çözdürme işlemine tabi<br />
tutulduktan sonra hücrelerin geri kazanımı için ihtiyaç duyulan fetal sığır serumu içermektedir<br />
ve memeli hücre kültürleri için hazır kullanımlı kriyoprezervasyon bir ortam sağlamaktadır.<br />
Synthesizer-a-Freeze® medium, %10 DMSO içeriğine sahipken protein barındırmamakta ve<br />
kimyasal olarak tanımlanmış olup primer hücre kültürleri için en uygun kriyoprezervasyon<br />
ortamı oluşturmaktadır.
5-<strong>HÜCRE</strong> <strong>KÜLTÜRÜ</strong> UYGULAMALARI<br />
5.1.Çözdürme: Sonraki çalışmalarda kullanım amacı ile saklanmış, dondurulmuş olan hücre<br />
hatlarının kullanılabilmesi için ilk olarak çözdürülmesi gerekmektedir. Çözdürme işlemi<br />
oldukça fazla hassasiyet gerektirmekte ve en az hücrelerin dondurulma aşaması kadar önem<br />
arz etmektedir.<br />
5.2.Ekimi:<br />
5.3.Hücrelerin Yeni Ortam Adaptasyonu ve Çoğalma Fazları<br />
Hücrelerin belirli bir ortamdan alınıp başka bir ortama ekimi yapılırken son derece dikkatli<br />
olunmalıdır. Çünkü hücreler bulunduğu ortamlara uyum sağlamak için uğraş sarfetmektedirler<br />
ve ani değişimler hücreler üzerinde şok etkisi yaratmaktadırlar. Hücre kültürü laboratuvarında<br />
bahsedilen bu ortam şartlarının hücreler üzerindeki etkisi hakkında fikir edinilmesi için belirli<br />
fazlar mevcuttur. Bunlar sırası ile şöyledir;<br />
5.3.1.Lag (Adaptasyon) Fazı<br />
- Hücreler girdikleri yeni besi ortamına ve şartlara uyum sağlamaya çalışırlar.<br />
- Hücre tipine göre uzunluğu değişebilir.<br />
- Bazı durumlarda çok kısa veya hiç olmayabilir. (Lag-Log fazı)<br />
5.3.2.Logaritmik (Log) Üreme Fazı<br />
- Hücrelerin uyum evresinin bittiği ve büyüme, bölünme maksimum düzeyde olduğu<br />
fazdır<br />
- Hücreler fiziksel ve kimyasal olarak en dengeli durumdadır<br />
- Dengeli bir büyüme görülmektedir.<br />
- Hücrelerin yapılacak işlem için en sağlıklı olduğu evredir. (Lag-Log fazı)<br />
5.3.3.Durgun Faz<br />
- Hücrelerin büyümeleri durur, toplam canlı hücre sayısı sabit kalır.<br />
- Hücrelerde üreme durur veya üreme oranı ile ölüm oranı dengededir. (Lag-Log fazı)<br />
5.3.4.Ölüm Fazı<br />
- Hücrelerin besin ve oksijen ihtiyacını karşılayamaması, ortamda toksik maddelerin<br />
birikmesi ve popülasyon yoğunluğunun dengesiz konumda artmış olmasından<br />
kaynaklanır.<br />
- Ölüm fazından alınan hücreler sağlıksız cevap verme eğilimindedirler. (Lag-Log fazı)<br />
-
Şekil 13: Hücrelerin yeni ortama göre durumları.<br />
5.4.Hücre Kültürünün Rutin Bakımı<br />
Kültüre daha yeni alınmış hücreler kültür kabına bağlanmaya başlamaktadırlar. Daha sonraki<br />
evrede kültür kabına yerleşen hücreler uygun besiyerinin de olması ile tek tabaka olana değin<br />
bölünmeye başlarlar. Yeteri düzeyde besin ve oksijene ulaşamayan hücrelerin bölünmesine<br />
devam etmesi onların sağlıksız olmasına neden olur. Hücrelerin % cinsinden yüzeyi<br />
kaplamasına konfluens adı verilmektedir. Hücreler metabolik aktivitelerini ve çoğalmalarını<br />
gerçekleştirebilmek için besiyeri içeriğini kullanmaktadırlar. Bu yüzden hücrelere taze ortam<br />
sağlanabilmesi için ortalama olarak 2-3 günde bir değiştirilmelidir. Bu, hücreler üzerinde<br />
yapılacak olan çalışmanın verimli olması için gereklidir. Kültür kabında bölünen hücrelerin<br />
monolayer (tek tabaka) düzeye ulaştıklarında bölünmeleri yavaşlar ve durur. Kanserli hücreler<br />
ise bu durumun aksi şekilde davranırlar. Kültür kabının yüzeyini kapladıklarında çok tabakalı<br />
olacak şekilde bölünmelerine devam ederler. (hücre kültürü çeviri).<br />
Kültürde bulunan hücrelerin rutin durumlarını saptamak için çeşitli uygulamalar vardır. Fenol<br />
red çözeltisinin kullanımı bu tekniklerden biri olmakla beraber, kullanışlı olması ile sıkça<br />
tercih edilen yöntemlerden biridir. Fenol red çözeltisi bir pH indikatörüdür ve stabil durumda<br />
(pH; 7.5) pembe renktedir. Ortamın pH’sı 7.5’ten daha düşük (asidik) bir değere indiği zaman<br />
sarı, pH 7.5’in üstünde (bazik) bir değere çıktığı zaman ise kırmızı renge bürünür. Bilindiği<br />
üzere hücreler degrede olduklarında hücre içerisindeki iyon vb. moleküllerin salgılanması<br />
gerçekleşir. Atık moleküllerin ortama salınması ile ortamın pH’sı ya asidik düzeye iner ya da<br />
bazik düzeye çıkmaktadır. Ortamda fenol red çözeltisinin bulunmasının nedeni hücre kültürü<br />
pH düzeyinin gözle görülecek düzeye bir belirteç olmasından gelmektedir.(fenol kırmızısı)<br />
5.5.Hücre Sayımı : Hücre kültürü çalışmalarında en önemli basamaklardan birini<br />
oluşturmaktadır. Hücre sayımı, çalışmalarda gereksinim duyulduğu kadar hücrenin işleme<br />
alınabilmesinde aynı zamanda da sayım yaparken kullanılan tripan blue boyası ile canlı ve<br />
ölü hücrelerinde analizinin yapılmasında olanak sağlamaktadır. Laboratuvarlarda 0.1 mm 3<br />
hacimde sayım yapılmasını sağlayan Thoma lamın tercih edilmektedir. Thoma lamın,<br />
üzerinde çukur bir kısım bulundurmakta ve bu çukurun oluşturmuş olduğu iki bölmeye lamel<br />
yerleştirildikten sonra hücreler aktarılmaktadır. Lamın sayım yapılacak alanı üzerinde kare
çizgilerle belirtilmiş bölmeler yer almaktadır. Thoma lamın İnverted mikroskobuna<br />
yerleştirilrek genellikle 10X’de hücrelerin sayımı gerçekleştirilmektedir.Sayım işlemi<br />
yapılırken en büyük karenin kenar çizgilerinde bulunan hücreler dışında bütün hücreler<br />
sayıma dahil edilmektedir.<br />
Şekil 14: Thoma lamın ve mikroskopta gözlemlenen sayım alanı<br />
5.6.Hücre Pasajlama:<br />
5.7.Dondurma: Hücreler dondurma işlemine tabi tutulduklarında, hızlı bir şekilde<br />
dondurulması hücre içeriğinde (intrasellüler) buz kristalleri olşumuna bağlı olarak hücre<br />
membranının hasarına sebebiyet vermektedir. Hızlı dondurmanın aksine yavaş<br />
gerçekleştirilen dondurma ekstraselüler ortamda (hücre dışı) buz kristallerinin oluşumuna ve<br />
osmotik dehidratasyona sebep olmakta böylece hücre hasarına yol açmaktadır. İntrasellüler ve<br />
ekstrasellüler ortamda meydana gelen buz kristallerinin oluşumu, hücre bariyerlerinin<br />
bozulması ile beraberinde getirdiği hücre ve organellerinin lizisine neden olmaktadır.<br />
Karşılaşılabilecek böyle sorunları ortadan kaldırmak yada en aza indirgemek için DMSO yada<br />
gliserol gibi kriyoprotektan ajanlar olarak isimlendirilen maddeler ile hücreler muamele<br />
edilmelidir. Kriyoprotektan ajanların kullanımının temel nedeni, H2O moelküllerini bağlaması<br />
böylece kristalizasyonu yavaşlatarak solütlerle aynı zaman aralığında kristalleşmesini<br />
sağlamasındandır. Kriyoprotektan ajanlar intrasellüler (gliserol ve dimetilsülfoksit(DMSO))<br />
ve ekstrasellüler (hidroksietil starch (HES)) olmak üzere iki şekilde bulunmaktadır.<br />
DMSO hücre zarını geçebilmekte ve suda büyük dercede çözünebilmesi ile hücre içinde ve<br />
dışında osmolaliteyi yükselterek hücre membranında bulunan tuz gradientini dengeye<br />
getirmektedir. DMSO’nun genellikle %10 konsantrasyonda kullanılmaktadır.<br />
Kriyoprotekatan ajanlar ile muamele edilmiş hücreler, fonksiyonlarının tamamen durduğu<br />
kabul edilen -196C’de sıvı azot içerisinde uzun süre muhafaza edilebilmektedir. Hücrelerin<br />
saklama sıcaklığnın -79C’nin altına düştüğü durumlarda hücre kaybına neden olmaktadır.
5.8.Saklama Koşulları: Hücre kültürü stoklanmasında kriyoprotektan ajanlar kullanılmasıyla<br />
beraber sıklıkla tercih edilen sıvı azat tankında(-196 o C) yada -80 o C’de muhafaza<br />
edilmektedirler. Kriyorotektan ajanlar hücre zarının ve organellerinin zarar görmesini<br />
minimize ederken özellikle sıvı azot tankının tercih edilmesinin nedeni hücre içi metabolik<br />
aktivitelerin tam anlamıyla yavaşlaması ve yaklaşık bir sene boyunca sağlıklı bir şekilde<br />
saklanabilmesi için uygun olmasıdır.