ALKOHOLE I FENOLE
ALKOHOLE I FENOLE
ALKOHOLE I FENOLE
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej<br />
<strong>ALKOHOLE</strong> I <strong>FENOLE</strong><br />
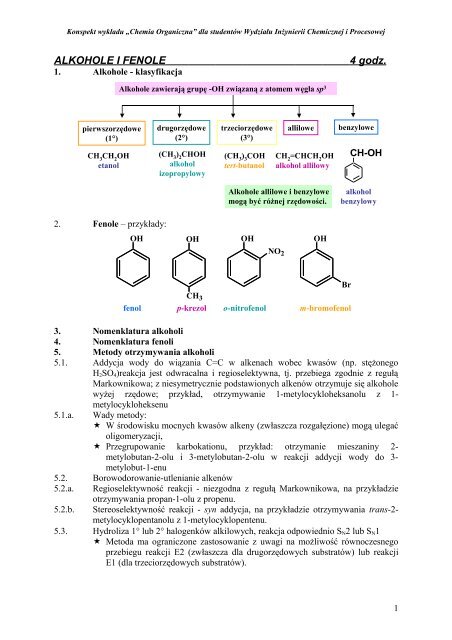
1. Alkohole - klasyfikacja<br />
pierwszorzędowe<br />
(1°)<br />
CH 3 CH 2 OH<br />
etanol<br />
2. Fenole – przykłady:<br />
Alkohole zawierają grupę -OH związaną z atomem węgla sp 3<br />
drugorzędowe<br />
(2°)<br />
(CH 3 ) 2 CHOH<br />
alkohol<br />
izopropylowy<br />
trzeciorzędowe<br />
(3°)<br />
(CH 3 ) 3 COH<br />
tert-butanol<br />
4 godz.<br />
allilowe benzylowe<br />
CH 2 =CHCH 2 OH<br />
alkohol allilowy<br />
Alkohole allilowe i benzylowe<br />
mogą być różnej rzędowości.<br />
OH OH OH<br />
OH<br />
NO2 CH3 fenol p-krezol o-nitrofenol m-bromofenol<br />
CH-OH<br />
alkohol<br />
benzylowy<br />
3. Nomenklatura alkoholi<br />
4. Nomenklatura fenoli<br />
5. Metody otrzymywania alkoholi<br />
5.1. Addycja wody do wiązania C=C w alkenach wobec kwasów (np. stężonego<br />
H2SO4)reakcja jest odwracalna i regioselektywna, tj. przebiega zgodnie z regułą<br />
Markownikowa; z niesymetrycznie podstawionych alkenów otrzymuje się alkohole<br />
wyżej rzędowe; przykład, otrzymywanie 1-metylocykloheksanolu z 1metylocykloheksenu<br />
5.1.a. Wady metody:<br />
W środowisku mocnych kwasów alkeny (zwłaszcza rozgałęzione) mogą ulegać<br />
oligomeryzacji,<br />
Przegrupowanie karbokationu, przykład: otrzymanie mieszaniny 2metylobutan-2-olu<br />
i 3-metylobutan-2-olu w reakcji addycji wody do 3metylobut-1-enu<br />
5.2. Borowodorowanie-utlenianie alkenów<br />
5.2.a. Regioselektywność reakcji - niezgodna z regułą Markownikowa, na przykładzie<br />
otrzymywania propan-1-olu z propenu.<br />
5.2.b. Stereoselektywność reakcji - syn addycja, na przykładzie otrzymywania trans-2metylocyklopentanolu<br />
z 1-metylocyklopentenu.<br />
5.3. Hydroliza 1° lub 2° halogenków alkilowych, reakcja odpowiednio SN2 lub SN1<br />
Metoda ma ograniczone zastosowanie z uwagi na możliwość równoczesnego<br />
przebiegu reakcji E2 (zwłaszcza dla drugorzędowych substratów) lub reakcji<br />
E1 (dla trzeciorzędowych substratów).<br />
Br<br />
1
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej<br />
5.4. Addycja odczynników Grignarga do aldehydów, ketonów, estrów, chlorków<br />
kwasowych i epoksydów, przykłady otrzymywania:<br />
Alkoholu cykloheksylometylowego w wyniku addycji chlorku<br />
cykloheksylomagnezu do aldehydu mrówkowego<br />
3-Metylobutan-2-olu w wyniku addycji bromku izopropylomagnezu do<br />
aldehydu octowego<br />
2-Metylopentan-2-olu w wyniku addycji jodku metylomagnezu do butanianu<br />
etylu<br />
3-Fenylometanolu w wyniku addycji bromku fenylomagnezu do benzofenonu<br />
3-Metylopentan-3-olu w wyniku addycji bromku etylomagnezu do węglanu<br />
dietylu<br />
6. Metody otrzymywania 1,2-dioli<br />
6.1. Utlenianie alkenów KMnO4 i OsO4 w niskiej temperaturze - otrzymywanie cis-1,2dioli,<br />
na przykładzie utleniania cykloheksenu<br />
6.2. Utlenianie alkenów nadkwasami – otrzymywanie trans-1,2-dioli, na przykładzie<br />
reakcji cykloheksenu z nadkwasem mrówkowym<br />
7. Alkohole wykorzystywane w przemyśle<br />
7.1. Metanol - dawniej produkowany z drewna i nieraz do tej pory nazywany<br />
alkoholem drzewnym; bardzo toksyczny - spożywanie może prowadzić do ślepoty.<br />
7.2. Etanol - dostępny w handlu to azeotrop zawierający 95% etanolu i 5% wody;<br />
stosowany w przemyśle chemicznym jako rozpuszczalnik lub substrat do syntezy<br />
eteru dietylowego, także w medycynie jako środek antyseptyczny.<br />
8. Metody otrzymywania fenoli<br />
8.1. Stapianie soli kwasów arenosulfonowych ze stałym NaOH na przykładzie<br />
otrzymywania 2-naftolu z 2-naftalenosulfonianu sodu.<br />
8.2. Nukleofilowa wymiana zaktywowanych chlorowcoarenów na przykładzie<br />
otrzymywania 2,4-dinitrofenolu z 2,4-dinitrochlorobenzenu.<br />
9. Właściwości fizyczne alkoholi i fenoli<br />
9.1. Temperatura wrzenia znacznie wyższa niż odpowiedniego węglowodoru lub eteru<br />
ze względu na tworzenie międzycząsteczkowych wiązań wodorowych.<br />
masa cząsteczkowa<br />
temp. wrzenia<br />
9.2. Rozpuszczalność w wodzie - metanol, etanol i 1-propanol rozpuszczają się w<br />
wodzie w sposób nieograniczony, rozpuszczalność wyższych alkoholi maleje w<br />
miarę wzrostu łańcucha alkilowego<br />
Nazwa<br />
metanol<br />
etanol<br />
propan-1-ol<br />
butan-1-ol<br />
pentan-1-ol<br />
heksan-1-ol<br />
etanol eter dimetylowy propan<br />
CH 3 OH<br />
Wzór<br />
CH 3 CH 2 OH<br />
CH 3 CH 2 CH 2 OH<br />
CH 3 (CH 2 ) 2 CH 2 OH<br />
CH 3 (CH 2 ) 3 CH 2 OH<br />
CH 3 (CH 2 ) 4 CH 2 OH<br />
T wrz.<br />
[ºC]<br />
65<br />
79<br />
97<br />
118<br />
138<br />
156<br />
Rozpuszczalność w H 2 O<br />
[g/100g H 2 O/20ºC]<br />
∞<br />
∞<br />
∞<br />
7.9<br />
2.7<br />
0.59<br />
2
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej<br />
10. Kwasowość alkoholi i fenoli<br />
10.1. Porównanie z kwasowością wody: alkohole są słabszymi kwasami od wody; fenole<br />
są mocniejszymi kwasami od wody: etanol (pKa = 15.9) < woda (pKa = 15.7) <<br />
fenol (pKa = 10.0).<br />
10.2. Porównanie kwasowości alkoholi i fenoli: stabilizacja anionu fenolanowego<br />
rezonansem (tzn. rozproszenie ładunku ujemnego między atomem tlenu i atomami<br />
węgla w pozycjach orto i para pierścienia aromatycznego) sprawia, że fenole są<br />
mocniejszymi kwasami od alkoholi.<br />
W anionie alkoholanowym ładunek (-) jest zlokalizowany na atomie tlenu.<br />
W anionie fenolanowym ładunek (-) jest zdelokalizowany; tj. rozproszony<br />
między atomem tlenu i atomami węgla w pozycjach orto i para pierścienia<br />
aromatycznego.<br />
10.3. Czynniki mające wpływ na kwasowość alkoholi<br />
Kwasowość alkoholi mierzona w wodzie maleje wraz ze wzrostem ich<br />
rzędowości (w fazie gazowej ta reguła nie ma zastosowania).<br />
Podstawniki elektronoakceptorowe zwiększają kwasowość alkoholu, ponieważ<br />
stabilizują anion alkoholanowy.<br />
2,2,2-trifluoroetanol<br />
CF 3 CH 2 OH<br />
pK a = 12.4<br />
metanol<br />
CH 3 OH<br />
pK a = 15.5<br />
spadek kwasowości<br />
etanol<br />
CH 3 CH 2 OH<br />
pK a = 15.9<br />
alkohol tert-butylowy<br />
(CH 3 ) 3 COH<br />
pK a = 18.0<br />
10.4. Czynniki mające wpływ na kwasowość fenoli<br />
Podstawniki elektronoakceptorowe w pozycjach orto i para w stosunku do<br />
grupy hydroksylowej zwiększają kwasowość fenoli.<br />
O 2N<br />
OH<br />
NO 2<br />
NO2 kwas pikrynowy<br />
pKa = 0.25<br />
Zwiększenie ilości podstawników<br />
elektronoakceptorowych w pozycjach orto i para w<br />
stosunku do grupy –OH powoduje znaczne<br />
zwiększenie kwasowości fenolu.<br />
Podstawniki elektronodonorowe w pozycjach orto i para w stosunku do grupy<br />
hydroksylowej zmniejszają kwasowość fenoli. Ta prawidłowość jest nie zawsze<br />
spełniona w przypadku podstawników elektronodonorowych w pozycji meta.<br />
anizol fenol m-metoksyfenol m-nitrofenol p-nitrofenol<br />
pKa = 10.2 9.9 9.7 8.3 7.2<br />
3
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej<br />
11. Otrzymywanie soli alkoholi i fenoli<br />
11.1. Reakcja alkoholi z metalami (sodem i potasem); alkohole (poza nielicznymi<br />
przypadkami) nie reagują z wodorotlenkami, ponieważ są słabszymi kwasami od<br />
wody!<br />
11.2. Reakcja fenoli z wodorotlenkami<br />
11.3. Reakcja alkoholanów z fenolami i fenolanów z alkoholami<br />
12. Reakcje alkoholi<br />
12.1. Reakcja z halogenowodorami (HX) - warunki reakcji zależą od rzędowości<br />
alkoholu i rodzaju halogenowodoru<br />
12.1.a. Alkohole1º: reakcja z kwasem bromowodorowym lub jodowodorowym wymaga<br />
obecności stężonego H2SO4 lub stężonego H3PO4; reakcja z kwasem solnym<br />
przebiega w obecności ZnCl2; przykłady: (a) otrzymywanie 1-bromobutanu z<br />
butan-1-olu pod wpływem HBr (48% aq) w obecności st. H2SO4, (b) otrzymywanie<br />
1-chloropropanu pod wpływem st. HCl w obecności ZnCl2.<br />
Mieszanina HCl(stęż.)/ZnCl2 jest to odczynnik LUCASA stosowany do<br />
rozróżniania alkoholi o różnej rzędowości - objawem reakcji jest wydzielenie<br />
się odrębnej fazy halogenku alkilowego z początkowo jednofazowej<br />
mieszaniny ROH/HCl(stęż.)/ZnCl2; w zależności o rzędowości alkoholu<br />
rozwarstwienie mieszaniny po czasie:<br />
Alkohol<br />
pierwszorzędowy (1º)<br />
drugorzędowy (2º)<br />
trzeciorzędowy (3º)<br />
Czas reakcji<br />
10 min. do kilku dni<br />
1-5 min.<br />
< 1 min.<br />
12.1.b. Alkohole 2º: reakcja z kwasem bromowodorowym lub kwasem solnym przebiega<br />
w obecności stężonego H2SO4 lub stężonego H3PO4; reakcja z kwasem<br />
jodowodorowym nie wymaga stosowania katalizatora; przykład: otrzymywanie 2bromobutanu<br />
z butan-2-olu pod wpływem mieszaniny HBr(aq)/ st. H2SO4.<br />
12.1.c. Alkohole 3º: reakcja ze stężonymi kwasami: jodowodorowym, bromowodorowym<br />
i solnym nie wymaga stosowania katalizatora.<br />
12.1.d. Reakcja 2º i 3º alkoholi asymetrycznych na przykładzie (R)-butan-2-olu -<br />
produktem jest mieszanina racemiczna (R)-2-bromobutanu i (S)-2-bromobutanu;<br />
tzn. reakcja przebiega według mechanizmu SN1.<br />
12.1.e. Ograniczenia reakcji alkoholi z halogenowodorami<br />
Ograniczona możliwość otrzymywania jodków alkilowych, ponieważ<br />
większość alkoholi bardzo źle reaguje z jodowodorem.<br />
Mała wydajność chlorków alkilowych z alkoholi (1º) i (2º) ze względu na<br />
bardzo wolny przebieg reakcji ze stężonym kwasem solnym (nawet w<br />
obecności ZnCl2) oraz liczne reakcje uboczne.<br />
Konkurencja reakcji podstawienia grupy OH z reakcją eliminacji wody;<br />
długotrwałe ogrzewanie mieszaniny alkoholu i stężonego kwasu solnego lub<br />
bromowodorowego sprzyja reakcji eliminacji i tworzeniu alkenów.<br />
Przegrupowanie karbokationu powstałego z alkoholu (2º) lub (3º) prowadzące<br />
do powstawania halogenków innych niż spodziewane;<br />
12.2. Reakcja alkoholi (1º) i (2º) z chlorkiem tionylu (SOCl2)<br />
Reakcja pozwala na ograniczenie powstawania niepożądanych produktów<br />
wynikających z przegrupowania karbokationu powstającego w reakcji alkoholi<br />
4
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej<br />
z HCl; na przykładzie otrzymywania 2-bromo-2-metylobutanu z 3metylobutan-2-olu.<br />
12.3. Reakcja alkoholi (1º) i (2º) z halogenkami fosforu: PCl3, PCl5, PBr3 i PI3 (P/I3) –<br />
reakcja daje dobre wyniki tylko w przypadku alkoholi 1º; przykłady<br />
Otrzymywanie bromku neopentylu z alkoholu neopentylowego<br />
Otrzymywanie 1-jodoheksadekanu z heksadenan-1-olu<br />
Otrzymywanie (R)-2-bromobutanu z (S)-butan-2-olu - reakcja przebiega według<br />
mechanizmu SN2, tzn. konfiguracja halogenków otrzymanych z alkoholi<br />
czynnych optycznie jest przeciwna do konfiguracji użytego alkoholu.<br />
12.4. Podsumowanie – przekształcanie alkoholi w halogenki alkilowe<br />
Reagenty do syntezy halogenków alkilowych z alkoholi<br />
alkohol<br />
(1º)<br />
(2º)<br />
(3º)<br />
chlorki<br />
SOCl 2<br />
SOCl 2<br />
HCl<br />
bromki<br />
PBr 3 lub HBr*<br />
PBr 3<br />
HBr<br />
*tylko w niektórych przypadkach<br />
jodki<br />
P/I 2<br />
P/I 2 *<br />
HI *<br />
12.5. Odwodnienie (dehydratacja) przez ogrzewanie ze stężonym H2SO4 lub H3PO4;<br />
warunki reakcji zależą od rzędowości alkoholu, alkohole wyżej rzędowe<br />
odwadniają się w łagodniejszych warunkach.<br />
12.5.a. Reguła Zajcewa na przykładzie odwodnienia 2-metylobutan-2-olu, otrzymanie<br />
mieszaniny 2-metylobut-2-enu (produkt główny) i 2-metylobut-1-enu<br />
12.5.b. Ograniczenie metody - izomeryzacja karbokationu: dehydratacja alkoholi,<br />
niezależnie od ich rzędowości, zachodzi według mechanizmu El i przebiega z<br />
przegrupowaniem karbokationu; przykłady:<br />
przegrupowanie karbokationu 1º do 3º przez przeniesienie anionu<br />
wodorkowego od atomu węgla sąsiadującego z atomem obdarzonym ładunkiem<br />
dodatnim do tego atomu węgla - odwodnienie 2-metylobutan-1-olu i<br />
otrzymanie mieszaniny 2-metylobut-2-enu (produkt główny) i 2-metylobut-1enu.<br />
odwodnienie 3,3-dimetylobutan-2-olu i otrzymanie mieszaniny 2,3dimetylobut-2-enu<br />
(produkt główny) i 2,3-dimetylobut-1-enu (przegrupowanie<br />
karbokationu 1º do 3º przez przeniesienie anionu metylowego od atomu węgla<br />
sąsiadującego z atomem obdarzonym ładunkiem dodatnim do tego atomu<br />
węgla).<br />
12.6. Estryfikacja<br />
Estry kwasów karboksylowych – reakcja alkoholi z kwasami karboksylowymi<br />
(wobec katalitycznych ilości mocnych kwasów, np. stężonego siarkowego, pto1uenosulfonowego<br />
lub chlorowodoru) oraz bezwodnikami lub chlorkami<br />
kwasów karboksylowych<br />
Przykłady estrów kwasu azotowego – nitrogliceryna<br />
Przykłady estrów kwasu fosforowego – fragment DNA<br />
12.7. Utlenianie<br />
12.7.a. Alkoholi 1° - reakcja dwuetapowa prowadząca kolejno do aldehydu, a następnie do<br />
kwasu karboksylowego.<br />
Utleniacze służące do utleniania alkoholi (1º) do aldehydów: odczynnik<br />
Coreya, odczynnik Collinsa, DMSO (dimetylosulfotlenek)/ chlorek oksalilu<br />
5
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej<br />
(reakcja Swerna); przykład – utlenianie oktan-1-olu do oktanalu przy użyciu<br />
PCC.<br />
odczynnik Coreya<br />
chlorochromian pirydyny (PCC)<br />
Utlenianie alkoholi (1º) bardzo trudno jest zatrzymać na etapie aldehydu,<br />
ponieważ aldehydy są bardzo podatne na utlenianie - większość powszechnie<br />
stosowanych utleniaczy (KMnO4/H2O; Na2Cr2O7/H2SO4/H2O; odczynnik<br />
Jonesa: CrO3/H2SO4/aceton/H2O) utlenia alkohole (1º) do kwasów<br />
karboksylowych; te same utleniacze utleniają alkohole (2º) do ketonów;<br />
przykład – utlenianie oktan-1-olu do kwasu oktanowego przy użyciu<br />
odczynnika Jonesa.<br />
12.7.b. Alkoholi 2° do ketonów; przykład - utlenianie cykloheksanolu do cykloheksanonu<br />
przy użyciu odczynnika Jonesa.<br />
12.7.c. Alkohole 3° nie utleniają się.<br />
12.7.d. Podsumowanie<br />
Reagenty do syntezy aldehydów, ketonów i kwasów karboksylowych z alkoholi<br />
Alkohol<br />
(1º)<br />
(1º)<br />
(2º)<br />
H 3C<br />
S<br />
O<br />
CH 3<br />
Produkt utlenienia<br />
aldehyd<br />
kwas karboksylowy<br />
keton<br />
CrO 3 * 2<br />
Reagent<br />
odczynnik Coreya (PCC)<br />
Na 2 Cr 2 O 7 /H 2 SO 4 /H 2 O<br />
Na 2 Cr 2 O 7 /H 2 SO 4 /H 2 O<br />
odczynnik Coreya (PCC)<br />
13. Reakcje fenoli<br />
13.1. Reakcje z udziałem grupy hydroksylowej - estryfikacja bezwodnikiem kwasowym<br />
lub chlorkiem kwasowym na przykładzie otrzymywania kwasu<br />
acetylosalicylowego<br />
13.2. Reakcje aromatycznej substytucji elektrofilowej<br />
13.2.a. Acylowanie metodą Friesa (fenoli nie można acylować metodą Friedla-Craftsa) na<br />
przykładzie otrzymywania:<br />
2-hydroksy-3-metyloacetofenonu lub 4-hydroksy-3-metyloacetofenonu z mkrezolu;<br />
2-hydroksy-4-metyloacetofenonu z octanu p-tolilu (w pochodnych parapodstawionych<br />
powstają tylko 2-hydroksyketony).<br />
N<br />
odczynnik Collinsa<br />
DMSO (dimetylosulfotlenek)/ chlorek oksalilu<br />
(reakcja Swerna)<br />
Cl<br />
O<br />
O<br />
Cl<br />
6
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej<br />
13.2.b. Alkilowanie fenoli alkenami lub alkoholami 2° lub 3° w obecności kwasu<br />
protonowego (np. HF lub H2SO4) (fenoli nie można alkilować metodą Friedla-<br />
Craftsa) na przykładzie otrzymywania 2,6-di-tert-butylo-4-metylofenolu z pkrezolu<br />
i 2-metylopropenu<br />
13.2.c. Bromowanie na przykładzie otrzymywania:<br />
2,4,6-Tribromofenolu w wyniku bromowania fenolu w rozpuszczalniku<br />
polarnym (w wodzie lub w kwasie octowym);<br />
p-Bromofenolu w wyniku bromowania fenolu w rozpuszczalniku niepolarnym<br />
(tj. disiarczku węgla: CS2) w niskiej temperaturze.<br />
13.2.d. Nitrowanie - fenole są bardzo podatne na utlenianie, dlatego nie można ich<br />
nitrować typową mieszaniną nitrującą (stęż. HNO3/stęż. H2SO4); stęż. kwas<br />
azotowy jest silnym utleniaczem!<br />
Otrzymywanie mieszaniny orto- i para-nitrofenolu w wyniku nitrowania fenolu<br />
rozcieńczonym (40%) kwasem azotowym.<br />
Otrzymywanie p-nitrofenolu bez domieszki o-nitrofenolu w wyniku reakcji<br />
fenolu z HNO2, a następnie rozcieńczonym HNO3.<br />
13.2.e. Sulfonowanie – regioselektywność reakcji w zależności od temperatury reakcji na<br />
przykładzie otrzymywania kwasu 2-hydroksybenzenosulfonowego lub kwasu 4hydroksybenzenosulfonowego<br />
13.3. Inne reakcje zachodzące w pierścieniu - utlenianie – otrzymywanie chinonów na<br />
przykładzie otrzymywania 1,4-benzochinonu z 1,4-hydrochinonu.<br />
7