barva v organických molekulách - Fakulta chemická - Vysoké učení ...
barva v organických molekulách - Fakulta chemická - Vysoké učení ...
barva v organických molekulách - Fakulta chemická - Vysoké učení ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
BARVA V ORGANICKÝCH MOLEKULÁCH<br />
Hana Zahradníková<br />
Ústav fyzikální a spotřební chemie, <strong>Fakulta</strong> <strong>chemická</strong>, <strong>Vysoké</strong> <strong>učení</strong> technické v Brně, Purkyňova 118, 612 00<br />
Brno, Česká republika, ustohalova.hana@post.cz<br />
1. Úvod<br />
Jedno z nejstarších barviv je indigo, které se používá již více než 4000 let. Bylo používáno<br />
k barvení hábitů Egyptských mumií. Když v roce 55 před Kristem napadl Julius Caesar<br />
Británii, zjistil, že místní lidé, kteří se nazývali Piktové, mají těla pomalována modrou barvou,<br />
formou indiga. Dnes se indigo, samozřejmě již vyráběné synteticky, používá například<br />
k barvení modrých Jeanů.<br />
Prvním synteticky vyrobeným barvivem byl anilinový purpur, také zvaný mauverin. V roce<br />
1856 se ho podařilo syntetizovat teprve osmnáctiletému W. H. Perkinovi, zatímco připravoval<br />
deriváty uhelného dehtu pro svého profesora. Protože okamžitě rozpoznal jeho možný<br />
potenciál, opustil školu a založil tak průmysl barviv z uhelného dehtu. Tento průmysl se začal<br />
rapidně rozrůstat a poskytoval celou škálu barviv brilantních odstínů, které dříve nebylo<br />
možno z přírodních látek vyrobit. Tyto barviva také měla mnohem lepší odolnost.<br />
S rozvojem nových barviv bylo nutné najít nějaký vztah mezi jejich barvou a chemickou<br />
strukturou těchto látek. Empirické řešení tohoto problému bylo navrženo v roce 1876<br />
O. N. Wittem a poskytlo řešení barevnosti na mnoho desetiletí. Podle tohoto řešení barviva<br />
obsahují barvu produkující chromogeny. Chromogeny jsou složeny z chromoforů, což je<br />
skupina, která nemusí nutně produkovat barevnost, a k nim jsou připojeny různé pomocné<br />
skupiny nazývané auxochromy vedoucí k produkci barvy.<br />
Chromofory obsahují uhlíkatý<br />
řetězec, ve kterém je<br />
konjugovaný systém dvojných<br />
vazeb (pravidelně se střídajících<br />
dvojných vazeb<br />
s jednoduchými), ale také azo<br />
skupiny, thio skupiny, nitroso<br />
skupiny a další. Auxochromy<br />
zahrnují skupiny jako –NH2, -<br />
NHR, -NR2, kde R representuje<br />
organické skupiny jako jsou –<br />
NO2, -CH3, -OH, -OR, -Br, -Cl<br />
atd. Je patrné, že některé<br />
z těchto skupin jsou<br />
elektrondonorní, například –<br />
NH2, a některé<br />
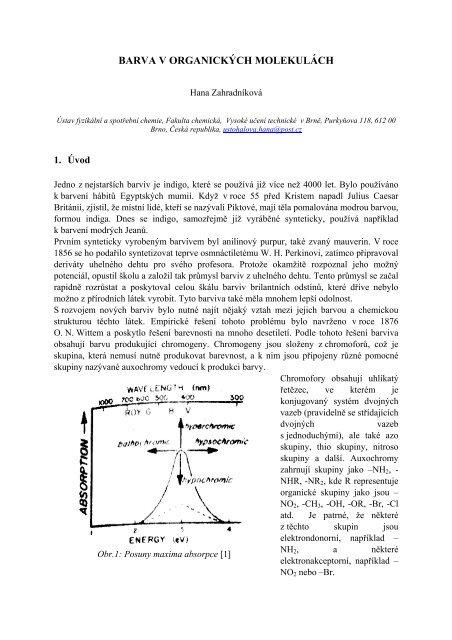
Obr.1: Posuny maxima absorpce [1]<br />
elektronakceptorní, například –<br />
NO2 nebo –Br.
Problémem této teorie ale bylo, že například centrální seskupení v molekule indiga<br />
neposkytovalo tmavou barvu v jiných strukturách, které byl ve shodě s Wittovým konceptem.<br />
Další teorie barevnosti <strong>organických</strong> molekul je široce používána dodnes (obr.1). Pokud<br />
organická látka má maximální absorpci v blízkosti ultrafialové hrany viditelného spektra,<br />
může být auxochromy, které mají bathochromní efekt, posunuta k delším vlnovým délkám.<br />
Auxochromy, které naopak absorpci posunují blíže k nižším vlnovým délkám, mají<br />
hypsochromní efekt. Auxochromy s hyperchromním efektem mohou zvyšovat intensitu barvy<br />
a naopak, auxochromy s efektem hypochromním intensitu barvy snižují.<br />
2. Polyenová barviva<br />
Obr.2: pz orbitaly molekuly 2,4hexadienu<br />
[1]<br />
Obr.3: Energetické uspořádání π orbitalů [1]<br />
Jestliže je systém konjugovaných vazeb dostatečně<br />
rozlehlý, tzv. polyeny, absorbuje světlo ve viditelné<br />
oblasti spektra a tak poskytuje barvu. Lze uvažovat tři<br />
skupiny <strong>organických</strong> barviv: necyklické polyeny,<br />
nebenzoidní cyklické systémy a benzoidní systémy.<br />
Uvažujme nyní molekulu jako je 2,4-hexadien<br />
(C6H10). Tato molekula má konjugovaný systém<br />
dvojných vazeb skládající se ze dvou dvojných vazeb,<br />
které jsou odděleny jednou jednoduchou vazbou.<br />
Uhlíkové atomy jsou spojeny jednoduchými vazbami<br />
σ. Dále jsou ve struktuře čtyři<br />
atomové pz orbitaly (obr.2),<br />
které jsou zodpovědné za<br />
vznik dvojných vazeb π. Je<br />
patrné (obr.3), že nejnižší<br />
energii má takový π orbital,<br />
kdy se všechny kladné pz<br />
orbitaly spojí v jeden lalok a<br />
záporné taktéž. Změnou<br />
znamének jednotlivých pz<br />
orbitalů postupně dostaneme π<br />
orbitaly s vyšší energií. Čtyři<br />
elektrony, jeden pro každý pz<br />
orbital, se pospojují do párů a<br />
vyplní tak orbitaly s nejnižší<br />
energií. Poskytují tak<br />
konfiguraci základního stavu.<br />
π → π ´ přechody jsou<br />
provázeny zářením o vlnové délce kolem 230nm, tedy v ultrafialové oblasti. Pokud je ve<br />
sloučenině přítomen delší řetězec konjugovaných dvojných vazeb, maximum absorpce se<br />
posouvá k delším vlnovým délkám, do viditelné oblasti spektra. U sloučeniny obecného<br />
složení H3C(-CH=CH)n-CH3 se do viditelné oblasti spektra dostaneme při n = 7 až n = 8.<br />
Pokud umístíme CH=CH skupinu vedle skupiny –CH=N- jsou změny odstínu pouze malé.
Typickými konjugovanými polyenovými barvivy jsou karotenoidy. Mezi ně patří i β-karoten,<br />
který je hlavní oranžovou součástí mrkve a jiných druhů zeleniny. Štěpí se na poloviny a<br />
v játrech se přeměňuje na vitamín A1. β-karoten se používá k barvení margarínů a dalších<br />
potravin, jako součást léků a kosmetických přípravků.<br />
Další<br />
významnou<br />
sloučeninou<br />
patřící mezi<br />
karotenoidy je<br />
crocin, který je<br />
hlavní součástí<br />
žlutého barviva<br />
nazývaného<br />
saffron. Je<br />
extrahován<br />
z rostliny,<br />
která se<br />
jmenuje crocus<br />
sativus, což je<br />
druh krokusu,<br />
který roste<br />
Obr.4: Struktura Chlorophylu a hemu [1]<br />
brzy na jaře.<br />
Toto barvivo<br />
se nejčastěji<br />
používá k vytvoření rýžově žluté barvy.<br />
Obr.5: Struktura pz orbitalů u molekuly<br />
benzenu [1]<br />
Karotenoidy se také mohou vyskytovat<br />
v tělech živočichů, například jako žluté,<br />
oranžové nebo červené ptačí peří.<br />
Látkou blízce příbuznou β-karotenu a<br />
vitamínu A1 je rhodopsin, viditelný purpur<br />
v očích. Je hlavním zprostředkovatelem<br />
vnímání světla. Maximální absorpce<br />
rhodopsinu je v oblasti kolem 500nm a<br />
způsobuje citlivost tyčinek.<br />
Příkladem polyenů patřících do skupiny<br />
cyklických nebenzoidních polyenů jsou<br />
porphyriny. Nejdůležitějšími z těchto látek<br />
jsou chlorophyl a hemová struktura (obr.4).<br />
Tyto dvě molekuly jsou si v mnohých<br />
ohledech velmi podobné. Chlorofyl je zelený<br />
pigment v rostlinách, který absorbuje<br />
světelné záření a přeměňuje ho na chemickou<br />
energii v procesu, který se nazývá<br />
fotosyntéza. Hem je červený pigment<br />
přítomný v savčí krvi, který transportuje<br />
kyslík.
Posunem jednoduchých a dvojných vazeb se struktura chlorophylu mění na strukturu hemu.<br />
Toto jsou dvě hlavní rezonanční formy. Musí být tedy vyměněny také atomy kovů.Centrální<br />
kov Mg 2+ poskytuje pouze dva elektrony, tedy jeden pár, zatímco Fe 3+ má také jeden<br />
nespárovaný elektron. Kation Fe 3+ může také poskytovat barvu sám o sobě, ale tento způsob<br />
vzniku barvy je založen na teorii ligandových polí. Červenou barvu hemu zapříčiňuje<br />
konjugovaný systém dvojných vazeb.<br />
Chlorofyl je jedním z mála přírodních barviv,<br />
které nejsou nahraditelná žádným syntetickým<br />
produktem. používá se k barvení mýdel,<br />
vosků, žvýkaček, ústních vod, potravinářských<br />
produktů a k barvení kůží. Absorpční<br />
spektrum chlorofylu a ukazuje maximální<br />
absorpci na obu krajích viditelného spektra,<br />
tedy v modré a červené oblasti a propouští<br />
světlo centrální oblasti viditelného spektra,<br />
Obr.6: Energetické uspořádání molekul<br />
benzenu, podle umísttění pz orbitalů [1]<br />
atomů a třech dvojných vazeb uspořádaných<br />
do kruhu. Existuje zde šest pz atomových<br />
orbitalů vedoucích ke vzniku šesti<br />
molekulových orbitalů π. Vrchní laloky<br />
každého molekulového orbitalu jsou<br />
ekvivalentní k sadě laloků opačného<br />
znaménka pod benzenovým kruhem. Orbital<br />
π1 je tedy orbital s nejnižší energií a orbital<br />
π6 naopak orbital s nejvyšší energií<br />
(obr.5,6). Přechody mezi energetickými<br />
hladinami vedou ke vzniku tří absorpčních<br />
pásů, které jsou z historických důvodů<br />
označeny jako p, α a β (obr.7). Jestliže se<br />
molekuly benzenu spojí do rozlehlejšího<br />
konjugovaného systému, dochází<br />
k bathochromnímu posunu, jak je vidět<br />
například u anthracenu. Jakmile se spojí šest<br />
aromatických cyklů, vzniká žlutě zbarvená<br />
látka 1,2,7,8-dibenznaphtacen s absorpčním<br />
spektrem, které ukazuje křivka C. U křivek<br />
B a C můžeme pozorovat, že relativně slabý<br />
α pás se spojil absorpčním pásem p.<br />
tedy v zelené oblasti.<br />
Poslední skupinou polyenových barviv jsou<br />
cyklické benzoidní systémy. Zástupcem je<br />
benzen, který se skládá ze šesti uhlíkových<br />
Obr.7: Přechody mezi energetickými<br />
hladinami [1]<br />
Benzoidní polyeny zahrnují barviva jako krystalová violeť, phenolphtalein a fluorescein.<br />
Všechny tyto látky patří mezi triphenyl methanová barviva. Vypuštěním jedné –N(CH3)2<br />
skupiny z těchto barviv dostaneme malachitovou zeleň a vypuštěním jednoho ze tří<br />
benzenových kruhů získáme Michlerovu hydrolovou modř.
3. Zelená barviva<br />
K vytvoření žlutých, oranžových a červených barviv postačuje jeden absorpční pás v modro-<br />
Fialovo-zelené oblasti. Podobně jeden absorpční pás v červeno-oranžovo-žluté oblasti bude<br />
produkovat fialovou a modrou barvu<br />
a střední modro-zeleno-žlutý<br />
absorpční pás bude poskytovat barvu<br />
purpurovou. Pouze pro zelenou barvu<br />
jsou nutné dva absorpční pásy, což<br />
bývá závažným problémem pro<br />
Obr.8: Struktura zeleného barviva [1]<br />
Obr.9: Oddělení dvou konjugovaných skupin u molekuly<br />
phenolphtaleinu [1]<br />
navrhovatele <strong>organických</strong> barviv. Při<br />
jeho řešení se často uchylují ke<br />
směsím modrých a žlutých barviv, ale<br />
to neposkytuje často tak intensivní barvy jako jediná organická molekula se dvěma<br />
absorpčními pásy. Navíc různé vymývání těchto barviv může vést ke změně odstínu barvy.<br />
Jednou z technik, které mohou být použity pro navržení takového barviva, je použití<br />
některých zablokujících skupin, které zabrání konjugaci mezi žlutým barvivem molekuly D1 a<br />
modrým barvivem<br />
molekuly D2 (obr.8).<br />
Tyto dvě molekuly<br />
potom budou<br />
absorbovat nezávisle<br />
na sobě. Dobrým<br />
příkladem spojení<br />
nebo oddělení dvou<br />
konjugovaných skupin<br />
je phenolphtalein<br />
(obr.9). V kyselém<br />
roztoku nejsou tři<br />
benzenové kruhy ve<br />
struktuře v konjugaci a<br />
mohou tak absorbovat<br />
pouze v ultrafialové<br />
oblasti spektra a<br />
sloučenina je tudíž<br />
bezbarvá. V zásaditém roztoku molekula pozvolna mění svou strukturu na zcela<br />
konjugovanou a phenolphtalein pak absorbuje v oblasti kolem 555nm a poskytuje tak<br />
tmavočervenou barvu. Z tohoto důvodu je phenolphtalein používán jako indikátor při<br />
acidobazických titracích. Změna barvy spojená se změnou kyselosti roztoku se někdy nazývá<br />
halochromismus.<br />
Phenolphtalein nefluoreskuje, protože vnitřní konverze umožňuje mnohem rychlejší cestu pro<br />
rozptýlení absorbované energie. Ale pokud do struktury přidáme jeden kyslíkový můstek,<br />
vznikne plochá, žlutě zbarvená molekula fluoresceinu s intensivní tmavozelenou fluorescencí.<br />
Sloučeniny jako je phenolphtalein, fluorescein nebo krystalová violeť patří do skupiny
triphenylmethanových barviv, protože kruhy nahrazují tři vodíky v centrální molekule<br />
methanu CH4.<br />
4. Donor-akceptorová barviva<br />
Velká většina <strong>organických</strong> barviv může být viděna jako spojení rozsáhlých chromoforních<br />
systémů, ke kterým jsou připojovány elektrondonorní nebo elektronakceptorní skupiny. Při<br />
řešení absorpce světla pomocí vibrujících atomů bylo nezbytné hledat lehčí atomy, kratčeji a<br />
pevněji spojené s růstem frekvence vibrací při posunutí absorpce z oblasti infračervené do<br />
oblasti viditelné. V našem případě však naopak posouváme absorpci z oblasti ultrafialové do<br />
oblasti viditelné snižováním frekvence. To můžeme uskutečnit rozšířením velikosti<br />
konjugovaného systému a to buď přímo rozšířením chromoforu nebo přidání donorové nebo<br />
akceptorové skupiny. Tyto skupiny mohou buď přímo rozšířit konjugaci nebo mohou<br />
orientovat nevazebné p orbitaly tak, že budou silně interagovat s π systémem. Přidané<br />
elektrony tak mohou být přímo z donorů pumpovány do konjugovaného systému.<br />
Pro každé dva dodané elektrony se vytvoří nová energetická hladina, která je přidána ke<br />
konjugovanému systému a to buď vazebně, nevazebně nebo protivazebně. Ačkoliv roste<br />
rozsah energií pokrytých hladinami tím, že je pokaždé přidána nová hladina, průměrná<br />
vzdálenost mezi těmito hladinami se snižuje, což vede ke snižování četnosti dovolených<br />
přechodů, tzn. bathochromnmnímu posunu.<br />
Typická donor-akceptorová resonanční situace může být popsána na příkladu krystalové<br />
violeti, kde jedna skupina –N(CH3)2 působí jako donor elektronů a druhá skupina –N(CH3)2<br />
jako elektronakceptor. Nevazebné elektrony tedy poskytují n orbitalů pro n → π přechody.<br />
Donor-akceptorní interakce nezávisí pouze na velikosti konjugovaného systému, ale také na<br />
jejich vzájemné poloze v cyklickém systému. Příkladem může být nitrophenylendiamin<br />
(obr.10), u kterého se významně mění vlnová délka absorpčního maxima v závislosti na<br />
vzájemné poloze aminových<br />
skupin na benzenovém jádře.<br />
Nahrazení skupiny –NH2<br />
skupinou –NR2 nebo –NHR vede<br />
k další sérii bathochromních<br />
posunů. Tyto látky poskytují<br />
širokou škálu barev a jsou<br />
používány především v barvách<br />
na vlasy, protože jejich malý<br />
Obr. 10: Ovlivnění absorpce vzájemnou polohou<br />
substituentů [1]<br />
objem usnadňuje penetraci do<br />
vlasu. V tomto případě můžeme<br />
mluvit o trošku více než tisíci<br />
použitelných barviv.<br />
Mnohem větší skupinou barviv jsou tzv. azo barviva, která ve svých konjugovaných<br />
systémech obsahují jednu nebo více azo skupin –N=N-. Příkladem monoazobarviv je<br />
toluidinová červeň a alizarinová žluť. Mezi diazobarviva obsahující dvě azo skupiny řadíme<br />
například Bismarkovu hněď. Existují také triazo- a polyazobarviva, jejichž příkladem může<br />
být například kyselá hněď 120.
Další významnou skupinou barviv jsou barviva obsahující chinonové skupiny. Mezi ně<br />
můžeme zařadit dobře známé barvivo madder, což je přírodní červené barvivo extrahované<br />
z kořenů rostlin Rubiaceae již od dob Starého Egypta. Dnes je známé pod názvem alizarin<br />
nebo také turecká červeň.<br />
Další tři významné látky jsou kermes, přírodní barvivo produkované hmyzem, a blízce<br />
příbuzný šarlat a šelaková barviva. Kermes byl extrahován v antické Indii z určitého druhu vší<br />
žijících na dubech. Šarlat byl získáván také v antické Indii z pryskyřice. Šelakové barvivo<br />
bylo produkováno již v Kortézských časech v Mexiku z hmyzu žijícího na kaktusech a jeho<br />
přípravu se podařilo udržet v tajnosti více než sto let.<br />
Indigo, modré barvivo používané k barvení Jeanů, bylo zmíněno již na začátku tohoto článku.<br />
K barvení se používá v bezbarvé formě, protože modrá forma tohoto barviva je nerozpustná<br />
ve vodě. Aktivní indigoidní chromofor, který je také někdy pro jeho neobvyklý tvar nazýván<br />
H-chromofor, může zahrnovat několik rezonančních forem. Indigo je nejstarším organickým<br />
barvivem, používá se již více než 4000 let a bylo získáváno z keře druhu Indigofera a to<br />
převážně z Indigofera sumatrana a Indigofera arrecta. Borytová modř, kterou používali<br />
Pictové před více než 2000 lety obsahuje indigo a byla získávána z modře zbarvených rostlin<br />
nebo modrého dřeva Isatis tictoria.<br />
Další historicky významnou formou indiga je barvivo Tyrian purpur, které používali<br />
k barvení svých oděvů císařové a další šlechta. Toto barvivo bylo vyráběno z bílého hlenu,<br />
který vylučovali v malých množstvích měkkýši Murex brandaris. Tento hlen na vzduchu a na<br />
světle oxidoval a vznikal tak načervenalý purpur. Exklusivním a velice drahým barvivem je<br />
6,6´-dibromindigo. Na výrobu jednoho gramu tohoto barviva je nutné spotřebovat až 10 tisíc<br />
lastur. Dnes se již ale komerčně nevyrábí, protože stejný odstín poskytují i mnohem levnější<br />
barviva. Další formou indiga je indirubin, který je přítomen v přírodním indigu, a thioindigo,<br />
kde dvě –NH skupiny jsou nahrazeny skupinami –S s malým hypsochromním posunem.<br />
Flavony a anthocyaniny mají brilantní odstíny a jsou součástí pigmentů mnoha zahradních<br />
květin. Zahrnují světložluté barvivo quercetin a cyanidin, které se v kyselém roztoku mění na<br />
červenou, a purpur v přírodním stavu se mění v zásaditých roztocích na modrou. Tyto látky<br />
mohou být použity jako acidobazické indikátory.<br />
Na závěr bychom měli zmínit hnědé barvivo melanin, které dává barvu například lidským<br />
vlasům nebo zvířecí srsti, pokožce a kůži.<br />
Termochromismus je změna zbarvení závislá na změně teploty. Může být způsoben jednak<br />
změnami ligandových polí s přechodem kovových iontů, ale také mnoha organickými<br />
barvivy, které mění svoji barvu s teplotou. Převážně jde o vratné strukturní změny v roztoku,<br />
ale v pevné fázi dochází také k trvalým změnám barvy při ochlazení na pokojovou teplotu.<br />
Příkladem může být žlutý barvivo anil, kde se při zahřátí mění hydroxidová skupina na<br />
skupinu chinoidní a <strong>barva</strong> se mění na červenou.<br />
Fotochromismus je změna barvy způsobená absorpcí fotonů nebo ultrafialového záření.<br />
Příkladem je bezbarvý 2-benzyl-3-benzoyl-chromon, který se po vystavení ultrafialovému<br />
záření mění na oranžový a ve tmě se vrací do původního stavu. Tuto změnu způsobuje pohyb<br />
vodíkového atomu a změna ketoskupiny na skupinu enolovou.
5. Závěr<br />
Větší a více komplikované organické molekuly mohou absorbovat světlo do energetických<br />
hladin zahrnujících organické molekuly. Tyto molekuly jsou založeny hlavně na π vazbách<br />
uspořádaných do konjugovaného systému s vazbami jednoduchými, ke kterým mohou být<br />
připojeny elektron-donorní nebo elektron-akceptorní skupiny. Takové molekuly zahrnují<br />
většinu biologických barviv, barviv obsažených v rostlinných a živočišných tkáních, barviva<br />
přírodní i syntetická.<br />
6. Literatura<br />
[1] Nassau, K.: The Physic and Chemistry of Color, The Fifteen Cause of Color. 2 nd ed.<br />
New York: J. Wiley and sons,2001. ISBN 0-471-39106-9