Quiz – Alkany & Cykloalkany
Quiz – Alkany & Cykloalkany
Quiz – Alkany & Cykloalkany
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Quiz</strong> <strong>–</strong> <strong>Alkany</strong> & <strong>Cykloalkany</strong><br />
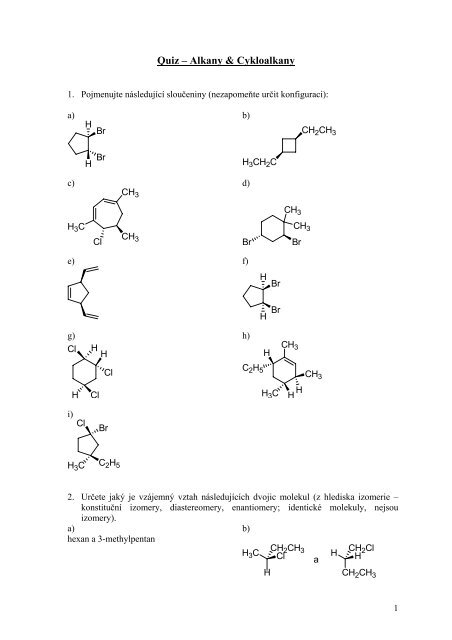
1. Pojmenujte následující sloučeniny (nezapomeňte určit konfiguraci):<br />
a) b)<br />
H<br />
Br<br />
H<br />
Br<br />
c) d)<br />
H 3C<br />
Cl<br />
CH 3<br />
CH 3<br />
e) f)<br />
g) h)<br />
Cl H<br />
H<br />
i)<br />
H<br />
Cl<br />
H 3C<br />
Cl<br />
Br<br />
Cl<br />
C 2H 5<br />
H 3CH 2C<br />
Br<br />
H<br />
H<br />
C 2H 5<br />
H<br />
Br<br />
Br<br />
H 3C<br />
CH 3<br />
CH 2CH 3<br />
CH 3<br />
Br<br />
CH 3<br />
H<br />
H<br />
CH 3<br />
2. Určete jaký je vzájemný vztah následujících dvojic molekul (z hlediska izomerie <strong>–</strong><br />
konstituční izomery, diastereomery, enantiomery; identické molekuly, nejsou<br />
izomery).<br />
a) b)<br />
hexan a 3-methylpentan<br />
H3C CH2CH3 Cl a<br />
H<br />
CH2Cl H<br />
H<br />
CH2CH3 1
c) d)<br />
H<br />
H3C Br<br />
H<br />
Cl<br />
H<br />
a<br />
H<br />
H3C Br<br />
H<br />
H<br />
Cl<br />
Cl<br />
C2H5 H<br />
C2H5 Cl<br />
H<br />
e) f)<br />
H<br />
H<br />
a<br />
F<br />
CH3 F<br />
CH3 H<br />
H<br />
g) h)<br />
H3C H<br />
Cl<br />
H3C Cl<br />
H<br />
a<br />
H<br />
CH3 Cl<br />
H<br />
H3C Cl<br />
i) j)<br />
H<br />
F<br />
a<br />
H<br />
F<br />
k) l)<br />
CH 3<br />
F<br />
Br Cl<br />
a<br />
Cl<br />
F<br />
H3C Br<br />
H<br />
F<br />
H<br />
CH 3<br />
H<br />
CH 3<br />
H<br />
F<br />
OH<br />
H<br />
CH 3<br />
H<br />
H<br />
F<br />
3C<br />
H<br />
CH3 F H<br />
m) n)<br />
Cl Cl<br />
Cl Cl<br />
CH3 a<br />
Cl<br />
H H H H<br />
H F<br />
o) p)<br />
H<br />
H<br />
a<br />
H<br />
H<br />
Br<br />
H<br />
Cl<br />
CH3 CH3 Cl<br />
H<br />
Br<br />
a<br />
a<br />
a<br />
a<br />
a<br />
a<br />
H C2H5 Cl<br />
H<br />
C2H5 Cl<br />
H 3C H<br />
F<br />
H<br />
OH<br />
CH 3<br />
H<br />
F<br />
H<br />
H<br />
3C<br />
F<br />
F<br />
H CH3 Cl<br />
H<br />
H3C F<br />
Br<br />
H<br />
CH 3<br />
H<br />
H<br />
CH 3<br />
3. Nakreslete možné konformace (popř. geometrické izomery) následujících cykloalkanů<br />
(cyklohexan → židličková konformace) a pokud lze, určete stabilnější:<br />
a) cis-1-isopropyl-4-methylcyklohexan<br />
b) cis-1,4-dimethylcyklohexan<br />
c) trans-1,2-dimethylcyklohexan<br />
a<br />
Br<br />
H<br />
2
Br<br />
d) cis-1,2-dimethylcyklohexan<br />
e) trans-1-terc-butyl-3-methylcyklohexan<br />
f) cis-1,3-dimethylcyklohexan<br />
g) 1,2-dimethylcyklopropan<br />
h) trans-1,4-dichlorcyklohexan<br />
i) cis-1,4-dichlorcyklohexan<br />
j) trans-1-chlor-2-methylcyklohexan<br />
4. Doplňte chybějící struktury:<br />
a)<br />
Cl<br />
Cl<br />
otočení<br />
kruhu<br />
b) Newmanův projekční vzorec pro gauche konformaci 1,2-dibromethanu:<br />
5. Vyberte, které z derivátů cyklohexanu jsou:<br />
H<br />
Br<br />
H<br />
Br Br Br<br />
H H<br />
A B C D E<br />
a) zcela identické.<br />
b) konfiguračními izomery.<br />
c) konformačními izomery.<br />
d) konstitučními izomery.<br />
H<br />
Br<br />
H<br />
Br<br />
H<br />
H<br />
Br<br />
H<br />
Br<br />
Br<br />
H<br />
H<br />
Br H<br />
6. Posuďte následující sloučeniny z hlediska symetrie nebo disymetrie a určete:<br />
a) Které z molekul jsou chirální?<br />
b) Které z molekul mají rovinu symetrie?<br />
c) Které z molekul mají C2 osu symetrie?<br />
F<br />
Br<br />
3
H OH<br />
H<br />
OH<br />
Br<br />
Cl<br />
O<br />
Br<br />
Br Br Br Br Br<br />
A B C D E<br />
C 2H 5CHCl 2 C 2H 5CHClC 2H 5 C 2H 5CHClCH 3<br />
F G H I J<br />
7. Určete, které z následujících molekul jsou chirální:<br />
OH<br />
CH 3<br />
CN<br />
O<br />
NH 2 O<br />
CO 2H<br />
CN<br />
H H<br />
H3C OH<br />
CH2CO2H OH<br />
OH<br />
OH<br />
OH<br />
CH 3<br />
CH2CO2H HO H<br />
HO H<br />
CH2CO2H A B C D E<br />
F G H I J<br />
8. Které z následujících podmínek mohou charakterizovat dvojici stereoizomerů:<br />
a) mohou být meso izomery<br />
b) mohou být tautomery<br />
c) mohou být enantiomery<br />
d) mohou být diastereomery<br />
e) mohou být konformačními izomery<br />
f) mohou být konstitučními izomery<br />
g) mohou být konfiguračními izomery<br />
h) žádné z předchozích tvrzení není správné<br />
OH<br />
CH 3<br />
4
9. Vyberte, které z molekul jsou:<br />
H<br />
H<br />
H<br />
C 2H 5<br />
CH 3<br />
CH 3<br />
H 3C<br />
H<br />
C2H5 H<br />
CH 3<br />
H<br />
H 3C<br />
H3C H<br />
CH3 CH3 CH 3<br />
H 3C<br />
H<br />
CH 3<br />
H<br />
C2H5 H<br />
H<br />
H 3C<br />
A B C D E<br />
a) zcela identické.<br />
b) konformačními izomery.<br />
c) konstitučními izomery.<br />
CH3 CH3 10. Určete, v jaké poloze (axiální nebo ekvatoriální) se bude nacházet červeně vyznačená<br />
skupina, tak aby následující šestičlenné cykly byly v nejstabilnější konformaci:<br />
H 3C<br />
CH 3<br />
H3C Cl<br />
CH H3C Cl<br />
H<br />
3 3C<br />
CH3<br />
CH3 H3C CH3 CH3<br />
H 3C<br />
CH 3<br />
CH 3<br />
H 3C<br />
CH 3<br />
CH 3<br />
CH 3<br />
H<br />
H<br />
CH 3<br />
A B C D<br />
H3C CH3 CH3 E F<br />
CH 3<br />
H<br />
H<br />
G H<br />
11. Určete počet stereogenních center následujících molekul, zda jsou chirální nebo<br />
achirální a zda obsahují některý z prvků symetrie (rovina symetrie nebo C2 osa<br />
symetrie):<br />
H 3C<br />
H 3C<br />
H 3C H 3C<br />
H 3C<br />
H 3C<br />
HO<br />
H 3C<br />
H 3C H 3C<br />
CH 3<br />
A B C D E<br />
OH<br />
OH<br />
H 3C<br />
H 3C<br />
OH<br />
OH<br />
H 3C<br />
H 3C<br />
OH<br />
OH<br />
H 3C<br />
H 3C<br />
F G H I<br />
OH<br />
OH<br />
H 3C<br />
HO<br />
CH 3<br />
OH<br />
J<br />
H<br />
OH<br />
5
12. Určete všechny monochlorované deriváty, které vzniknou při radikálové chloraci<br />
následující sloučeniny:<br />
CH 3<br />
CH 3<br />
CH 3CHCH 2CHCH 3<br />
Který z nich bude vznikat nejsnadněji a proč?<br />
13. Následující uhlovodíky podléhají fotochemicky iniciované chloraci nebo bromaci<br />
s příslušným halogenem (chlor nebo brom). Určete počet mono-, di- a<br />
trihalogenovaných konstitučních izomerů, které vzniknou po reakci s jedním, dvěmi<br />
nebo třemi ekvivalenty halogenu.(Nepočítejte stereoizomery.)<br />
CH 3CH 2CH 3 CH 3CH 2CH 2CH 3 (CH 3CH 2) 4C (CH 3) 2CHCH(CH 3) 2<br />
A B C D<br />
H 2<br />
H<br />
C<br />
2C<br />
H2C CH2<br />
14. Určete a nakreslete produkty reakce cyklopropanů a cyklobutanu v následujících<br />
schématech a vysvětlete rozdílnou reaktivitu v porovnání s cyklopentanem a více<br />
uhlíkatými cykloalkany.<br />
a) b)<br />
CH3 HBr<br />
?<br />
Br 2<br />
?<br />
b) d)<br />
H 2<br />
Ni, 200°C ?<br />
e)<br />
CH 3<br />
H 2<br />
Pt ?<br />
CH 3<br />
H 2SO 4 ?<br />
15. Napište všechny příslušné alkeny, jejichž katalytickou hydrogenací (H2 / Pt, Pd nebo<br />
Ni / Δp) může vzniknout:<br />
a)<br />
CH 3<br />
CH 3CHCH 2CH 3<br />
E<br />
6<br />
CH 2
)<br />
c)<br />
CH 3<br />
CH 3<br />
CH 3CHCHCH 3<br />
CH 3<br />
16. Určete konfiguraci na asymetrickém uhlíku a plně pojmenujte:<br />
a) b)<br />
CH3 Cl<br />
HOH2C H CH2CH3 Cl<br />
c)<br />
CH3 d)<br />
H<br />
Br<br />
CH 2CH 2CH 3<br />
e)<br />
F<br />
H<br />
f)<br />
Br Cl<br />
Cl<br />
g) h)<br />
H<br />
Cl<br />
H 3C<br />
CH 3<br />
OH<br />
H<br />
i) j)<br />
HO<br />
H<br />
OHC<br />
CH 2<br />
OH<br />
OH<br />
H<br />
H<br />
ClH 2C<br />
O<br />
C<br />
H<br />
F<br />
CH 3<br />
H<br />
Br<br />
Br<br />
CH 3<br />
CH 3<br />
CH 2CH 3<br />
CH 2CH 3<br />
HO<br />
CH 3<br />
H OH<br />
CH 2<br />
Cl H<br />
CH 3<br />
Br<br />
CH 2OH<br />
17. 2,2-Dimethylbutan byl podroben fotoiniciované chloraci.<br />
a) Kolik možný monochlorovaných derivátů 2,2-dimethylbutanu můžeme získat?<br />
b) Od těchto derivátů napište možné stereoizomery a určete u nich konfiguraci.<br />
7
18. Doplňte chybějící reaktan(y), reagent(y) nebo produkt(y) a produkt(y) plně<br />
pojmenujte.<br />
H3C CH3 CH<br />
CH3 CH3C CHCH3 Cl CH3 + HNO 3<br />
CH 3<br />
CH 3<br />
CH3 H3C C CH3 CH3 O 2<br />
ΔT<br />
430°C<br />
H 2 / RaneyNi<br />
EtOH,<br />
25°C, 1atm<br />
SO 2 + O 2<br />
ΔT<br />
CH 3<br />
CH 3CHCHCH 3<br />
CH 3<br />
H3C CH2 O<br />
S<br />
O<br />
CH3 H3C C CH2Br CH3 OH<br />
8
Mg H<br />
H3C CH2Br 2O<br />
diethylether<br />
CH 3CH 2CH 2CH 3<br />
Cl 2 / hν<br />
19. Vypočítejte celkovou ΔH 0 enthalpii z disociačních energií vazeb u následujících reakcí:<br />
a) (CH3)3C-H + Cl-Cl → (CH3)3C-Cl + H-Cl<br />
DH 0 = 400 DH 0 = 243 DH 0 = 349 DH 0 = 432 kJ mol -1<br />
b) CH3CH2CH2-H + Br-Br → CH3CH2CH2-Br + H-Br<br />
DH 0 = 423 DH 0 = 193 DH 0 = 294 DH 0 = 366 kJ mol -1<br />
c) CH3CH3 + Cl2 → CH3CH2Cl + HCl<br />
DH 0 = 421 DH 0 = 243 DH 0 = 353 DH 0 = 432 kJ mol -1<br />
d) (CH3)2CH-H + F-F → (CH3)2CH-F + H-F<br />
DH 0 = 413 DH 0 = 159 DH 0 = 439 DH 0 = 570 kJ mol -1<br />
9
Řešení:<br />
1. Příklady g, h a i jsou molekuly, kde jsou více než dva vodíky na cykloalkanovém kruhu<br />
zaměněny za substituenty. V tomto případě se konfigurace určuje vůči prvnímu substituentu,<br />
tzv. referenční substituent (označení “r“), následující pomlčkou a názvem substituentu. U<br />
všech ostatních substituentů se určuje už pouze relativní konfigurace, buď cis (“c“) nebo trans<br />
(“t“), vzhledem k referenčnímu substituentu.<br />
a) b)<br />
H<br />
Br<br />
CH 2CH 3<br />
Br<br />
H<br />
H3CH2C trans-1,2-dibromcyklopentan cis-1,4-dimethylcyklobutan<br />
c) Z hlediska geometrie dvojných vazeb d)<br />
leží <strong>–</strong>CH3 skupiny v poloze 1 a 4 v rovině<br />
cykloheptanového kruhu.<br />
H 3C<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
Cl<br />
Br Br<br />
trans-5-chlor-1,4,6-trimethylcyklohepta- trans-2,4-dibrom-1,1-dimethylcyklohexan<br />
1,3-dien<br />
e) f)<br />
Br<br />
H<br />
cis-3,5-divinylcyklopenten cis-1,2-dibromcyklopentan<br />
g) h)<br />
Cl H<br />
H<br />
Cl<br />
H Cl<br />
H H<br />
3C H<br />
r-1,t-2,c-4-trichlorcyklohexan t-6-ethyl-1,r-3,t-4-trimethylcyklohex-1-en<br />
H<br />
C 2H 5<br />
H<br />
Br<br />
CH 3<br />
CH 3<br />
10
i)<br />
Cl<br />
Br<br />
H C<br />
3C 2H5 r-1-brom-1-chlor-t-3-ethyl-3-methylcyklopentan<br />
2.<br />
a) konstituční izomery b) konstituční izomery<br />
a<br />
CH<br />
H 2CH3 3C Cl<br />
H<br />
a<br />
CH<br />
H 2Cl<br />
H<br />
CH2CH3 c) enantiomery d) diastereomery<br />
H<br />
H3C Br<br />
H<br />
Cl<br />
H<br />
a<br />
H<br />
H3C Br<br />
H<br />
H<br />
Cl<br />
Cl<br />
C2H5 H<br />
C2H5 Cl<br />
H<br />
a<br />
H C2H5 Cl<br />
H<br />
C2H5 Cl<br />
e) enantiomery f) konstituční izomery<br />
H<br />
H<br />
a<br />
F<br />
CH3 H<br />
H<br />
a<br />
H3C H<br />
F<br />
CH3 H<br />
H<br />
F<br />
F F F<br />
g) enantiomery h) enantiomery<br />
H<br />
OH<br />
H3C H<br />
CH3 H<br />
Cl a Cl<br />
Cl<br />
H<br />
H<br />
H3C H H3C Cl<br />
CH3 i) žádný vztah (nejsou izomery) j) diastereomery<br />
H<br />
F<br />
a<br />
H<br />
F<br />
H<br />
CH 3<br />
CH 3<br />
k) identické molekuly l) diastereomery<br />
Br<br />
CH3 F<br />
Cl<br />
a<br />
H3C Cl<br />
F<br />
Br<br />
H3C F<br />
F<br />
H<br />
CH3 H<br />
a<br />
H<br />
a<br />
a<br />
H<br />
OH<br />
CH 3<br />
H<br />
H<br />
H<br />
3C<br />
F<br />
F<br />
H CH3 m) žádný vztah (nejsou izomery) n) identické molekuly<br />
Cl Cl<br />
Cl Cl<br />
CH3 Cl<br />
a<br />
Cl a H<br />
H H H H<br />
H F H3C F<br />
CH 3<br />
H<br />
H<br />
CH 3<br />
11
o) enantiomery p) enantiomery<br />
H<br />
H<br />
H<br />
H<br />
Br<br />
a<br />
H<br />
a<br />
CH3 Cl<br />
H<br />
Cl<br />
CH3 Br<br />
3. Stabilnější je konformace, která má oba substituenty na ekvatoriálních vazbách nebo<br />
objemnější ze substituentů na ekvatoriální vazbě a méně objemný na axiální.<br />
a)<br />
CH CH H3C 3<br />
b)<br />
H 3C<br />
c)<br />
d)<br />
e)<br />
f)<br />
g)<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3 CH3<br />
H 3C<br />
H3C CH<br />
H3C CH 3<br />
C(CH 3) 3 C(CH 3) 3<br />
CH 3<br />
CH 3 H 3C<br />
H 3C<br />
H<br />
CH 3<br />
H<br />
H 3C<br />
H<br />
CH 3<br />
C<br />
H<br />
3<br />
CH 3<br />
CH 3<br />
C<br />
H 3<br />
H<br />
CH 3<br />
CH 3<br />
- trans-1,2-dimethylcyklopropan je stabilnější, protože methylové skupiny si méně překáží,<br />
narozdíl od cis-1,2-dimethylcyklopropanu.<br />
Br<br />
H<br />
Br<br />
H<br />
12
h)<br />
Cl<br />
i)<br />
Cl<br />
j)<br />
4.<br />
a)<br />
b)<br />
Cl<br />
CH 3<br />
Cl<br />
Cl<br />
H<br />
H<br />
H<br />
H<br />
Cl<br />
Cl<br />
Br<br />
Br<br />
Cl<br />
Cl<br />
otočení<br />
kruhu<br />
Cl<br />
Cl<br />
CH 3<br />
5. a) Zcela identické jsou molekuly: AC a BF.<br />
b) Konfiguračními izomery jsou molekuly A a D.<br />
b) Konformačními izomery jsou molekuly D a e.<br />
c) Konstitučními izomery jsou molekuly E a F.<br />
6.<br />
Chirální molekuly <strong>–</strong> E, F, J<br />
Molekuly s rovinou symetrie <strong>–</strong> A, B, C, D, G, H, I<br />
Molekul s C2 osou symetrie - E<br />
Cl<br />
Cl<br />
Cl<br />
7. Molekuly B, F, G a I jsou chirální.<br />
8. Dvojice stereoizomerů může být meso izomery, enantiomery, diastereomery,<br />
konfromačními izomery nebo konfiguračními izomery (správné odpovědi: a, c, d, e, g).<br />
9. a) Zcela identické jsou molekuly: CE a BD.<br />
b) Konformačními izomery jsou molekuly A a D.<br />
c) Konstitučními izomery jsou molekuly B a E.<br />
13
10. A <strong>–</strong> axiální; B <strong>–</strong> ekvatoriální; C <strong>–</strong> axiální; D <strong>–</strong> ekvatoriální; E <strong>–</strong> ekvatoriální; F <strong>–</strong> axiální;<br />
G <strong>–</strong> axiální; H <strong>–</strong> axiální.<br />
11.<br />
molekula # stereogenních center chiralita prvek symetrie<br />
A 2 chirální osa C2<br />
B 2 achirální rovina<br />
C 2 chirální žádný<br />
D 2 chirální osa C2<br />
E 2 chirální žádný<br />
F 4 chirální osa C2<br />
G 4 achirální rovina<br />
H 4 chirální osa C2<br />
I 4 achirální rovina<br />
J 3 chirální žádný<br />
12. Výchozí molekula je symetrická, proto obsahuje pouze tři typy různě vázaných<br />
vodíkových atomů a při monochloraci budou vznikat následující sloučeniny:<br />
a) b) c)<br />
CH 3<br />
CH 3<br />
CH2CHCH2CHCH3 Cl<br />
CH 3 CH 3<br />
CH3CCH2CHCH3 Cl<br />
CH 3 CH 3<br />
CH3CHCHCHCH3 Cl<br />
Nejsnadněji bude vznikat ten derivát, kde je chlor vázaný na terciárním uhlíku b).<br />
13.<br />
Počet A B C D E<br />
monosubstituovaných izomerů 2 2 2 2 1<br />
disubstituovaných izomerů 4 6 6 6 3<br />
trisubstituovaných izomerů 5 9 11 9 4<br />
14. Z důvodu velkého napětí na kruhu, cyklopropan (27,6 kcal/mol) a cyklobutan (26,4<br />
kcal/mol) velmi snadno podléhají rozštěpení cyklu na rozdíl od cyklopentanu (6,5 kcal/mol)<br />
nebo více uhlíkatých cykloalkanů (cyklohexan <strong>–</strong> 0 kcal/mol; cykloheptan <strong>–</strong> 6,3 kcal/mol,<br />
atd.). U cyklopropanu tyto reakce probíhají především jako adice a mnoho z nich je<br />
inicializováno atakem elektrofilu.<br />
a) b)<br />
CH3 HBr H3C CH3 Br 2<br />
Br Br<br />
c) d)<br />
H 2<br />
Ni, 200°C<br />
CH 3<br />
H 2SO 4<br />
Br<br />
OSO 3H<br />
14
e)<br />
CH 3<br />
15.<br />
a)<br />
CH 3<br />
H 2<br />
Pt<br />
H 2C CCH 2CH 3<br />
b)<br />
CH 3<br />
c)<br />
CH 3CHC<br />
16.<br />
a)<br />
Cl<br />
H<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 2<br />
CH 2CH 3<br />
(R)-2-chlorbutan<br />
b)<br />
HOH 2C<br />
Cl<br />
CH 3<br />
CH 2CH 3<br />
CH 3<br />
H 3CC CHCH 3<br />
CH 3<br />
CH3 CH3C CCH3 CH3 CH 2<br />
CH 3<br />
Cl H<br />
CH 2CH 3<br />
(S)-2-chlor-2-methylbutan-1-ol<br />
c)<br />
H<br />
Br<br />
CH 3<br />
CH 2CH 2CH 3<br />
(S)-2-brompentan<br />
d)<br />
H<br />
ClH 2C<br />
CH 3<br />
CH 2CH 3<br />
(S)-1-chlor-2-methylbutan<br />
CH 3<br />
CH 3CHCH CH 2<br />
3<br />
1 4<br />
2<br />
CH 3<br />
HOH 2C Cl<br />
CH 2CH 3<br />
CH 3<br />
H Br<br />
CH 2CH 2CH 3<br />
CH 3<br />
H CH 2Cl<br />
CH 2CH 3<br />
1<br />
3 2<br />
4<br />
4<br />
2 1<br />
3<br />
3<br />
4 1<br />
2<br />
3<br />
4 1<br />
2<br />
2<br />
4 3<br />
1<br />
1<br />
2 3<br />
4<br />
1<br />
2 3<br />
4<br />
3<br />
1 2<br />
4<br />
15
e)<br />
H<br />
Br<br />
F<br />
Cl<br />
F<br />
H Br<br />
Cl<br />
(S)-brom(chlor)fluormethan<br />
f)<br />
Cl<br />
F<br />
H<br />
Br<br />
F<br />
Br H<br />
Cl<br />
(R)-brom(chlor)fluormethan<br />
g)<br />
H<br />
Cl<br />
H 3C<br />
CH 3<br />
OH<br />
H<br />
H<br />
CH 3<br />
(2S, 3R)-3-chlorbutan-2-ol<br />
h)<br />
O<br />
C<br />
H<br />
Br<br />
HO<br />
CH 3<br />
Br<br />
CH 2OH<br />
3<br />
4 1<br />
2<br />
3<br />
1 4<br />
2<br />
H<br />
Cl<br />
Br<br />
CH 3<br />
OH<br />
Br<br />
CH 3<br />
CHO<br />
1<br />
2 3<br />
4<br />
1<br />
3 2<br />
4<br />
OH<br />
CH 2OH<br />
CH3 H OH<br />
H Cl<br />
CH3 (2S, 3R)-2,3-dibrom-3,4-dihydroxy-2-methylbutan-1-al<br />
i)<br />
HO<br />
H OHC<br />
CH 2<br />
OH<br />
OH<br />
H<br />
HO<br />
H<br />
CH 2OH<br />
CHO<br />
(2R, 3S)-2,3,4-trihydroxybutan-1-al<br />
j)<br />
CH 3<br />
H OH<br />
CH 2<br />
Cl H<br />
CH 3<br />
H<br />
CH 3<br />
H OH<br />
CH 2CHClCH 3<br />
CH 2CHOHCH 3<br />
Cl H<br />
CH 3<br />
(2S, 4S)-4-chlorpentan-2-ol<br />
OH<br />
3<br />
4 1<br />
2<br />
2<br />
1 4<br />
3<br />
H<br />
HO<br />
3<br />
4 1<br />
2<br />
CHO<br />
H3C Br<br />
HO Br<br />
CH2OH CHO<br />
OH<br />
H<br />
CH2OH 1<br />
2 3<br />
4<br />
1<br />
2 3<br />
4<br />
2<br />
4 1<br />
3<br />
2<br />
4 1<br />
3<br />
2<br />
1 4<br />
3<br />
1<br />
2 3<br />
4<br />
1<br />
3 2<br />
4<br />
3<br />
4 1<br />
2<br />
3<br />
2 1<br />
4<br />
1<br />
3 2<br />
4<br />
1<br />
2 3<br />
4<br />
1<br />
2 3<br />
4<br />
16
17.<br />
a)<br />
CH 3<br />
CH 3CCH 2CH 3<br />
CH 3<br />
Cl 2<br />
hν<br />
CH 2Cl<br />
CH 3CCH 2CH 3<br />
CH 3<br />
+ CH3CCHClCH3 +<br />
CH3 CH3CCH2CH2Cl CH3 CH3 CH3 1-chlor-2,2-dimethylbutan 3-chlor-2,2-dimethylbutan 1-chlor-3,3-dimethylbutan<br />
b) 1-Chlor-2,2-dimethylbutan a 1-chlor-3,3-dimethylbutan nejsou chirální sloučeniny.<br />
Sloučenina 3-chlor-2,2-dimethylbutan bude při chloraci vznikat jako racemická směs<br />
enantiomerů:<br />
CH 3<br />
Cl H<br />
C(CH 3) 3<br />
CH 3<br />
H Cl<br />
C(CH 3) 3<br />
18.<br />
H3C CH3 CH<br />
3<br />
1 4<br />
2<br />
3<br />
4 1<br />
2<br />
O 2<br />
ΔT<br />
1<br />
3 2<br />
4 (R)-<br />
1<br />
2 3<br />
4 (S)-<br />
HOO<br />
CH3 C CH3 H +<br />
fenol aceton<br />
- k oxidaci kumenu dochází velmi snadno za vzniku hydroperoxidu a následného rozkladu<br />
v kyselém prostředí na fenol a aceton.<br />
CH3 CH3C CHCH3 Cl CH3 + HNO 3<br />
Zn, HCl<br />
430°C<br />
CH 3<br />
OH<br />
CH 3CHCHCH 3<br />
CH 3<br />
2,3-dimethylbutan<br />
NO 2<br />
nitrocyklohexan<br />
- nitrace probíhající radikálovým mechanismem probíhá za vysokých teplot a často i dochází<br />
až k štěpení vazeb C-C.<br />
+<br />
H 3C<br />
O<br />
CH 3<br />
17
CH 3<br />
H2 / RaneyNi<br />
H H<br />
EtOH,<br />
CH3 25°C, 1atm CH3 CH3 cis-1,2-dimethylcyklohexan<br />
- katalytická hydrogenace 1,2-dimethylcyklohexenu vede k tvorbě 1,2-dimethylcyklohexanu a<br />
poněvadž se jedná o syn-adici vodíku na dvojnou vazbu vzniká cis-izomer.<br />
SO2 + O<br />
O<br />
2<br />
H3C CH3 H<br />
ΔT<br />
3C CH2SOH O<br />
ethansulfonová kyselina<br />
- příprava alkansulfonových kyselin se provádí sulfoxidací příslušného alkanu směsí SO2<br />
a O2 za zvýšené taploty (~ 400°C). Sulfonace kyselinou sírovou není možné, protože dojde<br />
ke spálení výchozí látky.<br />
CH3 H3C C CH3 CH3 Mg<br />
H3C CH2Br diethylether<br />
CH 3CH 2CH 2CH 3<br />
Br2 / hν<br />
H3C CH3 C CH2Br CH3 1-brom-2,2-dimethylpropan<br />
Cl 2 / hν<br />
19.<br />
a) ΔH 0 = -138 kJ mol -1<br />
b) ΔH 0 = -44 kJ mol -1<br />
c) ΔH 0 = -121 kJ mol -1<br />
d) ΔH 0 = -437kJ mol -1<br />
2 H2O H3C CH2Mg Br<br />
H 3C CH 3<br />
ethylmagnesium bromid ethan<br />
CH 3<br />
CH 3<br />
CH3CH2CH2CH2 Cl + H<br />
+ Cl<br />
CH<br />
Cl 2CH3 CH<br />
H 2CH3 1-chlorbutan (S)-2-chlorbutan (R)-2-chlorbutan<br />
18