You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
KARBOKSILNE KISELINE<br />
▪ Karboksilne kiseline su organska jedinjenja koja u<br />
svojoj strukturi sadrže karboksilnu grupu<br />
(funkcionalna grupa u kojoj je hidroksilna grupa<br />
vezana za karbonilni C–atom):<br />
: O:<br />
C<br />
karboksilna kiselina<br />
RCOOH<br />
..<br />
OH ..<br />
karboksilna<br />
grupa<br />
O<br />
R CO 2<br />
H C<br />
R<br />
OH<br />
R = H<br />
alkil-grupa<br />
aril-grupa<br />
heterociklicni ostatak<br />
▪ Naziv karboksilna grupa nastaje sažimanjem<br />
naziva karbonil i hidroksil.<br />
Podela karboksilnih kiselina<br />
1) U zavisnosti od ugljovodoničnog ostatka za koji je<br />
vezana karboksilna grupa razlikujemo:<br />
alifatične k.k. opšte formule RCOOH<br />
aromatične k.k. opšte formule ArCOOH<br />
heterociklične k.k.<br />
▪ Ako ugljovodonični ostatak sadrži nezasićenu<br />
vezu, to su nezasićene k.k.<br />
2) Prema broju karboksilnih grupa razlikujemo:<br />
monokarboksilne k. (monokiseline)<br />
dikarboksilne k. (dikiseline)<br />
polikarboksilne k. (polikiseline).<br />
1<br />
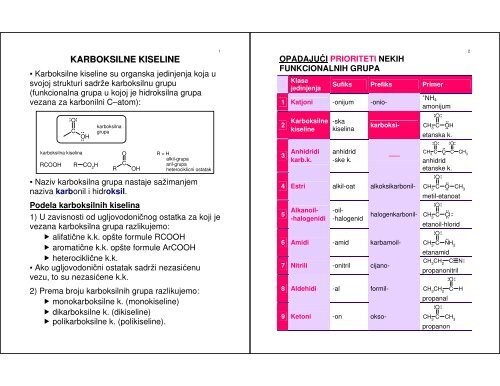
OPADAJUĆI PRIORITETI NEKIH<br />
FUNKCIONALNIH GRUPA<br />
Klasa<br />
jedinjenja<br />
Sufiks Prefiks Primer<br />
1 Katjoni -onijum -onio-<br />
2<br />
Karboksilne<br />
kiseline<br />
Anhidridi<br />
karb.k.<br />
-ska<br />
kiselina<br />
anhidrid<br />
-ske k.<br />
+ NH 4<br />
amonijum<br />
: O:<br />
..<br />
karboksi- CH 3<br />
C OH ..<br />
etanska k.<br />
: O: : O:<br />
..<br />
CH 3<br />
C O..<br />
C CH 3<br />
3<br />
–––<br />
anhidrid<br />
etanske k.<br />
: O:<br />
..<br />
4 Estri alkil-oat alkoksikarbonil- CH 3<br />
C O..<br />
CH 3<br />
metil-etanoat<br />
5<br />
: O:<br />
Alkanoil- -oil-<br />
..<br />
halogenkarbonil- CH C Cl<br />
-halogenidi -halogenid<br />
3 .. :<br />
etanoil-hlorid<br />
: O: ..<br />
6 Amidi -amid karbamoil- CH 3<br />
C NH 2<br />
etanamid<br />
CH C N<br />
7 Nitrili -onitril cijano-<br />
3<br />
CH 2<br />
:<br />
propanonitril<br />
: O:<br />
8 Aldehidi -al formil- CH 3<br />
CH 2<br />
C H<br />
propanal<br />
: O:<br />
9 Ketoni -on okso- CH 3<br />
C CH 3<br />
propanon<br />
2
OPADAJUĆI PRIORITETI NEKIH<br />
FUNKCIONALNIH GRUPA – NASTAVAK<br />
Klasa<br />
jedinjenja<br />
10 Alkoholi<br />
Fenoli<br />
-ol<br />
Sufiks Prefiks Primer<br />
hidroksi-<br />
CH 3<br />
CH 2<br />
CH 2<br />
1-propanol<br />
11 Tioli -tiol merkapto-<br />
CH 3<br />
CH 2<br />
CH 2<br />
1-propantiol<br />
..<br />
12 Amini -amin amino- CH 3<br />
CH 2<br />
CH 2<br />
NH 2<br />
1-propanamin<br />
13 Etri -etar<br />
14 Sulfidi -sulfid<br />
alkoksi-<br />
oksa-<br />
alkiltio-<br />
tia-<br />
15 Alkeni -en alkenil-<br />
16 Alkini -in alkinil-<br />
17 Halogenidi -halogenid halo-<br />
18 Nitro ––– nitro-<br />
19 Alkani -an alkil-<br />
OH<br />
..<br />
..<br />
SH<br />
..<br />
..<br />
3<br />
..<br />
CH 3<br />
CH 2<br />
O..<br />
CH 2<br />
CH 3<br />
etoksietan<br />
dietil-etar<br />
..<br />
CH 3<br />
S..<br />
CH 3<br />
dimetil-sulfid<br />
H CH 3<br />
C C<br />
H H<br />
propen<br />
CH 3<br />
C C CH 3<br />
2-butin<br />
..<br />
CH 3<br />
CH 2<br />
CH 2<br />
Br .. :<br />
1-brompropan<br />
CH 3<br />
CH 2<br />
CH 2<br />
NO 2<br />
1-nitropropan<br />
CH 3 CH 2 CH 3<br />
propan<br />
NOMENKLATURA KARBOKSILNIH KISELINA<br />
1) Uobičajena (trivijalna) imena ukazuju na<br />
prirodne izvore iz kojih su kiseline prvobitno<br />
izolovane ili na industrijske načine dobijanja.<br />
▪ Kiseline sa razgranatim lancem dobijaju imena od<br />
imena kiselina kojima pripada najduži lanac.<br />
▪ Položaj supstituenata u odnosu na –COOH grupu<br />
se označava grčkim slovima: α, β, γ, δ itd.<br />
▪ α–C–atom je prvi C do –COOH grupe.<br />
▪ Prostije kiseline se mogu posmatrati kao<br />
supstituisane sirćetne kiseline.<br />
2) IUPAC–ovim sistemom imena k.k. izvode se<br />
dodavanjem završetka –ska kiselina imenu<br />
ugljovodonika sa istim brojem C–atoma uključujuči i<br />
–COOH grupu (najduži niz C–atoma u kome se<br />
nalazi –COOH grupa, a koji uključuje najveći broj<br />
drugih funkcionalnih grupa).<br />
▪ Položaj supstituenata u odnosu na –COOH grupu<br />
se označava brojevima.<br />
▪ Karboksilni C–atom je uvek C–1!!!<br />
▪ –COOH grupa je funkcionalna grupa najvišeg<br />
prioriteta!<br />
▪ Zasićene ciklične kiseline imenuju se kao<br />
cikloalkankarboksilne kiseline.<br />
▪ U ovim jedinjenjima i aromatičnim k.k. C–atom<br />
vezan za –COOH grupu je C–1!<br />
▪ Dikarboksilne kiseline se imenuju kao dikiseline.<br />
4
5<br />
6<br />
Struktura<br />
HCOOH<br />
CH 3 COOH<br />
CH 3 CH 2 COOH<br />
IUPAC–<br />
ovo ime<br />
metanska<br />
kiselina<br />
etanska<br />
k.<br />
propanska<br />
k.<br />
CH 3 (CH 2 ) 2 COOH butanska<br />
k.<br />
CH 3 (CH 2 ) 3 COOH pentanska<br />
k.<br />
CH 3 (CH 2 ) 4 COOH heksanska<br />
k.<br />
Uobičajeno<br />
(trivijalno)<br />
ime<br />
mravlja<br />
kiselina<br />
sirćetna<br />
k.<br />
propionska<br />
k.<br />
buterna<br />
k.<br />
valerijanska<br />
k.<br />
kapronska<br />
k.<br />
Izvor<br />
(poreklo)<br />
sekret<br />
žlezda<br />
mrava<br />
(formica,<br />
lat. mrav)<br />
sirće<br />
(acetum,<br />
lat. sirće)<br />
mlečni<br />
proizvodi<br />
(pion,<br />
grč.<br />
mast)<br />
buter<br />
(posebno<br />
užegli)<br />
(butyrum,<br />
lat. buter)<br />
koren<br />
biljke<br />
valerijana<br />
miris<br />
kozjeg<br />
loja<br />
(caper,<br />
lat. koza)<br />
Struktura<br />
CH 3 CH 2 CHCOOH<br />
CH 3<br />
IUPAC–ovo ime<br />
γ β α<br />
4 3 2 1<br />
2-metilbutanska<br />
CH 3<br />
5 4<br />
3 2 1<br />
CH 3 CH 2 CHCHCOOH<br />
γ β α<br />
δ<br />
CH 3<br />
CH 2 CH 2 CHCOOH<br />
Cl<br />
CH 3<br />
kiselina<br />
2,3-dimetilpentanska<br />
k.<br />
CH 3 CHCOOH<br />
OH<br />
γ β α<br />
4 3 2 1<br />
4-hlor-2-metilbutanska<br />
k.<br />
β α<br />
3 2 1<br />
2-hidroksipropanska<br />
k.<br />
Uobičajeno<br />
(trivijalno) ime<br />
α-metilbuterna<br />
kiselina<br />
α,β-dimetilvalerijanska<br />
k.<br />
γ-hlor-α-metilbuterna<br />
k.<br />
α-hidroksipropionska<br />
k.<br />
(mlečna k.)<br />
CH 2<br />
COOH feniletanska k. fenilsirćetna k.<br />
H 2<br />
C CH COOH propenska k. akrilna k.<br />
2-metil-<br />
C H 2<br />
CH 3 CH<br />
CH 3<br />
C COOH<br />
CHCOOH<br />
CH<br />
CHCOOH<br />
propenska k.<br />
2-butenska k.<br />
(cis- i trans-)<br />
3-fenilpropenska<br />
k.<br />
(cis- i trans-)<br />
metakrilna k.<br />
krotonska k.<br />
cimetna k.
O<br />
CH 3<br />
CCHCH 2<br />
CH 2<br />
COOH<br />
CH 2<br />
CH 2<br />
CH 3<br />
5-okso-4-propilheksanska kiselina<br />
COOH<br />
O<br />
4-oksocikloheksankarboksilna<br />
kiselina<br />
N<br />
COOH<br />
benzenkarboksilna kiselina<br />
(benzoeva kiselina)<br />
COOH<br />
COOH<br />
NH 2<br />
COOH<br />
COOH<br />
2-aminobenzenkarboksilna<br />
kiselina<br />
(o-aminobenzoeva kiselina,<br />
antranilna kiselina)<br />
Cl<br />
Br<br />
COOH<br />
N H 2<br />
1-brom-2-hlorciklopentankarboksilna<br />
kiselina<br />
O<br />
5-butil-6-heptenska kiselina<br />
(ne 5-etenilnonanska kis.)<br />
OH<br />
OH<br />
COOH<br />
COOH<br />
COOH<br />
4-amino-2-hidroksibenzenkarboksilna<br />
kiselina<br />
(tereftalna kiselina)<br />
7<br />
Struktura<br />
HOOC–COOH<br />
HOOCCH 2 COOH<br />
IUPAC–<br />
ovo ime<br />
etan-<br />
-dikiselina<br />
propan-<br />
-dikiselina<br />
HOOC(CH 2 ) 2 COOH butan-<br />
-dikiselina<br />
HOOC(CH 2 ) 3 COOH pentan-<br />
-dikiselina<br />
HOOC(CH 2 ) 4 COOH heksan-<br />
-dikiselina<br />
HOOC<br />
H<br />
H<br />
HOOC<br />
COOH<br />
H<br />
COOH<br />
H<br />
COOH<br />
COOH<br />
1,2-benzendikarboksilna<br />
kiselina 1,3-<br />
(ftalna kiselina)<br />
(izoftalna kiselina)<br />
1,4-<br />
cis-2-<br />
buten-<br />
-dikiselina<br />
trans-2-<br />
buten-<br />
-dikiselina<br />
Uobičajeno<br />
(trivijalno)<br />
ime<br />
oksalna<br />
kiselina<br />
malonska<br />
k.<br />
ćilibarna<br />
k.<br />
glutarna<br />
k.<br />
adipinska<br />
k.<br />
maleinska<br />
k.<br />
fumarna<br />
k.<br />
8<br />
Izvor<br />
(poreklo)<br />
(oksus, lat.<br />
oštar,<br />
kiselo)<br />
oksidacija<br />
jabučne k.<br />
(acidum<br />
malicum)<br />
destilat<br />
ćilibara<br />
(succinum,<br />
lat. ćilibar)<br />
oksidacija<br />
masti ili<br />
masnih k.<br />
(adeps, lat.<br />
mast)<br />
biljka<br />
fumaria<br />
(fumus, lat.<br />
dim)<br />
piridin-3-karboksilna kiselina<br />
(nikotinska kiselina)
STRUKTURA I FIZIČKE OSOBINE<br />
KARBOKSILNIH KISELINA<br />
H 124,1 o<br />
1,202 A o<br />
111 o C O<br />
124,9<br />
1,343 A o o<br />
O 106,3 o<br />
0,972 A o<br />
1,097 A o<br />
H<br />
Molekulska struktura mravlje kiseline<br />
Planaran molekul sa približnim rasporedom<br />
jednakostranicnog trougla oko karbonilnog C.<br />
▪ K.k. su POLARNA jedinjenja – prisustvo<br />
polarizovane karbonilne i hidroksilne grupe!<br />
▪ K.k. imaju veoma visoke T t i T klj zbog mogućnosti<br />
obrazovanja intermolekulske vodonične veze u<br />
čvrstom i tečnom stanju – dimeri:<br />
R<br />
..<br />
.. O.<br />
. . . . . . . H O:<br />
C<br />
C<br />
: O..<br />
H. . . . . . ..<br />
.. O. .<br />
dimer<br />
▪ T klj k.k. su:<br />
□ više od T klj UGLJOVODONIKA slične<br />
molekulske mase (RCOOH su polarna jedinjenja)<br />
□ više od T klj ALKOHOLA slične molekulske mase<br />
(RCOOH grade jače vodonične veze).<br />
R<br />
9<br />
Jedinjenje CH 3 CH 2 COOH CH 3 (CH 2 ) 2 CH 2 OH CH 3 (CH 2 ) 3 CH 3<br />
T klj (°C) 141 118 36<br />
▪ Niže k.k. su dobro rastvorne u vodi zbog<br />
mogućnosti obrazovanja intermolekulskih<br />
vodoničnih veza sa molekulima vode:<br />
R<br />
.. H<br />
O . . . ... ..<br />
H .. O .<br />
C<br />
: O H . ..<br />
. . ... ..<br />
O<br />
H<br />
..<br />
H<br />
▪ Rastvorljivost opada sa povećanjem hidrofobnog<br />
dela moleklula – granica rastvorljivosti je kod k.k. sa<br />
5 C–atoma.<br />
▪ Kiseline sa:<br />
1–3 C–atoma – tečnosti oštrog mirisa, dobro<br />
rastvorne u vodi,<br />
4–9 C–atoma – uljaste tečnosti, neprijatnog<br />
mirisa, slabo rastvorne u vodi,<br />
10 i više C–atoma – čvrste supstance,<br />
nerastvorne u vodi, bez mirisa usled male<br />
isparljivosti.<br />
10
SINTEZA KARBOKSILNIH KISELINA<br />
1. Reakcije oksidacije<br />
▪ Najvažniji postupci za dobijanje k.k. posebno u<br />
industrijskim razmerama.<br />
1.1. Primarnih alkohola i aldehida<br />
▪ Direktno iz alkohola ili iz aldehida oksidacijom se<br />
dobija kiselina sa istim brojem C–atoma.<br />
RCH 2<br />
OH<br />
[O]<br />
1 o alkohol aldehid<br />
R = alkil- ili aril-grupa<br />
[O] a) K 2<br />
Cr 2<br />
O 7<br />
/H 2<br />
SO 4<br />
RCHO<br />
[O]<br />
b) CrO 3<br />
/H 2<br />
SO 4<br />
c) KMnO 4<br />
/H 2<br />
SO 4<br />
ili NaOH/H 2<br />
O<br />
(kisela ili bazna sredina)<br />
d) HNO 3<br />
RCOOH<br />
karboksilna<br />
kiselina<br />
CH 2<br />
CH 3<br />
CH 2<br />
CH 3<br />
KMnO 4<br />
CH 3 (CH 2 ) 3 CHCH 2 OH<br />
CH 3 (CH 2 ) 3 CHCOOH<br />
NaOH/H 2<br />
O<br />
2-etil-1-heksanol<br />
2-etilheksanska k.<br />
1.2. Nezasićenih ugljovodonika<br />
▪ Energična oksidacija – niz C–atoma se raskida na<br />
mestu gde se nalazi nezasićena veza.<br />
11<br />
1.3. Alkilbenzena (arena)<br />
▪ Energična oksidacija – alifatični bočni niz<br />
alkilbenzena je osetljiv na oksidaciju bez obzira na<br />
veličunu.<br />
▪ Ovum procesom se raskidaju veze u benzilnom<br />
položaju:<br />
Ar<br />
C<br />
H<br />
[O]<br />
ArCOOH<br />
Benzilni položaj!!!<br />
CH 3<br />
CH 2<br />
CH 3<br />
COOH<br />
KMnO 4<br />
H + , ∆<br />
[O] a) K 2<br />
Cr 2<br />
O 7<br />
/H 2<br />
SO 4<br />
b) KMnO 4<br />
/H 2<br />
SO 4<br />
ili NaOH/H 2<br />
O<br />
(kisela ili bazna sredina)<br />
c) razbl. HNO 3<br />
COOH<br />
1-etil-3-metilbenzen 1,3-benzendikarboksilna k.<br />
(izoftalna k.)<br />
K 2<br />
Cr 2<br />
O 7<br />
/H 2<br />
SO 4<br />
(CH 3<br />
) 2<br />
CH C(CH 3<br />
) 3<br />
HOOC<br />
C(CH 3<br />
)<br />
∆<br />
3<br />
1-terc-butil-4-izopropilbenzen 4-terc-butilbenzenkarboksilna k.<br />
(p-terc-butilbenzoeva k.<br />
12<br />
KMnO 4<br />
CH 3<br />
CH CHCH 2<br />
CH 3<br />
H + CH<br />
, ∆ 3 COOH + CH 3 CH 2 COOH<br />
2-penten<br />
etanska k. propanska k.<br />
(sircetna k.) (propionska k.)<br />
KMnO 4<br />
C CCH 3<br />
COOH<br />
H + CH<br />
, ∆ 3<br />
COOH +<br />
1-propinilbenzen<br />
1,2,3,4-tetrahidronaftalen<br />
razbl HNO 3<br />
∆<br />
COOH<br />
COOH<br />
1,2-benzendikarboksilna k.<br />
(ftalna k.)
1.4. Ketona<br />
▪ Energična oksidacija – dolazi do raskidanja veze<br />
sa obe strane karbonilne grupe – nastaje smeša<br />
proizvoda.<br />
CH 3<br />
CH 2<br />
a<br />
O<br />
HNO 3<br />
, ∆<br />
C CH 2<br />
CH 2<br />
CH 2<br />
CH 3<br />
CH 3 COOH + CH 3 (CH 2 ) 3 COOH<br />
ili<br />
KMnO 4<br />
/H 2<br />
SO 4<br />
, ∆<br />
b<br />
a<br />
3-heptanon<br />
+<br />
CH 3 CH 2 COOH + CH 3 (CH 2 ) 2 COOH<br />
13<br />
C H 3<br />
CH 3<br />
C Br<br />
CH 3<br />
-<br />
OH /H 2<br />
O<br />
∆<br />
H 3<br />
C<br />
C CH 2<br />
H 3<br />
C<br />
NaCN<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
Br CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
CN CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
COO -<br />
1-brombutan S N<br />
2 pentanonitril so pentanske k.<br />
-<br />
Pažnja: CN je jaka baza - RX mora biti 1 o !<br />
NaCN<br />
E2<br />
2-brom-2-metilpropan<br />
(terc-butil-bromid)<br />
2-metilpropen<br />
+<br />
H /H 2<br />
O<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
COOH<br />
pentanska k.<br />
14<br />
b<br />
2. Hidroliza nitrila<br />
▪ Alifatične i aromatične k.k. se mogu dobiti iz nitrila.<br />
R<br />
CN<br />
ili<br />
Ar CN<br />
+<br />
H /H 2<br />
O<br />
∆<br />
-<br />
OH /H 2<br />
O<br />
∆<br />
R<br />
COOH<br />
ili<br />
Ar COOH<br />
+ NH 4<br />
+<br />
-<br />
R COO + NH 3<br />
ili<br />
-<br />
Ar COO<br />
CH 2<br />
Cl CH 2<br />
CN +<br />
CH 2<br />
COOH<br />
NaCN<br />
H /H 2<br />
O<br />
(hlormetil)benzen feniletanonitril<br />
feniletanska k.<br />
(benzil-hlorid)<br />
(fenilacetonitril)<br />
(fenilsircetna k.)<br />
CH 3<br />
CH 3<br />
+ -<br />
NH 2<br />
N 2<br />
Cl<br />
NaNO 2<br />
, HCl, H 2<br />
O<br />
CuCN<br />
0-5 o C<br />
(o-toluidin)<br />
∆<br />
(o-toluendiazonijum-hlorid)<br />
CH 3<br />
(o-tolunitril)<br />
∆<br />
+<br />
H /H 2<br />
O<br />
CN<br />
CH 3<br />
COOH<br />
2-metilbenzenkarboksilna k.<br />
(o-metilbenzoeva k.)
3. Karboksilovanje Grignard–ovih reagenasa<br />
▪ Grignard–ovi reagensi reaguju sa ugljendioksidom<br />
(CO 2 ) veoma slično kao sa karbonilnim jedinjenjima.<br />
▪ Reakcija se izvodi:<br />
□ uvoñenjem gasovitog CO 2 u etarski rastvor<br />
Grignard–ovog reagensa ili<br />
□ izlivanjem Grignard–ovog reagensa na "suvi<br />
led" (čvrst CO 2 ).<br />
▪ Nastaje so k.k. koja protonovanjem sa razbl.<br />
mineralnom kiselinom daje k.k.<br />
δ _<br />
..<br />
..<br />
: O<br />
-<br />
:<br />
+<br />
O : MgX +<br />
δ _ δ + H /H 2<br />
O<br />
δ<br />
R MgX +<br />
+ aps. etar<br />
C<br />
R C<br />
- XMgOH<br />
: O:<br />
O<br />
Grignard-ov<br />
reagens<br />
δ _<br />
ili<br />
- +<br />
Ar COO MgX<br />
ili<br />
Ar MgX<br />
so karboksilne kis.<br />
R<br />
Ar<br />
ili<br />
COOH<br />
COOH<br />
15<br />
4. Hidroliza trihalogenskih derivata<br />
▪ Reaguju trihalogenski <strong>derivati</strong> alkana i arena.<br />
- OH<br />
OH , H 2<br />
O<br />
- H 2<br />
O<br />
R CCl 3<br />
R C OH R COOH<br />
ili<br />
OH<br />
ili<br />
Ar CCl 3<br />
Ar COOH<br />
ili<br />
Ar C(OH) 3<br />
HO<br />
OH<br />
CH 3<br />
CCl 3 -<br />
C<br />
COOH<br />
Cl 2<br />
OH , H 2<br />
O<br />
- H<br />
OH 2<br />
O<br />
hν<br />
ili<br />
metilbenzen trihlormetilbenzen<br />
benzenkarboksilna k.<br />
(toluen)<br />
∆<br />
fenilmetantriol<br />
(benzo-trihlorid)<br />
(benzoeva k.)<br />
5. Hidroliza derivata karboksilnih kiselina<br />
▪ K.k. se mogu dobiti hidrolizom svojih derivata.<br />
16<br />
-<br />
Br MgBr COO + MgBr COOH<br />
+<br />
H /H 2<br />
O<br />
Mg CO 2<br />
aps. etar<br />
(p-sek-butilbenzoeva k.)<br />
1-brom-4-(1-metilpropil)-<br />
benzen<br />
(p-brom-sek-butilbenzen)<br />
4-(1-metilpropil)benzenkarboksilna<br />
k.<br />
+<br />
Mg CO 2<br />
- + H /H 2<br />
O<br />
Cl MgCl COO MgCl COOH<br />
aps. etar<br />
2-hlor-2-metilbutan<br />
2,2-dimetilbutanska k.<br />
RX može biti 1 o , 2 o ili 3 o alkil-halogenid!
17<br />
HEMIJSKE OSOBINE KARBOKSILNIH KISELINA<br />
Kiselost<br />
▪ Najvažnija osobina k.k. je njihova kiselost.<br />
▪ Jonizacija k.k. u vodenom rastvoru: 1<br />
RCOOH + H 2<br />
O<br />
K e<br />
-<br />
RCOO + H 3<br />
O +<br />
kiselina baza konjugovana<br />
baza<br />
konjugovana<br />
kiselina<br />
▪ U stanju ravnoteže, izraz za K e je:<br />
K e<br />
=<br />
[RCOO<br />
-<br />
] [H 3<br />
O + ]<br />
[H 2<br />
O] [RCOOH]<br />
▪ Izraz za konstantu kiselosti,K a je: 2<br />
K a<br />
= [H 2<br />
O]K e<br />
=<br />
[RCOO<br />
-<br />
] [H 3<br />
O + ]<br />
[RCOOH]<br />
▪ Merilo za jačinu kiselosti:<br />
□ K a (što je vrednost K a veća, kiselost je veća),<br />
□ pK a = –logK a (što je vrednost pK a manja,<br />
kiselost je veća).<br />
▪ Za k.k. K a ≈ 10 –4 –10 –5 (pK a ≈ 4–5).<br />
1 ▪ U vodenom rastvoru molekul k.k. (RCOOH, nejonizovani<br />
molekul) je u ravnoteži sa karboksilatnim anjonom (RCOO – ) i<br />
protonom (H + ), odnosno, hidronijum jonom (H 3 O + ).<br />
▪ Kiselost k.k. izražena je ovom jednačinom (jonizacija k.k. u<br />
vodenom rastvoru) i odgovarajućom konstantom ravnoteže K e .<br />
2 ▪ Kako se radi o razblaženom vodenom rastvoru (k.k. slabo<br />
jonizuje), to se može uzeti da je [H 2 O] = const.<br />
18<br />
▪ K.k. su kiselije od ostalih organskih jedinjenja koja<br />
imaju kiseli H–atom:<br />
RCOOH > H 2 O > ROH > HC≡CH > NH 3 > RH<br />
Važno:<br />
K.k. su kisele – mogu da disoju i daju H + .<br />
K.k. su kiselije od ostalih organskih<br />
jedinjenja koja imaju kiseli H–atom – u<br />
–COOH grupi polarizacija C=O u neposrednoj<br />
blizini –OH grupe olakšava disocijaciju!<br />
Vrednosti K a k.k. se razlikuju – na<br />
ravnotežu, koja je kvantitativno izražena<br />
vrednošću K a , utiče struktura kiseline.<br />
Struktura i kiselost k.k.<br />
▪ Stabilnost molekula i jona zavisi od strukture i<br />
elektronskih efekata!<br />
RCOOH + H 2<br />
O<br />
K e<br />
-<br />
RCOO + H 3<br />
O +<br />
▪ Stanje ravnoteže zavisi od razlika u relativnoj<br />
stabilnosti nejonizovane k.k. i karboksilatnog jona.<br />
▪ Ravnoteže će biti pomerena "" (u pravcu<br />
jonizacije kiseline) utoliko više ukoliko je:<br />
□ stabilnost k.k. u nejonizovanom stanju manja<br />
(njena sposobnost da jonizuje veća),<br />
□ stabilnost nastalog karboksilatnog jona veća<br />
(njegova težnja za primanjem H + manja).
R<br />
H<br />
C<br />
O<br />
H<br />
alkohol<br />
pK a<br />
= 16-18<br />
H<br />
slabo kiseo<br />
R<br />
δ<br />
O<br />
C<br />
δ +<br />
_<br />
O<br />
H<br />
karboksilna kiselina<br />
pK a<br />
= 4-5<br />
▪ Disocijacija kod alkohola (slaba disocijacija):<br />
ROH<br />
-<br />
RO + H<br />
+<br />
jako kiseo<br />
▪ I za alkohol i za alkoksidni jon postoji samo po<br />
jedna struktura – nema stabilizacije!<br />
▪ Disocijacija kod k.k.:<br />
..<br />
O :<br />
C ..<br />
R O..<br />
H<br />
.. -<br />
: O:<br />
C +<br />
R O..<br />
H<br />
k.k.<br />
neekvivalentne<br />
rez. strukture<br />
R<br />
R<br />
..<br />
O :<br />
C .. -<br />
O..<br />
:<br />
.. -<br />
: O:<br />
C<br />
..<br />
O..<br />
karboksilatni<br />
anjon<br />
ekvivalentne<br />
rez. strukture<br />
+ H<br />
+<br />
19<br />
Molekul k.k.<br />
▪ U nedisosovanom molekulu k.k. deluju 2<br />
elektronska efekta:<br />
□ induktivni efekat (–I) – značajan<br />
(destabilizuje molekul k.k.)<br />
R<br />
δ<br />
O<br />
C<br />
δ +<br />
_<br />
k.k.<br />
O<br />
H<br />
Jak -I efekat δ+ karbonilnog C-atoma<br />
smanjuje stabilnost nedisosovanog molekula kiseline<br />
jer olakšava izdvajanje H +<br />
□ rezonancioni efekat (el. par sa O se pomera<br />
duž π–veze) – manje značajan<br />
(ide na ruku –I efektu jer omogućava lakše<br />
izdvajanje H + )<br />
.. .. -<br />
O : : O:<br />
.. -<br />
: O:<br />
C ..<br />
C +<br />
R O..<br />
H<br />
R O H C +<br />
..<br />
R O..<br />
H<br />
k.k.<br />
neekvivalentne rez. strukture<br />
Na kiseoniku je "+" šarža<br />
(razdvajanje naelektrisanja)<br />
što olakšava izdvajanje H +<br />
20
Karboksilatni anjon<br />
δ _<br />
..<br />
O :<br />
C .. -<br />
R δ + O..<br />
:<br />
karboksilatni anjon<br />
ekvivalentne rez. strukture<br />
.. -<br />
: O:<br />
C ..<br />
R δ + O..<br />
▪ Stabilnost karboksilatnog anjona jako povećana –<br />
stabilizacija rezonancijom (oslobaña se E).<br />
▪ "–" šarža je ravnomerno rasporeñena<br />
(delokalizovana) na oba O–atoma.<br />
▪ Da bi se H + ponovo asocirao treba dovesti E<br />
ekvikalentnu E rezonancije!<br />
H<br />
R<br />
o<br />
1,20 A<br />
C<br />
C<br />
O<br />
O<br />
O<br />
_<br />
1/2<br />
_<br />
1/2<br />
δ _<br />
p orbitala sa C<br />
se preklapa jednako sa<br />
p orbitalama sa dva O<br />
(4 e - su rasporedjena<br />
na 3 atoma)<br />
1,26 A<br />
H<br />
o<br />
C<br />
O<br />
_<br />
R<br />
C<br />
Na +<br />
O<br />
O<br />
_<br />
21<br />
Uticaj supstituenata na kiselost k.k.<br />
▪ Kiselost k.k. povećavaju faktori koji povećavaju<br />
stabilnost karboksilatnog anjona više nego<br />
stabilnost kiseline!<br />
G<br />
akceptori<br />
elektrona<br />
C<br />
O<br />
O<br />
_<br />
(stabilizuju anjon)<br />
povecavaju kiselost k.k.<br />
1. ALIFATIČNE K.K.<br />
G<br />
C<br />
donori<br />
elektrona<br />
O<br />
O<br />
_<br />
(destabilizuju anjon)<br />
smnjuju kiselost k.k.<br />
Kiselina<br />
pK a<br />
HCOOH mravlja 3,75<br />
CH 3 COOH sirćetna 4,76<br />
ClCH 2 COOH hlorsirćetna 2,87<br />
Cl 2 CHCOOH dihlorsirćetna 1,25<br />
Cl 3 CCOOH trihlorsirćetna 0,65<br />
O 2 N–CH 2 COOH nitrosirćetna 1,68<br />
HO–CH 2 COOH<br />
hidroksisirćetna<br />
(glikolna)<br />
3,83<br />
22<br />
o<br />
1,36 A<br />
OH<br />
o<br />
1,26 A<br />
O
CH 3<br />
H<br />
δ<br />
O<br />
C O<br />
δ +<br />
mravlja k.<br />
pK a<br />
= 3,75<br />
_<br />
δ<br />
O<br />
C<br />
δ +<br />
_<br />
pK a<br />
= 4,76<br />
O<br />
sircentna k.<br />
H<br />
H<br />
+<br />
H +<br />
+<br />
H +<br />
H<br />
C<br />
O<br />
O<br />
formijatni jon<br />
CH 3<br />
C<br />
_<br />
O<br />
O<br />
acetatni jon<br />
Molekul srćetne k. je stabilniji od molekula<br />
mravlje: prisutna CH 3 grupa svojim +I efektom<br />
smanjuje δ+ na karbonilnom C (on slabije povlači e –<br />
duž σ–veze).<br />
Stabilnost acetatnog jona je smanjena (povećana<br />
je njegova baznost) u odnosu na formijatni: prisutna<br />
CH 3 grupa svojim +I efektom povećava "–" šaržu na<br />
karbonilnom C (ceo anjon je destabilizovan i<br />
olakšano je vezivanje H + ).<br />
CH 3 COO – je jača baza od HCOO – , pa je<br />
HCOOH jača kiselina od CH 3 COOH!<br />
_<br />
23<br />
Cl<br />
CH 2<br />
_<br />
δ<br />
O<br />
C<br />
δ +<br />
hlorsircentna k.<br />
pK a<br />
= 2,87<br />
O<br />
H<br />
+<br />
H +<br />
Cl<br />
CH 2<br />
hloracetatni jon<br />
Molekul hlorsrćetne k. je manje stabilan od<br />
molekula mravlje: prisutni Cl svojim –I efektom<br />
povećava δ+ na karbonilnom C (on jače povlači e –<br />
duž σ–veze).<br />
Stabilnost hloracetatnog jona je povećana<br />
(smanjena je njegova baznost) u odnosu na<br />
formijatni: usled –I efekta Cl "–" šarža nije<br />
skoncentrisana samo na atomima O nego je<br />
delimično raspršena i na ostale atome u nizu.<br />
ClCH 2 COO – je slabija baza od HCOO – , pa je<br />
ClCH 2 COOH jača kiselina od HCOOH!<br />
: O:<br />
+<br />
N<br />
_<br />
: O..<br />
:<br />
_<br />
δ<br />
O<br />
: O:<br />
O<br />
+<br />
+<br />
CH 2 C O H H + N CH 2<br />
C<br />
δ +<br />
_<br />
: O..<br />
:<br />
nitrosircentna k.<br />
O<br />
anjon nitrosircetne k.<br />
pK a<br />
= 1,68<br />
▪ Anjon nitrosirćetne k. je stabilniji (slabija baza) od<br />
anjona hlorsirćetne k.: –NO 2 grupa je zbog "+" šarže<br />
na N elektronegativnija (jači –I) i jače privlači e – od<br />
Cl.<br />
O 2 NCH 2 COO – je slabija baza od ClCH 2 HCOO – , pa<br />
je O 2 NCH 2 COOH jača kiselina od ClCH 2 COOH!<br />
C<br />
O<br />
O<br />
_<br />
24<br />
_
HO<br />
CH 2<br />
_<br />
δ<br />
O<br />
C<br />
δ +<br />
hidroksisircentna k.<br />
pK a<br />
= 3,83<br />
O<br />
H<br />
+<br />
H +<br />
HO<br />
CH 2<br />
C<br />
anjon hidroksisircetne k.<br />
▪ Anjon hidroksisirćetne k. je stabilniji (slabija baza)<br />
od anjona sirćetne k.: usled –I efekta –OH grupe "–"<br />
šarža nije skoncentrisana samo na atomima O nego<br />
je delimično raspršena i na ostale atome u nizu.<br />
HOCH 2 COO – je slabija baza od CH 3 COO – , pa<br />
je HOCH 2 COOH jača kiselina od CH 3 COOH!<br />
▪ Induktivni efekat opada sa rastojanjem (gotovo je<br />
zanemarljiv ako se njegov uticaj posmatra preko više<br />
od 4 C atoma).<br />
Kiselina<br />
pK a<br />
CH 3 CH 2 CH 2 COOH buterna 4,82<br />
CH 3 CH 2 CH(Cl)COOH α-hlorbuterna 2,86<br />
CH 3 CH(Cl)CH 2 COOH β-hlorbuterna 4,05<br />
ClCH 2 CH 2 CH 2 COOH γ-hlorbuterna 4,53<br />
▪ Poredak kiselosti halogen supstituisanih k.k. slične<br />
strukture je u skladu sa relativnim –I efektom atoma<br />
halogena (veća elektronegativnost jači –I efekat)!<br />
Kiselina<br />
pK a<br />
FCH 2 COOH fluorsirćetna 2,56<br />
ClCH 2 COOH hlorsirćetna 2,87<br />
BrCH 2 COOH bromsirćetna 2,9<br />
ICH 2 COOH jodsirćetna 4,17<br />
O<br />
O<br />
25<br />
_<br />
2. NEZASIĆENE ALIFATIČNE K.K.<br />
▪ Kiselost k.k. zavisi od vrste hibridizacije C–atoma<br />
za koji je vezana –COOH grupa!<br />
Hibridna<br />
orbitala<br />
Udeo s–<br />
orbitale<br />
sp 3 1/4<br />
sp 2 1/3<br />
sp 1/2<br />
Što je u hibridnoj orbitali<br />
veći udeo s–orbitale<br />
elektroni su bliže jezgru<br />
(javlja se induktivan efekat<br />
privlačenja elektrona ka<br />
jezgru C–atoma).<br />
▪ Elektronegativnost hibridizovanih C–atoma<br />
opada u nizu: Csp > Csp 2 > Csp 3<br />
Kiselina<br />
pK a<br />
COOH<br />
3 propionska 4,78<br />
CH 3<br />
CH 2<br />
sp<br />
H 2<br />
C CH COOH<br />
sp 2<br />
HC<br />
C COOH<br />
sp<br />
akrilna 4,25<br />
propiolna 1,79<br />
▪ Akrilna k.: nasuprot –I efektu Csp 2 deluje +R<br />
efekat (povećana el. gustina na karbonilnom O) koji<br />
smanjuje kiselost:<br />
_<br />
.. δ<br />
.. _<br />
O:<br />
: O:<br />
+<br />
H 2<br />
C CH C OH CH 2<br />
CH C OH<br />
δ +<br />
+R efekat C=C veze<br />
▪ Meñutim, kako –I efekat Csp 2 preovlañuje nad +R ef.<br />
C=C veze, akrilna k. je ipak nešto jača k. od propionske.<br />
▪ Propiolna k.: +R efekat postoji i kod C≡C veze ali je<br />
zanemarljiv u odnosu na jak –I efekat Csp.<br />
26
3. BENZOEVA<br />
I SUPSTITUISANE BENZOEVE K.<br />
▪ U nedisosovanom molekulu benzoeve k. deluju 2<br />
elektronska efekta:<br />
□ induktivni efekat (–I) Csp 2 – povećava kiselost<br />
(olakšava izdvajanje H + – destabilizuje molekul)<br />
δ<br />
O<br />
C<br />
δ +<br />
sp 2<br />
pK a<br />
= 4,20<br />
_<br />
□ rezonancioni efekat (+R) benzenovog prstena<br />
– smanjuje kiselost<br />
(povećana el. gustina na karbonilnom O i tako<br />
otežava izdvajanje H + – stabilizuje molekul)<br />
C<br />
O<br />
..<br />
O : +<br />
OH<br />
C<br />
H<br />
.. - : O :<br />
OH<br />
27<br />
Benzoeva kiselina je jača kiselina od svog<br />
zasićenog analoga: cikloheksankarboksilne<br />
kiseline!<br />
COOH<br />
COOH<br />
<<br />
sp 3 sp 2<br />
pKa 4,87 4,20<br />
Cikloheksankarboksilna k. <br />
• –COOH grupa je vezana za Csp 3 cikloheksilgrupa<br />
je donor elektrona (+I) ka –COOH grupi.<br />
Benzoeva k. <br />
• –COOH grupa je vezana za Csp 2 zbog Csp 2<br />
preko koga je vezana za –COOH grupu, fenilgrupa<br />
je ovde, poput C=C veze (npr. kod akrilne<br />
k.) slabiji elektron donor ka –COOH grupi nego<br />
zasićeni (Csp 3 ) C–atom<br />
–I efekat Csp 2 preovlañuje nad +R<br />
efektom!<br />
28<br />
.. -<br />
O :<br />
-<br />
: O<br />
.. :<br />
+<br />
C<br />
:<br />
+<br />
OH<br />
C<br />
OH<br />
Važno: Da bi došlo do<br />
rezonancije –COOH grupa<br />
i fenilno jezgro moraju biti u<br />
koplanarnom položaju!<br />
. .<br />
. .<br />
. .<br />
.<br />
C<br />
.<br />
O<br />
OH
Z<br />
COOH<br />
pK a<br />
Supstituent p-<br />
N<br />
+<br />
_<br />
: O..<br />
:<br />
H 4,20<br />
NO 2 3,44<br />
OH 4,58<br />
p-nitrobenzoeva k.<br />
..<br />
: O<br />
: O:<br />
_ ..<br />
: O:<br />
+<br />
H +<br />
..<br />
: O<br />
N<br />
+<br />
_<br />
: O..<br />
:<br />
..<br />
: O<br />
N<br />
+<br />
_<br />
: O..<br />
:<br />
..<br />
HO..<br />
O δ<br />
C<br />
δ +<br />
-I efekat NO 2<br />
grupe<br />
O δ<br />
C<br />
δ +<br />
-I efekat OH grupe<br />
: O:<br />
C OH<br />
N + C OH<br />
_<br />
+<br />
: O .. :<br />
-R efekat NO 2<br />
grupe<br />
narocito povoljno!<br />
(povecanje δ + na karb. C-atomu)<br />
O<br />
_ ..<br />
: O:<br />
O<br />
C<br />
_<br />
N + C<br />
_<br />
_<br />
+<br />
O<br />
: O .. :<br />
O<br />
anjon p-nitrobenzoeve k.<br />
narocito<br />
(-R i -I ef. NO 2<br />
grupe deluju u istom smeru) povoljno!<br />
p-hidroksibenzoeva k.<br />
..<br />
..<br />
O: : O<br />
..<br />
+<br />
HO..<br />
C OH HO..<br />
C<br />
+R efekat OH grupe<br />
(povecana el. gustina na<br />
karb. O)<br />
O<br />
O<br />
_<br />
H + .. +<br />
_<br />
+ ..<br />
C<br />
_<br />
HO<br />
HO..<br />
: C<br />
_<br />
:<br />
_<br />
_<br />
OH<br />
O<br />
O<br />
anjon p-hidroksibenzoev k.<br />
narocito nepovoljno!<br />
(+R i -I ef. OH grupe deluju u suprotnim smerovima, +R je daleko jaci)<br />
p-Nitrobenzoeva k. je jača od p-hidroksibenzoeve k. jer je <br />
• molekul p-nitrobenzoeve k. manje stabilan,<br />
• anjon p-nitrobenzoeve k. stabilniji.<br />
O<br />
O<br />
H<br />
H<br />
29<br />
4. DIKARBOKSILNE K.<br />
▪ Dikarboksilne k. koje imaju –COOH grupe na<br />
krajevima ugljovodoničnog lanca:<br />
Kiselina pK a1 pK a2<br />
HOOC–COOH oksalna 1,27 4,28<br />
HOOCCH 2 COOH malonska 2,85 5,70<br />
HOOC(CH 2 ) 2 COOH ćilibarna 4,19 5,64<br />
HOOC(CH 2 ) 3 COOH glutarna 4,35 5,42<br />
▪ Dikarboksile k. imaju 2 K a pri čemu je K a1 > K a2<br />
(teže je ukloniti H + iz anjona nego iz neutralnog<br />
molekula)<br />
HOOC<br />
pentan-dikiselina<br />
COOH<br />
K a1<br />
+<br />
H +<br />
_<br />
H +<br />
OOC<br />
+<br />
_<br />
OOC<br />
K a2<br />
COOH<br />
▪ Dve –COOH grupe meñusobno utiču jedna na<br />
drugu svojim –I efektom (sa rastojanjem se<br />
smanjuje).<br />
▪ Jak –I efekat jedne –COOH grupe omogućava<br />
lakše odvajanje H + iz druge.<br />
H<br />
O<br />
_<br />
δ<br />
O<br />
C<br />
δ+<br />
HOOC<br />
_<br />
δ<br />
O<br />
C<br />
δ+<br />
O<br />
H<br />
H<br />
O<br />
_<br />
δ<br />
O<br />
C<br />
δ+<br />
_<br />
δ<br />
O<br />
C<br />
δ+<br />
CH 3<br />
COOH pK a<br />
= 4,76 (K a<br />
= 1,75 x 10 -5 )<br />
COOH<br />
pK a1<br />
= 1,27 (K a1<br />
= 5400 x 10 -5 )<br />
pK a2<br />
= 4,28 (K a2<br />
= 5,2 x 10 -5 )<br />
O<br />
COO<br />
_<br />
H<br />
30
KARAKTERISTIČNE REAKCIJE K.K.<br />
1. Reakcije zamene (supstitucije) protona –<br />
KISELOST<br />
▪ Nastaju soli k.k. – sve su rastvorne u vodi!<br />
1.1. Reakcije sa metalima<br />
2CH 3<br />
COOH + Zn (CH 3<br />
COO) 2<br />
Zn + H 2<br />
etanska k. cink-etanoat<br />
(sircetna k.)<br />
(cink-acetat)<br />
2H + + Zn H 2<br />
+ Zn 2+<br />
1.2. Reakcije sa hidroksidima<br />
CH 3<br />
COOH + NaOH<br />
etanska k.<br />
(sircetna k.)<br />
H 2<br />
O<br />
- +<br />
CH 3<br />
COO Na + H 2<br />
O<br />
natrijum-etanoat<br />
(natrijum-acetat)<br />
1.3. Reakcije sa karbonatima i bikarbonatima<br />
2CH 3<br />
COOH + Na 2<br />
CO 3<br />
+ 2-<br />
2H + CO 3<br />
Bikarbonatni test:<br />
CH 3<br />
COOH + NaHCO 3<br />
+ -<br />
H + HCO 3<br />
H 2<br />
O<br />
H 2<br />
CO 3<br />
H 2<br />
CO 3<br />
H 2<br />
O<br />
2CH 3<br />
COONa + CO 2<br />
+ H 2<br />
O<br />
CO 2<br />
+ H 2<br />
O<br />
CH 3<br />
COONa + CO 2<br />
+ H 2<br />
O<br />
CO 2<br />
+ H 2<br />
O<br />
▪ Reakcija k.k. sa bikarbonatima (bikarbonatni test)<br />
je karakteristična za k.k.<br />
▪ Za razliku od k.k. fenoli pokazuju negativan<br />
bikarbonatni test!<br />
31<br />
1.4. Reakcije sa amonijakom i <strong>derivati</strong>ma<br />
amonijaka<br />
▪ Baze poput amonijaka i njegovih derivata (amina<br />
(1°, 2°, 3°), hidroksilamina, hidrazina) reaguju sa<br />
k.k. dajući odgovarajuće soli – ne adiraju se na<br />
karbonilnu grupu kao kod aldehida i ketona.<br />
▪ Ova jedinjenja su istovremeno baze i nukleofili ali<br />
se prenos protona (deprotonovanje) odigrava brže<br />
nego nukleofilni napad!<br />
H<br />
C H 3<br />
: O:<br />
C<br />
: O:<br />
C<br />
: O:<br />
C<br />
: O:<br />
..<br />
..<br />
O..<br />
H + : NH 3<br />
H 3<br />
C C O.. : - +<br />
NH 4<br />
amonijum-etanoat<br />
(amonijum-acetat)<br />
: O:<br />
..<br />
..<br />
..<br />
O.. H + CH 3<br />
NH 2<br />
H C O.. - +<br />
CH 3<br />
NH 3<br />
metilamin metilamonijum-metanoat<br />
(metilamonijum-formijat)<br />
: O:<br />
..<br />
..<br />
O.. H + : NH 2<br />
OH<br />
C O.. : - +<br />
NH 3<br />
OH<br />
hidroksilamin<br />
hidroksilamonijum-benzoat<br />
CH 3<br />
CH 2<br />
CH 2<br />
COOH + 2<br />
N NH<br />
hidrazin<br />
- +<br />
CH 3<br />
CH 2<br />
CH 2<br />
COO H 3<br />
NNH 2<br />
hidrazinijum-butanoat<br />
(hidrazinijum-butirat)<br />
32
2. Redukcija sa litijum-aluminijumhidridom<br />
(LiAlH 4 )<br />
▪ Nastaju 1° alkoholi.<br />
RCOOH<br />
ili<br />
ArCOOH<br />
1) LiAlH 4<br />
, THF<br />
2) H<br />
+<br />
, H 2<br />
O<br />
RCH 2<br />
OH<br />
ili<br />
ArCH 2<br />
OH<br />
33<br />
3. Dekarboksilacija<br />
▪ Izdvajanje molekula CO 2 iz molekula k.k.<br />
O<br />
kat.<br />
R C O H R H + O C O<br />
∆<br />
ili<br />
ili<br />
Ar H<br />
ArCOOH<br />
ugljovodonik<br />
34<br />
1 o alkohol<br />
COOH<br />
CH 2<br />
OH<br />
1) LiAlH 4<br />
2) H<br />
+<br />
, H 2<br />
O<br />
CH 3<br />
CH 3<br />
3-metilbenzenkarboksilna<br />
k<br />
(m-metilbenzil-alkohol)<br />
(3-metilfenil)metanol<br />
(m-metilbenzoeva k.)<br />
▪ Pri dekarboksilovanju k.k. ugljovodonični ostatak<br />
prima H + iz –COOH grupe, uz nastajanje<br />
odgovarajućeg ugljovodonika i izdvajanje CO 2 .<br />
▪ Reakcija se često vrši destilacijom soli k.k. u<br />
prisustvu "natron kreča" (smeša NaOH i CaO).<br />
- NaOH, CaO<br />
CH 3<br />
COO + Na<br />
CH<br />
∆<br />
4<br />
+ CO 2<br />
COOH<br />
1) LiAlH 4<br />
2) H<br />
+<br />
, H 2<br />
O<br />
CH 2<br />
OH<br />
-<br />
COO<br />
+<br />
Na<br />
NaOH, CaO<br />
∆<br />
+ CO 2<br />
2-cikloheksenkarboksilna<br />
k.<br />
2-cikloheksenilmetanol<br />
natrijum-benzoat<br />
▪ Zapravo se dešava dekarboksilovanje<br />
karboksilatnog anjona.<br />
R<br />
O<br />
C<br />
..<br />
O.. : -<br />
R - H +<br />
: + CO 2<br />
R H<br />
▪ Što je kiselina jača, jače disocira, daje stabilniji<br />
karboksilatni anjon – dekarboksilacija je brža.
35<br />
▪ Izuzetno lako se dekarboksiluju npr. trihlorsirćetna<br />
i 2,4,6-trinitrobenzoeva k. – veoma su jake k.<br />
Cl<br />
Cl<br />
Cl<br />
C COOH<br />
H 2<br />
O<br />
100 o C<br />
Cl<br />
Cl<br />
C H + CO 2<br />
Cl<br />
Cl<br />
trihlorsircetna k.<br />
trihlormetan<br />
Cl<br />
Cl<br />
Cl<br />
Cl C COOH<br />
+<br />
H + Cl C<br />
-<br />
COO Cl C H + CO 2<br />
O 2<br />
N<br />
NO 2<br />
O 2<br />
N<br />
COOH<br />
COOH<br />
NO 2<br />
NO 2<br />
2,4,6-trinitrobenzenkarboksilna<br />
k.<br />
(2,4,6-trinitrobenzoeva k.)<br />
NO 2<br />
O 2<br />
N<br />
+<br />
H +<br />
Cl<br />
stabilan<br />
karboksilatni anjon<br />
O 2<br />
N<br />
H 2<br />
O<br />
100 o C<br />
H<br />
NO 2<br />
1,3,5-trinitrobenzen<br />
-<br />
COO<br />
NO 2<br />
NO 2<br />
stabilan<br />
karboksilatni anjon<br />
Cl<br />
NO 2<br />
+ CO 2<br />
O 2<br />
N<br />
H<br />
NO 2<br />
4. Konverzija u derivate k.k.<br />
▪ Iz k.k. se mogu dobiti njihovi <strong>derivati</strong>: alkanoilhalogenidi,<br />
anhidridi, estri, amidi.<br />
NO 2<br />
+ CO 2<br />
DOBIJANJE DERIVATA K.K.<br />
1. Alkanoil-halogenidi (halogenidi k.k.)<br />
O<br />
R<br />
C X<br />
X = F, Cl, Br, I<br />
R = alkil- ili aril-grupa.<br />
▪ Imenuju se promenom imena alkanske kiseline iz<br />
koje nastaju u ALKANOIL-HALOGENID.<br />
▪ Halogenidi cikloalkankarboksilnih kiselina zovu se<br />
CIKLOALKANKARBONIL-HALOGENIDI.<br />
Cl<br />
O<br />
pentanoil-hlorid<br />
O<br />
C<br />
Cl<br />
cikloheksankarbonil-hlorid<br />
O<br />
CH 3<br />
CCl<br />
etanoil-hlorid<br />
(acetil-hlorid)<br />
O<br />
C<br />
benzoil-jodid<br />
CH 3<br />
I<br />
O<br />
CH 3<br />
CHCH 2<br />
CBr<br />
3-metilbutanoil-bromid<br />
▪ Najznačajniji predstavnici su alkanoil-hloridi.<br />
▪ Dobijaju se delovanjem hlorida mineralnih kiselina<br />
na k.k..<br />
RCOOH<br />
ili<br />
ArCOOH<br />
SOCl 2<br />
PCl 3<br />
PCl 5<br />
R<br />
O<br />
Cl<br />
ili Ar<br />
O<br />
Cl<br />
36
CH 3<br />
COOH<br />
etanska k.<br />
(sircenta k.)<br />
COOH<br />
benzenkarboksilna k.<br />
(benzoeva k.)<br />
SOCl 2<br />
∆<br />
PCl 3<br />
∆<br />
CH 3<br />
COCl<br />
etanoil-hlorid<br />
(acetil-hlorid)<br />
benzoil-hlorid<br />
COCl<br />
37<br />
Dobijanje anhidrida<br />
2.1. Reakcijom k.k. sa alkanoil-hloridima<br />
O O O O<br />
∆<br />
RCOH + ClCR' RCOCR'<br />
+ HCl<br />
▪ Mogu se dobiti prosti (R = R') ili mešoviti (R≠R')<br />
anhidridi.<br />
38<br />
2. Anhidridi k.k.<br />
R<br />
C O<br />
O<br />
C O<br />
R<br />
R = alkil- ili aril-grupa.<br />
▪ Imenuju se dodajući izraz ANHIDRID imenu<br />
kiseline (ili imenima, u slučaju mešovitih).<br />
O O<br />
CH 3<br />
COCCH 3<br />
anhidrid<br />
etanske k.<br />
(anhidrid sircetne k.,<br />
acetanhidrid)<br />
O<br />
O<br />
O<br />
anhidrid<br />
etanske i propanske k.<br />
O<br />
CH 3<br />
COOH + CH 3<br />
COCl<br />
etanska k. etanoil-hlorid<br />
(sircetna k.) (acetil-hlorid)<br />
∆<br />
O O<br />
CH 3<br />
COCCH 3<br />
anhidrid<br />
etanske k.<br />
(acetanhidrid)<br />
2.2. Reakcijom Na-soli k.k. sa alkanoil-hloridima<br />
O<br />
O<br />
O O<br />
- +<br />
RCO Na + ClCR' RCOCR' + Na<br />
+ -<br />
Cl<br />
▪ Mogu se dobiti prosti (R = R') ili mešoviti (R≠R')<br />
anhidridi.<br />
-<br />
CH 3<br />
COO<br />
+<br />
Na +<br />
natrijum-etanoat<br />
(natrijum-acetat)<br />
Cl<br />
O<br />
C<br />
benzoil-hlorid<br />
H 3<br />
C<br />
O<br />
C<br />
O<br />
O<br />
C<br />
(anhidrid<br />
sircetne i benzoeve k.)<br />
O<br />
O<br />
O<br />
anhidrid<br />
2-buten-dikiseline<br />
(anhidrid maleinske k.<br />
maleinanhidrid)<br />
O<br />
O<br />
anhidrid<br />
1,2-benzendikarboksilne k.<br />
(anhidrid ftalne k.,<br />
ftalanhidrid)<br />
2.3. Reakcijom k.k. sa acetanhidridom<br />
O<br />
2RCH 2<br />
COH +<br />
O O<br />
CH 3<br />
COCCH 3<br />
acetanhidrid<br />
(dehidrataciono<br />
sredstvo)<br />
∆<br />
O O<br />
RCH 2<br />
COCCH 2<br />
R<br />
+ 2CH 3<br />
COOH
O<br />
∆<br />
O<br />
2 COOH + (CH 3<br />
CO) 2<br />
O C O C + 2CH 3<br />
COOH<br />
benzenkarboksilna k.<br />
(benzoeva k.)<br />
anhidrid benzenkarboksilne k.<br />
(benzanhidrid)<br />
O O<br />
∆<br />
2CH 3<br />
CH 2<br />
COOH + (CH 3<br />
CO) 2<br />
O CH 3<br />
CH 2<br />
C O C CH 3<br />
CH 2<br />
+ 2CH 3<br />
COOH<br />
propanska k. anhidrid propanske k.<br />
▪ Acetanhidrid se dobija iz ketena:<br />
H 2<br />
C C O<br />
CH 3<br />
COOH<br />
etanska k.<br />
(sircetna k.)<br />
+ CH 3<br />
COOH<br />
AlPO 4<br />
700 o C H 2 O +<br />
H 2<br />
C C O<br />
etenon<br />
(keten)<br />
OH<br />
H 2<br />
C C O<br />
O<br />
C<br />
CH 3<br />
39<br />
2.4. Dobijanje cikličnih anhidrida<br />
▪ Zagrevanjem dikarboksilnih kiselina<br />
(intramolekulska dehidratacija) dobijaju se ciklični<br />
anhidridi.<br />
▪ Nastaju stabilni peto– ili šestočlani prstenovi.<br />
O<br />
COH<br />
H 2<br />
C<br />
H 2<br />
C<br />
COH<br />
O<br />
butan-dikiselina<br />
(cilibarna k.)<br />
O<br />
∆<br />
O<br />
O<br />
O<br />
+ H 2<br />
O<br />
oksa-2,5-ciklopentandion<br />
anhidrid butan-dikiseline<br />
(anhidrid cilibarne k.)<br />
O<br />
40<br />
adicija sircetne k. na<br />
karbonilnu grupu ketena<br />
OH<br />
OH<br />
∆<br />
O<br />
+ H 2<br />
O<br />
O O<br />
CH 3<br />
COCCH 3<br />
anhidrid etanske k.<br />
(acetanhidrid)<br />
O<br />
1,2-benzendikarboksilna k.<br />
(ftalna k.)<br />
O<br />
anhidrid<br />
1,2-benzendikarboksilne k.<br />
(anhidrid ftalne k.)<br />
(ftalanhidrid)<br />
O<br />
COOH<br />
COOH<br />
pentan-dikiselina<br />
(glutarna k.)<br />
∆<br />
O<br />
+ H 2<br />
O<br />
O<br />
oksa-2,6-cikloheksandion<br />
anhidrid pentan-dikiseline<br />
(anhidrid glutarne k.)
3. Estri k.k.<br />
R<br />
C O<br />
41<br />
42<br />
H + acil grupa<br />
▪ "" ESTERIFIKACIJA!<br />
▪ "" HIDROLIZA estra!<br />
▪ Ravnoteža može da se pomeri prema estarskom<br />
O R'<br />
proizvodu:<br />
korišćenjem viška jednog od reaktanata<br />
(alkohol se uzima u višku) ili<br />
selektivnim uklanjanjem jednog od proizvoda<br />
iz reakc. smeše.<br />
▪ U stanju ravnoteže izraz za konstantu ravnoteže<br />
esterifikacije, K e , je:<br />
O<br />
C<br />
O CH v 1 = v 2<br />
3<br />
k 1 [RCOOH][R'OH] = k 2 [RCOOR'][ H 2 O]<br />
NH 2<br />
metil-(2-amino)benzoat<br />
k<br />
(metil-antranilat)<br />
1 [ RCOOR' ][ H2O]<br />
= K =<br />
k e [ RCOOH][ R'OH]<br />
(β) 4 3 (α)<br />
2<br />
(γ)<br />
5<br />
2<br />
O<br />
O<br />
Protoni (H + ) kao katalizator ubrzavaju postizanje<br />
1<br />
5-metiloksa-2-ciklopentanon<br />
ravnoteže – istovremeno ubrzavaju i esterifikaciju i<br />
(γ-valerolakton)<br />
hidrolizu!<br />
O<br />
O<br />
H 3<br />
C<br />
C<br />
OH + CH 3<br />
CH 2<br />
OH<br />
H +<br />
H 3<br />
C<br />
C<br />
OCH 2<br />
CH 3<br />
+ H 2<br />
O<br />
etanska k. etanol<br />
etil-etanoat<br />
(sircetna k.) (etil-alkohol)<br />
(etil-acetat)<br />
Reakcija esterifikacije spada u<br />
O<br />
R C<br />
R, R' = alkilili<br />
aril-grupa<br />
▪ Imenuju se kao ALKIL-ALKANOATI.<br />
▪ Uobičajeno (trivijalno) ime cikličnih estara je<br />
LAKTON, a po IUPAC–u su to OKSA-2-<br />
CIKLOALKANONI.<br />
O<br />
O<br />
3-metilbutil-etanoat<br />
(izopentil-acetat)<br />
(α)<br />
2<br />
O<br />
(β) O 1<br />
oksa-2-ciklobutanon<br />
(β-propiolakton)<br />
Dobijanje estara<br />
3.1. Reakcijom k.k. sa alkoholima –<br />
ESTERIFIKACIJA<br />
▪ Kiselo–katalizovana rekcija – katalizator H + jon.<br />
▪ Bez prisistva H + reakcija je jako spora!!!<br />
RCOOH + R'OH<br />
RCOOR' + H 2<br />
O<br />
reakcije nukleofilne acilne supstitucije.<br />
Esterifikacija je kiselo–katalizovana<br />
adiciono–eliminaciona reakcija!!!
Mehanizam ESTERIFIKACIJE (kisela–kataliza)<br />
Faza 1: protonovanje karboksilne grupe<br />
+ H<br />
: O:<br />
: O<br />
R C + H +<br />
..<br />
O H R C .. - H + ..<br />
O..<br />
H<br />
.. H<br />
: O<br />
R C ..<br />
+ O..<br />
H<br />
.. H<br />
: O<br />
R C +<br />
O..<br />
karbokatjon stabilizovan rezonancijom<br />
(aktivirana karbonilna grupa za napad nukleofila)<br />
Faza 2: nukleofilni napad alkohola (adicija)<br />
+ H<br />
: O<br />
R C ..<br />
O..<br />
H<br />
..<br />
+ R'OH ..<br />
: O .. H<br />
..<br />
R C O..<br />
H<br />
O<br />
..<br />
R' + H<br />
O H<br />
- H + : .. ..<br />
R C O<br />
+ H + ..<br />
O<br />
..<br />
:<br />
R'<br />
sp 3<br />
H<br />
tetraedarski intermedijer<br />
▪ Tetraedarski intermedijer je kjučan – podleže<br />
kiselo–katalizovanom razlaganju u oba smera:<br />
protonovanjem O alkoksi grupe (R'O)<br />
indukuje se eliminacija alkohola reversnim<br />
redosledom faza 1 i 2,<br />
protonovanjem bilo kojeg O hidroksilne grupe<br />
(OH) uz eliminaciju H 2 O nastaje estar (faza 3).<br />
Faza 3: eliminacija vode<br />
: O .. H<br />
+ H<br />
..<br />
+<br />
R C O..<br />
H<br />
- H +<br />
O<br />
..<br />
:<br />
R'<br />
+ H<br />
: O<br />
R C ..<br />
O..<br />
R'<br />
: O .. H<br />
H - H 2<br />
O<br />
R C O : +<br />
+ H<br />
O:<br />
H 2<br />
O<br />
..<br />
R'<br />
.. H<br />
.. H<br />
: O<br />
: O<br />
R C ..<br />
+ O R' R C +<br />
..<br />
O..<br />
protonovani estar<br />
R'<br />
H<br />
- H + : O:<br />
+ H + R C ..<br />
O..<br />
estar<br />
R'<br />
43<br />
▪ Uloga kiselog katalizatora, protona:<br />
aktivira karbonilnu grupu za nukleofilni napad<br />
alkohola (faza 2),<br />
transformiše hidroksilnu grupu (loša odlazeća<br />
grupa) u dobru odlazeću grupu, vodu (faza 3).<br />
▪ Sve faze su povratne te dodatak viška alkohola ili<br />
uklanjanjem vode ili estra iz reakc. smeše, pomera<br />
ravnotežu u desno u fazama 2 i 3.<br />
▪ Hidroliza estra vrši se reversnom reakcijom i<br />
favorizovana je u prisustvu vode.<br />
▪ Kiselo–katalizovana hidroliza estra je adiciono–<br />
eliminaciona reakcija – nukleofil je H 2 O, a eliminiše<br />
se alkohol.<br />
I esterifikacija i hidroliza estra su reakcije<br />
veoma osetljive na uticaj sternih faktora<br />
voluminozne grupe u molekulu kiseline i<br />
alkohola, odnosno, estra!<br />
▪ Reaktivnost u reakciji esterifikacije:<br />
za alkohole: CH 3 OH > 1° > 2° > 3°<br />
za k.k.: HCOOH > CH 3 COOH > RCH 2 COOH ><br />
> R 2 CHCOOH> R 3 CCOOH<br />
44
45<br />
3.2. Intramolekulska dehidratacija γ- i δ-hidroksi<br />
kiselina – sinteza cikličnih estara (laktona)<br />
2<br />
H 2<br />
C<br />
3<br />
C<br />
1<br />
α<br />
O<br />
COH<br />
β<br />
H γ<br />
2<br />
C<br />
4 H2<br />
OH<br />
H 2<br />
SO 4<br />
, H 2<br />
O; ∆<br />
(α)<br />
(β)<br />
3<br />
4<br />
2<br />
O<br />
O<br />
5<br />
(γ)<br />
1<br />
+ H 2<br />
O<br />
3.4. Reakcijom anhidrida k.k. i alkohola (ili<br />
fenola)<br />
O<br />
O<br />
O O<br />
RCOCR + R'OH<br />
ili<br />
ArOH<br />
∆<br />
RCOOR' + RCOOH<br />
ili<br />
RCOOAr<br />
O<br />
46<br />
COOH<br />
4-hidroksibutanska k.<br />
(γ-hidroksibuterna k.)<br />
oksa-2-ciklopentanon<br />
(γ-butirolakton)<br />
O<br />
HO<br />
+<br />
∆<br />
O<br />
+<br />
2<br />
H 2<br />
3<br />
H 2<br />
C<br />
C<br />
1<br />
α<br />
O<br />
β<br />
γ<br />
COH<br />
OH<br />
CH 2<br />
CH 2<br />
4 5<br />
5-hidroksipentanska k.<br />
(δ-hidroksivalerijanska k.)<br />
δ<br />
H 2<br />
SO 4<br />
, H 2<br />
O; ∆<br />
(α)<br />
3<br />
4<br />
(β)<br />
O<br />
5<br />
(γ)<br />
O<br />
6<br />
(δ)<br />
+ H 2<br />
O<br />
oksa-2-cikloheksanon<br />
2<br />
1<br />
(δ-valerolakton)<br />
anhidrid<br />
benzenkarboksilne k.<br />
O<br />
O<br />
+ CH 3<br />
OH<br />
O<br />
anhidrid<br />
butan-dikiseline<br />
(anhidrid cilibarne k.)<br />
fenilmetanol<br />
(benzil-alkohol)<br />
∆<br />
fenilmetil-benzoat<br />
(benzil-benzoat)<br />
COOCH<br />
H 2<br />
C<br />
3<br />
H 2<br />
C<br />
COOH<br />
(kiseli metil-estar cilibarne k.)<br />
(monometil-sukcinat)<br />
3.3. Reakcijom alkanoil-hlorida i alkohola (ili<br />
fenola)<br />
O<br />
RCCl + R'OH<br />
ili<br />
ArOH<br />
RCOOR' + HCl<br />
ili<br />
RCOOAr<br />
O<br />
O<br />
O<br />
+ 2CH 3<br />
OH<br />
∆<br />
COOCH 3<br />
H 2<br />
C<br />
H 2<br />
C<br />
COOCH 3<br />
(metil-estar cilibarne k.)<br />
(dimetil-sukcinat)<br />
3.5. Reakcijom soli k.k. i halogen-alkana<br />
O<br />
benzoil-hlorid<br />
Cl<br />
+<br />
HO<br />
fenilmetanol<br />
(benzil-alkohol)<br />
O<br />
O<br />
fenilmetil-benzoat<br />
(benzil-benzoat)<br />
O<br />
-<br />
O + Na<br />
natrijum-etanoat<br />
(natrijum-acetat)<br />
O<br />
- +<br />
RCO Na + R'X RCOOR' + Na<br />
+ -<br />
X<br />
Cl<br />
+<br />
1 o<br />
hlorfenilmetan<br />
(benzil-hlorid)<br />
O<br />
O<br />
fenilmetil-etanoat<br />
(benzil-acetat)
3.6. Reakcijom estra k.k. i alkohola ili fenola<br />
(transesterifikacija)<br />
O<br />
RCOR' + R"OH<br />
ili<br />
ArOH<br />
CH 3<br />
COOCH 2<br />
CH 3<br />
+ CH 3<br />
OH<br />
etil-etanoat<br />
(etil-acetat)<br />
4. Amidi k.k.<br />
metanol<br />
+ -<br />
H ili OH<br />
RCOOR" + R'OH<br />
ili<br />
RCOOAr<br />
+ -<br />
H ili OH<br />
CH 3<br />
COOCH 3<br />
+ CH 3<br />
CH 2<br />
OH<br />
metil-etanoat<br />
(metil-acetat)<br />
etanol<br />
47<br />
O<br />
NH 2<br />
etanamid<br />
(acetamid)<br />
O<br />
NH 2<br />
benzenkarboksamid<br />
(benzamid)<br />
O<br />
NH<br />
N-etilpropanamid<br />
(N-etilpropionamid)<br />
O<br />
C<br />
CH 3<br />
N CH 3<br />
CH 3<br />
2,N,N-trimetilbenzenkarboksamid<br />
(2,N,N-trimetilbenzamid)<br />
O<br />
(β)<br />
NH 2<br />
cikloheksankarboksamid<br />
(α)<br />
3<br />
4<br />
2<br />
O<br />
5<br />
(γ)<br />
1<br />
NH<br />
6 (δ)<br />
aza-2-cikloheksanon<br />
(δ-valerolaktam)<br />
48<br />
O<br />
O<br />
O<br />
R<br />
C NH 2<br />
R C NHR' R C NR' 2<br />
1 o 2 o 3 o<br />
R, R' = alkil- ili aril-grupa<br />
▪ Imenuju se kao ALKANAMIDI.<br />
▪ Kod uobičajenih imena, završetak –SKA<br />
KISELINA zamenjuje se sufiksom AMID.<br />
▪ U cikličnim sistemima završetak –KARBOKSILNA<br />
KISELINA zamenjen je sufiksom KARBOKSAMID.<br />
▪ Supstituenti na azotu označavaju se prefiksom N-<br />
ili N,N- u zavisnosti od broja supstituenata.<br />
▪ Uobičajeno (trivijalno) ime cikličnih amida je<br />
LAKTAM, a po IUPAC–u su to AZA-2-<br />
CIKLOALKANONI.<br />
Dobijanje amida k.k.<br />
4.1. Reakcijom termičke dekompozicije<br />
amonijum-soli k.k.<br />
RCOOH + NH 3<br />
- +<br />
∆<br />
RCOO NH 4<br />
amonijum-so k.k.<br />
amonijum-alkanoat<br />
O<br />
RCNH 2<br />
+ H 2<br />
O<br />
1 o<br />
amid<br />
▪ Prvo se formira amonijum-so koja se nalazi u<br />
ravnoteži sa k.k. i NH 3 .<br />
▪ Na povišenoj T termička disocijacija amonijum-soli<br />
postaje značajna, pa će u ravnoteži biti prisutni i<br />
znatne količine amonijaka i k.k.<br />
▪ Dolazi do sporije, ali termodinamički favorizovanije<br />
reakcije amina i kiseline.<br />
▪ Iz molekula k.k. i NH 3 (nukleofil) adiciono–<br />
eliminacionom reakcijom nastaje amid.<br />
▪ Analogno reaguju 1° i 2° amini (alifatični i<br />
aromatični) – nastaju 2°, odnosno, 3° amidi!
CH 3<br />
COOH +<br />
O<br />
+<br />
NH 2 CH NH 3<br />
HN<br />
C 3<br />
COO -<br />
CH 3<br />
(anilinijum-acetat)<br />
∆<br />
2 o amid<br />
N-feniletanamid<br />
(N-fenilacetamid)<br />
(acetanilid)<br />
+ H 2<br />
O<br />
4.2. Reakcijom alkanoil-hlorida i amonijaka, 1° i<br />
2° amina<br />
O<br />
R<br />
benzoil-hlorid<br />
O<br />
Cl<br />
Cl<br />
+ 2<br />
NH 2<br />
benzenamin<br />
(anilin)<br />
2NH 3<br />
2R'NH 2<br />
2R' 2<br />
NH<br />
R<br />
O<br />
1 o amid<br />
O<br />
NH 2<br />
R NHR'<br />
2 o amid<br />
O<br />
R NR' 2<br />
3 o amid<br />
O<br />
N<br />
H<br />
+ -<br />
+ NH 4<br />
Cl<br />
+ -<br />
+ R'NH 3<br />
Cl<br />
+ -<br />
+ R' 2<br />
NH 2<br />
Cl<br />
N-fenilbenzenkarboksamid<br />
(N-fenilbenzamid)<br />
+<br />
49<br />
+ -<br />
NH 3<br />
Cl<br />
(anilinijum-hlorid)<br />
O<br />
H<br />
CH 3<br />
CH 2<br />
CCl + 2CH 3<br />
CH 2<br />
NCH 3<br />
propanoil-hlorid<br />
(propionil-hlorid)<br />
N-metiletanamin<br />
(etilmetilamin)<br />
O<br />
+ -<br />
CH 3<br />
CH 2<br />
CNCH 2<br />
CH 3<br />
+ CH 3<br />
CH 2<br />
NH 2<br />
Cl<br />
CH 3<br />
CH 3<br />
N-etil-N-metilpropanamid etilmetilamonijum-hlorid<br />
(N-etil-N-metilpropionamid)<br />
4.3. Reakcijom anhidrida k.k. i amonijaka, 1° i 2°<br />
amina<br />
R<br />
O<br />
O<br />
O<br />
R<br />
O<br />
∆<br />
- +<br />
+ 2NH 3 + RCOO NH 4<br />
R NH 2<br />
1 o amid<br />
▪ Analogno reaguju 1° i 2° amini (alifatični i<br />
aromatični) – nastaju 2°, odnosno, 3° amidi!<br />
O<br />
O<br />
O<br />
anhidrid<br />
benzenkarboksilne k.<br />
O<br />
O<br />
O<br />
anhidrid<br />
butan-dikiseline<br />
(anhidrid cilibarne k.)<br />
∆<br />
N(CH 3<br />
)<br />
+ 2HN(CH 2<br />
3<br />
) 2<br />
N-metilmetanamin<br />
(dimetilamin) N,N-dimetilbezenkarboksamid<br />
(N,N-dimetilbenzamid)<br />
NH +<br />
∆<br />
2 H , H 2<br />
O<br />
+ 2NH 3 - +<br />
O NH 4<br />
O<br />
O<br />
+<br />
O<br />
- +<br />
COO NH 2<br />
(CH 3<br />
) 2<br />
dimetilamonijum-benzoat<br />
O<br />
NH 2<br />
OH<br />
O<br />
poluamid butan-dikiseline<br />
(poluamid cilibarne kiselina)<br />
(sukcinaminska k.)<br />
50
O<br />
O<br />
O<br />
anhidrid<br />
pentan-dikiseline<br />
(anhidrid glutarne k.)<br />
CONH 2<br />
+ CONH 2<br />
∆<br />
H , H 2<br />
O<br />
+ 2NH 3 - +<br />
COO NH 4<br />
COOH<br />
poluamid pentan-dikiseline<br />
(poluamid glutarne k.)<br />
4.4. Reakcijom estara k.k. i amonijaka, 1° i 2°<br />
amina<br />
R<br />
O<br />
OR'<br />
O<br />
+ NH ∆<br />
3 R NH + R'OH<br />
2<br />
1 o amid<br />
▪ Analogno reaguju 1° i 2° amini (alifatični i<br />
aromatični) – nastaju 2°, odnosno, 3° amidi!<br />
O<br />
OCH 3<br />
metil-estar<br />
cikloheksankarboksilne k.<br />
∆<br />
NHCH<br />
+ H 3<br />
2<br />
NCH 3 + CH 3<br />
OH<br />
O<br />
N-metilcikloheksankarboksamid<br />
COOCH 2<br />
CH 3<br />
CON(CH 3<br />
)<br />
∆<br />
2<br />
+ HN(CH 3<br />
) 2 + CH 3<br />
CH 2<br />
OH<br />
etil-benzoat<br />
N,N-dimetilbenzenkarboksamid<br />
(N,N-dimetilbenzamid)<br />
51<br />
52<br />
4.5. Intramolekulska dehidratacija γ- i δ-amino k.<br />
– sinteza cikličnih amida (laktama)<br />
4-aminobutanska k.<br />
(γ-aminobuterna k.)<br />
O<br />
1<br />
COOH<br />
(α)<br />
2<br />
2<br />
∆ 3 1<br />
α<br />
β<br />
3 γ NH (β) 4<br />
2<br />
5<br />
4<br />
(γ)<br />
3<br />
β<br />
4<br />
γ<br />
2<br />
α<br />
δ<br />
5<br />
COOH<br />
NH 2<br />
5-aminopentanska k.<br />
(δ-aminovalerijanska k.)<br />
1<br />
∆<br />
NH<br />
aza-2-ciklopentanon<br />
(γ-butirolaktam)<br />
(α)<br />
3<br />
O<br />
2<br />
1<br />
NH<br />
4 6<br />
(β)<br />
5<br />
(γ)<br />
(δ)<br />
+ H 2<br />
O<br />
aza-2-cikloheksanon<br />
(δ-valerolaktam)<br />
+ H 2<br />
O<br />
4.6. Reakcija anhidrida dikarboksilnih k. i<br />
amonijaka, 1° amina– sinteza imida (azotovi<br />
analozi cikličnih anhidrida)<br />
O<br />
O<br />
∆ NH 2 ∆<br />
O + 2NH 3 - +<br />
NH<br />
O NH - H 4 2<br />
O<br />
- NH 3<br />
O<br />
O<br />
O<br />
anhidrid<br />
aza-2,5-ciklopentandion<br />
butan-dikiseline<br />
(butanimid)<br />
(anhidrid cilibarne k.)<br />
(sukcinimid)<br />
O<br />
O<br />
CONH 2<br />
∆<br />
∆ NH<br />
O + 2NH 3 - +<br />
COO NH - H 4 2<br />
O<br />
- NH O<br />
3<br />
O<br />
aza-2,6-cikloheksandion<br />
(pentanimid)<br />
(anhidrid glutarne k.)<br />
anhidrid<br />
pentan-dikiseline<br />
O
4.7. Reakcija dikarboksilnih k. i amonijaka, 1°<br />
amina– sinteza imida (azotovi analozi cikličnih<br />
anhidrida)<br />
COOH<br />
CONH<br />
∆<br />
2<br />
+ 2NH 3<br />
- H 2<br />
O<br />
- +<br />
COOH COO NH 4<br />
butan-dikiselina<br />
(cilibarna k.)<br />
COOH<br />
COOH<br />
pentan-dikiselina<br />
COOH<br />
COOH<br />
1,2-benzemdikarboksilna k.<br />
(ftalna k.)<br />
∆<br />
+ 2NH 3<br />
- 2H 2<br />
O<br />
+ 2NH 3<br />
-NH 3<br />
∆<br />
- 2H 2<br />
O<br />
-NH 3<br />
▪ Analogno reaguju 1° amini.<br />
NH 3<br />
+<br />
O<br />
NH 2 ∆<br />
OH - H 2<br />
O<br />
- NH 3<br />
O<br />
poluamid butan-dikiseline<br />
(poluamid cilibarne kiselina)<br />
(sukcinaminska k.)<br />
3<br />
4<br />
O<br />
5<br />
2<br />
1<br />
NH<br />
O<br />
aza-2,6-cikloheksandion<br />
6<br />
O<br />
O<br />
NH<br />
1,2-benzendikarboksimid<br />
(ftalimid)<br />
O<br />
NH<br />
53<br />
O<br />
aza-2,5-ciklopentandion<br />
(butanimid)<br />
(sukcinimid)<br />
5. Nitrili – posebna klasa derivata k.k.<br />
R C N<br />
Ar C N<br />
▪ Smatraju se <strong>derivati</strong>ma k.k. jer:<br />
hidrolizom daju k.k.<br />
lako se transformišu u druge derivate k.k.<br />
nitrilni C–atom je istog oksidacionog stanja<br />
kao i karboksilni C.<br />
▪ Imenuju se kao ALKANONITRILI.<br />
▪ Uobičajena (trivijalna) imena izvode se obično<br />
zamenom nastavka –SKA KISELINA sufiksom<br />
NITRIL.<br />
▪ Cijanocikloalkani se imenuju kao<br />
CIKLOALKANKARBONITRILI.<br />
▪ Kao supstituent, –C≡N se zove CIJANO.<br />
H 3<br />
C C N<br />
etanonitril<br />
(acetonitril)<br />
(metil-cijanid)<br />
N<br />
CH 3<br />
CH 3<br />
CHCH 2<br />
CN<br />
3-metilbutanonitril<br />
(3-metilbutironitril)<br />
(2-metilpropil-cijanid)<br />
N<br />
CN<br />
butanodinitril<br />
(sukcinonitril)<br />
N<br />
54<br />
ciklopentankarbonitril<br />
(ciklopentil-cijanid)<br />
benzenkarbonitril<br />
(benzonitril)<br />
(fenil-cijanid)
Dobijanje nitrila<br />
5.1. Alkanonitrili (alkil-cijanidi) iz halogenalkana<br />
reakcijom nukleofilne supstitucije halogena<br />
cijanidnim jonom<br />
+ -<br />
R X + K CN R CN<br />
1 o<br />
(3 o eliminacija!!!)<br />
+ -<br />
+ K X<br />
5.2. Aromatični nitrili (aril-cijanidi) iz<br />
diazonijumovih soli i CuCN (Sandmeyer–ova<br />
reakcija)<br />
+ - CuCN<br />
Ar N N Cl<br />
Ar CN<br />
5.3. Dehidratacijom 1° amida<br />
R<br />
Ar<br />
O<br />
ili<br />
O<br />
P 2<br />
O 5<br />
, ∆<br />
- H 2<br />
O<br />
R CN<br />
NH 2<br />
ili<br />
Ar CN<br />
O<br />
C<br />
benzenkarboksamid<br />
(benzamid)<br />
P 2<br />
O 5<br />
, ∆<br />
C N<br />
- H<br />
NH 2<br />
O<br />
2<br />
benzenkarbonitril<br />
(benzonitril)<br />
55<br />
Dobijanje dikarboksilnih kiselina<br />
▪ Analogno dobijanju monokarboksilnih kiselina<br />
samo što se odgovarajuće reakcije vrše na dva<br />
mesta u molekulu.<br />
▪ Npr. oksidacijom diola, hidrolizom nitrila,<br />
karboksilovanjem Grignard–ovih reagenasa itd.<br />
HOCH 2<br />
CH 2<br />
OH<br />
1,2-etandiol<br />
(etilen-glikol)<br />
KMnO 4<br />
/H 2<br />
SO 4<br />
HOOC COOH<br />
etan-dikiselina<br />
(oksalna k.)<br />
Br 2<br />
2 KCN<br />
H 2<br />
C CH 2<br />
BrCH 2<br />
CH 2<br />
Br CN CH 2<br />
CH 2<br />
CN<br />
CCl 4<br />
eten<br />
butanodinitril<br />
1,2-dibrometan<br />
HOOCCH 2<br />
CH 2<br />
COOH<br />
HOOC(CH 2<br />
) 2<br />
COOH<br />
butan-dikiselina<br />
Cl(CH 2<br />
) 4<br />
Cl<br />
1,4-dihlorbutan<br />
butan-dikiselina<br />
1) LiAlH 4<br />
, aps. etar<br />
+ HOCH 2<br />
(CH 2<br />
) 2<br />
CH 2<br />
OH<br />
2) H , H 2<br />
O<br />
1,4-butandiol<br />
2 KCN<br />
NC(CH2 ) 4<br />
CN H +<br />
, H 2<br />
O<br />
heksandinitril<br />
1) Mg, aps. etar<br />
2) CO 2<br />
+<br />
3) H , H 2<br />
O<br />
∆<br />
+<br />
H , H 2<br />
O<br />
∆<br />
SOCl 2<br />
HOOC(CH 2<br />
) 4<br />
COOH<br />
heksan-dikiselina<br />
56
57<br />
Ponašanje dikarboksilnih kiselina pri zagrevanju<br />
1. Etan- i propan-dikiselina se dekarboksiluju<br />
HOOC COOH<br />
∆<br />
HCOOH + CO 2<br />
etan-dikiselina metanska k.<br />
(oksalna k.)<br />
(mravlja k.)<br />
STRUKTURA I FIZIČKE OSOBINE DERIVATA<br />
K.K.<br />
L<br />
δ<br />
+<br />
C<br />
-<br />
δ<br />
O<br />
58<br />
HOOC CH 2<br />
COOH<br />
∆<br />
CH 3<br />
COOH + CO 2<br />
propan-dikiselina etanska k.<br />
(malonska k.)<br />
(sircetna k.)<br />
Lako dekarboksilovanje malonske kiseline:<br />
H<br />
. . HO<br />
O<br />
. . .<br />
: O:<br />
∆<br />
CO 2<br />
+ C CH 2<br />
C C<br />
HO<br />
HO CH2 O<br />
enol-oblik<br />
Dekarboksilacija je veoma olakšana mogucnoscu obrazovanja<br />
6-clanog ciklicnog prelaznog stanja<br />
(karbonilni O jedne -COOH grupe se ponasa<br />
kao akceptor protona iz -OH grupe druge -COOH grupe)<br />
2. Butan- i pentan-dikiselina zagrevanjem daju<br />
ciklične anhidride (dehidratacija)<br />
COOH<br />
COOH<br />
butan-dikiselina<br />
(cilibarna k.)<br />
∆<br />
- H 2<br />
O<br />
O<br />
O<br />
O<br />
(anhidrid<br />
cilibarne k.)<br />
COOH<br />
COOH<br />
pentan-dikiselina<br />
(glutarna k.)<br />
∆<br />
- H 2<br />
O<br />
HO<br />
O<br />
C<br />
O<br />
O<br />
O<br />
(anhidrid<br />
glutarne k.)<br />
3. Heksan- i heptan-dikiselina zagrevanjem daju<br />
ciklične ketone (dekarboksilacija + dehidratacija)<br />
HOOC<br />
COOH<br />
heksan-dikiselina<br />
(adipinska k.)<br />
Ba(OH) 2<br />
; ∆<br />
- H 2<br />
O<br />
- CO 2<br />
O<br />
ciklopentanon<br />
Ba(OH) 2<br />
; ∆<br />
HOOC COOH O<br />
- H 2<br />
O<br />
heptan-dikiselina<br />
- CO 2 cikloheksanon<br />
CH 3<br />
R<br />
120 o<br />
trigonalna hibridizacija<br />
▪ Derivati k.k. su POLARNA jedinjenja – prisustvo<br />
polarizovane karbonilne grupe!<br />
▪ Hloridi, anhidridi i estri imaju T klj bliske T klj aldehida<br />
i ketona slične molekulske mase.<br />
▪ Amidi imaju više T klj zbog mogućnosti stvaranja<br />
intermolekulskih vodoničnih veza:<br />
Jedinjenje<br />
H<br />
R<br />
N H . . . . ..<br />
: O .. C<br />
. . . . . .:<br />
O..<br />
C<br />
N H . . . . . .<br />
R<br />
H<br />
O<br />
CH 3<br />
CCl<br />
O<br />
O<br />
CH 3<br />
COCCH 3<br />
O<br />
CH 3<br />
CNH 2<br />
T klj (°C) 51 140 221<br />
▪ Granica rastvorljivosti u vodi je 3 do 5 C–atoma za<br />
estre i 3 do 6 C–atoma za amide.<br />
▪ Derivati k.k. su rastvorni u uobičajenim organskim<br />
rastvaračima.<br />
▪ Isparljivi estri imaju prijatan, karakterističan miris<br />
hloridi imaju oštar, iritirajući miris.
HEMIJSKE OSOBINE DERIVATA K.K.<br />
Redukcija derivata k.k. sa LiAlH 4<br />
derivat k.k.<br />
Derivat k.k.<br />
O<br />
RCCl<br />
O O<br />
RCOCR<br />
O<br />
RCOR'<br />
O<br />
RCNH 2<br />
O<br />
RCNHR'<br />
O<br />
RCNR' 2<br />
1) LiAlH 4<br />
, aps. etar<br />
2) H<br />
+<br />
, H 2<br />
O<br />
proizvod<br />
Proizvod redukcije sa<br />
LiAlH 4<br />
RCH 2 OH<br />
RCH 2 OH + HOCH 2 R<br />
RCH 2 OH + HOR'<br />
RCH 2 NH 2<br />
RCH 2 NHR'<br />
RCH 2 NR' 2<br />
RC≡N RCH 2 NH 2<br />
59<br />
NUKLEOFILNA ACILNA SUPSTITUCIJA<br />
Mehanizam adicije–eliminacije <br />
Najvažniji reakcioni put za dobijanje derivata k.k.,<br />
kao i zanjihove meñusobne transformacije!<br />
▪ Nukleofil napada karbonilni C (adicija) i nastaje<br />
tetraedarski intermedijer, koji se razlaže uz<br />
eliminaciju odlazeće grupe.<br />
▪ Ukupna reakcija je supstitucija odlazeće grupe<br />
nukleofilom!<br />
▪ Adiciono–eliminacione reakcije mogu biti<br />
katalizovane kiselinom ili bazom.<br />
R<br />
: O:<br />
C<br />
..<br />
L<br />
derivat k.k.<br />
alkanoil-hlorid L =<br />
anhidrid L =<br />
estar L =<br />
amid L =<br />
..<br />
Cl .. :<br />
..<br />
O..<br />
: O:<br />
C R'<br />
..<br />
O..<br />
R'<br />
..<br />
NH 2<br />
..<br />
NHR'<br />
..<br />
NR' 2<br />
60<br />
O<br />
O<br />
O<br />
O<br />
HOCH 2 CH 2 CH 2 CH 2 OH<br />
HOCH 2 CH 2 CH 2 CH 2 CH 2 OH
Mehanizam kiselo–katalizovane, adiciono<br />
eliminacione reakcije<br />
Faza 1: protonovanje<br />
61<br />
Mehanizam bazno–katalizovane, adiciono<br />
eliminacione reakcije<br />
Faza 1: deprotonovanje NuH<br />
62<br />
+ ..<br />
: O:<br />
O<br />
R<br />
C + H +<br />
..<br />
L R C - H +<br />
derivat kiseline<br />
(supstrat)<br />
H<br />
..<br />
L<br />
Faza 2: adicija–eliminacija<br />
+ .. H<br />
O<br />
R<br />
C ..<br />
L<br />
+ : NuH<br />
nukleofil<br />
1 adicija 2 eliminacija<br />
Faza 3: deprotonovanje<br />
1<br />
+: O<br />
R<br />
C<br />
..<br />
: O<br />
R<br />
C +<br />
H<br />
..<br />
L<br />
..<br />
: O<br />
R<br />
C<br />
H<br />
+<br />
L<br />
karbokatjon stabilizovan rezonancijom<br />
(aktivirana karbonilna grupa za napad nukleofila)<br />
: O<br />
.. H<br />
.. - H +<br />
R C L<br />
+ H<br />
+<br />
+<br />
Nu H<br />
H<br />
Nu<br />
R<br />
- H + : O<br />
..<br />
+ H +<br />
R<br />
C<br />
: O<br />
H<br />
.. + H + : O<br />
C L<br />
- H + R C<br />
Nu<br />
Nu<br />
proizvod<br />
supstitucije<br />
Nu<br />
+ H<br />
: O<br />
R<br />
C Nu<br />
protonovani<br />
proizvod<br />
supstitucije<br />
H<br />
+<br />
LH<br />
2<br />
+ : LH<br />
odlazeca<br />
grupa<br />
Nu H + : B - -<br />
: Nu + H B<br />
nenaelektrisani<br />
nukleofil<br />
baza<br />
katalizator<br />
naelektrisani<br />
nukleofil<br />
▪ Baza (:B – ) osigurava maksimalnu koncentraciju<br />
negativno naelektrisanog (deprotonovanog)<br />
nukleofila koji napada karbonilni C.<br />
Faza 2: adicija–eliminacija<br />
: O:<br />
-<br />
C .. + : Nu<br />
R L<br />
nukleofil<br />
derivat kiseline<br />
(supstrat)<br />
1 adicija 2 eliminacija<br />
Faza 3: regeneracija katalizatora<br />
.. -<br />
: L +<br />
.. -<br />
: O:<br />
: O:<br />
1 .. 2<br />
.. -<br />
R C L<br />
C + : L<br />
R Nu<br />
Nu<br />
odlazeca<br />
proizvod grupa<br />
supstitucije<br />
H<br />
B<br />
L<br />
H<br />
+ : B -<br />
baza<br />
regenerisani<br />
katalizator
Relativna reaktivnost derivata k.k. u reakcijama<br />
nukleofilne supstitucije adiciono-eliminacionim<br />
mehanizmom<br />
▪ U reakciji nukleofilne supstitucije sa vodom<br />
(hidroliza):<br />
najreaktivniji<br />
najmanje<br />
reaktivan<br />
: O:<br />
C<br />
R L ..<br />
derivat k.k.<br />
R<br />
: O:<br />
..<br />
: O:<br />
R C O..<br />
C R'<br />
: O:<br />
..<br />
R C O..<br />
R'<br />
R<br />
: O:<br />
C<br />
: O:<br />
C<br />
..<br />
Cl .. :<br />
..<br />
NR' 2<br />
+ H 2<br />
O<br />
20 o C<br />
brzo<br />
+ H 2<br />
O 20 o C<br />
sporo<br />
+ H 2<br />
O<br />
+ H 2<br />
O<br />
+ -<br />
H ili OH ; ∆<br />
vrlo sporo<br />
+ -<br />
H ili OH ; ∆<br />
izuzetno sporo<br />
RCOOH + HCl<br />
63<br />
RCOOH + R'COOH<br />
RCOOH + R'OH<br />
RCOOH + HNR' 2<br />
Važno: Redosled relativne rektivnosti derivata<br />
k.k. je dosledan:<br />
: O:<br />
: O:<br />
: O:<br />
: O:<br />
..<br />
R C Cl .. :<br />
..<br />
..<br />
> R C O..<br />
C R' > R C O<br />
..<br />
R' ><br />
najreaktivniji<br />
R<br />
: O:<br />
C<br />
..<br />
NH 2<br />
najmanje<br />
reaktivan<br />
▪ Ovakav redosled relativne reaktvnosti<br />
direktno zavisi od strukture .. tj.:<br />
koliko je dobra odlazeća grupa,<br />
kakav elektronski uticaj vrši na<br />
susednu karbonilnu grupu.<br />
L<br />
Što je : slabija baza, bolja je odlazeća<br />
grupa, odnosno, bolje će se odvojiti od molekula –<br />
derivat k.k. je reaktivniji.<br />
▪ U sledećem nizu raste baznost odlazeće grupe:<br />
..<br />
L<br />
O<br />
- -<br />
- -<br />
Cl < OCR < OR < NH 2<br />
hloridni karboksilatni alkoksidni amidni<br />
jon jon<br />
jon<br />
jon<br />
..<br />
L<br />
..<br />
L<br />
: O:<br />
: O:<br />
: O:<br />
: O:<br />
: O:<br />
.. ..<br />
..<br />
..<br />
R C Cl :<br />
.. > R C O..<br />
C R' > R C O<br />
..<br />
R' > R C NH 2<br />
Što je karbonilni C–atom u strukturi derivata k.k.<br />
elektrofilniji (više δ+), derivat je reaktivniji!!!<br />
▪ U strukturi za karbonilni C-atom su vezani<br />
heteroatomi: N, O i Cl, koji se razlikuju po relativnoj<br />
elektronegativnosti i veličini (koef. el. negativnosti<br />
respektivno: 3,0; 3,4; 3,2).<br />
▪ Ukupan elektronski uticaj strukture na<br />
susednu karbonilnu grupu je odreñen dejstvom<br />
njenog:<br />
A. induktivnog (–I) i<br />
B. rezonancionog (+R) efekta.<br />
▪ Kao rezultat sveukupnog elektronskog efekta L grupe,<br />
elektrofilnost C–atoma karbonilne grupe opada u nizu:<br />
najpozitivniji<br />
-<br />
najmanje<br />
pozitivan<br />
64
A. Induktivni efekat<br />
▪ Što je "–I" efekat privlačenja elektrona duž σ–veze –<br />
L grupe veći, to će karbonilni C–atom biti više δ+<br />
(elektrofilniji).<br />
▪ Intenzitet –I efekta L grupe opada u nizu:<br />
R<br />
: O:<br />
C<br />
najpozitivniji<br />
: O:<br />
: O:<br />
: O:<br />
: O:<br />
.. ..<br />
..<br />
..<br />
Cl .. : > R C O..<br />
C R' > R C O<br />
..<br />
R' > R C NH 2<br />
najmanje<br />
pozitivan<br />
B. Rezonancioni efekat<br />
▪ Kao i u slučaju k.k. i kod njihovih derivata slob el.<br />
par supstituenta može biti delokalizovan na<br />
karbonilni O–atom:<br />
R<br />
: O:<br />
C<br />
.. -<br />
.. -<br />
: O: : O:<br />
..<br />
L R C L R C + ..<br />
+<br />
L<br />
(I) (II) (III)<br />
rezonancija u molekulu derivata k.k.<br />
▪ Mogućnost rezonancije dovodi do smanjene<br />
elektrofilnosti karbonilnog C–atoma!<br />
▪ Što je "+R" efekat odavanja elektrona duž π–veze<br />
–L grupe veći, dipolarna rezonanciona struktura (III)<br />
će biti više zastupljena, odnosno, molekul derivata<br />
kiseline će biti stabilniji (manje reaktivan).<br />
65<br />
▪ Amidi: –L = –NH 2<br />
: O:<br />
dipolarna rezonanciona struktura (III) je<br />
C ..<br />
R NH 2<br />
najzastupljenija (N je najmanje<br />
elektronegativan u nizu: O, Cl, N).<br />
▪ Estri: –L = –OR'<br />
: O:<br />
dipolarna rezonanciona struktura (III) je<br />
C ..<br />
R OR' .. nešto manje zastupljena (O je<br />
elektronegativniji od N).<br />
▪ Ipak je "+R" efekat –OR' grupe značajan.<br />
▪ Anhidridi: –L = –OCOR'<br />
: O:<br />
: O:<br />
reaktivniji su od estara jer slob. el. parove<br />
C ..<br />
R O C .. R' središnjeg O–atoma dele 2 karbonilne<br />
grupe, umanjujući tako stabilizaciju<br />
molekula rezonancijom.<br />
▪ Hloridi: –L = –Cl<br />
: O:<br />
Najreaktivniji zbog:<br />
C ..<br />
R Cl : • velike rel. el. negativnosti Cl,<br />
..<br />
• slabog +R efekata Cl (slabo<br />
preklapanje velike 3p–orbitale Cl sa 2p–orbitalom<br />
karbonilnog C).<br />
Reaktivnost aroil-hlorida je znatno smanjena u<br />
odnosu na alkanoil-hloride.<br />
.. -<br />
: O:<br />
: O:<br />
+<br />
Cl<br />
Cl<br />
+<br />
.. -<br />
.. -<br />
: O : : O :<br />
Cl<br />
Cl<br />
+<br />
66<br />
+R efekat arom. prstena smanjuje elektrofilnost karbonilnog C-atoma!!!
REAKCIJE ADICIJE–ELIMINACIJE DERIVATA<br />
K.K. SA NUKLEOFILIMA:<br />
sa vodom – hidroliza<br />
sa alkoholom – alkoholiza<br />
sa amonijakom – amonoliza<br />
sa aminima (1° i 2°) – aminoliza.<br />
1. Alkanoil-halogenidi<br />
▪ Veoma su reaktivni – nije potreban katalizator.<br />
1.1. Hidroliza<br />
▪ Veoma burno reaguju sa vodom – hidrolizuju čak i<br />
pod uticajem vlage iz vazduha.<br />
R<br />
: O:<br />
C<br />
1<br />
2<br />
O<br />
..<br />
.. + HOH ..<br />
Cl .. : nukleofil<br />
adicija<br />
eliminacija<br />
RCCl + H 2<br />
O<br />
alkanoil-hlorid<br />
O<br />
R<br />
CH 3<br />
CH 2<br />
CCl + H 2<br />
O<br />
1<br />
.. -<br />
: O:<br />
..<br />
C Cl .. :<br />
: OH<br />
+ 2<br />
O<br />
RCOH + HCl<br />
k.k.<br />
2<br />
O<br />
: O:<br />
R<br />
C ..<br />
+ O<br />
: O:<br />
H<br />
H<br />
- H +<br />
C ..<br />
R O..<br />
H<br />
k.k.<br />
CH 3<br />
CH 2<br />
COH + HCl<br />
propanoil-hlorid propanska k.<br />
67<br />
.. -<br />
+ : Cl ..<br />
:<br />
odlazeca<br />
grupa<br />
+ HCl<br />
1.2. Alkoholiza<br />
▪ Sasvim je analogna reakciji hidrolize, i dobar je<br />
način za dobijanje estara.<br />
O<br />
RCCl + R'OH<br />
alkanoil-hlorid<br />
O<br />
RCOR' + HCl<br />
estar<br />
▪ Obično se dodaju baze, kao što su hidroksidi<br />
alkalnih metala, piridin ili amini, da neutrališu<br />
sporedni proizvod, HCl.<br />
O<br />
CH 3<br />
CCl + CH 3<br />
CH 2<br />
CH 2<br />
OH<br />
etanol-hlorid<br />
(acetil-hlorid)<br />
1-propanol<br />
O<br />
N(CH 2<br />
CH 3<br />
) 3 + -<br />
CH 3<br />
COCH 2<br />
CH 2<br />
CH 3<br />
+ HN(CH 2<br />
CH 3<br />
) 3<br />
Cl<br />
propil-etanoat<br />
(propil-acetat)<br />
▪ U slučaju aroil-hlorida reakciju alkoholize je<br />
moguće izvoditi u vodenoj sredini u prisustvu<br />
hidroksida alkalnih metala (baza koja neutrališe<br />
HCl) s obzirom na njihovu znatno smanjenu<br />
reaktivnost u poreñenju sa alkanoil-hloridima.<br />
O<br />
benzoil-hlorid<br />
Cl<br />
+ CH 3<br />
OH<br />
metanol<br />
NaOH/H 2<br />
O<br />
O<br />
metil-benzoat<br />
68<br />
trietilamonijum-hlorid<br />
+ -<br />
+ Na Cl<br />
OCH 3
1.3. Amonoliza i aminoliza<br />
benzoil-hlorid<br />
O<br />
CCl<br />
+ NH 3<br />
(višak)<br />
O<br />
benzenkarboksamid<br />
(benzamid)<br />
CNH 2<br />
+ HCl<br />
▪ Analogno reaguju 1° i 2° amini.<br />
▪ Nastali HCl se neutrališe viškom amonijaka ili<br />
amina.<br />
NH 3<br />
69<br />
+ -<br />
NH 4<br />
Cl<br />
2. Anhidridi<br />
▪ Reakcije anhidrida k.k. sa nukleofilima su (iako<br />
manje burne) sasvim analogne reakcijama alkanoilhlorida.<br />
▪ Umesto hloridnog jona (Cl – ) odlazeća grupa je<br />
karboksilatni jon (RCOO – ).<br />
▪ Sa nukleofilima reaguju bez prisustva katalizatora.<br />
▪ Praktična primena: kako su manje reaktivni od<br />
alkanoil-hlorida, anhidridi se radije koriste kao<br />
polazna jedinjenja za dobijanje mnogih derivata k.k.<br />
2.1. Hidroliza<br />
70<br />
O O<br />
O O<br />
RCOCR + H 2<br />
O RCOH + HOCR<br />
anhidrid k.k. k.k. k.k.<br />
: O:<br />
RC<br />
..<br />
O..<br />
: O:<br />
CR<br />
..<br />
+ HOH ..<br />
nukleofil<br />
1<br />
R<br />
.. -<br />
: O:<br />
..<br />
C O..<br />
: OH<br />
+ 2<br />
: O:<br />
CR<br />
2<br />
R<br />
: O:<br />
C ..<br />
+ O<br />
H<br />
H<br />
- H +<br />
: O:<br />
- ..<br />
+ : OCR ..<br />
odlazeca<br />
grupa<br />
1<br />
2<br />
adicija<br />
eliminacija<br />
: O:<br />
C ..<br />
R O..<br />
H<br />
k.k.<br />
: O:<br />
..<br />
+ HOCR ..<br />
k.k.<br />
O<br />
O<br />
O<br />
O<br />
CH 3<br />
COCCH 3<br />
+ H 2<br />
O CH 3<br />
COH + HOCCH 3<br />
anhidrid<br />
sircetna k.<br />
sircetne k.
2.2. Alkoholiza<br />
71<br />
2.3. Amonoliza i aminoliza<br />
72<br />
O O<br />
O<br />
O<br />
O<br />
O<br />
RCOCR + R'OH<br />
anhidrid k.k.<br />
RCOR' + HOCR<br />
estar k.k.<br />
O<br />
+ NH 3<br />
(višak)<br />
: O:<br />
RC<br />
1<br />
2<br />
..<br />
O<br />
..<br />
adicija<br />
: O:<br />
CR<br />
eliminacija<br />
O<br />
O<br />
O<br />
anhidrid<br />
propanske k.<br />
..<br />
+ HOR' ..<br />
nukleofil<br />
1<br />
R<br />
R'<br />
+ CH 3<br />
OH<br />
.. -<br />
: O:<br />
C<br />
O..<br />
+<br />
..<br />
O..<br />
H<br />
: O:<br />
CR<br />
2<br />
O<br />
: O:<br />
R<br />
C ..<br />
+ O<br />
: O:<br />
R'<br />
C ..<br />
R O..<br />
R'<br />
estar<br />
H<br />
- H +<br />
: O:<br />
- ..<br />
+ : OCR ..<br />
odlazeca<br />
grupa<br />
: O:<br />
..<br />
+ HOCR ..<br />
k.k.<br />
O<br />
+<br />
OCH 3<br />
HO<br />
metil-propanoat propanska k.<br />
▪ Osim u slučaju hidrolize, sporedni proizvod,<br />
karboksilna kiselina, obično je nepoželjna i uklanja<br />
se obradom reakcione smeše razblaženim<br />
alkalijama.<br />
anhidrid benzoeve k.<br />
O<br />
CNH 2<br />
benzenkarboksamid<br />
(benzamid)<br />
+<br />
NH 3<br />
O<br />
COH<br />
amonijum-benzoat<br />
O<br />
- +<br />
CO NH 4<br />
▪ Analogno reaguju 1° i 2° amini.<br />
▪ Nastala ROOH se neutrališe viškom amonijaka ili<br />
amina.<br />
Ciklični anhidridi (anhidridi dikarboksilnih k.)<br />
▪ Stupaju u slične reakcije adicije–eliminacije, pri<br />
čemu se otvara prsten!<br />
O<br />
O<br />
+ H 2<br />
O<br />
O<br />
anhidrid<br />
butan-dikiseline<br />
(anhidrid cilibarne k.)<br />
∆<br />
H 2<br />
C<br />
H 2<br />
C<br />
COOH<br />
COOH<br />
butan-dikiselina<br />
(cilibarna k.)<br />
(sukcinska k.)<br />
▪ Reakcije sa alkoholima (alkoholiza), amonijakom<br />
(amonoliza) i 1º aminima (aminoliza) su pominjane<br />
kod dobijanja estara i amida.
3. Estri<br />
▪ U reakcijama adicije–eliminacije sa nukleofilima su<br />
manje reaktivni od hlorida i anhidrida k.k.<br />
▪ Najčešće je nužno prisustvo katalizatora.<br />
3.1. Hidroliza<br />
3.1.1. Kiselo–katalizovana<br />
kisela-kataliza<br />
O<br />
O<br />
RCOR' + H 2<br />
O<br />
H +<br />
RCOH + HOR'<br />
estar k.k. k.k. alkohol<br />
▪ Povratna reakcija!<br />
▪ Mehanizam ove reakcije je suprotan rakciji<br />
esterifikacije – nukleofil je voda, a eliminiše se<br />
alkohol!!!<br />
3.1.2. Bazno–katalizovana<br />
▪ Reakcija saponifikacije!<br />
bazna-kataliza<br />
O<br />
O<br />
-<br />
B:<br />
-<br />
RCOR' + H 2<br />
O RCO + HOR'<br />
estar k.k. so k.k. alkohol<br />
73<br />
▪ Kao baza se često koristi sam hidroksilni jon!<br />
: O:<br />
RC<br />
O<br />
OCH 3<br />
metil-butanoat<br />
KOH/H 2<br />
O<br />
∆<br />
O<br />
O<br />
-<br />
K<br />
+ + CH 3<br />
OH<br />
kalijum-butanoat<br />
.. -<br />
: O:<br />
: O:<br />
1<br />
2<br />
.. .. -<br />
..<br />
OR' .. + : OH ..<br />
R C OR'<br />
R<br />
C -<br />
..<br />
.. ..<br />
O..<br />
H + : OR'<br />
nukleofil<br />
..<br />
: OH<br />
katalizator<br />
..<br />
k.k. odlazeca<br />
grupa<br />
3 alkoksidni jon<br />
: O:<br />
1 adicija<br />
..<br />
2 eliminacija<br />
C .. - + HOR' ..<br />
prevodjenje k.k. u njenu so<br />
R O..<br />
:<br />
alkohol<br />
3<br />
pod uticajem bazne cestice, alkoksidnog jona<br />
karboksilatni jon<br />
Poslednja faza je nepovratna – karboksilatni jon<br />
(RCOO – ) je veoma stabilna čestica (stabilizovana<br />
rezonancijom)!!!<br />
Molekul alkohola ne može napasti karboksilatni<br />
jon!!!<br />
Upravo iz tog razloga bazno–katalizovana<br />
esterifikacija nije moguća!!! 3<br />
74<br />
▪ Uloga baze (B) je da transformiše slab nukleofil,<br />
vodu, u negativno naelektrisani i veoma nukleofilni<br />
hidroksilni jon.<br />
: - H<br />
..<br />
.. -<br />
OH ..<br />
:OH .. + B H<br />
jak<br />
nukleofil<br />
B +<br />
baza<br />
katalzator<br />
slab<br />
nukleofil<br />
3<br />
bazno-katalizovana esterifikacija nije moguca!!!<br />
B : - + H<br />
..<br />
.. -<br />
OR' ..<br />
:OR' .. + B H<br />
baza<br />
jak<br />
katalzator slab<br />
nukleofil<br />
nukleofil<br />
: O:<br />
R<br />
C ..<br />
O..<br />
H<br />
k.k.<br />
-<br />
+ : OR'<br />
alkoksidni<br />
jon<br />
nukleofil<br />
R<br />
: O:<br />
C<br />
karboksilatni anjon<br />
..<br />
.. -<br />
+ HOR' ..<br />
O..<br />
: alkohol
Zašto se bazno–katalizovana hidroliza estra<br />
zove SAPONIFIKACIJA<br />
▪ Kada se masti ili ulja (trigliceridi – estri viših<br />
masnih kiselina i glicerola) hidrolizuju u baznoj<br />
sredini u prisustvu NaOH ili KOH, dobija se glicerol i<br />
sapuni (smeša Na ili K soli masnih kiselina sa 12–<br />
20 C–atoma):<br />
C<br />
CH<br />
C<br />
H 2<br />
H 2<br />
O<br />
O<br />
O<br />
O<br />
CR'<br />
O<br />
CR''<br />
O<br />
CR'''<br />
triglicerid<br />
(mast ili ulje)<br />
+ 3NaOH<br />
CH 2<br />
OH<br />
CH<br />
OH +<br />
C<br />
H 2<br />
OH<br />
glicerol<br />
O<br />
R'CO<br />
- +<br />
Na<br />
O<br />
R''CO<br />
- +<br />
Na<br />
O<br />
R'''CO<br />
- +<br />
Na<br />
sapuni<br />
75<br />
3.2. Alkoholiza<br />
▪ Reakcija transesterifikacije – direktna<br />
transformacija jednog estra u drugi, bez nastajanja<br />
slobodne k.k.<br />
▪ Reakcija je katalizovana kiselinom ili bazom!<br />
O<br />
RCOR' + R''OH<br />
estar alkohol<br />
+ -<br />
H ili OR''<br />
O<br />
RCOR'' + HOR'<br />
estar alkohol<br />
▪ Ravnotežna reakcija – da bi se ravnoteža pomerila<br />
u "desno" obično se koristi veliki višak alkohola<br />
(R"OH).<br />
O<br />
OCH 2<br />
CH 3<br />
+ CH 3<br />
OH<br />
etil-butanoat<br />
metanol<br />
H 2<br />
SO 4<br />
O<br />
+ CH<br />
OCH 3<br />
CH 2<br />
OH<br />
NaOCH 3<br />
3<br />
metil-butanoat<br />
etanol<br />
76<br />
▪ Mehanizmi transesterifikacije katalizovani<br />
kiselinama ili bazama analogni su mehanizmima<br />
hidroliza u odgovarajuće k.k.:<br />
kisela–kataliza – započinje protonovanjem<br />
karbonilnog O estra nakon čega sledi nukleofilni<br />
napad molekula alkohola na karbonilni C<br />
bazna–kataliza – započinje deprotonovanjem<br />
alkohola, a nastali alkoksid ( – OR"), nukleofil, se<br />
adira na karbonilnu grupu estra.
3.3. Amonoliza i aminoliza<br />
▪ U reakciji nije potreban katalizator, ali je reakcionu<br />
smešu neophodno zagrevati!<br />
O<br />
COCH 2<br />
CH 3<br />
∆<br />
+ H 2<br />
NCH 3<br />
O<br />
N-metilbenzenkarboksamid<br />
(N-metilbenzamid)<br />
▪ Analogno reaguju amonijak i 2° amini.<br />
77<br />
CNHCH 3<br />
+ CH 3<br />
CH 2<br />
OH<br />
4. Amidi<br />
▪ Najmanje reaktivni <strong>derivati</strong> k.k., delimično i zbog<br />
toga što su jako stabilizovani delokalizacijom slob.<br />
el. para atoma azota.<br />
▪ Posledica toga je da adiciono–eliminacione<br />
reakcije u koje stupaju, zahtevaju oštre reakcione<br />
uslove.<br />
4.1. Hidroliza<br />
▪ Do hidrolize dolazi samo uz produženo zagrevanje<br />
pod jako kiselim ili baznim uslovima.<br />
4.1.1. Kiselo–katalizovana<br />
▪ Povratna reakcija!<br />
78<br />
kisela-kataliza<br />
O<br />
O<br />
H +<br />
+<br />
RCNH 2<br />
+ H 2<br />
O RCOH + NH 4<br />
amid k.k. ∆ k.k. amonijum-so<br />
O<br />
NH 2<br />
propanamid<br />
+ H 2<br />
O<br />
O<br />
H 2<br />
SO 4<br />
∆<br />
OH<br />
propanska k.<br />
+<br />
2-<br />
+ (NH 4<br />
) 2<br />
SO 4
Mehanizam kiselo-katalizovane hidrolize amida<br />
+ .. H<br />
: O:<br />
O<br />
R<br />
C + H +<br />
..<br />
1<br />
..<br />
NH 2<br />
R C .. + HOH<br />
- H +<br />
..<br />
NH 2<br />
nukleofil<br />
: OH<br />
.. : OH<br />
.. OH<br />
.. + H + : ..<br />
.. - H +<br />
+<br />
R C NH 2<br />
R C NH 2<br />
R C NH 3<br />
+ H +<br />
- H +<br />
O<br />
: OH<br />
:<br />
..<br />
OH<br />
..<br />
..<br />
H + H<br />
+ : O<br />
R<br />
C<br />
H<br />
..<br />
+ NH 3<br />
OH odlazeca<br />
grupa<br />
1 adicija 2 eliminacija<br />
4.1.2. Bazno–katalizovana<br />
▪ Nepovratna reakcija!<br />
O<br />
bazna-kataliza<br />
O<br />
RCNH 2<br />
+ H 2<br />
O<br />
amid k.k.<br />
+ H<br />
NHCH 2<br />
O<br />
3<br />
N-metilpropanamid<br />
: O:<br />
- H + R<br />
C + H + OH<br />
-<br />
OH<br />
∆<br />
-<br />
OH<br />
∆<br />
O<br />
k.k.<br />
-<br />
RCO + HNH 2<br />
so k.k.<br />
O<br />
-<br />
O<br />
so propanske k.<br />
O<br />
OH<br />
propanska k.<br />
2<br />
+<br />
+ NH 4<br />
amonijum-so<br />
+ CH 3<br />
NH 2<br />
metilamin<br />
+<br />
H , H 2<br />
O<br />
+<br />
+ CH 3<br />
NH 3<br />
metilamonijum-so<br />
79<br />
Mehanizam bazno-katalizovane hidrolize amida<br />
.. -<br />
: O:<br />
: O:<br />
: O:<br />
..<br />
1<br />
2<br />
- ..<br />
..<br />
RC<br />
NH R C NH 2<br />
R<br />
C 2<br />
+ : OH ..<br />
.. - ..<br />
O H<br />
nukleofil<br />
:<br />
.. + : NH<br />
OH<br />
2<br />
katalizator<br />
..<br />
k.k.<br />
odlazeca<br />
grupa<br />
3 amidni jon<br />
: O:<br />
1 adicija<br />
..<br />
2 eliminacija<br />
C .. - + NH 3<br />
prevodjenje k.k. u njenu so<br />
R O..<br />
:<br />
3<br />
pod uticajem bazne cestice, amidnog jona<br />
karboksilatni anjon<br />
▪ Obradom reakcione smeše sa razblaženom<br />
mineralnom kiselinom, dobija se k.k.<br />
Nitrili – posebna klasa derivata k.k.<br />
▪ Cijanidna grupa je polarizovana – na C–atomu se<br />
δ + -<br />
δ<br />
pojavljuje delimično "+" šarža tako da<br />
R C N podleže napadu nukleofila!<br />
1. Hidroliza nitrila<br />
▪ Veoma oštri reakcioni uslovi – neophodno<br />
prisustvo koncentrovane kiseline ili baze uz<br />
zagrevanje.<br />
▪ Mehanizmi ovih reakcija vrše se preko<br />
intermedijarnog amida i uključuje faze adicije–<br />
eliminacije!<br />
80
1.1. Kiselo–katalizovana<br />
▪ Povratan proces!<br />
81<br />
1.2. Bazno–katalizovana<br />
▪ Nepovratan proces!<br />
82<br />
kisela-kataliza<br />
O<br />
H +<br />
+<br />
RCN + H 2<br />
O RCOH + NH 4<br />
nitril<br />
∆ k.k. amonijum-so<br />
bazna-kataliza<br />
RCN + H 2<br />
O<br />
nitril<br />
-<br />
OH<br />
∆<br />
-<br />
RCOO + NH 3<br />
so k.k. amonijak<br />
N<br />
R<br />
C(CH 2<br />
) 4<br />
C<br />
heksanodinitril<br />
(adiponitril)<br />
N + H 2<br />
O<br />
H 2<br />
SO 4 +<br />
2-<br />
HOOC(CH 2<br />
) 4<br />
COOH + (NH 4<br />
) 2<br />
SO 4<br />
∆<br />
heksan-dikiselina<br />
(adipinska k.)<br />
Mehanizam kiselo-katalizovane hidrolize nitrila<br />
..<br />
R C N:<br />
+ H +<br />
+<br />
+<br />
R C N H R C<br />
..<br />
N H<br />
+ HOH ..<br />
- H + - H 2<br />
O<br />
R<br />
.. ..<br />
+<br />
..<br />
NH<br />
NH NH 2<br />
NH 2 C +<br />
O<br />
H - H<br />
..<br />
+<br />
R C + H<br />
..<br />
+<br />
OH R C ..<br />
OH R C ..<br />
+ H + .. - H + ..<br />
OH<br />
+<br />
H<br />
imino kiselina<br />
(tautome amida)<br />
..<br />
NH 2 C ..<br />
O..<br />
amid<br />
H +<br />
H 2<br />
O<br />
+<br />
RCOOH + NH 4<br />
k.k.<br />
▪ Početno protonovanje azota cijanidne grupe je<br />
praćeno nukleofilnim napadom molekula vode.<br />
▪ Deprotonovanjem nastaje neutralni intermedijer,<br />
imino kiselina, koji tautomerizuje u amid.<br />
▪ Amid dalje hidrolizuje kao što je ranije opisano.<br />
- H +<br />
+ H +<br />
Mehanizam bazno-katalizovane hidrolize nitrila<br />
.. -<br />
N :<br />
H<br />
- ..<br />
R C N:<br />
+ : OH<br />
R<br />
C ..<br />
..<br />
OH<br />
nukleofil<br />
..<br />
katalizator anjon imino kiseline<br />
R<br />
..<br />
- ..<br />
NH<br />
: NH<br />
C ..<br />
O R C .. : - ..<br />
O..<br />
amidatni jon<br />
H<br />
..<br />
OH ..<br />
R<br />
..<br />
OH ..<br />
..<br />
NH 2 C ..<br />
O..<br />
amid<br />
..<br />
NH<br />
R C ..<br />
O..<br />
H<br />
imino kiselina<br />
(tautomer amida)<br />
- ..<br />
+ : OH ..<br />
- .. - H 2<br />
O<br />
+ : OH ..<br />
+ H 2<br />
O<br />
-<br />
RCOO + NH 3<br />
so k.k.<br />
▪ Direktan napad hidroksilnog jona daje anjon imino<br />
kiseline (amidnog tautomera), koji se protonuje na<br />
azotu dajući imino kiselinu (tautomer amida).<br />
▪ Imino kiselina tautomerizuje u amid koji dalje<br />
hidrolizuje kao što je ranije opisano.<br />
▪ Obradom reakcione smeše sa razblaženom<br />
mineralnom kiselinom, dobija se k.k.
2. Alkoholiza nitrila<br />
▪ Kiselo–katalizovana reakcija.<br />
R<br />
kisela-kataliza<br />
RCN + R'OH<br />
nitril<br />
.. ..<br />
NH<br />
NH C +<br />
O<br />
H - H<br />
..<br />
+<br />
R C ..<br />
+ H + OR' ..<br />
R'<br />
H +<br />
∆<br />
NH<br />
RCOR'<br />
iminoestar<br />
..<br />
R C N:<br />
+ H +<br />
+<br />
+<br />
R C N H R C<br />
..<br />
N H<br />
+ R'OH ..<br />
- H + - R'OH<br />
iminoestar<br />
83<br />
Reakcija derivata k.k. sa Grignard–ovim<br />
reagensima<br />
1. Alkanoil-hloridi<br />
R<br />
C O<br />
alkanoil-hlorid<br />
1<br />
2<br />
1 O<br />
R'MgX<br />
Cl R C - MgXCl<br />
keton<br />
R'<br />
ne može se izolovati<br />
1) R'MgX<br />
2) H<br />
+<br />
, H 2<br />
O<br />
adicija-eliminacija (nukleofilna acilna supstitucija)<br />
nukleofilna adicija Grignard-ovog reagensa na keton<br />
2<br />
R<br />
OH<br />
C<br />
R'<br />
R'<br />
3 o alkohol<br />
84<br />
▪ Hidrolizom iminoestra se dobija estar k.k.<br />
NH<br />
RCOR'<br />
iminoestar<br />
+ H 2<br />
O<br />
H +<br />
∆<br />
+<br />
RCOOR' + NH 4<br />
estar k.k.<br />
O<br />
CH 3<br />
CH 2<br />
CCl<br />
propanoil-hlorid<br />
1) aps. etar<br />
OH<br />
2) H<br />
+<br />
, H 2<br />
O<br />
+ 2H 3<br />
C MgBr CH 3<br />
CH 2<br />
C CH 3<br />
CH 3<br />
2-metil-2-butanol<br />
3 o alkohol<br />
O<br />
Cl<br />
propanoil-hlorid<br />
+ 2<br />
MgCl<br />
1) aps. etar<br />
2) H<br />
+<br />
, H 2<br />
O<br />
OH<br />
1,1-difenil-1-propanol
.. -<br />
: O:<br />
: O :<br />
+<br />
MgX<br />
R<br />
C δ - δ + 1 .. 2<br />
.. + R'' MgX R C Cl ..<br />
:<br />
Cl .. :<br />
- ClMgX<br />
R''<br />
alkanoil-hlorid<br />
: O: .. -<br />
: O :<br />
+<br />
MgX<br />
R<br />
C δ - δ + 3<br />
+ R'' MgX R C R''<br />
R''<br />
R''<br />
keton<br />
ne može se izolovati<br />
85<br />
2. Estri<br />
2<br />
1<br />
1) R''MgX<br />
O<br />
O<br />
R<br />
C R''MgX<br />
OR' R C 2) H<br />
+<br />
, H 2<br />
O<br />
- R'OMgX R''<br />
estar<br />
keton<br />
ne može se izolovati<br />
1<br />
2<br />
adicija-eliminacija (nukleofilna acilna supstitucija)<br />
nukleofilna adicija Grignard-ovog reagensa na keton<br />
R<br />
OH<br />
C R''<br />
R''<br />
3 o alkohol<br />
86<br />
R<br />
OH<br />
C R''<br />
R''<br />
3 o alkohol<br />
H<br />
+<br />
, H 2<br />
O<br />
O<br />
etil-benzoat<br />
COCH 2<br />
CH 3<br />
1) aps. etar<br />
OH<br />
2) H<br />
+<br />
, H 2<br />
O<br />
+ 2H 3<br />
C MgBr C CH 3<br />
CH 3<br />
2-fenil-2-propanol<br />
3 o alkohol<br />
1<br />
3<br />
+ 2 = adicija-eliminacija (nukleofilna acilna supstitucija)<br />
nukleofilna adicija Grignard-ovog reagensa na keton<br />
H<br />
O<br />
COCH 2<br />
CH 3<br />
etil-formijat<br />
1) aps. etar<br />
OH<br />
2) H<br />
+<br />
, H 2<br />
O<br />
+ 2H 3<br />
C MgBr H C CH 3<br />
CH 3<br />
2-propanol<br />
2 o alkohol
: O:<br />
R<br />
C .. +<br />
OR' ..<br />
estar<br />
.. -<br />
: O :<br />
+<br />
MgX<br />
δ δ + 1 .. 2<br />
R'' MgX R C OR' ..<br />
- R'OMgX<br />
R''<br />
87<br />
3. Nitrili<br />
R C N<br />
1) R'MgX<br />
2) H<br />
+<br />
, H 2<br />
O<br />
- Mg(OH)X<br />
NH<br />
R C R'<br />
imin<br />
+<br />
H , H 2<br />
O<br />
R<br />
C O<br />
R'<br />
+<br />
+ NH 4<br />
88<br />
-<br />
+<br />
: O: .. -<br />
: O :<br />
+<br />
MgX<br />
R<br />
C δ - δ + 3<br />
R'' MgX R C R''<br />
R''<br />
R''<br />
keton<br />
ne može se izolovati<br />
N<br />
etanonitril<br />
(acetonitril)<br />
+<br />
MgBr<br />
butilmagnezijum-bromid<br />
1) aps. etar<br />
2) H<br />
+<br />
, H 2<br />
O<br />
keton<br />
O<br />
2-heksanon<br />
R<br />
OH<br />
C R''<br />
R''<br />
H<br />
+<br />
, H 2<br />
O<br />
.. - + ..<br />
N MgX<br />
NH<br />
δ - δ +<br />
:<br />
δ + -<br />
δ<br />
R C N:<br />
+ R' MgX<br />
R<br />
C H<br />
+<br />
, H 2<br />
O<br />
R' R C - Mg(OH)X R'<br />
nitril<br />
anjonska imino so<br />
imin<br />
1 +<br />
2<br />
3 o alkohol<br />
= adicija-eliminacija (nukleofilna acilna supstitucija)<br />
3 nukleofilna adicija Grignard-ovog reagensa na keton<br />
▪ Reakcije estara k.k. sa Grignar–ovim reagensima<br />
sasvim su analogne reakcijama hlorida – kao<br />
proizvod nastaje 3° alkohol!<br />
▪ U reakciji nukleofilne acilne supstitucije (1 + 2), u<br />
fazi eliminacije umesto hloridnog jona (Cl – ) odlazeća<br />
grupa je alkoksidni jon ( – OR').<br />
O<br />
R<br />
C R'<br />
keton<br />
+<br />
+ NH 4<br />
+<br />
H , H 2<br />
O
Amidi su amfoterna jedinjenja<br />
▪ Mogu da reaguju kao:<br />
slabe baze<br />
slabe kiseline.<br />
Slabe baze<br />
▪ Amidi su mnogo slabije baze od amina!!!<br />
▪ U molekulu amida moguće je protonovanje na 2<br />
mesta – na N i na karbonilnom O!<br />
: O:<br />
R<br />
C + H<br />
N<br />
H<br />
H (nema stabilizacije<br />
rezonancijom)<br />
protonovanje na N<br />
- H + + H +<br />
+ H + - H +<br />
.. -<br />
.. -<br />
: O:<br />
: O: : O:<br />
R<br />
C ..<br />
NH 2<br />
R C NH 2<br />
R C + ..<br />
+<br />
NH 2<br />
(I) (II) (III)<br />
rezonancija u molekulu amida<br />
+ .. H<br />
O<br />
R<br />
C ..<br />
NH 2<br />
.. H<br />
: O<br />
R<br />
C + NH ..<br />
2<br />
protonovanje na O<br />
..<br />
: O<br />
R<br />
C<br />
H<br />
+<br />
NH 2<br />
katjon stabilizovan rezonancijom<br />
(delokalizacija "+" šarže - jace stabilizovan rezonancijom<br />
od neprotonovanog amida)<br />
89<br />
Protonovanje na N<br />
▪ Slobodan el. par sa N učestvuje u rezonanciji sa<br />
"=" vezom karbonilne grupe:<br />
molekul amida je stabilizovan rezonancijom<br />
za razliku od protonovanog amida<br />
kao posledica delokalizacije slob. el. para sa<br />
N na karbonilno O javlja se delimično "+"<br />
naelektrisanje na N<br />
čime je jako smanjena baznost amida!<br />
Protonovanje na O<br />
▪ Protonovanjem na karbonilnom O nastaje katjon<br />
koji je rezonanciono stabilizovan (rezonanciona<br />
stabilizacija "+" šarže) – jače je rezonanciono<br />
stabilizovan od neprotonovanog amida (razdvajanje<br />
naelektrisanja).<br />
Važno: do protonovanja dolazi na<br />
karbonilnom O i to u jako kiselim uslovima!<br />
Slabe kiseline<br />
▪ Vodonici iz amino grupe 1° i 2° amida su slabo<br />
kiseli zbog delimično "+" šarže na N:<br />
..<br />
: O: -<br />
..<br />
: O: -<br />
R<br />
C +<br />
NH H R C +<br />
NR' H<br />
(III)<br />
(III)<br />
1 o 2 o<br />
90
▪ Svoje slabo kisele osobine mogu manifestovati<br />
isključivo u jako baznim uslovima:<br />
: O:<br />
R<br />
C ..<br />
N<br />
H<br />
H<br />
+ ..<br />
+ Na : NH 2<br />
: O:<br />
- +<br />
NH<br />
R<br />
C -<br />
3<br />
+ Na ..<br />
NH ..<br />
natrijum-amid<br />
jaka baza<br />
91<br />
..<br />
: O: -<br />
R<br />
C ..<br />
NH<br />
amidatni jon<br />
rezonanciono stabilizovan<br />
Imidi su kiseli<br />
▪ Vodonik na N u strukturi imida je kiseo zbog<br />
delimično "+" šarže na N:<br />
ftalimid<br />
.<br />
O.<br />
: N<br />
. O<br />
.<br />
.. -<br />
.<br />
.<br />
O<br />
.<br />
.<br />
O<br />
: N H<br />
N<br />
+<br />
H<br />
. O<br />
. . O<br />
. H<br />
delokalizacija slob. el. para sa N<br />
.<br />
.<br />
O<br />
+<br />
N H<br />
. O<br />
. .. -<br />
▪ S obzirom da je delokalizacija slob. el. para sa N<br />
kod imida veća nego kod amida, IMIDI:<br />
praktično nemaju bazni karakter<br />
znatno su jače kiseline od amida<br />
mogu se deprotonovati u znatno blažim baznim<br />
uslovima (vodeni rastvor hidroksida ili karbonata) –<br />
nastaje rezonanciono stabilizovan imidatni jon.<br />
ftalimid<br />
K +<br />
.<br />
.<br />
O<br />
: N<br />
. O<br />
.<br />
H<br />
KOH/H 2<br />
O<br />
.<br />
.<br />
O<br />
.. -<br />
.<br />
.<br />
O<br />
.<br />
.<br />
O<br />
. O<br />
imidatni jon<br />
. O<br />
O..<br />
: N:<br />
N: N:<br />
rezonanciono stabilizovan<br />
▪ Imidatni jon može da reaguje sa jedinjenjima koja<br />
sadrže polarizovanu vezi CX (ugljenik–halogen).<br />
.<br />
.<br />
O<br />
: N : - +<br />
K<br />
. O<br />
. kalijum-ftalimid<br />
Gabriel-ova sinteza 1 o amina:<br />
. .<br />
O<br />
+ BrCH 2<br />
CH 2<br />
CH 3<br />
(S N<br />
2)<br />
: N CH 2<br />
CH 2<br />
CH 3<br />
RX mora biti 1 o<br />
- KBr<br />
. O<br />
-<br />
OH /H 2<br />
O<br />
∆<br />
-<br />
COO<br />
H 2<br />
N CH 2<br />
CH 2<br />
CH 3<br />
propilamin<br />
+<br />
-<br />
COO<br />
.<br />
.<br />
O<br />
Gabriel-ova sinteza 2-aminokarboksilnih k.: . O<br />
.<br />
O<br />
: N : - +<br />
K + ClCH 2<br />
COCH 2<br />
CH 3<br />
: N CH 2<br />
COOCH 2<br />
CH<br />
(S 3<br />
N<br />
2)<br />
. O<br />
. etil-hloretanoat<br />
- KCl<br />
(etil-hloracetat)<br />
. O<br />
. α-halogenestar<br />
kalijum-ftalimid<br />
-<br />
1) OH /H 2<br />
O; ∆<br />
+<br />
2) H /H 2<br />
O<br />
COOH<br />
+ -<br />
H 3<br />
NCH 2<br />
COO +<br />
2-aminoetanska k.<br />
(glicin)<br />
COOH<br />
92
Hell–Vollhardt–Zelinsky reakcija<br />
▪ Slično aldehidima i ketonima, α-C–atom alkanskih<br />
(alifatičnih) k. može se halogenovati pomoću X 2<br />
(Cl 2 , Br 2 ) u prisustvu kat. količine elementarnog<br />
(crvenog) fosfora:<br />
P<br />
R CH COOH + X 2<br />
H<br />
▪ Mogu se zameniti svi α-H–atomi!<br />
R CH COOH + HX<br />
X<br />
2-halogenkarboksilna k.<br />
(α-halogensupstituisana k.)<br />
▪ Prevoñenje α-halogensupstituisane k. u druge<br />
supst. k.:<br />
RCH 2<br />
CHCOOH<br />
X<br />
(S N<br />
2)<br />
-<br />
CN<br />
-<br />
NO 2<br />
RCH 2<br />
CHCOOH<br />
CN<br />
RCH 2<br />
CHCOOH<br />
NO 2<br />
-<br />
1) OH /H 2<br />
O<br />
2) H<br />
+ RCH<br />
/H 2<br />
O<br />
2<br />
CHCOOH<br />
OH<br />
2-cijanokarboksilna k.<br />
(α-cijanokiselina)<br />
2-nitrokarboksilna k.<br />
(α-nitrokiselina)<br />
2-hidroksikarboksilna k.<br />
(α-hidroksikiselina)<br />
93<br />
94<br />
▪ Iz α,β-nezasićene k. konjugovanom adicijom može<br />
nastati čitav niz sistema.<br />
RCH CHCOOH<br />
(α,β-nezasicena k.)<br />
+<br />
H /H 2<br />
O<br />
HX<br />
NH 3<br />
HCN<br />
RCHCH 2<br />
COOH<br />
OH<br />
RCHCH 2<br />
COOH<br />
X<br />
RCHCH 2<br />
COO<br />
-<br />
+ NH 3<br />
RCHCH 2<br />
COOH<br />
CN<br />
3-hidroksikarboksilna k.<br />
(β-hidroksikiselina)<br />
3-halogenkarboksilna k.<br />
(β-halogenkiselina)<br />
3-aminokarboksilna k.<br />
(β-aminokiselina)<br />
3-cijanokarboksilna k.<br />
(β-cijanokiselina)<br />
▪ Ovo je zapravo 1,4–adicija nukleofilnog reagensa<br />
H–B na α,β-nezasićeni karbonilni sistem:<br />
β<br />
C<br />
α<br />
C<br />
O<br />
C<br />
+<br />
OH<br />
Cini se da je doslo<br />
do 1,2-adicije NuH<br />
na dvostruku vezu C-C!!!<br />
δ+<br />
1,4-adicija β<br />
H B C<br />
δ _<br />
B<br />
enol-oblik<br />
O<br />
H<br />
α<br />
C OH<br />
C<br />
izomerizacija<br />
β α<br />
C C<br />
B<br />
H<br />
C<br />
O<br />
OH<br />
NH 3<br />
/H 2<br />
O<br />
RCH 2<br />
CHCOO -<br />
+ NH 3<br />
2-aminokarboksilna k.<br />
(α-aminokiselina)<br />
1) KOH/ alkohol; ∆<br />
2) H<br />
+<br />
/H 2<br />
O<br />
RCH<br />
CHCOOH<br />
(α,β-nezasicena k.)
Dietil-malonat<br />
▪ Malonska kiselina je važan predstavnik dikiselina.<br />
▪ Znatno veći sintetski značaj ima njen dietil-estar<br />
dietil-propandioat (dietil-malonat)!<br />
CH 3<br />
COOH<br />
O<br />
Cl 2<br />
P<br />
NCCH 2<br />
COO - Na + H + , H 2<br />
O<br />
∆<br />
natrijumova so<br />
cijanosircetne k.<br />
CH 3<br />
CH 2<br />
OH<br />
H 2<br />
SO 4<br />
H 2<br />
C<br />
C<br />
COCH 2<br />
CH 3<br />
HN<br />
OCH 2<br />
CH 3<br />
iminoestar<br />
alkoholiza<br />
O<br />
-<br />
N C CH 2<br />
CO Na<br />
+<br />
ClCH 2<br />
COOH NaOH/H 2 O<br />
+<br />
H , H 2<br />
O<br />
HOOCCH 2<br />
COOH<br />
propan-dikiselina<br />
(malonska k.)<br />
esterifikacija<br />
O<br />
COCH 2<br />
CH 3<br />
H 2<br />
C<br />
COCH 2<br />
CH 3<br />
O<br />
dietil-propandioat<br />
(dietil-malonat)<br />
ClCH 2<br />
COO - Na + CN-<br />
95<br />
▪ Dietil-malonat se u reakciji sa jakim bazama<br />
ponaša kao kiselina:<br />
O O<br />
+ - ..<br />
CH 3<br />
CH 2<br />
OCCHCOCH 2<br />
CH 3<br />
+ Na : OCH .. 2<br />
CH 3<br />
jaca k.<br />
pK a<br />
= 13<br />
H<br />
: O: : O:<br />
Na + .. ..-<br />
..<br />
CH 3<br />
CH 2<br />
O..<br />
C CH C OCH .. 2<br />
CH 3<br />
+ CH 3<br />
CH 2<br />
OH<br />
slabija k.<br />
pK a<br />
= 15,9<br />
..<br />
CH 3<br />
CH 2<br />
O..<br />
..<br />
CH 3<br />
CH 2<br />
O..<br />
.. -<br />
: O: : O :<br />
C<br />
C<br />
CH<br />
C<br />
..<br />
: O: : O: -<br />
CH<br />
C<br />
rezonanciona stabilizacija anjona<br />
..<br />
OCH .. 2<br />
CH 3<br />
..<br />
OCH .. 2<br />
CH 3<br />
▪ U strukturi dietil-malonata H–atomi metilenske<br />
grupe su kiseli:<br />
deluje "–I" efekat<br />
-<br />
δ H -<br />
δ<br />
2 karbonilne grupe<br />
: O: : O:<br />
δδ<br />
(destabilizuje<br />
+<br />
CH 3<br />
CH 2<br />
O C C C OCH 2<br />
CH 3<br />
δ<br />
molekul – olakšava<br />
+ δ +<br />
odlazak H + H<br />
)<br />
anjon koji nastaje odlaskom H + je stabilizovan<br />
rezonancijom<br />
96
Malonestrarska sinteza<br />
▪ Dietil-malonat se koristi kao prekursor (polazno<br />
jedinjenje) u sintezi alkil- i dialkilsirćetnih k.<br />
▪ Postupak se zove malonestarska sinteza!<br />
▪ Zasniva se na:<br />
velikoj kiselosti metilenskih H–atoma u<br />
strukturi dietil-malonata<br />
veoma lakoj dekarboksilaciji malonske<br />
kiseline i supstituisanih malonskih kiselina.<br />
O<br />
H<br />
CH 3<br />
CH 2<br />
O C C C OCH 2<br />
CH 3<br />
H<br />
O<br />
H C<br />
OCH 2<br />
CH 3<br />
O H O<br />
H<br />
CH 3<br />
CH 2<br />
O C C C OCH 2<br />
CH 3<br />
COOH<br />
CH 3<br />
CH 2<br />
O C C C<br />
H C COOH<br />
R<br />
R<br />
(monosupstituisana sircetna k.)<br />
O R' O<br />
R'<br />
R<br />
R<br />
(disupstituisana sircetna k.)<br />
97<br />
H<br />
H<br />
R'<br />
CO 2<br />
CH 2<br />
CH 3<br />
C<br />
CO 2<br />
CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH 3<br />
C<br />
R<br />
CO 2<br />
CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH 3<br />
C<br />
H<br />
(dietil-alkilmalonat)<br />
R<br />
CO 2<br />
CH 2<br />
CH 3<br />
(dietil-dialkilmalonat)<br />
+ -<br />
Na OC 2<br />
H 5<br />
C 2<br />
H 5<br />
OH<br />
+<br />
Na<br />
-<br />
OC 2<br />
H 5<br />
C 2<br />
H 5<br />
OH<br />
H<br />
+<br />
Na<br />
CO 2<br />
CH 2<br />
CH 3<br />
-<br />
C: Na<br />
+<br />
CO 2<br />
CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH 3<br />
-<br />
: C R<br />
CO 2<br />
CH 2<br />
CH 3<br />
R<br />
X<br />
alkilovanje<br />
R'<br />
X<br />
alkilovanje<br />
▪ Pravila i ograničenja S N 2 reakcija važe i za faze<br />
alkilovanja!!!<br />
▪ Osim 1° i 2° halogenalkana mogu se koristiti i<br />
druga jedinjenja koja u molekulu sadrže<br />
polarizovanu vezu CX:<br />
H<br />
CO 2<br />
CH 2<br />
CH 3<br />
C<br />
R<br />
CO 2<br />
CH 2<br />
CH 3<br />
(dietil-alkilmalonat)<br />
O<br />
RCX X CH X<br />
2<br />
COR' CH 2<br />
CR'<br />
alkanoil-halogenid α-halogenestar α-halogenketon<br />
-<br />
OH /H 2<br />
O<br />
∆<br />
O<br />
-<br />
COO<br />
COOH<br />
+<br />
H /H 2<br />
O<br />
H C R<br />
H C R<br />
COO - COOH<br />
O<br />
∆<br />
- CO 2<br />
supstituisana malonska k.<br />
H<br />
C<br />
H<br />
R<br />
98<br />
COOH<br />
R'<br />
CO 2<br />
CH 2<br />
CH 3<br />
C<br />
R<br />
CO 2<br />
CH 2<br />
CH 3<br />
(dietil-dialkilmalonat)<br />
-<br />
OH /H 2<br />
O<br />
∆<br />
COO<br />
-<br />
COOH<br />
+<br />
H /H 2<br />
O<br />
R' C R R' C R<br />
COO<br />
-<br />
COOH<br />
∆<br />
- CO 2<br />
disupstituisana malonska k.<br />
R'<br />
COOH<br />
C R<br />
H
Lako dekarboksilovanje malonske kiseline:<br />
HO<br />
H<br />
. .<br />
O<br />
. . .<br />
: O:<br />
C<br />
CH2<br />
C<br />
O<br />
∆<br />
CO 2<br />
+<br />
HO<br />
C CH 2<br />
HO<br />
enol-oblik<br />
HO<br />
O<br />
C<br />
CH 3<br />
99<br />
ZADATAK<br />
Koristeći dietil-malonat i ostale reaktive, prikažite<br />
sintezu:<br />
a) 3-fenilpropanske kiseline<br />
100<br />
Dekarboksilacija je veoma olakšana mogucnoscu obrazovanja<br />
6-clanog ciklicnog prelaznog stanja<br />
(karbonilni O jedne -COOH grupe se ponasa<br />
kao akceptor protona iz -OH grupe druge -COOH grupe)<br />
H<br />
CO 2<br />
CH 2<br />
CH 3<br />
C H<br />
H<br />
COOH<br />
C CH 2<br />
CO 2<br />
CH 2<br />
CH 3<br />
H<br />
H<br />
CO 2<br />
CH 2<br />
CH 3<br />
C H<br />
+<br />
Na<br />
-<br />
OC 2<br />
H 5<br />
C 2<br />
H 5<br />
OH<br />
H<br />
CO 2<br />
CH 2<br />
CH 3<br />
-<br />
C: Na<br />
+<br />
CH 2<br />
Cl<br />
CO 2<br />
CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH 3<br />
H<br />
CO 2<br />
CH 2<br />
CH 3<br />
C CH 2<br />
CO 2<br />
CH 2<br />
CH 3<br />
OH<br />
-<br />
/H 2<br />
O<br />
∆<br />
H<br />
-<br />
COO<br />
C CH 2<br />
COO<br />
-<br />
+<br />
H /H 2<br />
O<br />
H<br />
COOH<br />
C CH 2<br />
COOH<br />
- 2<br />
COOH<br />
∆<br />
CO<br />
H C<br />
H<br />
CH 2<br />
3-fenilpropanska k.
) 2-etilbutan-dikiseline<br />
101<br />
CO 2<br />
CH 2<br />
CH 3<br />
COOH<br />
H<br />
C<br />
H<br />
HOOC<br />
CH 2<br />
C CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH 3<br />
H<br />
H<br />
CO 2<br />
CH 2<br />
CH 3<br />
C H<br />
+<br />
Na<br />
-<br />
OC 2<br />
H 5<br />
C 2<br />
H 5<br />
OH<br />
H<br />
CO 2<br />
CH 2<br />
CH 3<br />
-<br />
C: Na<br />
+<br />
CH 3<br />
CH 2<br />
Br<br />
CO 2<br />
CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH 3<br />
Br<br />
CO 2<br />
CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH<br />
+ 3<br />
Na<br />
-<br />
OC 2<br />
H 5 -<br />
H C CH 2<br />
CH 3<br />
Na<br />
+ : C CH 2<br />
CH 3<br />
C 2<br />
H 5<br />
OH<br />
CH 2<br />
CO 2<br />
CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH<br />
-<br />
3<br />
COO<br />
+<br />
OH<br />
-<br />
/H 2<br />
O -<br />
H /H 2<br />
O<br />
CH 3<br />
CH 2<br />
O 2<br />
CCH 2<br />
C CH 2<br />
CH 3<br />
OOCCH 2<br />
C CH 2<br />
CH<br />
∆<br />
3<br />
CO 2<br />
CH 2<br />
CH<br />
-<br />
3<br />
COO<br />
CO 2<br />
CH 2<br />
CH 3<br />
CO 2<br />
CH 2<br />
CH 3<br />
HOOCCH 2<br />
C CH 2<br />
CH 3<br />
∆<br />
- CO 2<br />
HOOCCH 2<br />
C CH 2<br />
CH 3<br />
COOH<br />
COOH<br />
COOH<br />
H<br />
2-etilbutan-dikiselina<br />
O<br />
X CH 2<br />
COR'<br />
α-halogenestar<br />
Mora biti estar!<br />
Nikako α-halogensupstituisana k.<br />
(jača k. XCH 2 COOH bi istisnula<br />
slabiju, dietil-malonat, iz njene soli).