ÐадаÑник по ÑеÑмодинамике неÑавновеÑнÑÑ Ð¿ÑоÑеÑÑов.
ÐадаÑник по ÑеÑмодинамике неÑавновеÑнÑÑ Ð¿ÑоÑеÑÑов.
ÐадаÑник по ÑеÑмодинамике неÑавновеÑнÑÑ Ð¿ÑоÑеÑÑов.
- TAGS
- agcl
- agno
- rtln
- catalysis.ru
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
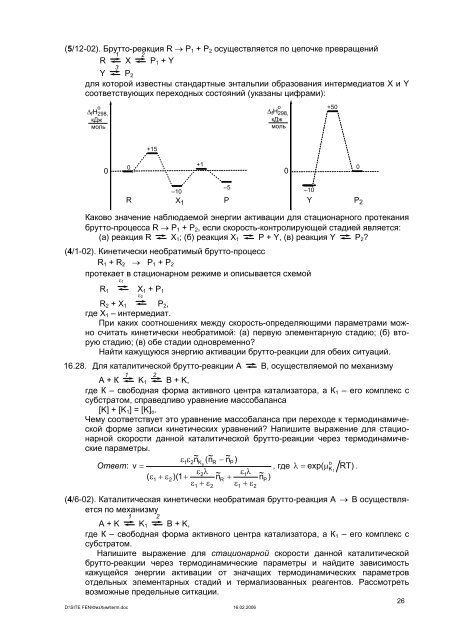
(5/12-02). Брутто-реакция R → P 1 + P 2 осуществляется по цепочке превращений<br />
1 2<br />
R X P 1 + Y<br />
3<br />
Y P 2<br />
для которой известны стандартные энтальпии образования интермедиатов X и Y<br />
соответствующих переходных состояний (указаны цифрами):<br />
0<br />
0<br />
Δ f H 298,<br />
–5<br />
o<br />
кДж<br />
моль<br />
o<br />
Δ f H 298,<br />
кДж<br />
моль<br />
+50<br />
+15<br />
+1<br />
0<br />
0<br />
–10<br />
R X 1<br />
P<br />
–10<br />
Y<br />
P 2<br />
Каково значение наблюдаемой энергии активации для стационарного протекания<br />
брутто-процесса R → P 1 + P 2 , если скорость-контролирующей стадией является:<br />
(а) реакция R X 1 ; (б) реакция X 1 P + Y, (в) реакция Y P 2 <br />
(4/1-02). Кинетически необратимый брутто-процесс<br />
R 1 + R 2 → P 1 + P 2<br />
протекает в стационарном режиме и описывается схемой<br />
ε 1<br />
R 1 X 1 + P 1<br />
ε 2<br />
R 2 + X 1 P 2 ,<br />
где Х 1 – интермедиат.<br />
При каких соотношениях между скорость-определяющими параметрами можно<br />
считать кинетически необратимой: (а) первую элементарную стадию; (б) вторую<br />
стадию; (в) обе стадии одновременно<br />
Найти кажущуюся энергию активации брутто-реакции для обеих ситуаций.<br />
16.28. Для каталитической брутто-реакции А В, осуществляемой по механизму<br />
1 2<br />
А + К K 1 B + K,<br />
где К – свободная форма активного центра катализатора, а К 1 – его комплекс с<br />
субстратом, справедливо уравнение массобаланса<br />
[K] + [K 1 ] = [K] o .<br />
Чему соответствует это уравнение массобаланса при переходе к термодинамической<br />
форме записи кинетических уравнений Напишите выражение для стационарной<br />
скорости данной каталитической брутто-реакции через термодинамические<br />
параметры.<br />
ε n<br />
~<br />
n<br />
~<br />
n<br />
~<br />
1ε<br />
2 K ( R − )<br />
o P<br />
Ответ: v = , где λ = exp( μ<br />
o K<br />
ε2λ<br />
( )(1 n<br />
~ ε1λ<br />
n<br />
~<br />
1<br />
RT)<br />
.<br />
ε1<br />
+ ε2<br />
+<br />
R +<br />
P )<br />
ε + ε ε + ε<br />
1<br />
2<br />
(4/6-02). Каталитическая кинетически необратимая брутто-реакция А → В осуществляется<br />
по механизму<br />
1 2<br />
1<br />
А + K K 1 B + K,<br />
где К – свободная форма активного центра катализатора, а К 1 – его комплекс с<br />
субстратом.<br />
Напишите выражение для стационарной скорости данной каталитической<br />
брутто-реакции через термодинамические параметры и найдите зависимость<br />
кажущейся энергии активации от значащих термодинамических параметров<br />
отдельных элементарных стадий и термализованных реагентов. Рассмотреть<br />
возможные предельные ситкации.<br />
D:\SITE FEN\ФизХим\term.doc 16.02.2006<br />
2<br />
26