Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
7. ВИДОВЕ КОВАЛЕНТНИ ВРЪЗКИ<br />
Вече з<strong>на</strong>ете, че ковалент<strong>на</strong>та връзка се образува с общ<strong>и</strong><br />
електронн<strong>и</strong> двойк<strong>и</strong>. Как са разпределен<strong>и</strong> те между атом<strong>и</strong>те в<br />
молекул<strong>и</strong>те <strong>на</strong> прост<strong>и</strong>те вещества <strong>и</strong> <strong>на</strong> х<strong>и</strong>м<strong>и</strong>чн<strong>и</strong>те съед<strong>и</strong>нен<strong>и</strong>я?<br />
ЕЛЕКТРООТРИЦАТЕЛНОСТ<br />
В молекул<strong>и</strong>те <strong>на</strong> водорода <strong>и</strong> хлора общ<strong>и</strong>те електронн<strong>и</strong> двойк<strong>и</strong><br />
се пр<strong>и</strong>вл<strong>и</strong>чат ед<strong>на</strong>кво от двата свър<strong>за</strong>н<strong>и</strong> атома. В молекулата<br />
<strong>на</strong> хлороводорода хлорн<strong>и</strong>ят атом пр<strong>и</strong>вл<strong>и</strong>ча по-с<strong>и</strong>лно общата<br />
електрон<strong>на</strong> двойка към себе с<strong>и</strong>.<br />
Свойството <strong>на</strong> атом<strong>и</strong>те <strong>на</strong> х<strong>и</strong>м<strong>и</strong>чн<strong>и</strong>те елемент<strong>и</strong> да пр<strong>и</strong>вл<strong>и</strong>чат<br />
общ<strong>и</strong>те електронн<strong>и</strong> двойк<strong>и</strong> се <strong>на</strong>р<strong>и</strong>ча електроотр<strong>и</strong>цателност.<br />
Електроотр<strong>и</strong>цателността се бележ<strong>и</strong> с гръцката<br />
буква χ (х<strong>и</strong>).<br />
Атом<strong>и</strong>те с по-голяма електроотр<strong>и</strong>цателност пр<strong>и</strong>вл<strong>и</strong>чат<br />
по-с<strong>и</strong>лно общ<strong>и</strong>те електронн<strong>и</strong> двойк<strong>и</strong>.<br />
Електроотр<strong>и</strong>цателността е свър<strong>за</strong><strong>на</strong> със строежа <strong>на</strong> атом<strong>и</strong>те<br />
<strong>и</strong> се <strong>и</strong>зменя <strong>за</strong>кономерно по пер<strong>и</strong>од<strong>и</strong> <strong>и</strong> груп<strong>и</strong> <strong>на</strong> пер<strong>и</strong>од<strong>и</strong>ч<strong>на</strong>та<br />
с<strong>и</strong>стема. В пр<strong>и</strong>ложен<strong>и</strong>е 1 в края <strong>на</strong> учебн<strong>и</strong>ка са предоставен<strong>и</strong><br />
данн<strong>и</strong> <strong>за</strong> относ<strong>и</strong>тел<strong>на</strong>та електроотр<strong>и</strong>цателност <strong>на</strong> елемент<strong>и</strong>те.<br />
НЕПОЛЯРНИ И ПОЛЯРНИ КОВАЛЕНТНИ ВРЪЗКИ<br />
Въз основа <strong>на</strong> електроотр<strong>и</strong>цателността <strong>на</strong> свър<strong>за</strong>н<strong>и</strong>те<br />
атом<strong>и</strong> се обособяват два в<strong>и</strong>да ковалентн<strong>и</strong> х<strong>и</strong>м<strong>и</strong>чн<strong>и</strong> връзк<strong>и</strong> –<br />
ковалент<strong>на</strong> неполяр<strong>на</strong> <strong>и</strong> ковалент<strong>на</strong> поляр<strong>на</strong>.<br />
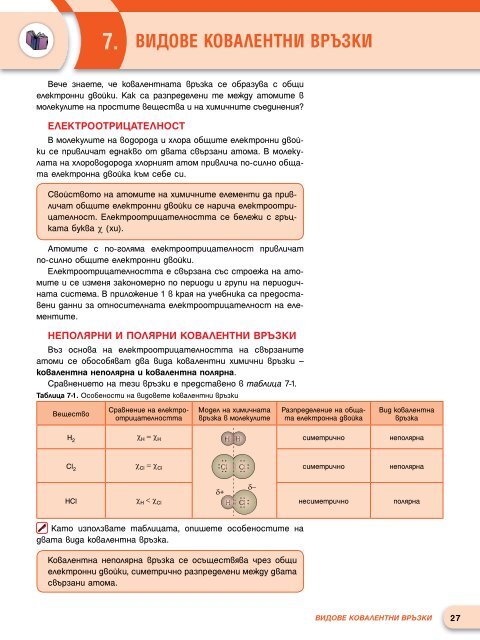
Сравнен<strong>и</strong>ето <strong>на</strong> тез<strong>и</strong> връзк<strong>и</strong> е представено в табл<strong>и</strong>ца 7-1.<br />
Табл<strong>и</strong>ца 7-1. Особеност<strong>и</strong> <strong>на</strong> в<strong>и</strong>довете ковалентн<strong>и</strong> връзк<strong>и</strong><br />
Вещество<br />
Сравнен<strong>и</strong>е <strong>на</strong> електроотр<strong>и</strong>цателността<br />
Модел <strong>на</strong> х<strong>и</strong>м<strong>и</strong>ч<strong>на</strong>та<br />
връзка в молекул<strong>и</strong>те<br />
Разпределен<strong>и</strong>е <strong>на</strong> общата<br />
електрон<strong>на</strong> двойка<br />
В<strong>и</strong>д ковалент<strong>на</strong><br />
връзка<br />
H 2<br />
χ H = χ H<br />
H<br />
H<br />
H<br />
с<strong>и</strong>метр<strong>и</strong>чно<br />
неполяр<strong>на</strong><br />
Cl 2<br />
χ Cl = χ Cl Cl<br />
Cl<br />
с<strong>и</strong>метр<strong>и</strong>чно неполяр<strong>на</strong><br />
<br />
+<br />
HCl χ H < χ Cl Cl<br />
нес<strong>и</strong>метр<strong>и</strong>чно поляр<strong>на</strong><br />
Като <strong>и</strong>зползвате табл<strong>и</strong>цата, оп<strong>и</strong>шете особеност<strong>и</strong>те <strong>на</strong><br />
двата в<strong>и</strong>да ковалент<strong>на</strong> връзка.<br />
Ковалент<strong>на</strong> неполяр<strong>на</strong> връзка се осъществява чрез общ<strong>и</strong><br />
електронн<strong>и</strong> двойк<strong>и</strong>, с<strong>и</strong>метр<strong>и</strong>чно разпределен<strong>и</strong> между двата<br />
свър<strong>за</strong>н<strong>и</strong> атома.<br />
ВИДОВЕ КОВАЛЕНТНИ ВРЪЗКИ<br />
27